Аналоги витамина d, композиции, содержащие указанные аналоги, и их применение
Иллюстрации
Показать всеИзобретение относится к аналогам витамина D общей формулы I, где R1 и R2 - галоген, C1-С6 углеводородный радикал, возможно замещенный 1, 2 -ОН группами, 1, 2 атомами F, или R1 и R2 - вместе - С3-С6 карбоцикл, или R1 и R2 - вместе - прямая связь, или R1 и R2 - Н, R3 - Н или C1-С3-углеводородный радикал, Х - (Е)-этилен, (Z)-этилен, этинилен или связь, Y и Z - Н, СН3; А - ОН, F или Н; В - -СН2- или Н2, при условии, что соединение I не является 3(S)-гидрокси-9,10-секохолеста-5(Z),7(Е),10(19),22(Е),24-пентаеном. Соединения проявляют сильное супрессорное действие на секрецию паратиреоидного гормона и полезны для лечения вторичного гиперпаратиреоидизма, возможно связанного с почечной недостаточностью. 4 н. и 15 з.п. ф-лы, 2 табл.
Реферат
Область изобретения
Данное изобретение относится к новым аналогам витамина D, к их использованию в терапии, к фармацевтическим композициям, содержащим указанные аналоги, к способам лечения, включающим в себя введение указанных аналогов нуждающимся в этом пациентам, и к использованию указанных аналогов при производстве лекарственных препаратов.
Уровень техники данного изобретения
В течение последних десятилетий понимание биологического действия витамина D все более возрастало. Классические эффекты витамина D включают в себя кальциевую и фосфатную абсорбцию из кишечника, которая жизненно необходима для минерального баланса и для роста и сохранения костей. Другим основополагающим действием витамина D является регулирование выделения паратиреоидного гормона (РТН) паращитовидными железами. Витамин D ингибирует выработку паратиреоидного гормона таким образом, чтобы низкий уровень витамина D в крови приводил к высокому уровню паратиреоидного гормона, и наоборот. Витамин D оказывает свое действие за счет интересного механизма, посредством которого ингибируется выработка мРНК, транслируемой в паратиреоидный гормон или его проформу. Однако влияние витамина D в биологических системах выходит за пределы данных эффектов. По-видимому, витамин D оказывает сильное воздействие на мышцы, иммунную систему, репродуктивную систему и пролиферацию и дифференцировку клеток. Фактически, клетки, содержащие рецептор витамина D (VDR), были найдены во многих частях тела, включая кишечник, почки, предстательную железу, кости, костный мозг, паращитовидные железы, кожу, печень, мышцы и лимфатическую ткань. Широкое распространение VDR сделало витамин D и его аналоги привлекательными соединениями для лечения различных заболеваний, включая рак, заболевания кожи и костей и аутоиммунные заболевания.
Данное изобретение относится к новому классу аналогов витамина D, оказывающих сильный супрессивный эффект на секрецию паратиреоидного гормона, которые, таким образом, можно использовать для лечения вторичного гиперпаратиреоидизма (s-HPT). Ключевым структурным элементом в активном витамине D являются две гидроксильные группы в положениях 1 и 25. В отличие от этого соединения по настоящему изобретению характеризуются блокированием 25-положения с тем, чтобы у них не было гидроксильных групп в данном положении; их также нельзя гидроксилировать в данное положение in vivo Р450-подобным ферментом.
Ранее были описаны аналоги витамина D, обладающие некоторым структурным сходством с соединениями по настоящему изобретению. В качестве примера в WO95/02577 исследованы соединения формулы
В WO91/00855 описаны соединения формулы
и Onisko, Tetrahedron Lett., 1107-1108, 13, 1977 описывает соединение формулы
которое может быть использовано для ингибирования ферментов печени, ответственных за гидроксилирование витамина D3 в 25-ОН витамин D3.
Наконец, Bogoslovsky et al., Vitamin D - Basic Research and its Clinical Application, proceedings of the Fourth Workshop on Vitamin D, Berlin West Germany 1979, A. W. Norman et al. (Eds.), p.1257-1259, Walter de Gruyter, Berlin 1979, представляли синтетическое исследование, включающее в себя получение 3(S)-гидрокси-9,10-секохолеста-5(Z),7(Е),10(19),22(Е),24-пентаена. Однако в данной ссылке не раскрыто никаких биологических данных относительно этого конкретного соединения.
Витамин D и его аналоги уже применяют при лечении s-HTP. Парикальцитол (19-нор-1,25-дигидроксивитамин D2) и доксеркальциферол (1α-гидроксивитамин D2) одобрены в США для лечения s-HTP, а 22-оксакальцитриол (максакальцитол) и гексафторкальцитриол (фалекальцитриол) одобрены в Японии [Malluche, Kidney Int., 367-374, 62, 2002]. Кроме того, кальцитриол как таковой и его пролекарство 1α(ОН)D3 также применяют при лечении и профилактики s-HTP [Brandi, Nephrol Dial Transplant, 829-842, 17, 2002].
При всех терапевтических вмешательствах, которые включают в себя введение витамина D и его аналогов, необходимо обращать внимание на неблагоприятные побочные эффекты, часто связанные с данным видом терапии, в частности с кальцемическими эффектами соединений витамина D. Эти побочные эффекты могут жестко ограничить, или даже воспрепятствовать использованию подобных соединений, несмотря на остальные клинически положительные эффекты. Поэтому в настоящем изобретении стремятся предоставить аналоги витамина D, которые обладают сниженным кальцемическим эффектом, сохраняя, в то же время, супрессивный эффект на секрецию паратиреоидного гормона.
Сущность изобретения
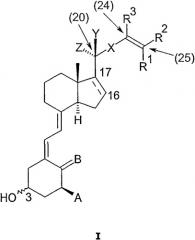
Соответственно, в настоящем изобретении предоставлены соединения, представленные формулой I
в которой
R1 и R2, которые могут быть одинаковыми или различными, представляют собой галоген, (С1-С6)углеводородный радикал, необязательно замещенный одной или двумя гидроксильными группами, или одним или более атомами фтора,
или вместе с атомом углерода, с которым они оба связаны, R1 и R2 образуют (С3-С6)карбоцикл,
или один из R1 и R2 вместе с R3 образует прямую связь, так что возникает тройная связь,
или оба R1 и R2 представляют собой водород;
R3, в том случае, когда он не образует прямой связи с одним из R1 и R2, представляет собой водород или (С1-С3)углеводородный радикал;
Х представляет собой (Е)-этилен, (Z)-этилен, этинилен или связь;
Y и Z независимо представляют собой водород или метил;
связь между С#16 и С#17 изображена пунктиром для иллюстрации того, что указанная связь может быть либо одинарной связью, в этом случае положением заместителя цикла является бета, или двойной связью;
А представляет собой гидроксил, фтор или водород;
В представляет собой СН2 или Н2;
конфигурация в 3-положении соответствует той же конфигурации, что и в природном витамине D3 (нормальная), или конфигурация в 3-положении противоположна природному витамину D3 (эпи);
при условии, что, если Х представляет собой (Е)-этилен или (Z)-этилен, один из R1 и R2 вместе с R3 не может образовывать прямой связи так, чтобы возникала тройная связь;
и при следующем условии, что, если Х представляет собой связь, R1 и R2 не являются водородом;
и при следующем условии, что соединение формулы I не является 3(S)-гидрокси-9,10-секохолеста-5(Z),7(Е),10(19),22(Е),24-пентаеном;
и его пролекарства и стереоизомерные формы.
В соединениях формулы I блокировка 25-положения достигается за счет присутствия углерод-углеродной двойной или тройной связи между углеродом #24 и #25. Таким образом, 25-положение не может быть гидроксилировано. Как более подробно обсуждается далее, на основании недавних данных предполагают, что гидроксилирование 25-положения имеет ограниченные последствия на супрессивный эффект по отношению к паратиреоидному гормону. Поэтому аналоги витамина D, которые блокированы для гидроксилирования в 25-положение, сохраняют свой супрессивный эффект по отношению к паратиреоидному гормону, лишаясь в то же время других видов активности витамина D, например кальцемического эффекта, связанного с ненарушенной структурой витамина D.
В следующем аспекте изобретение относится к применению соединения формулы I в терапии.
В следующем аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы I.
В еще одном аспекте изобретение относится к способам лечения, включающим в себя стадию введения соединения формулы I нуждающемуся в этом пациенту.
В еще одном аспекте изобретение относится к применению соединения формулы I при получении лекарственного средства.
Подробное описание изобретения
В предпочтительном варианте осуществления данного изобретения R1 и R2, рассматриваемые по отдельности, независимо представляют собой бром, хлор, метил, этил, трифторметил, гидроксиметил, (1- или 2-)гидроксиэтил, нормальный, изо- или циклопропил, 2-гидрокси-2-пропил, 2-метил-2-пропил, 3-пентил или 3-гидрокси-3-пентил.
В другом предпочтительном варианте осуществления R1 и R2 являются одинаковыми и оба представляют собой водород, метил, этил, бром, хлор или трифторметил.
В другом варианте осуществления R1 и R2, взятые вместе с атомом углерода, с которым они оба связаны, образуют С3 карбоцикл, С4 карбоцикл или С5 карбоцикл.
В другом предпочтительном варианте осуществления R1 и R2, взятые вместе, включают в себя этилен, триметилен, тетраметилен или пентаметилен, например, R1 и R2, взятые вместе с атомом углерода, с которым они оба связаны, образуют С3 карбоцикл, С4 карбоцикл, С5 карбоцикл или С6 карбоцикл.
В другом предпочтительном варианте осуществления, если R2 составляет часть тройной связи, то R1 представляет собой разветвленный С1-6 углеводородный радикал, необязательно замещенный одной или двумя гидроксильными группами. В частности, R1 представляет собой разветвленный С1-6 углеводородный радикал, необязательно замещенный одной гидроксильной группой, такой как -СМе3, -С(ОН)Ме2 или -С(ОН)Et2.
В другом предпочтительном варианте осуществления R3 в случае, когда он не является частью тройной связи, представляет собой водород, метил или циклопропил.
В следующем предпочтительном варианте осуществления А является гидроксилом или фтором.
В следующем предпочтительном варианте осуществления R1 и R2 представляют собой радикал, полученный при удалении одного атома водорода из линейного, разветвленного или циклического насыщенного С1-6 углеводорода.
В частности, соединения формулы I можно выбрать из перечня, включающего в себя
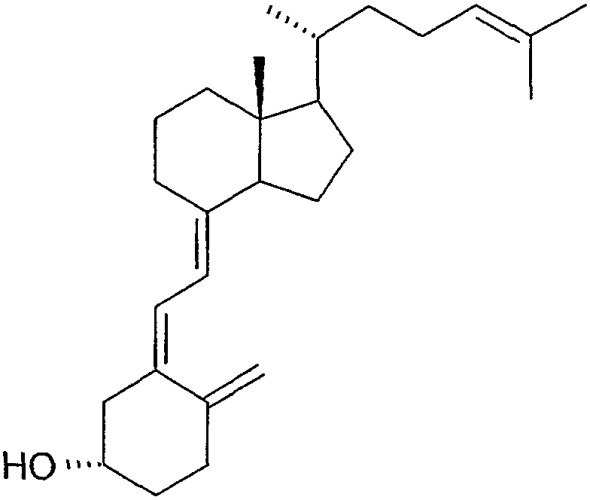
1(S),3(R)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(E),24-пентаен (соединение 1),
1(S),3(R)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Z),24-пентаен (соединение 2),
20(S),1(S),3(R)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 3),
1(S),3(R)-дигидрокси-9,10-секо-26,27-циклохолеста- 5(Z),7(E),10(19),22(Е),24-пентаен (соединение 4),
20(S),1(S),3(R)-дигидрокси-9,10-секо-26,27-циклохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 5),
1(S),3(R)-дигидрокси-9,10-секо-26,27-метанохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 6),
20(S),1(S),3(R)-дигидрокси-9,10-секо-26,27-метанохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 7),
1(S),3(R)-дигидрокси-20(S)-(4,4-дибром-1,3-бутадиен-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 8),
1(S),3(R),26-тригидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24(Е)-пентаен (соединение 9),
20(S),1(S),3(R),26-тригидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24(Е)-пентаен (соединение 10),
1(S),3(R),26-тригидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24(Z)-пентаен (соединение 11),
20(S),1(S),3(R),26-тригидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24(Z)-пентаен (соединение 12),
1(S),3(R)-дигидрокси-20(R)-(4-метил-5-этил-5-гидрокси-1(Е),3(Е)-гептадиенил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 13),
1(S),3(R)-дигидрокси-20(R)-(3-циклопропил-1(Е),3-бутадиенил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 14),
1(S),3(R)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),24-тетраен-22-ин (соединение 15),
1(S),3(R)-дигидрокси-20(R)-(5-метил-5-гидрокси-1,3-гексадиинил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 16),
1(S),3(R)-дигидрокси-20(S)-(5-этил-5-гидрокси-1,3-гептадиинил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 17),
1(S),3(R)-дигидрокси-20(R)-(5-этил-5-гидрокси-1,3-гептадиинил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 18),
1(S),3(R)-дигидрокси-20(R)-(5,5-диметил-1,3-гексадиинил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 19),
1(S),3(R)-дигидрокси-20(S)-(5,5-диметил-1,3-гексадиинил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 20),
1(S)-фтор-3(R)-гидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 21),
1(S),3(R)-дигидрокси-19-нор-9,10-секохолеста-5,7(E),22(Е),24-тетраен (соединение 22),
1(S),3(S)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 23),
1(S),3(R)-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),16,22(Е),24-гексаен (соединение 24),
1(S),3(R)-дигидрокси-26,26,26,27,27,27-гексафтор-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 25),
3(S),26-дигидрокси-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24(Е)-пентаен (соединение 26),
1(S),3(R)-дигидрокси-20(R)-(4,4-дибром-1,3-бутадиен-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 27),
1(S),3(R)-дигидрокси-26,27-диметил-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 28),
1(S),3(S)-дигидрокси-26,27-диметил-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 29),
1(S),3(R)-дигидрокси-24-метил-26,27-метано-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 30),
1(S),3(R)-дигидрокси-20(R)-(4,4-дихлор-1,3-бутадиен-1-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 31),
1(S),3(R)-дигидрокси-26,27-этано-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 32),
1(S),3(R)-дигидрокси-26,27-пропано-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 33),
1(S),3(R)-дигидрокси-20(S)-циклопропилиденметил-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 34),
1(S),3(R)-дигидрокси-20(R)-циклопропилиденметил-9,10-секопрегна-5(Z),7(E),10(19)-триен (соединение 35),
20(S),1(S),3(R)-дигидрокси-26,26,26,27,27,27-гексафтор-9,10-секохолеста-5(Z),7(E),10(19),22(Е),24-пентаен (соединение 36).
Соединения формулы I могут содержать хиральные центры, такие как асимметрично замещенные атомы углерода, и углерод-углеродные двойные связи, которые приводят к появлению стереоизомерных форм, таких как энантиомеры, диастереомеры и геометрические изомеры (цис/транс). Настоящее изобретение относится ко всем таким формам, либо в чистом виде либо в виде их смесей.
Например, конфигурация при С-3, или при С-20 (когда Y отличается от Z) в формуле I может быть R или S, или, если Х представляет собой этилен, конфигурация может быть Е или Z.
Соединения формулы I можно получить в кристаллическом виде, либо непосредственно концентрированием из органического растворителя, либо кристаллизацией или перекристаллизацией из органического растворителя или смеси указанного растворителя и сорастворителя, который может быть органическим или неорганическим, например водой. Кристаллы можно выделить в форме, в существенной степени не содержащей растворителя, или в виде сольвата, такого как гидрат. Данное изобретение включает в себя все кристаллические модификации и формы, а также их смеси.
В настоящем контексте, если не заявлено иначе, под термином «пролекарство» имеют в виду соединения, в которых одна или несколько гидроксильных групп замаскированы в виде групп, которые могут быть повторно преобразованы в гидроксильные группы in vivo с тем, чтобы получить соединения формулы I при введении пациенту. Примерами подобных групп являются сложные эфиры, например эфиры карбоновых кислот и эфиры фосфорной кислоты. Хорошо известно, что проформы витамина D гидроксилируются в печени и почках для достижения биологически активного состояния. В соответствии с этим соединения формулы I, в которых А представляет собой гидроксил, являются предпочтительными соединениями, но соединения, в которых А является водородом, фактически представляют собой пролекарства другого типа, которые могут быть гидроксилированы до активного состояния при введении пациенту.
В настоящем контексте под термином «углеводородный радикал» имеют в виду радикал, полученный при удалении одного атома водорода из линейного, разветвленного и/или циклического, насыщенного или ненасыщенного углеводорода. Указанный линейный, разветвленный и/или циклический, насыщенный или ненасыщенный углеводород включает в себя, но не ограничивается этим, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 3-гексил, циклопропил, циклобутил, циклопентил, циклогексил, 2-метил-2-пропил, 2-метилциклопропил, 2-метилаллил, 1-проп-2-инил, 1-бут-2-инил, 3-метил-1-пентил, 1-гекс-1-ен-3-инил.
В настоящем контексте под термином «галоген» имеют в виду соединения седьмой основной группы Периодической системы, то есть фтор, хлор, бром и йод, и, в особенности, хлор и бром.
Термины «нормальный» и «эпи», используемые для описания абсолютной конфигурации соединения по настоящему изобретению, относятся к абсолютной конфигурации самого природного витамина D3. Следовательно, если конфигурацию данного углерода называют «нормальной», она соответствует конфигурации витамина D3 для данного конкретного атома углерода. Аналогичным образом, если конфигурацию данного углерода называют «эпи», это конфигурация, противоположная конфигурации витамина D3 для данного конкретного атома углерода.
Особенное значение для настоящего изобретения имеет лечение вторичного гиперпаратиреоидизма (s-HPT), например, в связи с почечной недостаточностью, с использованием витамина D и его аналогов. Гиперпаратиреоидизм является заболеванием, которое характеризуется повышенной секрецией паратиреоидного гормона из паращитовидных желез. При s-HPT причиной увеличенной секреции является не дисфункция данных желез, а скорее факторы вне желез, например почечная недостаточность. Витамин D абсорбируется из пищи или вырабатывается в коже в проформе, которую нужно активировать, чтобы достигнуть биологически активного состояния. Часть этой активации происходит в почках как гидроксилирование данной проформы. У пациентов с почечной недостаточностью, например у пациентов, подвергаемых диализу, данное гидроксилирование снижено, что приводит к более низкому уровню активного витамина D в крови. Как указывалось выше, низкий уровень витамина D приводит к большой выработке паратиреоидного гормона, и это патологическое состояние называется вторичным паратиреоидизмом.
Паратиреоидный гормон оказывает значительное влияние на клетки в костях, приводя к выделению ими кальция в кровоток. При непатологических условиях данный процесс является хорошо сбалансированным для обеспечения соответствующего уровня кальция в костях. Однако при повышенных уровнях паратиреоидного гормона в течение продолжительных периодов времени кости будут терять слишком много кальция и станут хрупкими и, таким образом, более склонными к переломам. Данное состояние называется остеодистрофией и остемаляцией, от которых часто страдают почечные пациенты. Кроме того, найдено, что продолжительное воздействие паратиреоидных гормонов оказывает токсическое действие на многие жизненно важные органы, например мышцы скелета, нервы и репродуктивную систему [Malluche, Kidney Int., 367-374, 62, 2002].
Один из способов регулирования уровня паратиреоидного гормона состоит во введении витамина D или его аналогов, которые будут ингибировать секрецию указанного гормона. Однако подобное терапевтическое вмешательство может быть затруднено серьезными неблагоприятными побочными эффектами, часто сопровождающими терапию витамином D. Как указывалось ранее, эффект витамина D и многих его аналогов заключается в повышенном поглощении кальция из кишечника, что может привести к гиперкальцемии. Данный эффект может ограничить полезность аналогов, которые выгодны в других отношениях. Таким образом, цель многих проводимых исследований витамина D заключается в сведении к минимуму кальцемического эффекта, при максимизации, в то же время, клинического эффекта. В идеале, если были идентифицированы структурные звенья в молекуле витамина D, ответственные за различные активности, можно было бы манипулировать этими структурами для получения селективности, например никакой кальцемической активности, но высокий супрессивный эффект по отношению к секреции паратиреоидного гормона. К сожалению, до сих пор не установлено подобной ясной зависимости структура-активность. Однако в этом отношении может помочь недавнее наблюдение Brandi в Nephrol Dial Transplant, 829-842, 17, 2002. Brandi сравнивает РТН супрессивный эффект кальцитриола, то есть 1,25(ОН)2D3 и его проформы, 1α(ОН)D3. 1α(ОН)D3 гидроксилируется в печени до 1,25(ОН)2D3, и вследствие различной фармакокинетики этих двух соединений биодоступность 1,25(ОН)2D3 была значительно ниже, когда пациенту вводили 1α(ОН)D3, чем когда пациенту вводили 1,25(ОН)2D3. Несмотря на разницу в биодоступности 1,25(ОН)2D3 при двух режимах дозировок, в подавлении секреции РТН не было существенного различия. Это приводит к предположению о том, что 25-гидроксильная группа не является обязательной для РТН супрессивного эффекта. Таким образом, одним из способов достижения желательной селективности могло бы стать блокирование 25-положения в структуре витамина D так, чтобы его нельзя было гидроксилировать, и таким образом сохраняя или даже повышая РТН супрессивный эффект, лишая, в то же время, молекулу другого витамина D родственных активностей и, в частности, ее кальцемического эффекта.
Кальцемические активности соединений по настоящему изобретению определяли на крысах in vivo, как описано ранее (Binderup, L., Bramm, E., Biochem. Pharmacol. 37, 889-895 (1988)). РТН супрессивный эффект соединений по настоящему изобретению определяли in vitro на бычьих паратиреоидных клетках: у взрослого крупного рогатого скота отбирали свежие бычьи паращитовидные железы через 20 минут после забоя. Из рубленой паратиреоидной ткани диспергированные паратиреоидные клетки получали, как описано ранее (E.M. Brown, S. Hurwitz and G.D. Aurbach; Preparation of viable bovine parathyroid cells; Endocrinology, 1976, vol. 99, no 6, 1582-1588). Затем клетки обрабатывали аналогами витамина D в течение 60 часов при 37°С и определяли РТН секрецию витамина D.
В таблице А перечислены супрессивные эффекты РТН и кальцемические активности соединений по настоящему изобретению. В качестве соединения сравнения использовали кальцитриол (1,25(ОН)2D3).
| Таблица АКальцемическая активность на крысах in vivo в соответствии с Binderup et al. Biochem. Pharmacol. 37, 889-895 (1988) и РТН супрессивный эффект, испытанный in vitro на бычьих паратиреоидных клетках согласно приведенному выше протоколу соединения по настоящему изобретению относительно кальцитриола (1,25(ОН)2D3) | ||
| Соединение | Кальцемическая активность in vivo относительно кальцитриола (1,25(ОН)2D3) | РТН секреция in vitro относительно необработанных бычьих паратиреоидных клеток (необработанные клетки в качестве контроля = 100%) |
| Кальцитриол | 100% | 60% |
| 1 | <10% | 57% |
| 3 | 1% | 61% |
| 6 | 1% | 56% |
| 7 | <0,5% | 65% |
| 25 | 8% | 74% |
| 27 | <0,5% | 65% |
| 28 | 1% | 62% |
Данные, приведенные в таблице А, показывают, что соединения по настоящему изобретению обладают сопоставимым РТН супрессивным эффектом по сравнению с соединением сравнения кальцитриолом (1,25(ОН)2D3) наряду с неожиданно более низким кальцемическим эффектом, чем соединение сравнения.
Таким образом, соединения по настоящему изобретению неожиданно проявляют высокую селективность, например ингибирование выработки паратиреоидного гормона, без нежелательного влияния аналогов витамина D, таких как 1,25(ОН)2D3, на баланс кальция в организме, включая кальцемическую и кальциурическую активности.
Таким образом, в конкретном варианте осуществления изобретение предоставляет способ лечения, предупреждения или улучшения состояния при s-НРТ, а в частности, s-НРТ, связанного с почечной недостаточностью, при этом данный способ включает в себя введение нуждающемуся в этом пациенту эффективного количества соединения формулы I. Необязательно указанный способ может включать в себя лечение другими терапевтически активными соединениями, обычно применяемыми при лечении указанного выше заболевания. Указанные соединения можно вводить сопутствующим образом или последовательно с соединениями по настоящему изобретению, и, в частности, они включают в себя фосфатные связывающие вещества.
Применение соединений по настоящему изобретению не может быть ограничено лечением s-PTH. Хорошо известно, что витамин D и его аналоги могут оказаться полезными при лечении множества заболеваний благодаря их высокой активности при вызывании дифференцировки и ингибировании нежелательной пролиферации некоторых клеток, включая клетки кожи и раковые клетки, а также иммуномодулирующему эффекту и эффекту роста и сохранения костей (Brown AJ: Vitamin D analogues. Am J Kidney Dis 32 (Suppl): S25-S39, 1988; Brown AJ et al.: Vitamin D. Am Physiol 277:F157-F175, 1999). Соответственно, в изобретении также предложен способ лечения, предупреждения или улучшения состояния при заболеваниях, характеризуемых аномальной дифференцировкой клеток и/или пролиферацией клеток, рака, лейкемии, рака груди, глиального рака мозга, остеосаркомы, меланомы, миелосклероза, псориаза, первичного гиперпаратиреоидизма, сахарного диабета, дискоидальной и системной красной волчанки, хронических кожных болезней аутоиммунного типа, гипертензии, угрей, алопеции, старения кожи, СПИДа, нейродегенеративных нарушений, болезни Альцгеймера, реакций хозяина против трансплантата и трансплантата против хозяина, отторжений трансплантатов, вызванной стероидами атрофии кожи и остеопороза, и для вызывания остеогенеза, при этом данный способ включает в себя введение нуждающемуся в этом пациенту эффективного количества соединения формулы I. Необязательно, указанный способ может включать в себя лечение другими терапевтически активными соединениями, обычно используемыми при лечении указанных выше заболеваний. Указанные соединения можно вводить сопутствующим образом, или последовательно с соединениями по настоящему изобретению, и они включают в себя фосфатные связывающие вещества, стероиды и анти-пролиферативные агенты.
При системном лечении с использованием настоящего изобретения вводят дневные дозы 0,001-2 мкг на килограмм массы тела, предпочтительно 0,002-0,3 мкг/кг массы тела млекопитающего, например 0,003-0,3 мкг/кг соединения формулы I, обычно соответствующие дневной дозе для взрослого человека от 0,1 до 200 мкг. Однако подходящий режим дозировки может включать в себя дозировку с более длительными интервалами, например каждый следующий день, каждую неделю, или даже с более продолжительными интервалами. При местном лечении дерматологических нарушений вводят мази, кремы или лосьоны, содержащие 0,1-1000 мкг/г и предпочтительно 0,1-500 мкг/г, например, 0,1-200 мкг/г соединения формулы I. Для местного применения в офтальмологии вводят мази, капли или гели, содержащие 0,1-1000 мкг/г и предпочтительно 0,1-500 мкг/г, например, 0,1-100 мкг/г соединения формулы I. Пероральные композиции составляют предпочтительно в виде таблеток, капсул или капель, содержащих от 0,07-100 мкг, предпочтительно 0,1-50 мкг соединения формулы I на разовую дозу.
В следующем предпочтительно аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы I. Препараты по настоящему изобретению как для ветеринарного медицинского применения, так и для использования для человека содержат активные ингредиенты в сочетании с фармацевтически приемлемыми носителем(лями) и, необязательно, другой терапевтический ингредиент(ы). Носитель(ли) должны быть «приемлемыми» в смысле совместимости с прочими ингредиентами данных препаратов и невредными по отношению к их реципиенту.
Обычно единичная доза состава содержит от 0,05 мкг до 100 мкг, предпочтительно от 0,1 мкг до 50 мкг соединения формулы I.
Под термином «единичная доза» имеют в виду единичную, то есть разовую дозу, которую можно ввести пациенту и с которой легко обращаться и упаковывать, которая остается в виде физически и химически стабильной разовой дозы, содержащей либо активное вещество как таковое, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Препараты включают в себя, например, препараты в форме, пригодной для перорального (включая продолжительное или рассчитанное по времени высвобождение), ректального, парентерального (включая подкожное, внутрибрюшинное, внутримышечное, внутрисуставное и внутривенное), чрескожного, офтальмологического, местного, назального или буккального ведения.
Препараты можно удобно представить в виде стандартной лекарственной формы и их можно изготовить любым из способов, известным в области фармации, например, как описано Remington, The Science and Practice of Pharmacy, 20th ed., 2000. Все способы включают в себя стадию объединения активного ингредиента с носителем, который представляет собой один или несколько дополнительных ингредиентов. Как правило, составы изготавливают равномерно и тонко смешивая активный ингредиент с жидким носителем или тонкоизмельченным твердым носителем, или ими обоими, а затем, в случае необходимости, формуя продукт в желательный препарат.
Препараты по настоящему изобретению, подходящие для перорального введения, могут иметь форму отдельных единиц, таких как капсулы, саше, таблетки или пастилки, каждая из которых содержит заранее определенное количество активного ингредиента; форму порошка или гранул; форму раствора или суспензии в водной жидкости или неводной жидкости, такой как этанол или глицерин; или форму эмульсии масло-в-воде или вода-в-масле. Подобные масла могут быть пищевыми маслами, например хлопковым маслом, кунжутным маслом, кокосовым маслом или арахисовым маслом. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают в себя синтетические или природные смолы, такие как трагакантовая камедь, альгинат, аравийская камедь, декстран, карбоксиметилцеллюлоза натрия, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Кроме того, активные ингредиенты можно вводить в виде болюса, электуария или пасты.
Таблетку можно изготовить, прессуя или формуя активный ингредиент необязательно с одним или более дополнительными ингредиентами. Прессованные таблетки можно изготовить прессованием в подходящем аппарате активного ингредиента(ов) в сыпучей форме, такой как порошок или гранулы, необязательно, смешанного со связывающим веществом, например, таким как лактоза, глюкоза, крахмал, желатин, аравийская камедь, трагакантовая камедь, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воски или тому подобное; смазывающим веществом, например, таким как олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или тому подобное; разрыхляющим агентом, например, таким как крахмал, метилцеллюлоза, агар-агар, бентонит, кроскармеллоза натрия, гликолят натриевого крахмала, кросповидон или тому подобное, или диспергирующим агентом, таким как полисорбат 80. Формованные таблетки можно изготовить формованием, в подходящем аппарате, смеси порошкообразного активного ингредиента и подходящего носителя, увлажненного инертным жидким разбавителем.
Препараты для ректального введения могут иметь вид суппозиториев, в которых соединение по настоящему изобретению смешано с низкоплавкими растворимыми в воде или нерастворимыми в воде твердыми веществами, такими как масло какао, гидрогенизированные растительные масла, полиэтиленгликоль или сложные эфиры жирных кислот полиэтиленгликолей, хотя можно изготовить эликсиры с использованием миристилпальмитата.
Удобно, чтобы препараты, подходящие для парентерального введения, содержали стерильный масляный или водный препарат активных ингредиентов, предпочтительно изотоничный крови реципиента, например изотонический раствор соли, изотонический раствор глюкозы или буферный раствор. Препарат удобно стерилизовать, например, фильтрованием через удерживающий бактерии фильтр, добавлением стерилизующего агента к препарату, облучением препарата или нагреванием препарата. Также для парентерального введения подходят липосомные препараты, описанные, например, в Encyclopedia of Pharmaceutical Technology, vol.9, 1994.
Альтернативно, соединение формулы I можно представить в виде стерильного твердого препарата, например высушенного вымораживанием порошка, который легко растворяется в стерильном растворителе перед использованием.
Чрескожные препараты могут иметь вид пластыря или повязки.
Препараты, подходящие для офтальмологического введения, могут иметь вид стерильного водного препарата активных ингредиентов, которые могут быть в микрокристаллической форме, например в виде водной микрокристаллической суспензии. Для представления активного ингредиента для офтальмологического введения можно также использовать липосомные препараты или системы биоразлагаемых полимеров, например, описанные в Encyclopedia of Pharmaceutical Technology, vol.2, 1989.
Препараты, подходящие для местного или офтальмологического введения, включают в себя жидкие или полужидкие препараты, такие как жидкие мази, лосьоны, гели, пластыри, эмульсии масло-в-воде или вода-в-масле, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.
Препараты, подходящие для назального или буккального ведения, включают в себя порошок, самораспыляющиеся и спреевые препараты, такие как аэрозоли и пульверизаторы.
Пролекарства настоящего изобретения можно также доставлять при использовании моноклональных антител, с которыми связаны молекулы соединения.
Помимо указанных выше ингредиентов, препараты соединения формулы I могут содержать один или более дополнительных ингредиентов, таких как разбавители, буферные агенты, ароматизаторы, красители, поверхностно-активные агенты, загустители, консерванты, например метилгидроксибензоат (включая антиоксиданты), эмульгирующие агенты и так далее.
Кроме того, указанные препараты могут также содержать другие терапевтически активные соединения, обычно используемые для лечения упомянутых выше заболеваний. Примеры подобных соединений включают в себя фосфатные связывающие вещества, стероиды и антипролиферативные агенты.
В еще одном аспекте изобретение относится к использованию соединения формулы I, необязательно, вместе с другим терапевтически активным соединением для производства лекарственного средства, предназначенного для лечения аномальной дифференцировки клеток и/или пролиферации клеток, рака, лейкемии, рака груди, глиального рака мозга, остеосаркомы, меланомы, миелосклероза, псориаза, первичного гиперпаратиреоидизма, s-PTH, s-PTH, связанного с почечной недостаточностью, сахарного диабета, дискоидной и системной красной волчанки, хронических дерматитов аутоиммунного типа, гипертензии, угрей, алопеции, старения кожи, СПИДа, нейродегенеративных нарушений, болезни Альцгеймера, реакций хозяина против трансплантата и трансплантата против хозяина, отторжения трансплантатов, вызванной стероидами атрофии кожи и остеопороза, и для вызывания остеогенеза. Указанное другое терапевтически активное соединение можно просто выбрать, например, из числа фосфатных связывающих веществ, стероидов и антипролиферативных агентов.
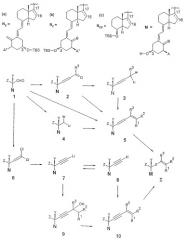
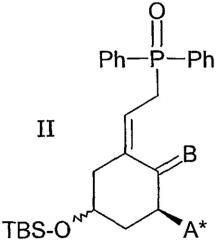
Соединение формулы I можно получить из промежуточных соединений 1 по реакционной схеме 1.
Схема 1
Символ * использован на схеме 1 для указания того, что группа А* в промежуточном соединении может либо быть идентична группе А, находящейся в соединении I (например, фтор в NZ), либо, альтернативно, может являться группой, которую можно преобразовать в нее на любой последующей стадии данного синтеза (например, гидроксил, защищенный силиловым эфиром, в NZ). Хотя это формально и не указано таким образом, аналогичная ситуация может также относится к переменным R1, R2, R3, Y и Z на схеме 1. Кроме того, идентичность N (то есть NE, NZ или NCD) и/или одной или более переменной группы(групп) может изменяться от промежуточного соединения к промежуточному соединению по ходу последовательности реакций. Однако действительная идентичность будет очевидна из конкретного контекста. Следует отметить, что хотя Cl и Li являются атомными символами (как С, Н и О), в качестве аббревиатуры функциональной группы или элемента, стабилизирующего литийорганические вещества, используют букву W. Конфигурацию (Е или Z) двойной связи (которая станет Х = этилен в конечных соединениях I) оставляют неопределенной в схеме 1 (рисуя линейное расположение), но определяют в случае необходимости.
Исходные соединения типа 1 и некоторые примеры промежуточных соединений типа 2, 4, 6, 7 и 8 хорошо известны специалисту в данной области техники и были описаны в литературе, например, G.-D. Zhu and W.H. Okamura в Chem. Rev. 1995, 95, 1877-1952. Суффиксы а, b и с устанавливают структуру группы N, определенной вверху схемы 1.
В общих чертах предполагаемые реакции, кото