Улучшенный способ получения -полиморфного бромгидрата элетриптана
Иллюстрации
Показать всеИзобретение относится к способу получения α-полиморфного бромгидрата элетриптана, включающему стадии (а) обработки раствора элетриптана в 2-бутаноне бромистоводородной кислотой и (b) отгонки азеотропной смеси 2-бутанона/воды до завершения образования безводного α-полиморфного бромгидрата элетриптана, а также к способу получения кристаллической α-полиморфной формы бромгидрата элетриптана, включающему (а) обработку раствора исходного вещества бромгидрата элетриптана в смеси 2-бутанона и воды и (b) отгонку азеотропной смеси 2-бутанона/воды до завершения образования безводного α-полиморфного бромгидрата элетриптана. Настоящее изобретение направлено на уменьшение трудоемкости способа получения α-полиморфа бромгидрата элетриптана, обеспечивающего высокий выход получения α-полиморфа бромгидрата элетриптана. Получаемый заявленными способами продукт является исключительно безводным α-полиморфом бромгидрата элетриптана с высоким выходом, т.е. получение других полиморфных форм или сольватов бромгидрата элетриптана при осуществлении заявленных способов не наблюдается. 2 н. и 9 з.п. ф-лы.
Реферат
Настоящее изобретение относится к улучшенному способу получения α-полиморфной кристаллической формы бромгидрата элетриптана.
Элетриптан, 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индол и способ его получения описаны в US-B-5607951. Дополнительные способы получения элетриптана описаны в ЕР-В-1088817 и WO-A-02/50063.
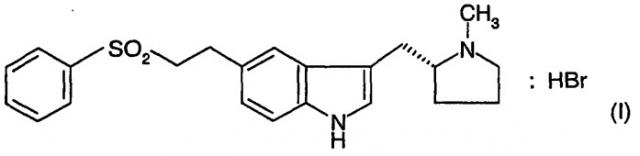
Бромгидрат элетриптана имеет структуру формулы (I) ниже.
WO-A-96/06842 описывает бромгидрат элетриптана, две из его кристаллических форм и способы их получения. Одна из кристаллических форм, описанная в настоящем описании, обозначенная как α-форма, в настоящее время имеется на рынке для лечения мигрени под названием Relpax™.
WO-A-00/32589 описывает кристаллический моногидрат бромгидрата элетриптана и способы его получения.
Два способа для превращения свободного основания элетриптана в α-полиморф бромгидрата элетриптана описаны в WO-A-96/06842. В соответствии с первым способом раствор элетриптана в ацетоне обрабатывали водным раствором бромистого водорода и полученное масло кристаллизовали из 2-пропанола. В соответствии со вторым способом раствор элетриптана в ацетоне обрабатывали водным раствором бромистого водорода и реакционную смесь суспендировали, нагревали с обратным холодильником, охлаждали и суспендировали второй раз.
В широких масштабах выход бромгидрата элетриптана с использованием таких способов предшествующей области техники находится в области 73%.
Необходимо принимать во внимание, что в получении достаточных количеств бромгидрата элетриптана для удовлетворения общего рынка Relpax™ увеличение выхода, особенно на последней стадии промышленного способа, является чрезвычайно важным для уменьшения стоимости лекарственного продукта и, следовательно, является промышленно важным. Любой успешный способ должен также быть трудоемким в смысле надежного получения однородного продукта, содержащего такую же кристаллическую форму, свободную от других кристаллических форм и сольватов.
В настоящее время было неожиданно обнаружено, что надежный способ с высоким выходом получения α-полиморфа бромгидрата элетриптана обеспечивается (а) обработкой раствора элетриптана 2-бутаноном с бромистоводородной кислотой и (b) отгонкой азеотропной смеси 2-бутанон/вода, пока не завершится образование безводного α-полиморфного бромгидрата элетриптана.
Выход, получаемый при использовании этого способа в крупномасштабном производстве, составляет от 93 до 96%. Получаемый продукт является исключительно α-полиморфом бромгидрата элетриптана; не наблюдали других полиморфных форм или сольватов. Предпочтительно получаемый продукт имеет желаемое белое окрашивание.
Считают, что продукт стадии (а) является гидратом, вероятно, моногидратом, описанным в WO-A-00/32589. Этот гидрат затем превращается на стадии (b) с образованием желаемого продукта.
Исходное вещество элетриптана является предпочтительно сухим (менее чем 0,3% воды по анализу Карла Фишера) и свободным от загрязнения частицами (раствор в 2-бутаноне может быть отфильтрован, если необходимо). Бромистоводородная кислота является предпочтительно 48% водным раствором и преимущественно добавляется в реакционный сосуд в виде раствора в 2-бутаноне в течение, по меньшей мере, часа и при комнатной температуре. При таком добавлении рН реакционной смеси не падает ниже 5 и образуется более чистая реакционная смесь с более высоким выходом. Применение от 0,95 до 1,05 молярных эквивалентов бромистоводородной кислоты является предпочтительным, применение 0,98 молярных эквивалентов является оптимальным. Всего около 21 литра 2-бутанона на килограмм исходного вещества элетриптана должно предпочтительно расходоваться. После добавления бромистоводородной кислоты реакционную смесь перемешивают предпочтительно в течение, по меньшей мере, 3 часов.
Во время азеотропной перегонки практически вся вода должна быть удалена из реакционной смеси. Остаточное содержание воды менее чем 0,5% мас./мас. является предпочтительным. Когда около 21 литра 2-бутанона на килограмм исходного вещества элетриптана расходуется в сочетании с 0,98 эквивалентами 48% бромистоводородной кислоты, окончательный объем около 11 литров на килограмм элетриптана является идеальным.
Продукт легко выделяют фильтрацией. Обычно реакционной смеси давали медленно остыть до комнатной температуры, необязательно гранулировали, фильтровали, далее промывали 2-бутаноном и сушили.
α-Полиморфный бромгидрат элетриптана, полученный вышеуказанным способом, необязательно подвергать последующей стадии, известной как стадия прокаливания полиморфа, которая увеличивает его устойчивость к последующему гидрированию. Следовательно, в соответствии с необязательной стадией (с) продукт со стадии (b) суспендировали при орошении толуолом и часть толуола удаляли дистилляцией. Предпочтительно удаляли, по меньшей мере, 12% толуола; наиболее предпочтительно удаляли около 16,5%. Стадию (с) можно повторить, если нужно.
Исходный объем 15 литров толуола на килограмм бромгидрата элетриптана является предпочтительным. Для оптимальных результатов перегонка толуола должна повторяться дважды, и необходимо поддерживать нагревание реакционной смеси при субтемпературе флегмы в течение минимум двух часов между перегонками. Субтемпература флегмы около 106°C является идеальной. Конечный продукт обычно выделяют фильтрацией. Обычно реакционную смесь охлаждали до комнатной температуры, гранулировали, фильтровали, промывали дополнительным количеством толуола и сушили.
Стадию (с) преимущественно проводили в атмосфере азота для предотвращения обесцвечивания продукта.
Следующий вариант воплощения изобретения обеспечивает способ образования стабильного α-полиморфного бромгидрата элетриптана из любой другой полиморфной и/или сольватированной/гидратированной формы бромгидрата элетриптана или из смеси различных полиморфных и/или сольватированных/гидратированных форм (включая смесь, содержащую α-полимерную форму как таковую).
Этот процесс превращения включает стадии (а) кристаллизации раствора исходного вещества бромгидрата элетриптана в смеси 2-бутанона и воды и (b) отгонки азеотропа 2-бутанона/воды до завершения образования безводного α-полиморфного бромгидрата элетриптана. Необязательная стадия прокаливания (с), как описано выше, также может быть проведена.
Этот способ является особенно преимущественным, так как ранее только осуществимый крупномасштабный способ превращения смешанных полиморфных и/или сольватированных/гидратированных форм бромгидрата элетриптана в чистый α-полиморф бромгидрата элетриптана в качестве предварительной стадии включал разрушение соли до свободного основания.
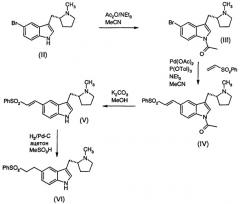
Элетриптан предпочтительно получают в соответствии со схемой 1 ниже.
Схема 1
Соединение (II) ((R)-5-бром-3-(N-метилпирролидин-2-илметил)-1Н-индол) может быть получено способами, описанными в US-B-5607951 или EP-B-1088817.
Соединение (III) ((R)-1-ацетил-5-бром-3-(N-метилпирролидин-2-илметил)-1Н-индол) может быть получено обработкой раствора соединения (II) в ацетонитриле ангидридом уксусной кислоты и триэтиламином. Реакцию предпочтительно проводят при нагревании с обратным холодильником.
Соединение (IV) ((R)-1-ацетил-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол) может быть получено обработкой раствора соединения (III) в ацетонитриле триэтиламином, три-о-толилфосфином, ацетатом палладия и фенилвинилсульфоном. Реакцию предпочтительно проводят при нагревании с обратным холодильником.
Соединение (II) может быть легко преобразовано в соединение (IV) без выделения соединения (III).
Соединение (V) ((R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол) может быть получено обработкой раствора соединения (IV) в метаноле карбонатом калия. Реакцию предпочтительно проводят при комнатной температуре. Подобный способ, описанный в предшествующей области техники (см. пример 58 US-B-5607951), использует перекристаллизацию для очистки и выделения соединения (V). Перекристаллизация является самым эффективным средством очистки, особенно из смеси ацетонитрила и воды или смеси ацетона и воды, но выход полученного продукта ниже оптимального. Неожиданно было обнаружено, что колоночная хроматография является более эффективным способом очистки сырого соединения (V), даже в большом многокилограммовом объеме, и значительно больший выход продукта может быть достигнут этим способом.
Когда используется хроматография для очистки соединения (V), метанольный раствор, получающийся в реакции, фильтровали и нейтрализовали водной кислотой, предпочтительно фосфорной кислотой. Затем смесь загружали в колонку, упакованную с подходящей стационарной фазой (предпочтительно полимером стирола, таким как смола CG-161, доступная от Tosoh Bioscience). Колонку элюировали смесью ацетона и водной кислоты (предпочтительно уксусной или фосфорной кислоты) и фракции, содержащие продукт, объединяли и концентрировали. Ацетон добавляли к концентрированному раствору и рН доводили до от 10 до 11 с использованием подходящего основания, такого как карбонат калия, для того чтобы осадить продукт. Продукт собирали, промывали водой и сушили.
Соединение (VI) (элетриптан) может быть получено обработкой раствора соединения (V) в смеси ацетона и воды палладием на угле и метансульфоновой кислотой в атмосфере водорода. Катализатор, включающий 5% палладия на угле, является предпочтительным. Особенно преимущественным катализатором для использования в этом способе является РМС 2020С (поставляемый Precious Metals Corporation), требующий такую же низкую загрузку катализатора, как 7% палладия на угле.
Следующие примеры иллюстрируют определенные способы осуществления изобретения. Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием прибора DSC-7 Perkin Elmer. Приблизительно 10 мг каждого образца тщательно отвешивали в 50-микролитровый алюминиевый лоток. Образцы нагревали при 20°С/минуту в диапазоне от 40°С до 220°С с продувкой газообразным азотом.
Пример 1
(а) (R)-5-Бром-3-(N-метилпирролидин-2-илметил)-1Н-индол (256 кг), ацетонитрил (380 кг), триэтиламин (115 кг) и ангидрид уксусной кислоты (115 кг) загружали в сухой остеклованный сосуд. Реакционную смесь нагревали до образования обратного тока и поддерживали при такой температуре в течение 4,5 часов.
(b) Смесь ацетонитрила (375 кг), ацетата палладия (12,5 кг) и три-о-толилфосфина (60 кг) перемешивали в течение 1 часа. Добавляли фенилвинилсульфон (160 кг), триэтиламин (92 кг) и, наконец, раствор, полученный в части (а), и смесь нагревали до образования обратного тока в течение 7,5 часов. Реакционную смесь охлаждали и добавляли раствор 190 кг концентрированной соляной кислоты в 1200 кг воды в течение 4 часов. Полученную смесь фильтровали для удаления отработанного катализатора и добавляли еще 3000 кг воды и 300 кг 50% масс./масс. водного раствора гидроксида натрия к фильтрату для осаждения продукта. Полученную суспензию фильтровали и промывали водой (500 кг) для получения сырого (R)-1-ацетил-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индола в виде темно-коричневого, влажного, кристаллического твердого вещества (535 кг влажного, эквивалентного 338 кг сухого). Такой сырой продукт добавляли к 530 кг ацетона и смесь нагревали до 60°С. При достижении этой температуры добавляли 814 кг воды в течение 2 часов, при этом одновременно охлаждая смесь обратно до температуры окружающей среды. Затем партию гранулировали в течение 2 часов и фильтровали для получения очищенного продукта (350 кг влажного, эквивалентные 280 кг сухого, 83%).
Пример 2
Метанол (660 кг) и (R)-1-ацетил-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (77 кг сухого эквивалента перекристаллизованного продукта примера 1) загружали в сосуд и полученную смесь перемешивали в течение 5 минут. Добавляли карбонат калия (8,9 кг) и смесь перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь нагревали до 35°С и добавляли фолиевый углерод (11,6 кг) и воду (235 кг). Полученную смесь фильтровали и фильтрат разводили добавлением воды (1300 кг, добавленной в течение двух часов) и гранулировали в течение 2 часов при комнатной температуре. Фильтрация давала сырой (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (75 кг влажного, эквивалентные 60,5 кг сухого, 88%).
Пример 3
Смесь ацетонитрила (940 кг) и сырого (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индола (478 кг сухого эквивалента, продукт способа примера 2) нагревали до 55°С. Добавляли воду (720 кг) и смесь охлаждали до 20°С и гранулировали в течение 2 часов при этой температуре. Чистый (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (482 кг влажного, эквивалентные 393 кг сухого, 82%) извлекали фильтрацией.
Пример 4
Ацетон (1140 кг) и (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (482 кг сухого эквивалента, перекристаллизованный продукт примера 3) загружали в сосуд и смесь нагревали до 55°С. Добавляли воду (1520 кг) и смесь охлаждали до 20°С и гранулировали в течение 2 часов. Перекристаллизованный (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (492 кг влажного, 343 кг сухого эквивалента, 87%) выделяли фильтрацией.
Пример 5
(R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол (200 кг сухого эквивалента) и ацетон (1186,5 кг) загружали в сухой, остеклованный сосуд. Добавляли деионизированную воду (300 кг), дополнительный ацетон (237 кг), метансульфоновую кислоту (55 кг) и суспензию палладия на угле (22,4 кг сухого эквивалента) в деионизированной воде (200 кг) и смесь гидрировали в атмосфере газообразного водорода. Реакционную взвесь фильтровали для удаления катализатора. Добавляли деионизированную воду (1300 кг) и 48% водный раствор гидроксида натрия (60 кг) для осаждения продукта, который выделяли фильтрацией и промывали смесью деионизированной воды (210 кг), ацетона (83 кг) и дополнительной деионизированной воды (710 кг) для получения 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (220 кг влажного, 157,65 кг сухого, 78,41%).
Пример 6
3-{[1-Метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индол (15 кг) и 2-бутанон (204 кг) загружали в сухой остеклованный сосуд. Добавляли раствор 48% водной бромистоводородной кислоты (6,45 кг) в 2-бутаноне (63 кг) и полученную взвесь подвергали азеотропной перегонке до остаточного объема 150 литров. Реакционную смесь охлаждали до 17,5°C и продукт выделяли фильтрацией. Продукт промывали 2-бутаноном (16 кг) для получения α-полиморфной формы бромгидрата 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (18,2 кг влажного, 17,5 кг сухого), 96,3%).
ДКС: Наблюдали один основной эндотерм с максимумом пика в диапазоне 173°С-179°С, показательный для α-полиморфа (см. WO-A-96/06842).
Пример 7
α-Полиморфный бромгидрат 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (300 кг) и толуол (3892 кг) загружали в сухой остеклованный сосуд. Полученную взвесь нагревали с обратным холодильником и приблизительно 666 кг толуола удаляли перегонкой. Суспензию охлаждали до 100-105°С и затем еще 666 кг толуола удаляли перегонкой. Затем реакционную взвесь охлаждали до 22,5°С и продукт выделяли фильтрацией. Продукт промывали толуолом (908 кг) для получения α-полиморфного бромгидрата 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (289 кг сухой массы, 96,3%).
ДКС: Наблюдали один основной эндотерм с максимумом пика в диапазоне 173°С-179°С, показательный для α-полиморфа (см. WO-A-96/06842).
Пример 8
Бромгидрат 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (10 кг), 2-бутанон (63 кг) и деионизированную воду (0,65 кг) загружали в сухой остеклованный сосуд и нагревали до 67,5°С для образования раствора. Раствор затем охлаждали до 60°С и добавляли еще 2-бутанон (42 кг) для осаждения продукта. Полученную взвесь подвергали азеотропной перегонке до остаточного объема реакционной смеси 50 литров и затем охлаждали до 22,5°С. Продукт выделяли фильтрацией и промывали 2-бутаноном (10,5 кг) для получения α-полиморфного бромгидрата 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (9,3 кг сухой массы, 93%).
ДКС: Наблюдали один основной эндотерм с максимумом пика в диапазоне 173°С-179°С, показательный для α-полиморфа (см. WO-A-96/06842).
Сравнительный пример
3-{[1-Метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индол (274 кг) и ацетон (3419 кг) загружали в сухой остеклованный сосуд. Добавляли раствор 48% водной бромистоводородной кислоты (114,7 кг) в ацетоне (1383 кг) при температуре от 50 до 55°С в течение 1 часа и полученную суспензию перемешивали в течение 4 часов. Реакционную смесь охлаждали до от 30 до 35°С и продукт выделяли фильтрацией. Продукт промывали ацетоном (861 кг) для получения α-полиморфной формы бромгидрата 3-{[1-метилпирролидин-2(R)-ил]метил}-5-(2-фенилсульфонилэтил)-1Н-индола (242,4 кг сухого, 73,0%).
ДКС: Наблюдали один основной эндотерм с максимумом пика в диапазоне 173°С-179°С, показательный для α-полиморфа (см. WO-A-96/06842).
1. Способ получения α-полиморфного бромгидрата элетриптана, включающий стадии (а) обработки раствора элетриптана в 2-бутаноне бромистоводородной кислотой и (b) отгонки азеотропной смеси 2-бутанона/воды до завершения образования безводного α-полиморфного бромгидрата элетриптана.
2. Способ по п.1, где содержание воды в реакционной смеси уменьшено до менее чем 0,5 мас.% /мас. на стадии (b).
3. Способ по п.1 или 2, включающий дополнительную стадию суспендирования продукта стадии (b) в орошающем толуоле и удаления части толуола перегонкой.
4. Способ по п.3, где, по меньшей мере, 12% толуола удаляют.
5. Способ по любому из предшествующих пунктов, где исходное вещество элетриптана получают обработкой раствора (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индола в ацетоне палладием на угле и метансульфоновой кислотой в атмосфере водорода.
6. Способ по п.5, где (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол получают обработкой раствора (R)-1-ацетил-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1H-индола в метаноле карбонатом калия.
7. Способ по п.6, где (R)-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индола очищают колоночной хроматографией.
8. Способ по п.6 или 7, где (R)-1-ацетил-5-(2-фенилсульфонилэтенил)-3-(N-метилпирролидин-2-илметил)-1Н-индол получают обработкой раствора (R)-1-ацетил-5-бром-3-(N-метилпирролидин-2-илметил)-1Н-индола в ацетонитриле триэтиламином, три-о-толилфосфином, ацетатом палладия и фенилвинилсульфоном.
9. Способ по п.8, где (R)-1-ацетил-5-бром-3-(N-метилпирролидин-2-илметил)-1Н-индол получают обработкой раствора (R)-5-бром-3-(N-метилпирролидин-2-илметил)-1Н-индола в ацетонитриле ангидридом уксусной кислоты и триэтиламином.
10. Способ получения α-полиморфной формы бромгидрата элетриптана из сольватированной/гидратированной формы бромгидрата элетриптана, включающий (а) обработку раствора исходного вещества бромгидрата элетриптана в смеси 2-бутанона и воды и (b) отгонку азеотропной смеси 2-бутанона/воды до завершения образования безводного α-полиморфного бромгидрата элетриптана.
11. Способ по п.10, включающий дополнительную стадию суспендирования продукта стадии (b) в орошающем толуоле и удаления части толуола перегонкой.