9а-азалиды с противовоспалительной активностью
Иллюстрации
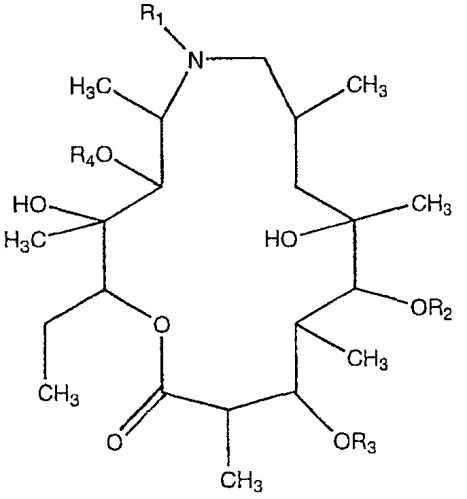
Показать всеДанное изобретение относится к 9А-азалидным соединениям формулы
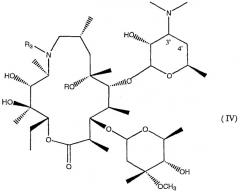
в которой R, R1, R2 и R3 имеют значения, определенные в данном описании, их фармацевтически приемлемым солям, фармацевтическим композициям для лечения воспалительных патологий, содержащим их в качестве активного ингредиента, а также к способу получения соединений формулы (I), который содержит удаление L-кладинозы в положении 3 катализируемой кислотой реакцией гидролиза производных азитромицина формулы II
в которой R, R1, R2 и R3 имеют значения, определенные в данном описании, в присутствии неорганической кислоты и протонного органического растворителя. Технический результат - получение соединений, которые обладают сильнодействующей противовоспалительной активностью и по существу лишены антибиотических свойств. 3 н. и 11 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение относится к макролидам с противовоспалительной активностью, и более конкретно, оно относится к 9а-азалидам без кладинозы в положении 3 с противовоспалительной активностью, их фармацевтически приемлемым солям и фармацевтическим композициям, которые содержат их в качестве активного ингредиента.
Известно, что кроме их антибиотических свойств многие антибиотики обладают также противовоспалительными свойствами [Clin. Immunother., 1996, 6, 454-464].
Азитромицин (The Merck Index, XIII edition, № 917, page 159) является прототипом класса антибиотических макролидов, обычно называемых азалидами, которые широко используют при лечении инфекций верхних и нижних дыхательных путей, одонтостоматологических инфекций, инфекций кожи и мягких тканей и негонококкового уретрита (вызванного Chlamydia trachomatis).
По сравнению с классическими макролидами азалиды обладают широким спектром действия, лучшим проникновением в ткань и таким полупериодом существования, что достаточным является введение его один раз в день.
Недавно научное сообщество обратило внимание на иммуномодулирующие и противовоспалительные активности макролидных антибиотиков [Journal of Antimicrobial Chemotherapy, 1998, 41, Suppl. B, 37-46].
Указанные активности были документированы как клиническими исследованиями, так и экспериментами in vivo и in vitro.
Доказано, что макролиды являются полезными при лечении воспалительных патологий, таких как панбронхиолиты [Thorax, 1997, 52, 915-918], бронхиальная астма [Chest, (1991), 99, 670-673], COPD (хроническое обструктивное легочное заболевание) (CHEST 2001, 120, 730-733), и в частности, доказано, что азитромицин является особенно эффективным при улучшении функции легких у пациентов с муковисцидозом [The Lancet, (1998), 351, 420].
Обнаружено, что активность in vitro макролидов является особенно эффективной при модуляции метаболических функций некоторых клеток иммунной системы, таких как нейтрофилы [The Journal of Immunology, 1997, 159, 3395-4005] и Т-лимфоциты [Life Science, 1992, 51, PL 231-236], и при модуляции медиаторов воспаления, таких как интерлейкин 8 (IL-8) [Am. J. Respir. Crit. Care Med., (1997), 156, 266-271] или интерлейкин 5 (IL-5) (патентные заявки ЕР 0775489 и ЕР 0771564 на имя Taisho Pharmaceutical Co., Ltd).
Нейтрофилы, в частности, составляют первую клеточную линию, подвергаемую рекрутингу у места инфекции или повреждения ткани в самых первых фазах воспалительной реакции.
Нефизиологическая аккумуляция нейтрофилов в воспалительной ткани, их активация, последующее высвобождение протеаз и повышение продуцирования реакционноспособных метаболитов кислорода характеризует некоторые формы воспалительной реакции, которая, в некоторых случаях, перерождается в патологические состояния.
Таким образом, даже если нейтрофилы являются существенными в иммунной защите и в воспалительном процессе, известно, что они вовлекаются в патологии, которые происходят из большинства хронических воспалительных условий и из повреждений посредством ишемической реперфузии (Inflammation and Fever; Viera Stvrtinova, Jan Jakubovsky and Ivan Hulin; Academic Electronic Press, 1995).
В том же самом документе описываются патологии, для которых доказано влияние измененной функциональности нейтрофилов на их генезис и/или на их развитие: они включают в себя атеросклероз, повреждение из-за ишемической реперфузии, ревматоидный артрит, васкулит и гломерулонефрит аутоиммунного происхождения и хронические легочные воспаления, такие как ARDS (респираторный дистресс-синдром взрослых людей).
COPD (хроническое обструктивное легочное заболевание) является хронической патологией, характеризующейся воспалением и прогрессивной деструкцией ткани легкого, вызванной массивным присутствием активированных нейтрофилов, с последующим высвобождением металлопротеиназ и повышением продуцирования кислородных радикалов [Am. J. Respir. Crit. Care Med., 1996, 153, 530-534] [Chest, 2000, 117 (2 Suppl.), 10S-14S].
Введение макролидов астматикам сопровождается снижением гиперсекреции и бронхиальной повышенной чувствительности, являющихся результатом их антиокислительного и противовоспалительного взаимодействия с фагоцитами и, особенно, с нейтрофилами; это взаимодействие могут предотвратить многие биоактивные липиды, вовлеченные в патогенез бронхиальной астмы, по причине оказания их дестабилизирующей мембраны, провоспалительной активности (Inflammation, Vol. 20, № 6, 1996).
В описании патентной заявки HR20010301 на имя Pliva имеется хорошее описание противовоспалительной активности азитромицина, известного антибактериального агента.
Оно включает в себя подтверждение способности азалида индуцировать апоптоз в нейтрофилах человека in vitro, как уже описано в литературе [J. Antimicrob. Chemother., 2000, 46, 19-26], и обеспечивает доказательство того, что его противовоспалительная активность согласуется с тем, что было описано для классических макролидов (кольца лактонов с 14 членами); в частности, было показано, что введение азитромицина стимулирует дегрануляцию нейтрофилов человека, ингибирует продуцирование реакционноспособных разновидностей кислорода в стимулированных нейтрофилах и, кроме того, ингибирует высвобождение интерлекина 8, который является сильнодействующим нейтрофилспецифическим активирующим и хемиотактическим фактором.
Характерная терапевтическая эффективность макролидов в патологиях, в которых традиционные противовоспалительные лекарственные средства, например, кортикостероиды, как доказано, являются неэффективными [Thorax, (1997), 52, 915-918, уже цитированная], подтверждает значительный интерес в этом новом потенциальном классе противовоспалительных лекарственных средств.
Однако тот факт, что классические макролиды обладают сильнодействующей антибактериальной активностью, не означает, что они могут быть использованы более широко при длительном лечении воспалительных процессов, не вызванных патогенными микроорганизмами; это может фактически вызывать быстрое развитие резистентных штаммов.
Таким образом, было бы желательно иметь новые вещества с макролидной структурой, которые проявляют противовоспалительную активность, но в то же время не обладают антибиотическими свойствами.
Некоторые классы макролидных производных, которые обладают противовоспалительной активностью, описаны в литературе. Например, в уже цитированной заявке на Европейский патент на имя Taisho заявлены производные эритромицина, модифицированные в положениях 3, 9, 11 и 12, как сильнодействующие ингибиторы синтеза IL-5.
В патентной заявке WO 00/42055 на имя Zambon Group описаны 3'-дедиметиламино-9-оксииминмакролиды, обладающие противовоспалительной активностью, но без антибиотической активности.
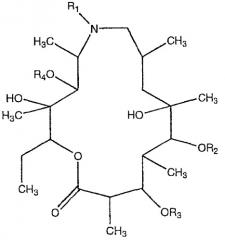
Производные азитромицина, без кладинозы и дезозамина, формулы
в которой
R1 представляет собой атом водорода, низший алкил или низший алканоил; R2, R3 и R4, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой атом водорода или низший алканоил, описаны в качестве противовоспалительных средств в патенте США 4886792 (Sour Pliva); кроме того, в этом же патенте заявлены промежуточные продукты в синтезе вышеуказанных соединений, у которых R2 представляет собой дезозамин, R3 и R4 представляют собой атом водорода и R1 имеет значения, уже указанные.
Использование эритромицина в качестве противовоспалительного средства, которое действует посредством снижения высвобождения интерлейкина 1 через ингибирование гликопротеина млекопитающего mdr-P, заявлено в патентной заявке WO 92/16226 на имя Smith-Kline Beecham Corporation.
Использование азитромицина для лечения неинфекционных воспалительных патологий заявлено в уже цитированной патентной заявке HR20010301 на имя Pliva.
Кроме этого, лечение, другое, чем острое лечение веществами, которые обладают доказанной антимикробной активностью, является очень нежелательным, поскольку, как уже указано, это может вызвать быстрое развитие резистентных штаммов и, в результате этого, препятствие действительной антибиотической терапии. Теперь авторами изобретения неожиданно обнаружено, что удалением кладинозы в положении 3 из 9а-азалидов получают соединения, которые обладают сильнодействующей противовоспалительной активностью и по существу лишены антибиотических свойств.
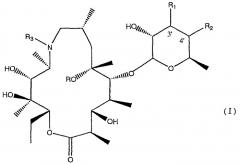
Таким образом, настоящее изобретение относится к соединениям формулы
в которой
R представляет собой атом водорода или метил,
R1 представляет собой атом водорода, N,N-ди-(С1-С3)-алкиламиногруппу, N-оксид N,N-ди-(С1-С3)-алкиламиногруппы, N-(С1-С4)-ацил-N-(С1-С3)-алкиламиногруппу или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4';
R2 представляет собой атом водорода или R2 вместе с R1 образуют связь между атомами углерода у 3' и 4';
R3 представляет собой неразветвленный или разветвленный С1-С5 алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, амино, неразветвленного или разветвленного С1-С5 алкила, С1-С4 алкоксигрупп, С1-С4 алкоксикарбонильных групп, аминокарбонильных групп или цианогрупп, или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы;
Х представляет собой О, S, SO, SO2, NR6 и R6 представляет собой атом водорода, неразветвленный или разветвленный С1-С3 алкил, С1-С3 алкоксикарбонильную группу, бензилоксикарбонильную группу;
Y представляет собой группу С6Н4, гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы, или представляет собой О, S, SO, SO2, NR6, где R6 имеет значения, указанные выше;
r равно целому числу от 1 до 3;
m равно целому числу от 1 до 6;
n равно целому числу от 0 до 2;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида;
и их фармацевтически приемлемым солям; при условии, что, когда R представляет собой атом водорода и R1 представляет собой диметиламиногруппу, R3 отличается от (С1-С5)-алкильной группы.
Соединения формулы I, в которой R представляет собой атом водорода, R1 представляет собой диметиламиногруппу и R3 представляет собой низший алкил, описаны в качестве промежуточных продуктов синтеза в патенте США 4886792 (столбец 3, соединение формулы V) на имя Sour Pliva.
Соединения формулы I являются противовоспалительными макролидами, которые лишены антибиотической активности и могут быть, следовательно, использованы при лечении и профилактике воспалительных патологий.
Термин "неразветвленный или разветвленный С1-С5 алкил" означает группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, трет-бутила, н-пентила и изопентила.
Термин "гетероарил с 5 или 6 членами, содержащими от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы" означает гетероциклы, такие как пиррол, тиофен, фуран, имидазол, пиразол, тиазол, изотиазол, изоксазол, оксазол, пиридин, пиразин, пиримидин, пиридазин, триазол, тиадиазол.
Специалисту в данной области должно быть очевидно, что замещение частично или полностью насыщенными формами гетероарилов, а также присутствие заместителей в ароматических кольцах (фенилах или гетероарилах), рассмотренных в значениях А и Y, создают соединения, которые не выходят за пределы сущности изобретения.
Предпочтительными соединениями формулы I являются соединения, в которых R, R2 и R3 имеют уже указанные значения и R1 представляет собой атом водорода, N-метил-N-(С1-С3)-алкиламиногруппу, N-оксид N-метил-N-(С1-С3)-алкиламиногруппы, N-(С1-С4)-ацил-N-метиламиногруппу или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4'.
Относящимися к этой группе, и даже более предпочтительными, являются соединения формулы I, в которой R1 представляет собой атом водорода, N,N-диметиламиногруппу, N-оксид N,N-диметиламиногруппы, N-ацетил-N-метиламиногруппу или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4'.
Среди соединений формулы I, в которой R, R1 и R2 имеют уже указанные значения, предпочтительными являются соединения, у которых R3 представляет собой неразветвленный или разветвленный (С1-С3) алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, амино, неразветвленного или разветвленного (С1-С3) алкила, С1-С4 алкокси и цианогрупп, или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы;
Х представляет собой О или NR6 и R6 представляет собой атом водорода, неразветвленный или разветвленный С1-С3 алкил;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы, или, когда n не равно 0, Y представляет собой О или NR6 и R6 представляет собой атом водорода, неразветвленный или разветвленный С1-С3 алкил;
r равно целому числу от 1 до 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу от 0 до 2;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
В объеме этой группы соединений формулы I предпочтительными являются соединения, у которых R3 представляет собой метил, бензил или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил с пятью или шестью членами, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой О или NR6 и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил с пятью или шестью членами, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола; или, когда n равно 1, Y представляет собой NR6 и R6 представляет собой атом водорода;
r равно целому числу от 1 до 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу, выбранному из 0 и 1;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
Относящимися к этой группе, и даже более предпочтительными, являются соединения формулы I, в которой R3 представляет собой метил, бензил или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил, выбранный из тиофена, фурана, имидазола, тиазола, пиридина и триазола;
Х представляет собой NR6 и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил, выбранный из тиофена, фурана, имидазола, тиазола, пиридина и триазола; или, когда n равно 1, Y представляет собой NR6 и R6 представляет собой атом водорода;
r равно 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу, выбранному из 0 и 1;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
Кроме того, предпочтительными являются соединения формулы I, в которой R и R2 имеют уже указанные значения, R1 представляет собой атом водорода, N-метил-N-(C1-C3)-алкиламиногруппу, N-оксид N-метил-N-(C1-C3)-алкиламиногруппы, N-(C1-C4)-ацил-N-метиламиногруппу или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4';
в то же самое время R3 представляет собой неразветвленный или разветвленный (С1-С3) алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, амино, неразветвленного или разветвленного (С1-С3) алкила, С1-С4 алкокси и цианогрупп, или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы;
Х представляет собой О или NR6 и R6 представляет собой атом водорода, неразветвленный или разветвленный С1-С3 алкил;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил с пятью или шестью членами, содержащими от одного до трех атомов, выбранных из азота, кислорода и серы, или, когда n отличается от 0, Y представляет собой О или NR6 и R6 представляет собой атом водорода, неразветвленный или разветвленный С1-С3 алкил;
r равно целому числу от 1 до 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу от 0 до 2;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
В пределах объема этой группы соединений формулы I предпочтительными являются соединения, у которых R3 представляет собой метил, бензил или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил с пятью или шестью членами, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой О или NR6 и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил с пятью или шестью членами, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола; или, когда n равно 1, Y представляет собой NR6 и R6 представляет собой атом водорода;
r равно целому числу от 1 до 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу, выбранному из 0 и 1;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
Относящимися к данной группе, и даже более предпочтительными, являются соединения формулы I, в которой R3 представляет собой метил, бензил или цепь формулы
-(СН2)r-X-(CH2)m-Y-(CH2)n-A,
в которой
А представляет собой атом водорода, фенил или гетероарил, выбранный из тиофена, фурана, имидазола, тиазола, пиридина и триазола;
Х представляет собой NR6 и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой группу С6Н4 или гетероарил, выбранный из тиофена, фурана, имидазола, тиазола, пиридина и триазола; или, когда n равно 1, Y представляет собой NR6 и R6 представляет собой атом водорода;
r равно 3;
m равно целому числу, выбранному из 1 и 2;
n равно целому числу, выбранному из 0 и 1;
кроме того, атом азота, с которым связан R3, может присутствовать в форме N-оксида.
Относящимися к указанной последней группе, и даже более предпочтительными, являются соединения формулы I, в которой R1 представляет собой атом водорода, N,N-диметиламиногруппу, N-оксид N,N-диметиламиногруппы, N-ацетил-N-метиламиногруппу или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4'.
Примеры фармацевтически приемлемых солей соединений формулы I являются соли с органическими или неорганическими кислотами, такими как хлористоводородная, бромистоводородная, иодистоводородная, азотная, серная, фосфорная, уксусная, винная, лимонная, бензойная, янтарная и глутаровая кислота.
Конкретными примерами соединений, включаемых настоящим изобретением, являются соединения, у которых R и R2 имеют значения, приведенные в формуле I, и R1 вместе с R2 образуют связь между атомами углерода у 3' и 4' или R1 представляет собой атом водорода, N,N-диметиламиногруппу, N-оксид N,N-диметиламиногруппы или N-ацетил-N-метиламиногруппу и в то же самое время R3 представляет собой метильную, бензильную, 3-[(тиазол-2-илметил)амино]пропильную, 3-[(тиофен-2-илметиламино]пропильную, 3-[(фуран-2-илметил)амино]пропильную, 3-[(имидазол-2-илметил)амино]пропильную, 3-(бензиламино)пропильную, 3-[2-[(тиазол-2-илметил)амино]этиламино]пропильную группу; 3-[6-(бензиламино)гексиламино]пропильную группу, кроме того, атом азота, к которому присоединен R3, может присутствовать в форме N-оксида.
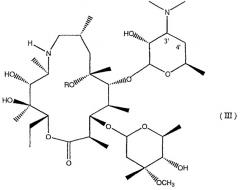
Соединения формулы I, которые включены в настоящее изобретение, получают по синтетической схеме, которая включает в себя удаление L-кладинозы в положении 3 соединений формулы
в которой R, R1, R2 и R3 имеют значения, указанные для соединений формулы I.
Удаление кладинозы, предпочтительно, осуществляют катализируемой реакцией кислотного гидролиза в присутствии неорганической кислоты, такой как серная кислота или хлористоводородная кислота, или протонного органического растворителя, такого как вода, метанол или этанол.
Соединения формулы II получают из оксима эритромицина А перегруппировкой Бекмана, восстановлением в амин и затем функционализацией последнего; любые синтетические вмешательства на уровне диметиламиногруппы в положении 3' включают в себя N-окисление, полное удаление или деметилирование и последующую функционализацию (алкилирование или ацилирование).
Для синтеза соединений формулы I, в которой заместитель R представляет собой метил, синтетическая схема является сходной, но начинается с оксима 6-О-метилэритромицина А или, в альтернативном случае, представляющий интерес азалид метилируют по известным способами.
Специалисту в данной области должно быть очевидно, что для того, чтобы избежать препятствий со стороны любых функциональных групп, присутствующих в положениях, в которых должны быть сделаны структурные модификации, будет более или менее пригодным и подходящим выбор определенного приоритета в синтетических вмешательствах, которые должны быть проведены.
Например, любое вмешательство в диметиламиногруппу в положении 3' может следовать или предшествовать увеличению макролидного кольца или может составлять заключительную стадию указанного синтеза.
В качестве следующего примера, рассматривающего удаление кладинозы, удаление осуществляют после реакций, которые приводят к расширению макролидного кольца или оно может следовать за структурными модификациями в положении 3' или предшествовать им.
Однако, как правило, не имеется взаимодействий, которые предотвращают удаление кладинозы на некоторой другой промежуточной стадии или в конце синтетического процесса.
Эти выборы процедуры будут диктоваться иногда техническими требованиями с целью оптимизации синтетического способа получения представляющего интерес продукта.
Инструкции для проведения вышеуказанных структурных модификаций в макролидах раскрыты подробнее ниже.
Оксимы эритромицина А, с конфигурацией Z или Е, являются известными соединениями, которые являются коммерчески доступными и могут быть получены общепринятыми способами, например, способами, указаанными в патенте США 3478014 на имя Pliva, или способами, описанными в литературе (J.C. Gasc et al.: The Journal of Antibiotics; 44, 313-330, 1991).
Синтез 9-дезоксо-9а-аза-9а-гомоэритромицина А проводят по общепринятым методикам, например, перегруппировкой Бекмана и последующим восстановлением в амин оксима эритромицина А (патент США 4328334, поданный Pliva Pharm. and Chem. Works) (Djokic S. et al., J. Chem. Soc. Perkin Trans., 1986, 1881) для получений соединений формулы
в которой
R имеет значения, приведенные в формуле I.
Замещение азалактона, полученного таким образом, выполняют по реакции присоединения к активированным олефинам с получением соответствующих 9а-амино-, гидрокси- или меркаптоалкилпроизводных, которые затем функционализируют у гетероатома по общепринятым синтетическим способам, или для получения N-алкилпроизводных, возможно замещенных, используют реакцию гидроалкилирования реакцией с альдегидами в присутствии восстанавливающего агента. Оба способа приводят к соединениям формулы
в которой
R и R3 имеют значения, приведенные в формуле I.
Метилирование 9а-аминогруппы по реакции Эшвайлера-Кларка формальдегидом в присутствии муравьиной кислоты описано в патенте Бельгии 892357 (Pliva Pharm and Chem. Works).
В патенте США 4464527 (Pfizer Inc.) описан способ получения N-этил- и N-(н-пропил)производного 9-дезоксо-9а-аза-9а-гомоэритромицина А.
Превращение в соответствующие N-оксиды проводят известными способами обработкой перкислотами, например, пероксидом водорода или метахлорпербензойной кислотой в присутствии органического растворителе (патент США 3928397, Hoffmann-La Roche Inc., уже цитированный) (J. Am. Chem. Soc. 1954, 76, 3121).
Удаление диметиламиногруппы проводят известными способами окислением, пиролизом и, если необходимо, восстановлением 9а-производных азитромицина формулы IV.
Для специалиста в данной области должно быть очевидно, что для того, чтобы избежать препятствия, создаваемые любыми функциональными группами, которые присутствуют в заместителе R3, удаление диметиламиногруппы будет, предпочтительно, проведено, исходя из промежуточных соединений формулы
в которой
R имеет уже указанные значения.
Окисление дает N-оксидные соединения формулы
в которой
R имеет уже указанные соединения,
пиролизом с последующим, если необходимо, восстановлением, эти реакции дают соответственно соединения формулы VIIa и VIIb
в которых
R имеет уже указанные значения;
и которые превращают в соответствующие соединения формулы II, в которой R, R2 и R3 имеют уже указанные значения и R1 представляет собой атом водорода или R1 вместе с R2 образуют связь между атомами углерода у 3' и 4', перегруппировкой Бекмана и восстановлением оксима в положении 9 в амин и последующей функционализацией таким образом полученного 9а-азалида, как описано ранее.
Монодеметилирование диметиламиногруппы в положении 3' проводят с использованием общепринятых способов обработкой бензилхлорформиатом в присутствии избытка основания, например, гидрокарбоната щелочного металла, и инертного растворителя с последующим удалением бензилоксикарбонильной группы в положении 2' и 3', как описано в патенте США 52500518 на имя Pliva; последующие реакции ацилирования или алкилирования таким образом полученного вторичного амина проводят по общепринятым синтетическим способам.
Кроме того, соединения формулы I, в которой R1 = R2 = H, могут быть получены восстановлением соответствующих соединений формулы I, в которой R1 и R2 вместе образуют связь.
Способ, описанный выше, в одном из его вариантов осуществления предполагает использование в качестве субстрата соединения формулы II, в которой R представляет собой метил, R1 представляет собой диметиламиногруппу, R2 представляет собой атом водорода и R3 представляет собой метил (азитромицин), и состоит в проведении синтетического вмешательства в диметиламиногруппу в положении 3' и удалении L-кладинозы по способам, описанным ранее.
Как указано выше, соединения формулы I, к которым относится настоящее изобретение, обладают противовоспалительной активностью, но лишены антибиотической активности.
Фармакологическую активность соединений формулы I оценивали на моделях кожного и легочного воспаления по сравнению с известными макролидами, такими как эритромицин и азитромицин, которые обладают как противовоспалительной, так и антибиотической активностью.
Противовоспалительную активность оценивали in vivo как ингибирование отека уха мыши, индуцированного РМА (миристат-ацетатом форбола) и как снижение скопления нейтрофилов в легком крысы, индуцированного LPS (липополисахарид E. coli).
Во всех испытаниях было обнаружено, что соединения настоящего изобретения являются очень активными в качестве противовоспалительных средств и обнаружено, что противовоспалительная активность является сравнимой с противовоспалительной активностью сравнительных соединений или выше, чем у них.
Кроме того, соединения настоящего изобретения не проявляют антибиотическую активность, что было продемонстрировано испытаниями, которые были проведены, и, таким образом, они могут быть использованы при длительных лечениях воспалительных процессов без развития нежелательного феномена резистентности.
Следовательно, очевидно, что соединения формулы I, которые обладают противовоспалительной активностью, но лишены антибиотической активности, могут быть полезными как при остром, так и хроническом лечении и при профилактике воспалительных патологий, особенно патологий, ассоциированных с измененной клеточной деятельностью нейтрофилов, например, ревматоидного артрита, васкулита, гломерулонефрита, повреждения из-за ишемической реперфузии, атеросклероза, септического шока, ARDS, COPD и астмы.
Терапевтически эффективные количества будут зависеть от возраста и от общего физиологического состояния пациента, пути введения и используемого фармацевтического препарата; терапевтические дозы обычно находятся между приблизительно 10 и 2000 мг/день и, предпочтительно, между приблизительно 30 и 1500 мг/день.
Соединения настоящего изобретения для использования при лечении и/или профилактике патологий, указанных выше, предпочтительно, будет использоваться в фармацевтической форме, подходящей для перорального, ректального, сублингвального, парентерального, местного, трансдермального и ингаляционного введения.
Настоящее изобретение далее относится к фармацевтическим препаратам, содержащим терапевтически эффективное количество соединения формулы I или одной из его солей в смеси с фармацевтически приемлемым наполнителем. Фармацевтические препараты настоящего изобретения могут быть жидкими, которые являются подходящими для перорального и/или парентерального введения, например, в виде капель, сиропов, растворов, инъецируемых растворов, которые являются готовыми для использования или которые получают разбавлением высушенного замораживанием продукта, но, предпочтительно, являются твердыми или полутвердыми, как таблетки, капсулы, гранулы, порошки, пилюли, пессарии, суппозитории, кремы, жидкие мази, гели, твердые мази, или растворы, суспензии, эмульсии или другие формы, подходящие для введения трансдермальным путем или ингаляцией.
В зависимости от типа препарата, кроме терапевтически эффективного количества одного или нескольких соединений формулы I, они могут содержать твердые или жидкие эксципиенты или разбавители для фармацевтического применения и, возможно, другие добавки, обычно используемые при получении фармацевтических препаратов, такие как загустители, агрегирующие агенты, смазывающие вещества, дезинтегрирующие агенты, корригенты и красители.
Фармацевтические препараты изобретения могут быть получены обычными способами.
Нижеследующие примеры представлены для лучшей иллюстрации настоящего изобретения.
Таблица, которая предшествует примерам, представляет химические структуры и аналитические характеристики синтетических промежуточных продуктов и соединений формулы I.
| промежуточный продукт 4 | CDCl3: 5,04 (д, 1H, J=4,2, H1"); 4,73-4,78 (м, 1H, H13); 4,35 (д, 1H, J=7,1, H1'); 4,28 (м, 1H, H5); 3,64 (д, J=6,6, H11); 3,40 (с, 3H, H7") | |
| промежуточный продукт 5 | CDCl3: 5,10 (д, 1H, J=4,3, H1"); 4,67-4,72 (м, 1H, H13); 4,36 (д, 1H, J=7,6, H1'); 4,25 (м, 1H, H3); 4,12 (м, 1H, H5); 3,35 (с, 3H, H7"); 2,35 (с, 3H, NCH3) | |
| промежуточный продукт 14 | ДМСО-d6: 5,0-5,1 (м, 1H, H13); 4,58 (д, 1H, J=7,4, H1'); 0,77 (т, 3H, J=7,0, H15) | |
| соединение 6 | CDCl3: 7,74 (м, 1H, Th); 7,28 (м, 1H, Th); 5,0-5,2 (м, 1H, H13); 4,50 (д, 1H, J=7,3, H1'); 4,23 (м, 2H, Th-CH2); 2,34 (с, 6H, Me2N); 0,89 (т, 3H, J=7,3, H15) | |
| соединение 10 | CDCl3: 7,72 (м, 1H, Th); 7,28 (м, 1H, Th); 5,01-5,06 (м, 1H, H13); 4,44 (д, 1H, J=7,3, H1'); 4,18 (м, 2H, Th-CH2); 2,27 (с, 6H, Me2N); 0,83 (т, 3H, J=7,3, H15) | |
| соединение 9 | CDCl3: 7,23, 7,03 и 6,97 (3м, 3H, тиофенил); 5,13 (м, 1H, H13); 4,46 (д, 1H, J=7,3, H1'); 4,06 {м, 2H, T-CH2); 2,29 (с, 6H, Me2N); 0,90 (т, 3H, J=7,4, H15) | |
| соединение 7 | CDCl3: 7,36 (м, 1H, фурил), 6,28-6,31 (2м, 2H, фурил); 5,05-5,10 (м, 1H, H13); 4,45 (д, 1H, J=7,3, H1'); 3,87 (м, 2H, F-CH2); 2,28 (с, 6H, Me2N); 0,89 (т, 3H, J=7,4, H15) | |
| соединение 8 | CDCl3: 7,58 (м, 1H, N=CH-N имидазол), 6,97 (с, 1H, N-CH=C имидазол); 5,10-5,16 (м, 1H, H13); 4,44 (д, 1H, J=7,4, H1'); 2,28 (с, 6H, Me2N); 0,91 (т, 3H, J=7,4, H15) | |
| промежуточный продукт 1 | CDCl3: 5,18 (д, J=4,6, 1H, H1"); 4,69 (м, 1H, H13); 4,56 (д, 1H, J=7,0, H1'); 4,28 (м, 1H, H3); 3,40 и 3,21 (2с, 6H, Me2N[O}); 2,33 (с, 3H, NCH3) | |
| соединение 11 | D2O: 7,38 (м, 5H, Ph); 4,9-5,0 (м, 1H, H13); 4,14 (с, 2H, CH2Ph); 2,73 (с, 6H, Me2N); 0,73 (т, 3H, J=7,1, H15) | |
| соединение 12 | ДМСО-d6: 7,2-7,35 (м, 5H, фенил); 5,00-5,06 (м, 1H, H13); 4,46 (д, 1H, J=7,4, Н1'); 3,67 (м, 2H, Ph-CH2); 2,21 (с, 6H, Me2N); 0,75 (т, 3H, J=7,0, H15) | |
| промежуточный продукт 20 | CDCl3: 4,92 (д, 1H, J=4,4, H1"); 4,75-4,80 (м, 1H, H13); 4,39 (д, 1H, J=7,5, H1'); 3,31 (с, 3H, H7"); 0,93 (т, 3H, J=7,5, H15) | |
| промежуточный продукт 21 | CDCl3: 5,09 (д, 1H, J=4,5, H1"); 4,91-4,96 (м, 1H, H13); 4,38 (д, 1H, J=7,5, H1'); 3,33 (с, 3H, H7"); 0,88 (т, 3H, J=7,3, H15) | |
| промежуточный продукт 24 | CDCl3: 7,74 (м, 1H, Th); 7,30 (м, 1H, Th); 5,10 (д, 1H, J=4,3, H1"); 5,01 (м, 1H, H13); 4,40 (д, 1H, J=7,6, H1'); 4,21 (м, 2H, Th-CH2); 3,69 (с, 1H, H11); 3,34 (c, 3H, H7"); 0,90 (т, 3H, J=7,4, H15) | |
| соединение 14 | CDCl3: 7,73 (м, 1H, Th); 7,28 (м, 1H, Th); 5,0-5,1 (м, 1H, H13); 4,37 (д, 1H, J=7,9, H1'); 4,20 (м, 2H, Th-CH2); 0,87 (т, 3H, J=7,5, H15) | |
| промежуточный продукт 23 | CDCl3: 7,71 (м, 1H, Th); 7,26 (м, 1H, Th); 5,08 (д, 1H, J=4,2, H1"); 4,86-4,94 (м, 1H, H13); 4,39 (д, 1H, J=7,6, H1'); 4,18 (м, 2H, Th-CH2); 3,32 (с, 3H, H7"); 0,82 (т, 3H, J=7,3, H15) | |
| соединение 13 | CDCl3: 7,73 (м, 1H, Th); 7,28 (м, 1H, Th); 4,96 5,03 (м, 1H, H13); 4,35 (д, 1H, J=7,6, H1'); 4,20 (м, 2H, Th-CH2); 0,83 (т, 3H, J=7,6, H15) | |
| промежуточный продукт 6 | ДМСО-d6: 4,8 (м, 2H, H13 и H1"); 4,43 (д, 1H, J=7,1, H1 1); 0,79 (т, 3H, J=7,3, H15) | |
| соединение 1 | CDCl3: 4,75-4,69 (м, 1H, H13); 4,61 (д, 1H, J=7,1, H1'); 3,61 (с, 1H, H11); 3,19 и 3,16 (2с, 6H, Me2N[O]); 2,38 (с, 3H, CH3N) | |
| соединение 2 | CDCl3: 5,38-5,43 (м, 1H, H13); 4,48 (д, 1H, J=7,0, H1'); 3,30 и 3,16 (2с, 6H, Me2N[O]); 2,93 (с, 3H, MeN[O]); 0,90 (т, 3H, J=6,5, H15) | |
| промежуточный продукт 3 | CDCl3: 5,67 (м, 2H, CH3'=CH4'); 4,99 (д, 1H, J=4,4, H1"); 4,66-4,70 (м, 1H, H13); 4,54 (д, 1H, J=6,5, H1'); 3,30 (с, 3H, H7"); 2,37 (с, 3H, CH3N) | |
| соединение 3 | CDCl3: 5,66 (м, 2H, CH3'=CH4'); 4,69-4,74 (м, 1H, H13); 4,60 (д, 1H, J=6,9, H1'); 3,61 (с, 1H, H11); 2,66 (с, 3H, CH3N) | |
| соединени |