Лекарственное средство для лечения доброкачественных и злокачественных опухолевых заболеваний, содержащее производное дисоразола
Иллюстрации
Показать всеИзобретение относится к области фармакологии и касается средства для лечения доброкачественных или злокачественных опухолевых и пролиферативных заболеваний, представляющего собой производное дисоразола общей формулы I, и применения указанных производных для лечения доброкачественных или злокачественных опухолевых и пролиферативных заболеваний. Средство обладает повышенной активностью. 2 н. и 4 з.п. ф-лы, 6 табл., 1 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к дисоразолу (за исключением дисоразола А1) и производным дисоразолов и их применению в качестве лекарственных средств, в частности для лечения доброкачественных и злокачественных опухолей у человека и млекопитающих животных.
Уровень техники
В ближайшие годы ожидается резкое увеличение смертности от онкологических и опухолевых заболеваний в мировом масштабе. В 2001 году во всем мире около 10 миллионов человек страдало от рака и свыше 6 миллионов человек умерло от этого заболевания. Развитие опухолей является основным заболеванием высших организмов в царстве растений, царстве животных и у человека. Общепризнанная многоступенчатая модель канцерогенеза предполагает, что в результате накопления ряда мутаций в отдельной клетке ее пролиферация и дифференцировка модифицируется таким образом, что в конечном итоге через промежуточные доброкачественные стадии достигается злокачественное состояние, сопровождающееся метастазами. Под термином рак или опухоль подразумевают клиническую картину с более чем 200 различными заболеваниями субъектов. Опухолевый процесс может протекать доброкачественным или злокачественным образом. Наиболее важными опухолями являются опухоли легкого, молочной железы, желудка, шейки матки, простаты, головы и шеи, толстой и тонкой кишки, печени и кровеносной системы. Существуют большие различия в протекании, прогнозе и реакции на терапию. Более чем 90% выявленных случаев относится к твердым опухолям, которые, особенно на поздних стадиях или при наличии метастазов, трудно поддаются лечению либо неизлечимы. Тремя основными принципами борьбы с раковыми заболеваниям остаются удаление хирургическим путем, лучевая терапия и химиотерапия. Несмотря на значительный прогресс все еще не удалось разработать лекарственные средства, которые давали бы заметное увеличение продолжительности жизни или даже полное излечение при широко распространенных твердых опухолях. Таким образом, изобретение новых лекарственных средств для борьбы с раковыми заболеваниями имеет большое значение.
Раскрытие изобретения
Данное изобретение относится к дисоразолу (за исключением дисоразола А1) и производным дисоразолов и их применению в качестве лекарственных средств, в частности для лечения доброкачественных и злокачественных опухолей у человека и млекопитающих животных.
Неожиданно было обнаружено, что дисоразолы, в особенности Е1 и D1, обладают сильным цитотоксическим действием в отношении человеческих опухолевых клеточных линий. В нано- и пикомолярных концентрациях они подавляют деление, в частности, клеток карциномы яичников, карциномы простаты, глиобластомы, карциномы легкого и рака молочной железы. Действие дисоразолов Е1 и D1 в данном случае является зависимым от клеточного цикла, даже при наномолярных концентрациях они удерживают клеточный цикл в фазе G2/M и вводят раковые клетки в апоптоз. Кроме того, была возможность показать, что в основе заявленного антипролиферативного действия дисоразолов лежит, в частности, эффективное ингибирование полимеризации тубулина. Дисоразол Е1, в частности, обладает высокой активностью в отношении клеточных линий, устойчивых к паклитакселу и виндезину. В соответствии с изобретением имелась возможность показать, что дисоразол Е1 имеет высокую активность в плане биологического действия и, таким образом, может применяться в качестве активного соединения в лекарственном средстве для борьбы с раком.
Это имеет значение, в частности, потому, что дисоразол А1 не пригоден для применения в качестве цитостатика (см. G.Hoefle, ежегодный отчет за 1999/2000 Gesellschaft fur Biotechnologische Forschung (Ассоциация биотехнологических исследований) GBF, с. 103).
В эксперименте по терапии с использованием, например, голых мышей, несущих опухолевый ксенотрансплантат NCl-H460 (но без ограничения этим), можно было тем не менее наблюдать значительное уменьшение роста опухоли при внутривенном введении дисоразола Е1 даже при дозах, которые не приводили к снижению массы тела или, возможно, гибели.
В фармацевтических исследованиях природные вещества представляют собой важный источник новых направленных структур, и в ряде случаев они являются непосредственно пригодными для создания нового лекарственного средства (см. статью Y.-Z.Shu, J. Nat. Prod., 61, 1053-1071, (1998)). Известно, что многие природные вещества обладают сильным цитотоксическим действием (см. статью V.J.Ram, S.Kumari, DNP, 14(8), 465-482, (2001)).
Известно, что природные вещества группы, состоящей из дисоразолов, выделены из бактерии штамма Sorangium cellulosum So ce 12 (см. статью R.Jansen, H.Irschik, H.Reichenbach, V.Wray, G.Hofle, Liebigs Ann. Chem., (8), 759-773, (1994)). В целом было выделено и охарактеризовано по физико-химическим показателям 29 дисоразолов. Относительно дисоразола А1 было показано, что он обладает антипролиферативным действием в клеточных моделях (см. статью H.Irschik, R.Jansen, К.Gerth, G.Hofle, H.Reichenbach, J.Antibiot. 48(1), 31-35, (1995), Y.A.EInakady, диссертация, Brunswick Technical University, 2001). Однако применение для лечения онкологических заболеваний не было раскрыто и не предполагалось. Биологические исследования других дисоразолов не проводились.
Соединения, соответствующие изобретению, пригодны без ограничения перечисленным для применения в качестве лекарственных препаратов для лечения доброкачественных и злокачественных онкологических заболеваний или других нарушений антипролиферативности у человека и животных. В принципе соединения, соответствующие изобретению, пригодны для борьбы со всеми нарушениями, в основе которых лежит неконтролируемое и быстрое деление клеток и которые в связи с этим вызывают патологические состояния. Соединения, соответствующие изобретению, могут быть использованы как индивидуальные вещества или в комбинации с другими цитотоксическими веществами, например цисплатином, карбоплатином, доксорубицином, ифосфамидом, циклофосфамидом, 5-FU(5-фторурацилом), метотрексатом, и, в особенности, в комбинации с ингибиторами сигнальной трансдукции, таким как, например, Герцептин, Гильвек или Пресса, но без ограничения перечисленным.
Синтетические и полусинтетические аналоги дисоразолов также обладают антипролиферативным действием. Важные свойства, такие как биологическая ингибирующая активность, стабильность и биофизические свойства, можно модулировать с помощью специфической модификации формы молекулы. Таким образом можно получать терапевтически ценные производные исходных соединений. Другая цель получения производных состоит в снижении возможных токсических побочных эффектов.
Соединения, соответствующие изобретению, можно вводить в виде жидких фармацевтических форм. Это осуществляют подходящим для каждого случая способом с использованием растворов или суспензий.
Соединения, соответствующие изобретению, могут применяться в подходящей форме для введения, предпочтительно в артерию (интраартериально в виде инъекции), в вену (внутривенно в виде инъекции или инфузии), в кожу (внутрикожно в виде инъекции), под кожу (подкожно в виде инъекции), в мышцу (внутримышечно в виде инъекции), в брюшную полость (внутрибрюшинно в виде инъекции или инфузии).
Если соединения общей формулы I, соответствующие изобретению, имеют по меньшей мере один центр асимметрии, они могут присутствовать в форме рацематов, в форме очищенных энантиомеров и/или диастереомеров или в форме смесей данных энантиомеров и/или диастереомеров, а именно как в виде собственно соединений, так и в виде фармацевтически приемлемых солей данных соединений. Смеси могут быть представлены в любых желаемых соотношениях стереомеров.
Если возможно, конфигурации каждой из двойных связей в соединениях, соответствующих изобретению, могут независимо друг от друга представлять собой Е или Z.
Если возможно, соединения, соответствующие изобретению, могут присутствовать в форме таутомеров.
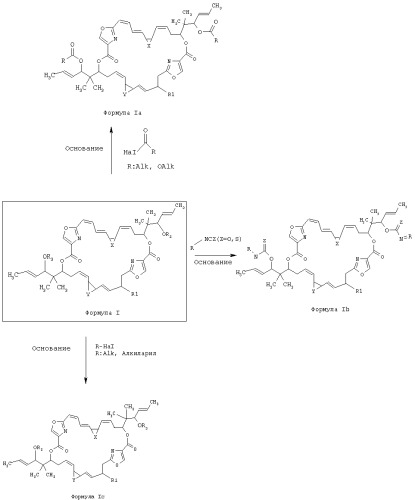
Согласно одному из вариантов осуществления изобретение относится к соединениям общей формулы I:
в которой независимо друг от друга
R1 обозначает
(i) водород,
(ii) OR4,
(iii) часть двойной связи с С5',
R2, R3 и R4 представляют собой
(i) водород,
(ii) незамещенный или замещенный (С1-С6)-алкил,
(iii) (С1-С4)-алкил, замещенный одним или более атомов фтора, предпочтительно трифторметильной группой;
(iv) незамещенный или замещенный (С1-С4)-алкил-(С6-С14)-арил, незамещенный или замещенный (С1-С4)-алкилгетероарил;
(v) (С1-С4)-алкоксикарбонил, (С1-С4)-алкиламинокарбонил, (С1-C4)-алкиламинотиокарбонил, (С1-С6)-алкилкарбонил или (С1-С6)-алкокосикарбонил-(С1-С6)-алкил, причем может иметь место замещение алкильного радикала F, Cl, Br, I, CN, NH2, NH-(С1-С20)-алкилом, NH-(С3-С12)-циклоалкилом, ОН, O-(С1-С20)-алкилом на одном или на множестве одинаковых или различных атомов одинаковыми или различными заместителями и может иметь место замещение арильного радикала F, Cl, Br, I, CN, NH2, NH-(C1-С20)алкилом, ОН, O-(С1-С20)-алкилом и/или (С3-С8)-гетероциклом, содержащим от 1 до 5 гетероатомов, предпочтительно азот, кислород, серу, на одном или на множестве одинаковых или различных атомах одинаковыми или различными заместителями,
и
X, Y обозначают в каждом отдельном случае независимо друг от друга или взятые вместе кислород, серу, две соседних гидроксильных группы, две соседних метоксильных группы часть двойной связи,
за исключением соединения, в котором R1 обозначает метоксил, R2, R3 обозначают водород, Х представляет собой кислород и Y обозначает часть двойной связи.
Термин "арил" в контексте данного изобретения обозначает ароматические углеводороды, в том числе фенилы, нафтилы и антраценилы. Данные радикалы также могут быть слиты с другими насыщенными, (частично) ненасыщенными или ароматическими циклическими системами.
Термин "гетероарил" обозначает 5-, 6-, или 7-членный циклический ароматический радикал, который содержит по меньшей мере 1, необязательно 2, 3, 4 или 5 гетероатомов, причем гетероатомы могут быть одинаковыми или разными. Гетероцикл может представлять собой часть би- или полициклической системы. Предпочтительными гетероатомами являются азот, кислород и сера. Предпочтительно, когда гетероарильный радикал выбран из группы, которая содержит пирролил, фурил, тиенил, тиазолил, оксазолил, изоксазолил, пиразолил, имидазолил, пиридинил, пиримидинил, пиразинил, индолил, индолизинил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, карбазолил, феназинил, фенотиазинил, акридинил.
Краткое описание чертежа
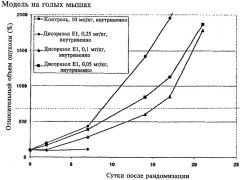
На чертеже представлены результаты эксперимента in vivo по лечению дисоразолом на примере опухолевого ксенотрансплантата NCI-H460.
Осуществление изобретения
Наиболее предпочтительными соединениями, соответствующими общей формуле I, являются соединения, входящие в следующую выборку:
(1) Дисоразол Е1
(2) Дисоразол D1
(3) Дисоразол А1 однозначно не является объектом данного изобретения
Схема 1
Соответствующие данному изобретению синтетические и полусинтетические аналоги дисоразолов общей формулы la, Ib и Ic получают согласно схеме 1:
Дисоразолы общей формулы 1 можно превратить стандартным способом в соответствующие данному изобретению производные согласно формулам Ia, Ib и Ic путем замещения водорода на R2, R3 и R4.
Например, если необходимо получить замещенные дисоразолы согласно формуле Ic, где R2, R3 и R4=алкил или алкиларил, проводят реакцию подходящего дисоразола общей формулы 1 с подходящим алкилирующим галогенидом или алкиларилгалогенидом и подходящим основанием, предпочтительно триэтиламином, пиридином, алкоксидом, гидридом натрия или карбонатом калия в соответствующем растворителе, например дихлорметане, диэтиловом эфире, ацетонитриле, N,N-диметилформамиде, при температуре от 0 до 100°С (см. j. Org. Chem., 36, 284-294, (1971)).
Например, если нужно получить замещенные дисоразолы согласно формуле Ib, где R2, R3 и R4=карбамат или тиокарбамат, можно провести реакцию подходящего дисоразола общей формулы I с подходящими изоцианатами или изотиоцианатами в присутствии приемлемого основания, предпочтительно триэтиламина, пиридина, гидрида натрия, алкоксида, NaOH в воде или карбоната калия в соответствующем растворителе, например дихлорметане, диэтиловом эфире, ацетонитриле, N,N-диметилформамиде или смесях растворителей, таких как смеси диоксана и воды или ТГФ (тетрагидрофурана) и воды при температуре от 0 до 100°С (см. DE 2040175, Rocz. Chem., 46, 717, (1972), Tetrahedron Lett., 34, 3745, (1993)).
Или в случае, когда нужно получить замещенные дисоразолы согласно формуле Ia, где R2, R3 и R4=алкилкарбонил или алкоксикарбонил, можно провести реакцию подходящего дисоразола общей формулы I с подходящими алкилкарбонилхлоридами, алкилкарбоновыми ангидридами или хлорформиатами в присутствии приемлемого основания, предпочтительно триэтиламина, пиридина, гидрида натрия, алкоксида, NaOH в воде или карбоната калия и соответствующего растворителя, например дихлорметана, диэтилового эфира, ацетонитрила, N,N-диметилформамида или смеси растворителей, таких как смеси диоксана и воды или ТГФ и воды при температуре от 0 до 100°С (см. J. Org. Chem., 22, 1551, (1957), Synth. Commun., 27, 2777, (1997), J. Org. Chem., 24, 774, (1959)).
Изобретение будет проиллюстрировано более подробно с помощью следующих примеров без ограничения ими.
Примеры
Возможности применения
Пример 1
Дисоразолы, такие как, например, дисоразол Е1, являются предпочтительными в качестве активного соединения в готовом к применению лекарственном средстве для лечения злокачественных онкологических заболеваний, таких как рак молочной железы, рак легкого, рак яичников, рак кожи, рак простаты, рак толстой кишки, рак клеток почки, рак печени, рак поджелудочной железы и формы рака головного мозга.
В предпочтительной форме введения активное соединение находится в виде лиофилизата в сочетании с наполнителями, известными компетентным специалистам в данной области, во флаконе для инъекций, и перед применением его растворяют с использованием физиологического солевого раствора, затем разводят в резервуаре для инъекций и вводят пациенту в вену с помощью канюли. Доза в зависимости от стадии онкологического заболевания и состояния здоровья пациента составляет от 0,1 до 100 мг активного соединения/м2. Период инфузии зависит от объективных показателей заболевания.
Пример 2
Применение дисоразолов, таких как, например, дисоразол Е1, в качестве активного соединения в готовом к применению лекарственном средстве для лечения воспалительных заболеваний. Данные заболевания включают, например, воспалительные заболевания дыхательных путей, такие как бронхиальная астма, аллергический ринит, аллергический конъюнктивит, атопический дерматит, экзема, аллергический ангиит, воспаления, опосредованные эозинофилами, такие как эозинофильная пневмония и синдром PIE (легочной инфильтрации при эозинофилии), крапивница, язвенный колит, болезнь Крона и пролиферативные кожные заболевания, такие как псориаз и кератоз.
Пример 3
Применение дисоразолов, таких как, например, дисоразол Е1, в качестве активного соединения в готовом к применению лекарственном средстве, обладающем иммуномодулирующим действием при лечении иммунных и аутоиммунных заболеваний. Данные заболевания включают, например, воспаления суставов, такие как артрит и ревматоидный артрит, и другие артритные заболевания, такие как ревматоидный спондилит и остеоартрит. Другие возможности применения представляют собой лечение пациентов, страдающих от сепсиса, септического шока, сепсиса, вызываемого грамотрицательными бактериями, синдрома токсического шока, респираторного дистресс-синдрома, астмы и других хронических легочных заболеваний, заболеваний, связанных с резорбцией костей, или реакций отторжения трансплантата либо других аутоиммунных заболеваний, таких как красная волчанка, рассеянный склероз, гломерулонефрит и увеит, инсулинзависимый сахарный диабет и хроническая демиелинизация.
Пример 4
Применение дисоразолов, таких как, например, дисоразол Е1, в качестве активного соединения в готовом к применению лекарственном средстве, которое может быть использовано для терапии инфекций, в частности вирусных инфекций и паразитарных инфекций, например для терапии малярии, инфекционной лихорадки, вызываемой инфекцией мышечной боли, ВИЧ-инфекций (СПИДа) и кахексии различных типов.
Получение
Для введения соединений, соответствующих изобретению, предпочтительно приемлемыми являются парентеральные, чрескожные, наружные, ингаляционные и интраназальные препараты. Приготовление, наполнение и закупоривание препаратов осуществляют в принятых антимикробных и асептических условиях.
Кроме по меньшей мере одного компонента, соответствующего изобретению, фармацевтические формы в зависимости от используемой фармацевтической формы необязательно содержат наполнители, такие как, в числе прочих, растворители, ускорители растворения, солюбилизаторы, эмульгаторы, смачивающие агенты, пеногасители, гелеобразующие агенты, сгустители, буферы, солеобразующие агенты, консерванты, антиоксиданты, красители, добавки, улучшающие вкус и запах. Выбор используемых наполнителей и их количеств зависит от выбранной фармацевтической формы и ориентирован на рецептуры, известные компетентным в данной области специалистам.
Лекарственные препараты, соответствующие изобретению, можно применять в подходящей форме для нанесения на кожу в виде раствора, суспензии, эмульсии, пены, мази, пасты или пластыря, введения через слизистую оболочку носа в виде капель, мази или спрея, введения через бронхиальный или альвеолярный эпителий, внутрилегочно или путем ингаляции в виде аэрозоля или ингалятора, введения через конъюнктиву в виде глазных капель, глазной мази, глазных таблеток, пластинок или глазного лосьона, введения в артерию в виде интраартериальной инъекции, введения в вену в виде внутривенной инъекции или инфузии, введения паравенозно в виде инъекции или инфузии, введения в кожу в виде подкожной инъекции или имплантата, введения в мышцу в виде внутримышечной инъекции или имплантата, введения в полость брюшины в виде внутрибрюшинной инъекции или инфузии.
При терапии опухолей соединения общей формулы I, соответствующие изобретению, могут быть использованы в виде индивидуального вещества или в комбинации с другими цитотоксическими веществами, такими как, например, паклитаксел, доцетаксел, винкристин, виндезин, цисплатин, карбоплатин, доксорубицин, ифосфамид, циклофосфамид, 5-ФУ(5-фторурацил), метотрексат, или в комбинации с иммуномодуляторами либо антителами и, в особенности, в комбинации с ингибиторами сигнальной трансдукции, такими как, например, Герцептин, Гливек или Иресса.
Пример 5
Препараты для парентарального введения дисоразолов, таких как, например, дисоразол Е1, могут присутствовать в отдельных дозированных унифицированных формах, таких как, например, ампулы и флаконы. Предпочтительно, когда используют растворы активного соединения, предпочтительно водные растворы и особенно изотонические растворы или (альтернативно) суспензии. Данные инъекционные формы могут быть приготовлены в виде препарата, готового к применению, или их готовят только непосредственно перед применением путем смешивания активного соединения, например лиофилизата, при необходимости с дополнительными твердыми носителями, с желательным растворителем или суспендирующим агентом.
Пример 6
Препараты для интраназального введения дисоразолов, таких как, например, дисоразол Е1, могут находиться в форме водных или масляных растворов или в форме водных или масляных суспензий. Они могут присутствовать также в виде лиофилизатов, которые готовят перед применением с помощью соответствующего растворителя или суспендирующего агента.
Биологическое действие соединений, соответствующих изобретению
Пример 7. Антипролиферативное действие на различные опухолевые клеточные линии
Соединения, соответствующие изобретению, исследуют на антипролиферативную активность в пролиферативном тесте на стабильных опухолевых клеточных линиях (см. D.A.Scuderio и соавт., Cancer Res., 48, 4827-4833, (1988)). Используемый тест служит для определения активности клеточной дегидрогеназы и делает возможным определение жизнеспособности клетки и, опосредованно, числа клеток. Используемыми в качестве примера клеточными линиями являются клеточная линия карциномы шейки матки человека KB/HeLa (ATCC CCL17), клеточная линия аденокарциномы яичников SKOV-3 (ATCC HTB77), клеточная линия глиобластомы человека SF-268 (NCI 503138), клеточная линия карциномы легкого NCI-H460 (NCI 503473) и клеточная линия аденокарциномы толстой кишки человека RKOP27.
Цитотоксическая или ингибирующая рост активность описанных соединений, а также референс-соединений представлены в таблице 1. Результаты показывают очень сильное ингибирование пролиферации выбранных опухолевых клеточных линий веществами, соответствующими изобретению.
| Таблица 1 | |||||
| Ингибирование пролиферации веществами, соответствующими изобретению, в тесте на цитотоксичность ХТТ на человеческих опухолевых клеточных линиях | |||||
| Пример | Пролиферативный тест ХТТ, ЕС50, мкг/мл | ||||
| KB/Hela | SKOV3 | SF-268 | NCI-H460 | RKOP27 | |
| Дисоразол Е1 | 0,00005 | 0,000016 | 0,00012 | 0,00003 | 0,00006 |
| Дисоразол D1 | 0,00015 | 0,0001 | 0,00022 | 0,00015 | 0,0003 |
| Дисоразол А1 | 0,00015 | 0,0002 | 0,00027 | 0,00015 | 0,00025 |
| Паклитаксел | 0,01 | 0,01 | 0,01 | 0,01 | |
| Виндезин | 0,002 | 0,002 | 0,005 | 0,006 |
Пример 8. Антипролиферативное действие на опухолевые клеточные линии с MDR (множественной лекарственной устойчивостью)
Для дальнейшей характеризации вещества, соответствующие изобретению, исследуют в отношении клеточных линий с множественной лекарственной устойчивостью (MDR) по сравнению с чувствительными клеточными линиями дикого типа.
Исследованные клеточные линии представлены клеточной линией острого миелоидного лейкоза LT12 и устойчивой линией LT12/mdr. Более того, в качестве тест-систем используют мышиную клеточную линию Р388 (лимфоидное новообразование, вызванное метилхолантреном) и доксорубицин-устойчивую линию Р388.
Результаты представляют в итоговой форме в таблице 2 ниже:
| Таблица 2 | ||||
| Ингибирующее действие дисоразола Е1 и референс-субстанций в пролиферативном тесте ХТТ на чувствительные и устойчивые опухолевые клеточные линии | ||||
| Пролиферативный тест ХТТ, ЕС50, мкг/мл | ||||
| Вещество | LT12 | LT12MDR | Р388 | P388ADR |
| Дисоразол Е1 | 0,0001 | 0,004 | 0,0004 | 0,001 |
| Паклитаксел | 0,005 | 0,340 | 0,035 | >3,16 |
| Виндезин | 0,0009 | 0,222 | 0,009 | 0,94 |
Дисоразол Е1 демонстрирует очень сильное ингибирующее действие на тестированные клеточные линии, тогда как в случае классических ингибиторов тубулина, таких как паклитаксел и винкристин, можно определить значительно более слабое действие и перекрестную устойчивость у клеточных линий MDR1.
Пример 9. Ингибирование полимеризации тубулина
Вещества исследуют в тесте in vitro на ингибирование полимеразации бычьего β-тубулина (см. статью D.M, Bollag и соавт., Cancer Res., 55, 2325-2333, (1995)). В данном тесте используют тубулин, очищенный с помощью циклов полимеризации и деполимеризации, который полимеризован при добавлении ГТФ, и нагревания. Значения ЕС50 ингибирования полимеризации β-тубулина с содержанием 30% ассоциированных белков (MAPs) приведены в таблице 3.
| Таблица 3 | |
| Ингибирование полимеризации β-тубулина с 30% MAPs | |
| Вещество | EC50, мкг/мл |
| Дисоразол Е1 | 1,50 |
| Дисоразол D1 | 2,50 |
| Дисоразол А1 | 4,8 |
| Виндезин | 0,40 |
| Эксперименты: n=2 |
Результаты показывают, что дисоразолы Е1 и D1 ингибируют полимеризацию тубулина при низких концентрациях.
Пример 10. Анализ клеточного цикла
Клеточный цикл включает развитие клетки от одной клеточной генерации до другой.
Во время фазы покоя (GO) и фазы предсинтеза (G1) клетка имеет диплоидный набор хромосом (2с). В фазе синтеза (S) количество ДНК увеличивается путем репликации. S-фаза заканчивается вхождением в предмитотическую фазу (G2M), в которой клетка имеет редуплицированный комплементарный набор хромосом (4с) и удвоенное содержание ДНК. В последующей временной фазе мейоза (М) происходит равномерное разделение редуплицированных хромосом на две дочерние клетки, которые затем в каждом случае снова демонстрируют содержание диплоидной ДНК и находятся в фазе G01, так что клеточный цикл может начинаться заново.
Для анализа клеточного цикла клетки KB/HeLa обрабатывают тест-веществами в различных концентрациях (0,1-1000 нМ) в течение 24 час при температуре 37°С.
Процентное соотношение клеток, блокированных в фазе G2/M клеточного цикла после обработки референс-субстанциями или выбранными тест-веществами, показано в таблице 4 ниже. Оценку результатов проводят при использовании специальной программы для анализа (ModFitTM).
| Таблица 4 | |
| Концентрация, при которой 50% клеток блокированы в фазе G2/M | |
| Пример | EC50, нМ (50% клеток в G2/M) |
| Дисоразол Е1 | 1,6 |
| Паклитаксел | 46 |
| Виндезин | 3,0 |
Соединения, соответствующие изобретению, имеют более высокую активность по сравнению со ссылочными соединениями. В частности, дисоразол Е1 ингибирует клеточный цикл в фазе G2/M в чрезвычайно низких концентрациях.
Пример 11. Результаты in vivo
Активность in vivo соединений, соответствующих изобретению, тестируют на моделях человеческих и мышиных ксенотрансплантатов.
В эксперименте по лечению голых мышей, несущих опухолевый ксенотрансплантат NCI-H460, дисоразол Е1, введенный внутривенно, может приводить к значительному уменьшению роста опухоли даже в дозах, которые не вызывают сильного уменьшения массы тела или, возможно, даже гибели.
На чертеже представлены результаты эксперимента in vivo по лечению дисоразолом на примере опухолевого ксенотрансплантата NCI-H460 с использованием следующих соединений:
Дисоразол Е1 (D-42805): 0,25 мг/кг, внутривенно: сутки 0, 7; гибель 8 животных (сутки 11, 12, 13)
Дисоразол Е1 (D-42805): 0,1 мг/кг, внутривенно: сутки 0, 7, 14, случаи гибели отсутствуют
Дисоразол Е1 (D-42805): 0,05 мг/кг, внутривенно: сутки 0, 7, 14, случаи гибели отсутствуют
Контроль: 0,9% солевой раствор, содержащий 3,3% ДМСО, 10 мл/кг
N=8 животных/группу
Пример 12. Тест AMES
Для оценки возможных побочных эффектов дисоразол Е1 исследуют на мутагенность с использованием флуктуационного анализа в отношении мутантных штаммов ТА98 и ТА100 бактерии Salmonella typhimurium в трех концентрациях (2,5, 5 и 10 мкМ). Исследования мутагенности далее проводят в присутствии фермента печени крыс S9. Результаты приводят в таблице 5 ниже:
| Таблица 5 | |||||
| Исследование дисоразола Е1 на мутагенность | |||||
| Соединение | Концентрация (мкМ) | AMES TA98 без S9 | AMES TA98 с S9 | AMES ТА100 без S9 | AMES TA100 с S9 |
| Дисоразол Е1 | 10 | Неактивен | Неактивен | Неактивен | Неактивен |
| Дисоразол Е1 | 5 | Неактивен | Неактивен | Неактивен | Неактивен |
| Дисоразол Е1 | 2,5 | Неактивен | Неактивен | Неактивен | Неактивен |
Дисоразол Е1 не проявляет эффектов в описанных условиях анализа при вышеуказанных концентрациях, вследствие этого является не активным в тесте AMES.
Пример 13. Влияние биосинтеза белка и непролиферирующих клеток
Для оценки возможного потенциала побочных эффектов исследуют влияние дисоразола Е1 на непролиферирующие клетки и на биосинтез белка (см. таблицу 6).
| Таблица 6 | |||
| Влияние дисоразола Е1 на непролиферирующие клетки и биосинтез белка | |||
| Вещество | Концентрация (мкМ) | Выжившие клетки, первичные гепатоциты человека1, среднее,% от контрольного | Синтез белка2, среднее, % от контрольного |
| Дисоразол Е1 | 1 | 119,6 | 95,9 |
| 1) Тестировано с alamarBLUE, первичные гепатоциты человека, n=3 | |||
| 2) Тестировано путем введения 14С-метионина, клетки | |||
| гепатоцеллюларной карциномы человека (HepG2), n=2 |
Результаты, приведенные в таблице 6, показывают, что дисоразол Е1 не оказывает отрицательного воздействия ни на синтез белка, ни на выживаемость непролиферирующих клеток.
1. Лекарственное средство для лечения доброкачественных или злокачественных опухолевых и пролиферативных заболеваний, отличающееся тем, что оно содержит по меньшей мере одно производное дисоразола общей формулы I
где независимо друг от друга
R1 выбран из группы, включающей водород и OR4, где R4 означает незамещенный (С1-С6)-алкил,
R2 и R3 означают водород или незамещенный (С1-С6)-алкил;
и Х означает кислород, две соседних гидроксильных группы или часть двойной связи,
Y означает кислород или часть двойной связи,
его таутомеры, E/Z-изомеры, стереоизомеры, включая диастереомеры и энантиомеры и их физиологически переносимые соли.
2. Лекарственное средство по п.1, отличающееся тем, что оно содержит производное дисоразола и фармацевтически приемлемые носители и/или разбавители и наполнители в форме растворов, суспензий, эмульсий, пен, мазей, паст, пластырей или имплантатов для введения.
3. Применение производных дисоразола общей формулы I
в которой независимо друг от друга
R1 выбран из группы, включающей водород и OR4, где R4 означает незамещенный (С1-С6)-алкил,
R2 и R3 означают водород или незамещенный (С1-С6)-алкил;
и Х означает кислород, две соседних гидроксильных группы или часть двойной связи,
Y означает кислород или часть двойной связи,
его таутомеры, E/Z-изомеры, стереоизомеры, включая диастереомеры и энантиомеры и их физиологически переносимые соли, при изготовлении лекарственного средства для лечения доброкачественных или злокачественных опухолевых и пролиферативных заболеваний у человека или животных.
4. Применение по п.3, где пролиферативное заболевание выбрано из группы, включающей заболевания дыхательных путей, бронхиальную астму, аллергический ринит, аллергический конъюнктивит, экзему и болезнь Крона.
5. Применение по п.3 производных дисоразола общей формулы I в виде соединения Е1, в котором R1 и R2 обозначают водород, R3 обозначает метил, а Х и Y представляют собой кислород.
6. Применение по пп.3 и 5 при изготовлении лекарственного средства для лечения рака молочной железы, рака яичников, рака легкого, рака кожи, рака простаты, рака почки, рака печени, рака поджелудочной железы, рака толстой кишки и форм рака головного мозга у человека.