Применение антибиотиков в качестве адъювантов вакцин
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается адъювантной композиции, включающей в себя противомикробное средство азалид тулатромицин, при этом азалид действует в качестве адъюванта. Изобретение касается также вакцины, содержащей несколько компонентов, включающих в себя (а) по меньшей мере один антиген, причем антиген выбран из группы, состоящей из антигена М. haemolytica, лейкотоксина М. haemolytica, капсульного антигена М. haemolytica, растворимого антигена М. haemolytica или их смеси, и (b) по меньшей мере один азалид, например тулатромицин, где азалид действует в качестве адъюванта. Адъювантная или вакцинная композиция согласно изобретению применимы для профилактики и лечения заболеваний, вызываемых патогенным фактором, раковой клеткой или аллергеном, у животного, отличного от человека. Предлагаемый адъювант позволяет повысить эффективность вакцинной композиции. 4 н. и 6 з.п. ф-лы, 16 табл., 2 ил.
Реферат
Изобретение связано с адъювантной композицией, включающей в себя по меньшей мере одно противомикробное средство, в частности, азалид, где противомикробное средство или азалид выступает в качестве адъюванта. Точнее, адъювантная композиция представляет собой адъювантную вакцину. Изобретение предоставляет также вакцину, включающую в себя (а) по меньшей мере один антиген и (b) по меньшей мере одно противомикробное средство, включая азалид, где указанное средство действует как адъювант. Адъювантная композиция или вакцина согласно изобретению применима для профилактики и лечения заболеваний, вызываемых патогенными факторами, такими как бактерии, например, M. haemolytica, простейшие, гельминты, вирусы, грибы, раковая клетка или аллерген. Применение азалида в качестве адъюванта до настоящего изобретения в литературе описано не было.
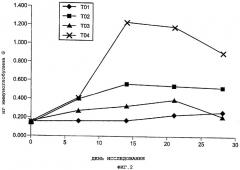
Краткое описание чертежей
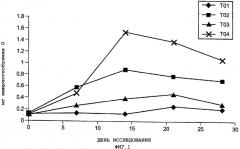
Фиг.1. Среднее геометрическое титров антитела против лейкотоксина для каждой из опытных групп.
Фиг.2. Средние значения титров антитела против цельной клетки, полученные методом наименьших квадратов, для каждой из опытных групп.
Сущность изобретения
Настоящее изобретение относится к адъювантной композиции, включающей в себя по меньшей мере одно противомикробное средство или антибиотик, в частности азалид, где указанное противомикробное средство или указанный антибиотик выступает в качестве адъюванта. Указанное противомикробное средство или указанный антибиотик может также обеспечивать терапевтические свойства (например, свойства антибиотиков); однако в предпочтительном варианте осуществления согласно изобретению указанное средство обеспечивает уровни противомикробных терапевтических свойств, от незначительных уровней до отсутствия таковых. Точнее, адъювантная композиция представляет собой адъювантную вакцину. Изобретение связано также с вакциной, которая содержит два компонента, включающих в себя (а) по меньшей мере один антиген и (b) по меньшей мере одно противомикробное средство, где противомикробное средство выступает в качестве адъюванта.
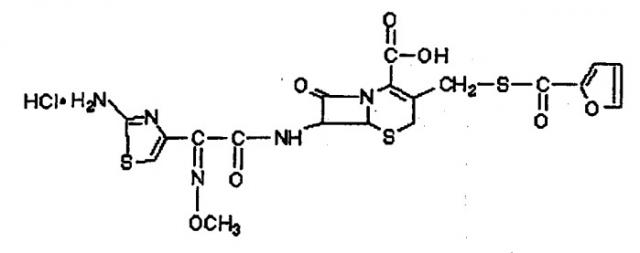
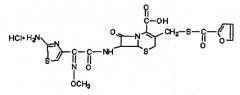
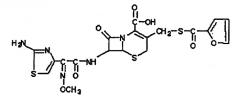
Противомикробное средство при применении в настоящем изобретении выступает в качестве адъюванта, т.е. повышает, усиливает, модулирует по мере усиления, развивает или иным образом способствует иммунной реакции на антиген. Для применения в настоящем изобретении подходит большое количество противомикробных средств, включая противомикробные средства, приведенные в описании. В одном варианте осуществления изобретения азалид представляет собой 15-членный 9а-азалид формулы I:
Химическим названием соединения формулы I является (2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-13-((2,6-дидезокси-3-C-метил-3-O-метил-4-C-((пропиламино)-метил)-α-L-рибо-гексопиразолил)окси-2-этил-3,4,10-тригидрокси-3,5,8,10,12,14-гексаметил-11-((3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил)окси)-1-окса-6-азациклопентадекан-15-он.
В другом варианте осуществления согласно изобретению азалид представляет собой смесь азалидов. В частности, азалид представляет собой смесь 9а-азалидов. Точнее, азалид представляет собой смесь 13-членного и 15-членного 9а-азалидов. Еще точнее, смесь 9а-азалидов содержит (а) соединение формулы I, представленное выше, и (b) соединение формулы II:
Химическим названием 13-членного 9а-азалида формулы II является (3R,6R,8R,9R,10S,11S,12R)-11-((2,6-дидезокси-3-C-метил-3-O-метил-4-C-((пропиламино)метил-α-L-рибо-гексопиранозил)окси)-2-((1R,2R)-1,2-дигидрокси-1-метилбутил)-8-гидрокси-3,6,8,10,12-пентаметил-9-((3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил)окси)-1-окса-4-азациклотридекан-13-он.
Точнее, смесь 9а-азалидов представляет собой композицию, включающую в себя (а) смесь соединений формулы I и II, которые представлены выше, в соотношении, соответственно, примерно от 90%±10% и примерно до 10%±10%; предпочтительно от 90%±4% и примерно до 10%±4%; (b) воду; и (с) одну или несколько кислот, присутствующих в суммарной концентрации примерно от 0,2 ммоль и примерно до 1,0 ммоль на мл композиции. Такая композиция может быть получена при нагревании до температуры в интервале примерно от 50°С и примерно до 90°С смеси, включающей в себя (i) соединение формулы (I), (ii) воду и (iii) одну или несколько кислот в суммарном количестве в интервале примерно от 0,2 ммоль и примерно до 1,0 ммоль на мл смеси.
Более точно, смесь 9а-азалидов представляет собой композицию, включающую в себя (а) (i) смесь соединений формул I и II, которые представлены выше, в соотношении, соответственно, примерно от 90%±10% и примерно до 10%±10%; предпочтительно от 90%±4% и примерно до 10±4%; (ii) воду; и (iii) одну или несколько кислот, присутствующих в общей концентрации примерно от 0,2 ммоль и примерно до 1,0 ммоль на мл композиции; и (b) один или несколько смешивающихся с водой сорастворителей в количестве примерно от 250 и примерно до 750 мг на мл композиции. Такая композиция может быть получены при нагревании до температуры в интервале примерно от 50°С и примерно до 90°С смеси, содержащей соединение формулы I или II, представленных выше, воду и одну или несколько кислот в количестве в интервале примерно от 0,2 ммоль и примерно до 1,0 ммоль на мл смеси, где один или несколько смешивающихся в водой сорастворителей добавляются перед, в процессе или после стадии нагревания в количестве примерно от 250 и примерно до 750 мг на мл композиции. В предпочтительном варианте осуществления смешивающийся с водой сорастворитель добавляют перед стадией нагревания.
Согласно настоящему изобретению концентрация соединения формулы I в композиции смеси 9а-азалидов, описанной выше, перед стадией нагревания составляет примерно от 50 мг на мл примерно до 500 мг на мл смеси. В предпочтительном варианте концентрация составляет примерно от 50 мг/мл примерно до 200 мг/мл.
Согласно настоящему изобретению концентрация первой смеси соединения I и соединения II в композиции смеси 9а-азалида, представленной выше, составляет примерно от 50 мг/мл примерно до 200 мг/мл композиции. В частности, концентрация первой смеси соединения I и соединения II в композициях 9а-азалидов, представленных выше, составляет примерно от 75 примерно до 150 мг/мл, точнее примерно от 90 мг/мл примерно до 110 мг/мл композиции.
Значение рН смеси заключено в интервале примерно от 5,0 примерно до 8,0, точнее, примерно от 5,0 примерно до 6,0. Нагревание производят в течение примерно от 0,5 примерно до 24 часов, точнее, примерно от 1 примерно до 8 часов.
Примеры подходящих кислот для композиций смесей 9а-азалидов, представленных выше, включают в себя, без ограничения, уксусную кислоту, бензолсульфоновую кислоту, лимонную кислоту, бромистоводородную кислоту, соляную кислоту, D- и L-молочную кислоту, метансульфоновую кислоту, фосфорную кислоту, янтарную кислоту, серную кислоту, D- и L-винную кислоту, п-толуолсульфоновую кислоту, адипиновую кислоту, аспаргиновую кислоту, камфорсульфоновую кислоту, 1,2-этандисульфоновую кислоту, лаурилсерную кислоту, глюкогептоновую кислоту, глюконовую кислоту, 3-гидрокси-2-нафтоновую кислоту, 1-гидрокси-2-нафтоновую кислоту, 2-гидроксиэтансульфоновую кислоту, яблочную кислоту, слизевую кислоту, азотную кислоту, нафталинсульфоновую кислоту, пальмитиновую кислоту, D-глюкаровую кислоту, стеариновую кислоту, малеиновую кислоту, малоновую кислоту, фумаровую кислоту, бензойную кислоту, холевую кислоту, этансульфоновую кислоту, глюкуроновую кислоту, глутаминовую кислоту, гиппуровую кислоту, лактобионовую (lactobionic) кислоту, лизиновую кислоту, миндальную кислоту, нападизиловую (napadisylic) кислоту, никотиновую кислоту, полигалактуроновую кислоту, салициловую кислоту, сульфосалициловую кислоту, триптофановую кислоту и их смеси. В частности, кислота представляет собой лимонную кислоту. В более конкретном варианте осуществления изобретения лимонная кислота присутствует в количестве примерно от 0,02 ммоль и примерно до 0,3 ммоль на мл композиции. В более предпочтительном варианте осуществления изобретения, кислота представляет собой смесь лимонной кислоты и соляной кислоты. В еще более предпочтительном варианте осуществления изобретения лимонная кислота присутствует в количестве примерно от 0,02 ммоль и примерно до 0,3 ммоль на мл композиции, и соляная кислота присутствует в количестве, достаточном для достижения значения рН композиции в интервале примерно от 5 до 6.
Примеры подходящих смешивающихся с водой сорастворителей для композиций смесей 9а-азалидов, представленных выше, включают в себя, без ограничения, этанол, изопропанол, диэтилгликольмонометилэфир, диэтиленгликольбутилэфир, диэтиленгликольмоноэтилэфир, диэтиленгликольдибутилэфир, полиэтиленгликоль-300, полиэтиленгликоль-400, пропиленгликоль, глицерин, 2-пирролидон, N-метил-2-пирролидон, глицеринформаль, диметилсульфоксид, дибудилсебекат, полисорбат 80 и их смеси. В частности, один или несколько смешивающихся с водой сорастворителей представляет собой пропиленгликоль. Точнее, пропиленгликоль присутствует в количестве примерно от 450 до 550 мг на мл композиции.
В другом конкретном варианте осуществления изобретения одна или несколько кислот представляют собой лимонную кислоту, присутствующую в количестве примерно от 0,02 ммоль до 0,3 ммоль на мл композиции, и соляную кислоту, присутствующую в количестве, достаточном для достижения значения рН композиции в интервале примерно от 5 до 6; один или несколько смешивающихся с водой сорастворителей представляет(ют) собой пропиленгликоль, присутствующий в количестве примерно от 450 до 550 мг на мл композиции; и композиция азалидов дополнительно включает антиоксидантный монотиоглицерин, присутствующий в количестве примерно от 4 мг/мл до 6 мг/мл композиции.
Цефтиофур представляет собой другой антибиотик, который особенно подходит в качестве адъюванта. Это видно из таблицы 8, представленной ниже, а также из других данных, представленных в описании. Цефтиофур представляет собой антибиотик, который доступен в различных солевых формах и кристаллах; таких, например, как натриевая соль, гидрохлорид и форма длительного действия, описанная как кристаллическая форма свободной кислоты, или CCFA. Форма длительного действия представляет собой форму лекарственного средства, особенно подходящую для применения в качестве адъюванта благодаря ее свойствам, включая длительный полупериод существования в организме.
Каждый антибиотик, представленный в таблицах данного описания, как отдельно, так и в сочетании с 1, 2, 3, 4 или 5 другими противомикробными средствами, конкретно описаны и заявлены в данном изобретении как применимые в качестве адъювантной вакцины или компонента вакцины.
Согласно изобретению антиген может представлять собой любой антиген, который в сочетании с противомикробным средством или, в частности, макролидом, в частности, азалидом или, точнее, бэта-лактамом, и более конкретно - цефтиофуром, вызывает повышенный, усиленный, модулируемый по мере усиления, развитый или иным образом облегченный иммунный ответ. В частности, антиген стимулирует продуцирование специфического антитела или антител, которые могут объединяться с антигеном; и/или антиген стимулирует генерирование лимфоцитов, специфичных в отношении антигена, причем указанные лимфоциты способны затем действовать против антигена путем продуцирования лимфокинов, регулирующих и стимулирующих функции эффектора, который может быть нацелен на антиген, или продуцированием клеток, которые могут специфически взаимодействовать с антигеном. Квалифицированный специалист может без труда определить подходящие антигены, и в распоряжении практикующего специалиста имеются следующие ссылки: Clinical Microbiology and Infectious Diseases of the Dog and Cat, Greene, Craig E. 1984. W.B. Saunders Co. Diseases of Feedlot Cattle. Jensen, R., and Makay, Donald R. 1965. Lea and Febiger. Virus Infections of Carnivores. Appel, M. J. ed. 1987. Elsevier Science Publishers B.V. Virus Infections of Ruminants. Dinter, Z. and Morein, B. 1990. Elsevier Science Publishers B.V. Veterinary Virology (2nd edition) Fenner, F.J. et al., 1993. Academic Press, Inc. Infectious Diseases. A Treatise of Infectious Processes. Hoeprich, P.D. et al., 1994. J.B. Lippincott Co. Diseases of Swine. Leman, A.D. et al., 1992. Iowa State University Press. Diseases of Poultry. Calnek, B.W. (ed) 1997. Iowa State University Press. Feline and Canine Infectious Diseases. Gaskell,R.M. and Bennett, M. 1996. Blackwell Science Ltd. Diseases and Disorders of Cattle. Blowey, R.W. and Weaver, A. D. 1991. Wolfe Publishing Ltd.
Примеры подходящих антигенов также определены в описании. В частности, антиген может представлять собой антиген M. haemolytica, лейкотоксин M. haemolytica, капсульный антиген M. haemolytica или растворимый антиген M. haemolytica, каждый из которых определен в настоящем описании, или их смесь (например, антиген One Shot®, коммерчески доступный от Pfizer, Inc., New York).
Изобретение связано со способом повышения, усиления, модулирования по мере усиления, развития или иным образом способствования иммунной реакции на антиген, включающий в себя введение адъювантной композиции или адъювантной вакцины согласно изобретению.
Изобретение связано со способом повышения, усиления, модулирования по мере усиления, развития или иным образом способствования иммунной реакции на антиген, включающий в себя введение вакцины согласно изобретению.
Изобретение связано также со способом лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном, включающим в себя стадию введения адъювантной композиции или адъювантной вакцины согласно изобретению.
Изобретение связано также со способом лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном, включающим в себя стадию введения вакцины согласно изобретению.
Изобретение связано также со способом профилактики заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном, включающим в себя стадию введения адъювантной композиции или адъювантной вакцины согласно изобретению.
Изобретение связано также со способом профилактики заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном, включающим в себя стадию введения вакцины согласно изобретению.
Адъювантная композиция или адъювантная вакцина согласно изобретению может применяться при производстве лекарственного средства для превентивного лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном.
Адъювантная композиция или адъювантная вакцина согласно изобретению может применяться при производстве лекарственного средства для терапевтического лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном.
Вакцина согласно изобретению может применяться при производстве лекарственного средства для превентивного лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном.
Вакцина согласно изобретению может применяться в производстве лекарственного средства для терапевтического лечения заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном.
Изобретение описано для применения в вакцинах для человека и вакцинах для животных, отличных от человека.
Адъювантная композиция может включать в себя одно или несколько противомикробных средств. Вакцина для человека или для животных, отличных от человека, может включать в себя по меньшей мере два компонента, вводимых либо одновременно, либо совместно в течение месяца, где первый компонент представляет собой адъювант, включающий в себя одно или несколько противомикробных средств, а второй компонент представляет собой один или несколько антигенных факторов.
В вакцине с адъювантом адъювант является противомикробным средством, которое представляет собой макролидный антибиотик. В вакцине для животных, отличных от человека, противомикробное средство представляет собой Draxxin® или тултрамицин, а антигенный фактор представляет собой одно или несколько средств, выбранных из группы, включающей в себя антиген M. haemolytica, лейкотоксин M. haemolytica, капсульный антиген M. haemolytica, растворимый антиген M. haemolytica или их смесь.
Адъювантная композиция, которая может применяться в вакцине и вводиться одновременно или совместно с антигеном, выбранным из любого антигена M. haemolytica, представляет собой адъювантную композицию по п. 10, где указанный 9а-азалид представляет собой композицию, включающую в себя (а) (i) смесь соединений формул I и II в соотношении примерно от 90%±10% и примерно до 10%±10%, соответственно; (ii) воду; и (iii) одну или несколько кислот, присутствующих в суммарной концентрации примерно от 0,2 ммоль до 1,0 ммоль на мл композиции; и (b) один или несколько смешивающихся с водой сорастворителей, присутствующих в количестве примерно от 250 до 750 мг на мл композиции.
Вакцина, включающая в себя любую из противомикробных адъювантных композиций, описанных в данном изобретении, вводится одновременно или совместно с антигеном.
Способ повышения, усиления, модулирования по мере усиления, развития или иного способствования иммунной реакции в организме животного на антиген, включающий в себя введение противомикробного средства животному.
Вакцина, где противомикробное средство представляет собой по меньшей мере один адъювантный компонент из одновременно или совместно вводимых противомикробных средств и антигена, где противомикробное средство выбрано из противомикробных средств, описанных в изобретении, и где антигенные средства представляют собой антигенные средства, описанные в настоящем изобретении.
Способ профилактики заболевания, вызываемого патогенным фактором, раковой клеткой или аллергеном у животного, включающий в себя стадию введения адъювантной композиции или вакцин, описанных в настоящем изобретении, животному, чувствительному к указанному заболеванию. Препарат лекарственного средства такого типа, как описано в настоящем изобретении, для создания вакцины или набора препаратов. Применение такого препарата вакцины или набора для вакцинации животных от заболевания.
Набор, включающий в себя адъювант или вакцины, описанные в настоящем изобретении, и инструкции по их применению, где компоненты набора содержат противомикробное средство или антигенное средство или оба указанных средства и где указанные компоненты могут вводиться совместно или одновременно.
Подробное описание изобретения
Определения
Используемое в описании единственное число в равной степени можно отнести к существительным во множественном числе.
Термин "адъювант", используемый в описании, за исключением особо оговоренных случаев, относится к любому веществу или смеси веществ, которое(ые) повышает(ют), усиливает(ют), модулирует(ют) по мере усиления, развивает(ют) или иным образом способствует(ют) иммунному ответу (например, гуморальному или клеточному иммунному ответу) на антиген.
Термин "антиген" или "антигенное средство", за исключением особо оговоренных случаев, относится к любому средству, которое при введении в организм иммунологически зрелого человека или животного стимулирует гуморально и/или клеточно опосредуемую иммунную реакцию. Антиген может представлять собой чистое вещество, смесь веществ или особый материал (включая клетки, клеточные фрагменты или фрагменты, полученные из клеток) или живой, обычно аттенуированный организм или вирус. Примеры подходящих антигенов включают в себя, без ограничения, белок, гликопротеид, липопротеид, пептид, углевод/полисахарид, липополисахарид, токсин, вирус, бактерию, гриб или паразит. Другие подходящие антигены включают в себя компоненты антигенов млекопитающих, такие как, без ограничения, антигенную детерминанту, эпитоп или пептид. Другие подходящие антигены включают в себя антигены, описанные в Патенте США № 5855894. Антиген может быть природным (природно экспрессируемым или природно созданным), синтетическим или полученным с помощью методик с использованием рекомбинатной ДНК, известных специалистам в данной области.
Термин "противомикробное средство" относится к любому средству, которое поражает или подавляет размножение или рост микроорганизма, включая бактерию, например M. haemolytica, простейшие, гельминты, вирусы, грибы, раковую клетку или аллерген. Оно представляет собой химическое соединение, которое является в достаточной степени нетоксичным по отношению к организму хозяину и предназначено для внутреннего или наружного введения. Примеры противомикробных средств представлены и подробно описаны ниже, но изобретение распространяется также на любое подобное средство, будь то средство, описанное ниже, или средство, открытое позже. Одним конкретным типом противомикробного средства является антибиотик, в особенности применимый в качестве адъюванта, которыми являются азалиды. Другим предпочтительным противомикробным средством являются бета-лактамы, в частности цефтиофур, более конкретно - цефтиофур длительного действия. Период введения или продолжительность приема противомикробного средства зависит от его эффективности и частоты введения для противомикробного применения. Обычно оно будет вводиться от 1 до 3 раз в день в течение примерно недели плюс или минут несколько дней. В предпочтительном варианте осуществления изобретения необходимо только одно введение адъюванта, содержащего антибиотик. В более предпочтительном варианте одно введение может осуществляться примерно в одно время с вакциной в одном шприце или аппликаторе или в отдельном шприце или аппликаторе примерно в одно время с другим компонентом или вакциной. В различных вариантах осуществления временной период может быть любым в интервале примерно от нуля (при одновременном введении), примерно от 1 до 2 часов или от 1 до 10 дней, со специфическими периодами в пределах примерно 1, 2, 3, 4, 5, 6, 7, 8 часов или примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, которые конкретно и отдельно описаны и заявлены в данном изобретении. Специалист может без труда определить длительность введения противомикробного средства.
Термин "азалид", за исключением особо оговоренных случаев, относится к классу соединений, характеризующихся сахарозамещенными азотсодержащими макроциклическими лактоновыми циклами. Примеры подходящих азалидов включают в себя, без ограничения, 8а- и 9а-азалиды и их смеси. В частности, азалид представляет собой 8а-азалид, 9а-азалид или их смеси. Примеры подходящих 8а-азалидов включают в себя, без ограничения, азалиды, описанные в Патенте США № 6054434. Примеры подходящих 9а-азалидов включают в себя, без ограничения, 9а-азалиды, описанные в Патентах США №№ 6339063 и 6514945.
Термин "капсульный антиген", за исключением особо оговоренных случаев, относится к любому из антигенов, обычно полисахариду по природе, которые находятся на поверхности бактериальных капсул. Капсульный антиген может также называться капсульным полисахаридом или капсульным соединением. Например, капсульный антиген может представлять собой растворимый капсульный полисахарид из M.(Р) haemolytica, которые описаны в литературе (см., например, Inzana, T.J., "Capsules and Virulence in the HAP Group of Bacteria" Can. J. of Vet. Research, 54:S22-S27 (1990); Adlam et al., "Purification, characterization and immunological properties of serotype-specific capsular polysaccharide of Pasteurella haemolytica (serotype A1) organisms" J. Gen. Microbiol., 130:2415-2426 (1984).
Термин "цефтиофур" относится к противомикробному антибиотику цефалоспориновых типов. Все цефалоспорины заявлены и описаны в настоящем изобретении. Концентрация цефалоспорина в препарате согласно изобретению может изменяться в интервале примерно от 1 мг/мл до 500 мг/мл. Например, для цефтиофура гидрохлорида предпочтительная концентрация составляет примерно 50 мг/мл. Обычно верхний предел концентрации определяется концентрацией, при которой масляная композиция становится слишком вязкой для введения шприцем. Дополнительная информация по дозировке и способу введения антибиотика цефтиофура гидрохлорида приводится в Патенте США № 4902683, который введен в данное описание в виде ссылки.
Доступны также препараты цефтиофура гидрохлорида с концентрацией 12,5 мг/мл. Когда антибиотиком является цефтиофур или его фармацевтически приемлемая соль, интервал его предпочтительных концентраций в композиции согласно изобретению составляет примерно от 1 примерно до 1000 мг/мл, более предпочтительно, примерно от 5 примерно до 750 мг/мл, еще более предпочтительно, примерно от 10 примерно до 100 мг/мл. Для антибактериальных средств, отличных от цефтиофура, подходящие интервалы концентраций, которые обеспечивают эквивалентную антибактериальную активность, могут определяться специалистом на основании данных, приведенных в литературе.
Цефтиофур является высокоэффективным антибиотиком, поставляемым в нескольких формах, таких как натриевая соль, HCl и свободная кислота, а также полиформы, и все они заявлены в настоящем изобретении. Наиболее предпочтительной для применения в настоящем изобретении является кристаллическая свободная кислота (CCFA). Отмечается, что желаемый уровень содержания метаболитов цефтиофура в плазме крови пациентов должен составлять примерно 0,2 мкг/мл или выше. В одном варианте осуществления согласно изобретению разовая доза CCFA в носителе с поддерживаемым высвобождением действующего вещества поддерживается на уровне содержания метаболитов цефтиофура в плазме крови, составляющем примерно 0,2 мг/мл или выше в течение по меньшей мере трех дней, предпочтительно в течение по меньшей мере примерно четырех дней, и наиболее предпочтительно в течение по меньшей мере примерно четырех дней после введения (поддерживаемая доставка CCFA). Сравнения по степени поддерживаемой доставки биоактивных средств проводили для эквивалентных форм, т. е. натриевые соли сравнивали с натриевыми солями, свободные основания - со свободными основаниями. Поддерживаемая доставка действующего вещества должна быть специфически выверена с общепринятым определением для этого термина, в соответствии с которым необходимо, чтобы профиль концентрации во времени имел три различимых фазы (т.е. фазу возрастания концентрации, фазу поддерживания постоянной концентрации и фазу уменьшения концентрации). Хотя термин "поддерживаемая доставка" может включать в себя указанное выше общепринятое определение, это не означает, что он не включает композициями с поддерживаемой доставкой действующего вещества, которые не обладают тремя различимыми фазами (например, композиция может иметь фазу повышения концентрации и увеличенную фазу снижения концентрации). Количество композиции согласно изобретению, предназначенное для введения, является таким, что будет обеспечивать доставку биоактивного средства в количестве и в течение периода, при которых осуществляется терапевтически полезное действие, необходимое для лечения или профилактики заболевания, без побочного токсикологического воздействия на пациента. Считается, что квалифицированный специалист без труда подберет точные необходимые количества. Например, когда в качестве биоактивного средства выбран CCFA, он вводится в лекарственной форме стандартной дозы для внутримышечного или подкожного введения, включающей в себя примерно от 0,5 до 10,0 мг CCFA/кг массы тела пациента, с предпочтительными дозами для домашнего скота в интервале от 4,4 до 6,6 мг/кг и для свиньи - интервале от 5,0 до 7,5 мг/кг. Подробное описания дозировок приведено в Патентах США №№ 5721359 и 6074657, которые введены в данное описание в виде ссылок.
Термин "одновременное введение", за исключением особо оговоренных случаев, относится к введению одного компонента согласно изобретению, такого как адъювант, в пределах некоторого периода времени относительно введения другого компонента, такого как вакцина. Место введения двух компонентов в организм животного может быть любым подходящим местом или способом введения. Обычно временной интервал между введениями составляет 10 дней или менее, более предпочтительно - неделю плюс-минус несколько дней, более предпочтительно - 2, 3, 4, 5, 6 дней. В различных вариантах осуществления согласно изобретению временной период может быть любым в интервале от 2 до 10 дней, с конкретно описанными периодами примерно в 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней. Компоненты могут вводиться в одном, двух или нескольких шприцах.
Термин "совместное введение", за исключением особо оговоренных случаев, относится к введению одного компонента согласно изобретению, такого как адъювант, в пределах некоторого периода относительно введения другого компонента, такого как вакцина. Место введения двух компонентов в организме животного может быть любым подходящим местом или способом введения. Обычно период между введением двух компонентов может составлять примерно от введения в одно и тоже время до периода в пределах часа. В различных вариантах осуществления согласно изобретению период может составлять примерно 0, 1 или 2 часов, предпочтительно, а также конкретно описаны и заявлены примерно 1, 2, 3, 4, 5, 6, 7 или 8 часов в тот же день, и каждый возможный период конкретно и отдельно описан и заявлен в настоящем изобретении. Период времени может составлять до 1 дня для совместного введения двух компонентов. Компоненты могут вводиться в одном, двух или нескольких шприцах или аппликатора. Более предпочтительно, компоненты могут вводиться в одном или двух шприцах в пределах часа, более предпочтительно, примерно в одно и то же время. Два компонента могут находиться в одном или разных шприцах.
Термин "набор" относится к любому набору или комплекту изделий для специального назначения, в данном случае для иммунизации человека или животного. Он может включать в себя и относиться к контейнеру для такого набора. Он может относиться к упакованному набору материалов, включающему в себя ампулы и инструкции или руководства. Он может быть в одной или нескольких частях в наборе, разделенном на отдельные секции. Набор может состоять из одной или нескольких упаковок, которые образуют или составляют любой конкретный набор.
Термин "лейкотоксин", за исключением особо оговоренных случаев, относится к любому соединению, токсичному в отношении лейкоцитов. Например, лейкотоксин может представлять собой растворимый токсин, полученный активным выращиванием Mannheimia (Pasteurella) haemolytica, как описано в литературе (см., например, Патент США 5055400; Заявку на патент Канады 91000097 и публикацию Gentry et al., "Neutralizing monoclonal antibodies to P. haemolytica leukotoxin affinity-purify the toxin from crude culture supernatants" Microbial Pathogenesis, 10: 411 - 417 (1991). Термин "лейкотоксоид" используется для описания инактивированного лейкотоксина. Иначе лейкотоксин называется в литературе, в соответствии с другими определениями, экзотоксином или цитотоксином.
Термин "растворимый антиген", за исключением особо оговоренных случаев, относится к любому(ым) антигену(ам) из любого источника, который(е) существует(ют) или может(гут) существовать в растворимом состоянии. Например, растворимый антиген может представлять собой растворимый антиген, выделяемый в процессе роста M.(P.) haemolytica и отличный от лейкотоксина и капсулированного антигена, такого как глюкопротеаза и нейраминидаза (см., например, Reggie et al. "Molecular Studies of Ssal, a Serotype-Specific Antigen of Pasteurella haemolytica A1", Infection and Immunity, Vol. 59 No.103398-3406 (1991).
Термин "тулатромицин", за исключением особо оговоренных случаев, относится к смесевой композиции 9а-азалидов, содержащей (а) (i) смесь соединений формул I и II, каждая из которых описана выше, в соотношении примерно от 90%±4% до 10%±4%, соответственно; (ii) воду; и (iii) одну или несколько кислот, присутствующих в суммарной концентрации примерно от 0,2 ммоль до 1,0 ммоль на мл композиции; и (b) один или несколько смешивающихся с водой сорастворителей, присутствующих в количестве примерно от 250 до 750 мг на мл композиции.
Термин "вакцина", за исключением особо оговоренных случаев, относится к любому препарату антигенного или иммуногенного материала, подходящему для стимулирования активного иммунитета у животных или человека. Противомикробное средство или адъювантная композиция вакцины и, в частности, композиция азалида или адъювантной вакцины согласно изобретению может применяться в таком препарате.
Противомикробное средство или адъювантная композиция вакцины и, в частности, азалида, для применения в настоящем изобретении, как показано выше, могут быть коммерчески доступными или могут быть получены с применением реакций органической химии и способов, известных в данной области, включая способы, описанные выше. Например, азалид формулы I, которая представлена выше, может быть получен с помощью реакции транслактонизации азалида формулы II, которая представлена выше. Аналогично, азалид формулы II может быть получен в результате реакции транслактонизации азалида формулы I. Смеси азалидов формул I и II могут быть получены из соединения формулы I или формулы II при обеспечении состояния равновесия в водном растворе. Способы получения азалида формулы I описаны в публикации Международной заявки на патент WO 98/56802. Способы получения азалида формулы II описаны в Патенте США № 6514945. Другие способы получения азалидов описаны в Патентах США №№ 6054434 и 6339063, а также в примерах, представленных ниже.
Вакцина согласно изобретению может быть получена любым из способов, известных в данном области, включая методику, представленную в примере 1 ниже. В частности, вакцина может быть получена при объединении по меньшей мере одного азалида по меньшей мере с одним антигеном, как описано в изобретении. Точнее, антиген находится в лиофилизированной форме и восстанавливается по меньшей мере одним раствором азалида, выступающим в качестве адъюванта, непосредственно перед применением. Альтернативно твердый (например, порошкообразный) азалид (например, соединение формулы I или соединение формулы II) объединяется с водным раствором антигена, с получением вакцины.
Адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может также содержать дополнительные средства. Например, могут присутствовать дополнительные антигены. В частности, адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может содержать сочетание антигенов из Pasteurella multocida, Haemophilus somni, Clostridial species, Mycoplasma species, респираторный вирус синцития крупного рогатого скота (Bovine Respiratory Syncytial Virus), вирус вирусной диареи крупного рогатого скота (Bovine Viral Diarrhea Virus) и вирус парагриппа 3 типа крупного рогатого скота (Bovine Parainfluenza Type 3 virus) или любое другое инфекционное средство или его производное. Адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может также содержать антиген(ы), относящийся(еся) к антигену из раковой клетки или аллергену, полученному(ым) из нее или идентичному(ым) ей.
Адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может дополнительно включать в себя один или несколько антиоксидантов, присутствующих в количестве примерно от 0,01 мг до 10 мг на мл композиции. В частности, один или несколько антиоксидантов, выбранных из группы, включающей в себя бисульфит натрия, сульфит натрия, метабисульфит натрия, тиосульфит натрия, натрийформальдегидсульфоксилат, L-аскорбиновую кислоту, эриторбиновую (erythorbic) кислоту, ацетилцистеин, цистеин, монотиоглицерин, тиогликолевую кислоту, тиомолочную кислоту, тиомочевину, дитиотрейтол, дитиоэритрейтол, глутатион, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, нордигидрогваяретовую кислоту, пропилгаллат, альфа-токоферол и их смеси. В частности, один или несколько антиоксидантов представляют собой монотиоглицерин. В другом конкретном варианте осуществления изобретения монотиоглицерин присутствует в количестве примерно от 4 мг/мл и примерно до 6 мг/мл композиции.
Адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может дополнительно включать в себя один или несколько консервантов в количестве примерно от 0,01 и примерно до 10 мг на мл композиции. Примеры подходящих консервантов включают в себя, без ограничения, хлорид бензалкония, хлорид бензэтония, бензойную кислоту, бензиловый спирт, метилпарабен, этилпарабен, пропилпарабен, бутилпарабен, бензоат натрия, фенол и их смеси. Для квалифицированного специалиста в данной области понятно, что наличие или отсутствие консерванта будет зависеть от антигена. Например, если антиген представляет собой живой бактериальный антиген, тогда добавлять консервант не следует.
Адъювантная композиция, адъювантная вакцина или вакцина согласно изобретению может также включать в себя дополнительный адъювант, который не является противомикробным сре