Новое применение замещенных аминометилхроманов
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается применения (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его фармацевтически приемлемых солей или сольватов для производства лекарственного средства для лечения каталепсии. Также предложена фармацевтическая композиция для лечения каталепсии, включающая в качестве активного ингредиента фармацевтически эффективное количество (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. 3 н.п. ф-лы.
Реферат
Настоящее изобретение относится к новому применению замещенных аминометилхроманов для лечения двигательных расстройств и неблагоприятных эффектов, индуцированных введением лекарственных средств, которые предназначены для лечения экстрапирамидных двигательных расстройств.
Изобретение предпочтительно относится к применению замещенных аминометилхроманов формулы I
где
R представляет собой водород или защитную группу гидроксила, их оптических изомеров и фармацевтически приемлемых солей или сольватов, в частности 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метилхроман-4-ола, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)хроман-7-ола, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ола или их оптических изомеров или физиологически приемлемых солей или их сольватов, для производства лекарственного средства для лечения экстрапирамидных двигательных расстройств и/или для производства лекарственного средства для лечения неблагоприятных эффектов антипаркинсонических лекарственных средств, используемых при экстрапирамидных двигательных расстройствах и/или для производства лекарственного средства для лечения экстрапирамидных симптомов (EPS), индуцированных нейролептиками. Соединения формулы I являются особо полезными при лечении дискинезии.
Патент US №5,767,132 описывает простые производные аминометилхромана, которые являются приемлемыми для профилактики и контроля осложнений инфаркта головного мозга (апоплектического удара), таких как нарушение мозгового кровообращения, церебральная ишемия, для профилактики и контроля церебральных расстройств, например мигрени, особенно у пожилых людей, по типу, подобному определенным алкалоидам спорыньи, для лечения беспокойства, напряженности и депрессивных состояний, сексуальных дисфункций, обусловленных центральной нервной системой, для лечения нарушения сна или усвоения пищи или для лечения психоза (шизофрении).
Кроме того, они являются приемлемыми для устранения когнитивной недостаточности, для улучшения способности к запоминанию и улучшения памяти, для лечения болезни Альцгеймера. Они также могут быть использованы для лечения побочных эффектов лечения гипертензии, в эндокринологии и гинекологии, например для лечения акромегалии, гипогонадизма, вторичной аменорреи, предменструального синдрома или нежелательной родильной лактации.
Подобные соединения описаны в работе "Метаболизм лекарственных средств и их свойства", том 29, №7, 1042-1050, 2001.
В отличие от соединений, раскрытых в патенте US №5,767,132, соединения в соответствии с формулой I являются простыми агонистами рецептора 5-HT1A и антагонистами допаминового рецептора D4. Они не выявляют ингибиторного влияния на допаминовые рецепторы D2 или D3.
Неожиданное преимущество соединений формулы I и, в частности, тех, у которых R=Н и F находится в 4-положении фенильного кольца, заключается в том, что у них действительно отсутствует какое-либо антагонистическое влияние на допаминовые рецепторы D2 (и D3). В отличие от рецептора D4 их антагонистические свойства в отношении допаминового рецептора D2 и равно, хоть и менее отчетливо, в отношении рецептора D3, ассоциируются с индукцией различных экстрапирамидных двигательных нарушений, которые могут подвергаться лечению с помощью соединений формулы I.
Используемый принцип получения аминометилхроманов формулы I в соответствии с изобретением раскрыт в патенте US №5,767,132. Патент US №5,767,132 введен в данную заявку как ссылка.
Аналогично способу, описанному в Патенте US № US 5,767,132, соединения формулы I в соответствии с пунктом 1 и их оптические изомеры и/или их фармацевтически приемлемые соли и сольваты могут быть получены таким образом, что
(а) соединение формулы II
где G представляет собой Cl, Br, l, алкилсульфонилокси, содержащую от 1 до 6 атомов углерода или арилсульфонилокси, содержащую от 6 до 10 атомов углерода, и R представляет собой защитную группу гидроксила,
подвергают реакции с амином формулы III
и, необязательно, отщепляют защитную группу гидроксила для получения соединений формулы I, где R=Н; или
(b) соединение формулы IV, полученное, как описано в патенте US №5,767,132
где алкил представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода, подвергают дезалкилированию при использовании дезалкилирующего агента для получения соединений формулы I, где R=Н.
Особо предпочтительным является способ (с) для получения соединений формулы IA
имеющих четкую стереохимию, в которых хроманамин формулы V
подвергают реакции с альдегидом формулы VI
и обрабатывают донором гидрида, предпочтительно комплексным гидридом, таким как борогидрид натрия.
Новое соединение формулы IA также является предметом данного изобретения.
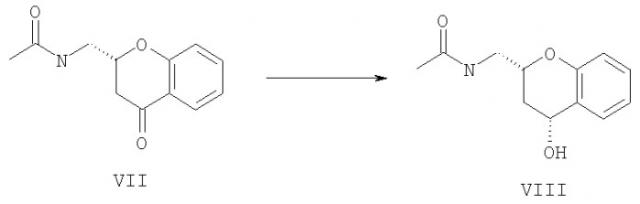
Исходное соединение формулы V для способа (с) предпочтительно получают при использовании соединения формулы VII (получаемого с помощью энантиоселективной каталитической гидрогенизации и кристаллизации в соответствии с WO 02/20507),
которое подвергают гидрогенизации для получения после необязательной кристаллизации энантиомерно и диастереомерно чистого соединения формулы VIII.
Соединение формулы VIII гидролизуют до соединения формулы V с помощью традиционных методов, предпочтительно путем обработки раствором гидроксида щелочного металла, такого как гидроксид натрия.
В предпочтительном способе получения соединения формулы VIII соединение формулы VII
является диастереоселективно гидрогенизированным с помощью комплексного гидрида, предпочтительно борогидрида щелочного металла, такого как борогидрид натрия в спирте, таком как метанол или этанол, что ведет к получению после необязательной кристаллизации энантиомерно и диастереомерно чистого соединения формулы VIII.
Этот способ гидрогенизации соединения формулы VII имеет то преимущество, что обеспечивает получение соединение VIII, не содержащего или содержащего только незначительные количества нежелательного диастереомера Vllla:
Таким образом, настоящее изобретение также относится к способу получения соединений формулы IA
имеющих четкую стереохимию, где хроманамин формулы V
подвергают реакции с альдегидом формулы VI
и обрабатывают донором гидрида.
Изобретение также относится к способу получения соединений формулы IB, который включает следующие этапы:
а) гидрогенизацию соединения формулы VII
до соединения VIII
которое необязательно кристаллизуют для очистки,
b) гидролиз соединения VIII, полученного на этапе а), до соединения формулы V
с) реакцию соединения формулы V, полученного на этапе b), с соединением формулы VI и обработку донором гидрида
Предпочтительным является описанный выше способ получения соединения формулы IA, где гидрогенизацию соединения формулы VII до соединения VIII на этапе а) проводят диастереоселективно с помощью комплексного гидрида, предпочтительно борогидрида щелочного металла, такого как борогидрид натрия в спирте, таком как метанол или этанол.
Особенно предпочтительной является описанная выше процедура для получения (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола при использовании соединения формулы VIA вместо VI
Алкильная группа в формуле IV предпочтительно является неразветвленной и имеет 1, 2, 3, или 4 атома углерода, предпочтительно является метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, втор. бутилом или трет. бутилом. Особо предпочтительным является метил.
В алкилсульфонилоксильной группе, содержащей от 1 до 6 атомов углерода, алкильный остаток может быть метилом, этилом, пропилом, изопропилом, бутилом, пентилом или гексилом. Особенно предпочтительной группой для алкилсульфонилокси является метансульфонилокси.
В арилсульфонилокси группе, содержащей от 6 до 10 атомов углерода, арильный остаток может быть фенилом, о-, м- или п-толилом, о-, м-, п-этилфенилом, о-, м- или п-пропилфенилом или нафтилом. Особенно предпочтительными для арилсульфонилокси являются бензолсульфонилокси, п-толуолсульфонилокси, нафталин-1- или нафталин-2-сульфонилокси.
Выражение "защитная группа гидроксила" является общеизвестным и относится к группам, приемлемым для защиты гидроксильной группы от химических реакций, однако эти группы легко удаляются после прохождения желаемых химических реакций по другим положениям в молекуле.
Традиционными группами этого типа являются незамещенные или замещенные арил, аралкил, ароил или ацил, а также алкильные группы, алкил-, арил- или аралкилсилильные группы или О, О- или О, S-ацетали. Природа и размер защитных групп гидроксила не являются критическими, поскольку они удаляются после прохождения желаемых химических реакций или последовательности реакций; при этом группы, содержащие 1-20, в частности 1-10, атомов углерода, являются предпочтительными. Примерами защитных групп гидроксила являются, среди прочих, бензил, 4-метоксибензил или 2,4-диметоксибензил или ароильные группы, такие как бензоил или п-нитробензоил, ацильные группы, такие как ацетил или пивалоил, п-толуолсульфонил, алкильные группы, такие как метил или трет. бутил, а также аллильные, алкилсилильные группы, такие как триметилсилил (TMS), триизопропилсилил (TIPS), трет. бутилдиметилсилил (TBS) или триэтилсилил, триметилсилилэтил, аралалкилсилильные группы, такие как трет. бутилдифенилсилил (TBDPS), циклические ацетали, такие как изопропилиден-, циклопентилиден-, циклогексилиден, бензилиден-, п-метоксибензилиден- или о-, п-диметоксибензилиденацеталь, ациклические ацетали, такие как тетрагидропиранил (Thp), метоксиметил (MOM), метоксиэтоксиметил (MEM), бензилоксиметил (ВОМ) или метилтиометил (МТМ). Ацильные группы, содержащие от 2 до 5 С атомов углерода, такие как ацетил, пропионил, бутирил и пивалоил, являются наиболее предпочтительными в качестве защитной группы гидрокисла в соединениях формулы I в соответствии с изобретением.
Соединения формулы I могут быть иным образом получены с помощью способов, которые известны сами по себе, такими как те, что описаны в литературе (например, в общеизвестных работах, таких как Хубен-Вэйль, "Методы органической химии", Жорж-Тим-Ферлаг, Штуттгарт), в частности при таких условиях реакции, как те, что не упомянуты подробно в данной заявке.
Соединения формул II и III являются известными; соединения формулы II или III могут быть легко получены аналогично известным соединениям, например аналогично тем, что описаны в патенте US №5,767,132.
Реакцию соединений формул II и III проводят в соответствии со способами, известными в литературе для алкилирования аминов. Компоненты могут быть расплавлены вместе при отсутствии растворителя в закрытой емкости или автоклаве, в случае необходимости. Также возможно, однако, проводить реакцию соединений в присутствии инертного растворителя. Примерами приемлемых растворителей являются углеводороды, такие как бензол, толуол или ксилен; кетоны, такие как ацетон или бутанон; простые эфиры, такие как тетрагидрофуран или диоксан; амиды, такие как диметилформамид или н-метилпирролидон; или нитрилы, такие как ацетонитрил, или, если это является желательным, смеси этих указанных растворителей или их смеси с водой. Желательно добавлять агент для связывания кислоты, например гидроксид щелочного металла или гидроксид щелочно-земельного металла, карбонат или бикарбонат или другую соль щелочного металла или щелочно-земельного металла со слабой кислотой, предпочтительно соль калия, натрия или кальция, или добавлять органическую основу, такую как триэтиламин, диметиламин, пиридин или хинолин, или избыток аминного соединения. Время реакции составляет от нескольких минут до 14 дней, в зависимости от используемых условий, а температура реакции составляет приблизительно от 0 до 150°C, в норме от 20 до 130°С.
Предпочтительными соединениями в контексте данного изобретения являются те, которые характеризуются общей формулой I
где
OR находится в 4-, 7- или 8-положении в системе хромана, и F находится в 4-положении фенильного кольца.
Таким образом, предпочтительными соединениями являются 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-7-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол, или их оптические изомеры или их физиологически приемлемые соли или сольваты, такие как
a) (2R/S,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
b) (2S,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
c) (2S,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
d) (2S,4S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
e) (2R,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
f) (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
g) (2R,4S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
h) (2R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-7-ол,
i) (2S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман 7-ол,
j) (2S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-7-ол,
k) (2R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол,
I) (2R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол,
m) (2S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол,
или их физиологически приемлемая соль, или их сольват.
Особо предпочтительными соединениями формулы I являются соединения, выбранные из группы, состоящей из
a) (2R/S,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола,
b) (2S,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола,
c) (2S,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)хроман-4-ола,
d) (2S,4S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол,
e) (2R,4R/S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола,
f) (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола,
g) (2R,4S)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола,
или их физиологически приемлемых солей или сольватов.
Наиболее предпочтительным соединением формулы I является (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол, или его физиологически приемлемая соль, или его сольват.
В контексте данного изобретения соединение аминометилхромана формулы I может быть представлено в различных стереоизомерных формах, т.е. в форме или их (+) или (-) энантиомеров или как смесь этих энантиомеров (рацемат). В отношении разделения рацематов на энантиомерные формы следует сделать ссылку на релевантные, известные специалисту источники информации.
В контексте данного изобретения могут также использоваться физиологически приемлемые соли. Физиологически приемлемые соли замещенных 2-аминометилхроманов формулы I могут быть солями в соответствии с изобретением с приемлемыми органическими или неорганическими кислотами, в частности минеральными кислотами, карбоновыми кислотами или сульфоновыми кислотами. Особо предпочтительными солями являются, например, таковые с соляной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, толуолсульфоновой кислотой, бензолсульфоновой кислотой, нафталиндисульфоновой кислотой, уксусной кислотой, пропионовой кислотой, молочной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой, бензойной кислотой.
Предпочтительная соль 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его оптических изомеров представляет собой моногидрохлорид или гемигидрат моногидрохлорида.
Предпочтительная соль 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-7-ола или его оптических изомеров представляет собой гидробромид или малеат.
Предпочтительная соль 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ола или его оптических изомеров представляет собой гидробромид или малеат.
Объектом изобретения является также новое применение замещенных аминометилхроманов формулы I, их оптических изомеров и/или их физиологически приемлемых солей и сольватов.
Было обнаружено, что замещенные аминометилхроманы формулы I
где
R представляет собой водород или защитную группу гидроксила,
и их оптические изомеры и фармацевтически приемлемые соли и сольваты, в частности 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метилхроман-4-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метилхроман-7-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол, или их оптический изомер, или их физиологически приемлемая соль, или их сольват имеют терапевтическую активность в отношении эстрапирамидных двигательных расстройств, таких как идиопатическая болезнь Паркинсона, синдромы Паркинсона, дискинетические, хореатические или дистонические синдромы, тремор, синдром Жилля де ля Туретте, баллизм, миоклонус, синдром неугомонных ног или болезнь Вилсона, а также экстрапирамидных двигательных нарушений [синоним экстрапирамидных симптомов (EPS)], индуцированных нейролептиками.
Кроме того, было обнаружено, что замещенные аминометилхроманы формулы I
где
R представляет собой водород или защитную группу гидроксила,
и их оптические изомеры и их фармацевтически приемлемые соли и сольваты, в частности 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино)-метил)-хроман-4-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-7-ол, 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-8-ол, или их оптический изомер, или их физиологически приемлемая соль, или их сольват имеют терапевтическую активность в отношении неблагоприятных эффектов антипаркинсонических лекарственных средств при экстрапирамидных двигательных расстройствах, в частности в отношении допаминомиметических неблагоприятных эффектов антипаркинсонических лекарственных средств при идиопатической болезни Паркинсона или синдромах Паркинсона.
Было обнаружено, что замещенные аминометилхроманы формулы I
где
R представляет собой водород или защитную группу гидроксила,
и их оптические изомеры, их фармацевтически приемлемые соли, в частности 2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино)-метил)-хроман-4-ол, или его оптический изомер, или его физиологически приемлемая соль или сольват, обладают исключительной эффективностью в устранении каталепсии.
Экстрапирамидные двигательные побочные эффекты, например, у грызунов определяются способностью лекарственного средства индуцировать каталепсию. Каталепсия определяется как состояние, при котором животное продолжает оставаться в ненормальной (нефизиологической "некомфортной") позе в течение длительного периода времени (например, М.Е.Stanley и S.D.Glick, Neuropharmacology, 1996; 15: 393-394; С.J.E.Niemegeers и Р.Janssen, Life Sci., 1979, 201-2216). Например, если задняя лапа крысы находится в поднятом состоянии, в частности на площадке, размещенной на 3 см выше поверхности земли, при этом нормальная крыса немедленно опускает лапу до уровня земли. Каталептическая крыса остается в такой неестественной позе даже в течение нескольких минут.
Благоприятное воздействие на экстрапирамидную двигательную систему ранее было описано для других лекарственных средств, имеющих 5-HT1A агонистическую активность. Буспирон, например, который является анксиолитическим лекарственным средством, демонстрирует умеренные антидискинетические свойства у пациентов с прогрессивной болезнью Паркинсона (В.Kleedorfer и др., J.Neurol Neurosurg. Psychiatry, 1991, 54: 376-377; V.Bonifati и др., Clin. Neuropharmacol., 1994, 17: 73-82). Основной механизм действия становится очевидным при стимуляции рецепторов 5-HT1A черных и полосатых проводящих путей.
Кроме того, антипсихотическое лекарственное средство клозапин, которое имеет чрезвычайно высокое сродство к допаминовому рецептору D4, а также к разнообразным другим рецепторам демонстрирует благотворное антидискинетическое влияние у пациентов с болезнью Паркинсона (например, Durif F. и др.. Neurology 1997; 48: 658-662). Недавно для экспериментального соединения 8-метил-6-(4-метил-1-пиперазинеил)-11Н-пиридо-[2,3-b][1,4]-бензодиазепина, структурного аналога клозапина со значительно повышенной по сравнению с самим клозапином селективностью для допаминового рецептора D4 (Liegeois JF и др., Eur. J. Pharmacol. 1995; 273: R1-R3), было показано благоприятное влияние на обезьян с признаками болезни Паркинсона (Tahar АН и др., Eur. J. Pharmacol. 2000; 399: 183-186).
У крыс при подкожном введении значение ED50 (т.е. подсчитанная доза для устранения каталепсии на 50%) для (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола составляет приблизительно 2 мг/кг, что является сравнимым или даже более эффективным по сравнению с другими агонистами 5-HT1A, такими как ипсапирон (ED50 10 мг/кг) или буспирон (ED50 6 мг/кг) и D4 антагонистом 8-метил-6(4-метил-1-пиперазинеил)-11Н-пиридо[2,3-b] [1,4,] бензодиазепином (ED50 3 мг/кг).
Таким образом, настоящее изобретение относится к использованию замещенных аминометилхроманов формулы I и их оптических изомеров и фармацевтически приемлемых солей и сольватов для производства лекарственного средства для лечения экстрапирамидных двигательных расстройств.
Таким образом, изобретение, в частности, относится к применению (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола его или фармакологически приемлемой соли или сольвата для производства лекарственного средства лечения экстрапирамидных двигательных расстройств.
Предпочтительная соль (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола представляет собой гемигидрат монохлорида (2R,4R)-2-({5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Таким образом, изобретение, в частности, относится к использованию для производства лекарственного средства для лечения экстрапирамидных двигательных расстройств, при этом фармакологически приемлемая соль представляет собой гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Кроме того, изобретение относится к применению фармацевтической композиции, содержащей, по крайней мере, (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол или одну из его биосовместимых солей или сольватов для лечения экстрапирамидных двигательных расстройств.
Соединение формулы I в соответствии с пунктом 1, или его физиологически приемлемая соль, или его сольват, полезное для экстрапирамидных двигательных расстройств, в частности лечения идиопатической болезни Паркинсона, синдромов Паркинсона, дискинетических, хореатических или дистонических синдромов, экстрапирамидных неблагоприятных побочных эффектов на моторику, вызванных нейролептиками, тремора, синдрома Жилля де ля Туретте, баллизма, миоклонуса, синдрома неугомонных ног или болезни Вилсона, и/или полезное для лечения неблагоприятных эффектов при идиопатической болезни Паркинсона или синдромах Паркинсона, при этом лекарственные композиции, как определено выше, предпочтительно вводятся в дозах от 0,1 до 100 мг, предпочтительно приблизительно от 1 до 20 мг. Композиция может вводится один или более раз в день, например 2, 3 или 4 раза в день. Специфическая доза для каждого пациента зависит от всякого рода факторов, например от активности специфического используемого соединения, от возраста, от веса тела, от общего состояния здоровья, от пола, от времени и способа введения, от скорости выведения, от комбинации фармацевтических веществ и от степени тяжести частного расстройства, к которому применяют указанную терапию. Пероральный способ введения является предпочтительным, но также могут использоваться парентеральные способы введения (например, внутривенный или чрескожный).
Антипаркинсонические лекарственные средства представляют собой традиционные лекарственные средства, такие как 1-допа (леводопа) или 1-допа в комбинации с ингибитором декарбоксилазы, таким как бензеразид или карбидопа, допаминовыми агонистами, такими как бромокриптин, апоморфин, каберголин, прамипексол, ропинирол, перголид, дигидро-α-эргокриптин или лизурид плюс все лекарственные средства, действующие посредством стимуляции допаминовых рецепторов, ингибиторов катехол-O-метил трансферазы (СОМТ), таких как энтакапон или толкапон, ингибиторов моноаминоксидазы (МАО), таких как селегилин, и антагонистов N-метил-D-аспартатных (NMDA) рецепторов, таких как амантадин или будипин.
Неблагоприятными эффектами антипаркинсонических лекарственных средств являются все типы дискинезии, такие как хореатические, дистонические, баллистические и миоклониальные дискинезии, а также двигательные (ответные) колебания или психотические состояния, такие как оптические или акустические галлюцинации.
Таким образом, настоящее изобретение относится к применению замещенных аминометилхроманов формулы I и их оптических изомеров, их фармацевтически приемлемых солей и сольватов для производства лекарственного средства для лечения неблагоприятных эффектов антипаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Таким образом, изобретение, в частности, относится к применению (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его фармакологически приемлемой соли или сольвата для производства лекарственного средства для лечения неблагоприятных эффектов антипаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Лечение неблагоприятных эффектов традиционных антипаркинсонических лекарственных средств, как указано выше, определяется при использовании модификации животной модели обезьян циномолгус с дрожательным параличом в соответствии с Р.J.Blanchet и др., Exp. Neurology 1998; 153: 214-222. Обезьян приводили в состояние дрожательного паралича путем инъекции 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР). Обезьян с дрожательным параличом постоянно подвергали лечению с помощью традиционной 1-допа терапии в соответствии с Р.J.Blanchet и др., Mov. Disord., 1998; 13: 798-802. Долгосрочное лечение с помощью 1-допа индуцирует экстрапирамидные двигательные побочные эффекты и психотические состояния, которые как качественно, так и количественно оценивали с помощью оценочной шкалы для ненормальных непроизвольных движений (Р.J.Blanchet и др., Mov. Disord. 1998; 13: 798-802) для различных частей тела (лица, шеи, туловища, каждой конечности) и путем оценки психотических состояний при наблюдении за вниманием обезьян, их реактивностью и подвижностью. (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол уменьшает как общую хорееформную дискинезию и дистоническую дискинезию, так и психотические состояния.
Типичное изучение эффективности соединений в соответствии с изобретением в отношении неблагоприятных эффектов болезни Паркинсона описано далее. 40 пациентов обоих полов с развитой идиопатической болезнью Паркинсона, осложненной дискинезией «пиковой дозы», принимали участие в двойном слепом исследовании. Основным критерием включения была степень Hoehn и Yahr >2.5 (литературный источник: Hoehn Н.М. и др., Neurology 1967; 17: 427-442), возраст 40-75 лет, продолжительность симптомов, по крайней мере, 5 лет и лечение 1-допа в течение периода, по крайней мере, 3 лет. Гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или плацебо вводили путем дополнения к традиционному лечению болезни Паркинсона, которое поддерживали без изменений в течение всего периода исследования. Дозу лекарственного средства при слепом исследовании определяли в течение периода 3 недель в интервале от 2,5 до 10 мг два раза в день. Потом лечение поддерживали без изменения в течение 3 недель. Перед началом определения и в конце периода лечения пациенты заполняли учетную карточку через 30-минутные интервалы в течение 48 часов. Учетная карточка разграничивала 5 различных состояний: (1) фаза подвижности без дискинезии, (2) фаза подвижности с дискинезией, причиняющей беспокойство, (3) фаза подвижности с дискинезией, не причиняющей беспокойства, (4) фаза, когда отсутствует подвижность, и (5) время сна (Hauser RA и др., Clin. Neuropharmacol., 2000, 23, 75-81). Первичный изменяющийся результат протокола состоял в определении изменений в отношении дискинезии, причиняющей беспокойства, в фазе подвижности. Статистический анализ данных карточек учета продемонстрировал значительное уменьшение дискинезии во время фазы подвижности, причиняющей беспокойство при лечении гемигидратом монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола, в то время как существенно увеличивался показатель отсутствия дискенезии в период исследования. Остальные параметры не изменялись.
Предпочтительная соль (2R,4R)-2-(([5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола представляла собой гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Таким образом, изобретение, в частности, относится к использованию для производства лекарственного средства для лечения неблагоприятных эффектов антипаркинсонических лекарственных средств при идиопатической болезни Паркинсона, при этом фармакологически приемлемая соль представляет собой гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Кроме того, изобретение относится к применению фармацевтической композиции, содержащей, по крайней мере, одно соединение (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или одну из его биосовместимых солей или сольватов для лечения неблагоприятных эффектов антипаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Кроме того, настоящее изобретение относится к применению замещенных аминометилхроманов формулы I, их оптических изомеров и фармацевтически приемлемых солей или сольватов для производства лекарственного средства для лечения идиопатической болезни Паркинсона.
Таким образом изобретение, в частности, относится к применению (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его фармакологически приемлемой соли или сольвата для производства лекарственного средства для лечения идиопатической болезни Паркинсона.
Типичная животная модель для идиопатической болезни Паркинсона представляет собой обезьян циномолгус в соответствии с Р.J.Blanchel и др., Exp. Neurology 1998; 153: 214-222. Обезьян приводили в состояние дрожательного паралича путем повторяемой инъекции 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР). Паркинсонические симптомы качественно оценивали при использовании шкалы дееспособности Лавальского университета (В.Gomez-Mancilla и др., 1993; Mov. Disord. 8: 144-150), определяя следующие симптомы: осанку, подвижность, лазание, походку, манеру держать пищу, издание звуков, почесывание, взаимодействие со стадом. (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ол уменьшает все паркинсонические симптомы и повышает общую активность.
Типичное исследование эффективности соединений в соответствии с изобретением при лечении идиопатической болезни Паркинсона описано ниже. 180 пациентов обоих полов с идиопатической болезнью Паркинсона подвергали двойному слепому исследованию. Основным критерием включения была стадия Hoehn и Yahr >2.0 (Hoehn Н.М. и др., Neurology 1967; 17: 427-442), возраст 50-80 лет, длительность симптомов, по крайней мере, 5 лет. Гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или плацебо вводили путем добавления к традиционному лечению болезни Паркинсона, которое поддерживали без изменений в течение всего периода исследования. Дозу лекарственного средства определяли в течение периода времени 4 недели в интервале от 2,5 до 10 мг два раза в день. Потом лечение поддерживали без изменения в течение 1 недели. Перед началом определения и в конце периода лечения пациенты заполняли учетную карточку через 30-минутные интервалы в течение 48 часов. Учетная карточка разграничивала 5 различных состояний: (1) фаза подвижности без дискинезии, (2) фаза подвижности с дискинезией, причиняющей беспокойство, (3) фаза подвижности с дискинезией, не причиняющей беспокойства, (4) фаза, когда отсутствует подвижность, и (5) время сна (Hauser RA и др., Clin. NeuropharmacoL, 2000, 23, 75-81). Это позволяло определять одновременно благоприятный эффект (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его физиологически приемлемой соли или сольвата, в частности гемигидрата монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола, на общую двигательную функцию, дистонию, двигательные флуктуации и на психоз. Кроме того, была показана эффективность для лечения тремора. Анализ показал значительное клиническое улучшение при лечении с помощью гемигидрата монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Предпочтительная соль (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола представляла собой гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Таким образом, изобретение, в частности, относится к применению для производства лекарственного средства для лечения идиопатической болезни Паркинсона, при этом физиологически приемлемая соль представляет собой гемигидрат монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола.
Кроме того, изобретение относится к использованию фармацевтической композиции, содержащей, по крайней мере, одно соединение (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или одну из его биосовместимых солей или сольватов в сочетании с, по крайней мере, одним твердым, жидким или полужидким наполнителем или добавкой для лечения идиопатической болезни Паркинсона.
Лимитирующий фактор при лечении болезни Паркинсона с помощью 1-допа и/или допаминовых агонистов представляет собой возникновение психоза или дискинезии или других двигательных флуктуации.
Было обнаружено, что соединения формулы I в соответствии с пунктом 1, или их физиологически приемлемые соли, или их сольваты улучшают антипаркинсонический эффект антипаркинсонических лекарственных средств, как определено выше, без индукции экстрапирамидных побочных эффектов.
Таким образом, дополнительная терапия, в частности, с помощью (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола или его фармацевтически приемлемой соли или сольвата, в частности гемигидрата монохлорида (2R,4R)-2-({[5-(4-фторфенил)-пиридин-3-илметил]-амино}-метил)-хроман-4-ола, в настоящее время открывает возможность увеличения доз 1-допа, и/или допаминовых агонистов, и/или всех других антипаркинсонических лекарственных средств, как определено выше, для того, чтобы противодействовать периодам недостаточной подвижности («off» фазы) без провокации указанных выше побочных эффектов. Это представляет собой совершенно новый поход к лечению болезни Паркинсона, что ведет к существенным преимуществам для пациентов
Таким образом, изобретение относится к фармацевтической композиции, содержащей в качестве активных ингредиентов, (i) соединение в соответствии с пунктом 11 или 12, и (ii) по крайней мере, одно антипаркинсоническое лекарственное средство в сочетании с одним или более фармацевтически приемлемых наполнителей.
В частности, изобретение относится к фармацевтич