Кинетический способ тестирования антиоксидантов
Иллюстрации
Показать всеИзобретение относится к области химии, к различным веществам и составам, содержащим кислород, и может быть использовано в пищевой технологии, в парфюмерной промышленности, биологии, фармакологии, медицине. В кинетическом способе тестирования антиоксидантов путем насыщения пробы эфиров высших ненасыщенных жирных кислот и антиоксидантов кислородом с перемешиванием при 60,0±0,2°С и образованием цепей их окисленных радикалов, определения количества поглощенного кислорода во времени с построением графика во времени, пробу эфиров ненасыщенных жирных кислот смешивают с водными растворами цетилтриметиламмония бромида и соли меди, добавляют навеску или раствор антиоксиданта, полученный образец доводят водой до 4 мл, насыщают кислородом, волюмометрически определяют объем поглощенного кислорода во времени, график во времени строят на основе дифференцирования полученных кинетических кривых, аппроксимируемых по трем участкам: первый и третий - прямыми, второй - параболой, на основе которых по времени, соответствующему первому перегибу определяют эффективность участия антиоксиданта в обрыве цепей, по тангенсу угла наклона касательной второго участка судят об участии антиоксиданта в разветвлении цепей, и по времени второго перегиба судят о полном расходовании антиоксиданта, при этом величина четвертого участка определяет суммарную скорость процесса. Достигается повышение эффективности тестирования. 3 табл., 5 ил.
Реферат
Изобретение относится к области химии, к различным веществам и составам, содержащим кислород, и может быть использовано в пищевой технологии, в парфюмерной промышленности, биологии, фармакологии, медицине.
Известен способ тестирования антиоксидантов по периоду индукции накопления гидропероксидов при окислении олеиновой кислоты кислородом воздуха. Сущность известного способа заключается в том, что определенное количество олеиновой кислоты окисляют кислородом воздуха при 80-100°С, во времени отбирают пробы по 1-2 мл, определяют содержание гидропероксидов путем окисления пробой иодида калия до иода и дальнейшее его оттитровывание тиосульфатом натрия. Параллельно исследуют окисление олеиновой кислоты в присутствии добавок антиоксидантов. Эффективность антиоксидантов оценивают по отношению периодов накопления гидропероксидов, соответствующих содержанию 0,1% I2, в образце с антиоксидантом и контрольном образце [1].
Недостатком способа является длительность и высокая трудоемкость, низкая точность метода из-за неустойчивости пероксидов и их быстрого неконтролируемого распада при температурах исследования, вследствие чего фиксируют разницу между концентрацией образовавшихся и распавшихся пероксидов.
Известен также способ внутреннего стандарта [2] для тестирования биоантиоксидантов. Сущность метода состоит в том, что пробу кумола смешивают с источником свободных радикалов 2,2'-динитрилазобисизомасляной кислоты (АИБН) и образцом природных липидов, окисляют при 60°С кислородом. Волюмометрически определяют концентрацию поглощенного кислорода. Эффективность биоантиоксидантов оценивают по периоду индукции поглощения кислорода во времени.
Недостатком способа является низкая точность из-за возможности соокисления жирнокислотных компонентов липидов и кумола. В работе [3] показано, что период индукции при окислении кумола появляется в отсутствии антиоксидантов не под действием жирнокислотных компонентов липидов. Недостатками способа являются также большая длительность процесса из-за низкой скорости окисления, низкая информативность из-за отсутствия кинетического анализа результатов и определения механизма окисления.
В качестве прототипа выбран прямой кинетический способ тестирования биоантиоксидантов [4]. Сущность способа состоит в том, что в качестве субстрата используют метиловые или этиловые эфиры жирнокислотных компонентов липидов (метилолеат, метиллинолеат) в количестве 0,5-2,5 мл в растворе хлорбензола в присутствии инициатора радикальных процессов 2,2'-динитрилазобисизомасляной кислоты (АИБН) в количестве от 1 до 4 мг/мл и добавок липидов в количестве от 1 до 3 мг/мл. Пробу насыщают кислородом при 60,0±0,2°С, волюмометрически определяют время поглощения 25 мм3 кислорода на 1 мл пробы . В аналогичных условиях определяют период поглощения 25 мм3 кислорода на 1 мл пробы контрольной пробы без добавок липидов . Рассчитывают антиоксидантную активность липидов по формуле:
где
Р - масса липидов, мг.
Недостатком способа является ограниченная точность вследствие непрямого анализа антиоксидантной активности и возможности соокисления метилолеата и липидов, о чем свидетельствует экстремальный характер зависимости периода индукции окисления метилолеата от концентрации липидов.
Задачей, решаемой настоящим изобретением, является увеличение эффективности тестирования антиоксидантов.
Время, соответствующее первому перегибу, определяло эффективность участия антиоксиданта в обрыве цепей. По тангенсу угла наклона второго участка определялось участие антиоксиданта в разветвлении цепей. Время, соответствующее второму перегибу, соответствовало полному расходованию антиоксиданта. Величина тангенса угла наклона третьего участка характеризовала разветвление цепей без участия антиоксиданта. Величина четвертого участка определяла суммарную скорость процесса.
Техническая сущность заявляемого изобретения заключается в том, что в известном кинетическом способе тестирования антиоксидантов путем насыщения пробы эфиров высших ненасыщенных жирных кислот и антиоксидантов кислородом с перемешиванием при 60,0±0,2°С и образованием цепей их окисленных радикалов, определения количества поглощенного кислорода во времени с построением графика во времени, пробу эфиров ненасыщенных жирных кислот смешивают с водными растворами цетилтриметиламмония бромида и соли меди, добавляют навеску или раствор антиоксиданта, полученный образец доводят водой до 4 мл, насыщают кислородом, волюмометрически определяют объем поглощенного кислорода во времени, график во времени строят на основе дифференцирования полученных кинетических кривых, аппроксимируемых по трем участкам: первый и третий - прямыми, второй - параболой, на основе которых по времени, соответствующему первому перегибу, определяют эффективность участия антиоксиданта в обрыве цепей, по тангенсу угла наклона касательной второго участка судят об участии антиоксиданта в разветвлении цепей, и по времени второго перегиба судят о полном расходовании антиоксиданта, при этом величина четвертого участка определяет суммарную скорость процесса.
В качестве субстрата в опытах используют термостатированную, непрерывно перемешиваемую водно-липидную каталитическую систему, стабилизированную эмульгатором, содержащую добавки антиоксидантов. Температура соответствует температуре окисления способа-прототипа. Скорость перемешивания подбиралась таким образом, чтобы процесс протекал в кинетической области. Оптимальные условия окисления подобраны экспериментально. С этой целью исследовано влияние солей металлов меди(II), никеля(II), кобальта(II), железа(II), железа(III) в зависимости от концентрации (пример 1). В результате установлена максимальная каталитическая активность катионов меди в концентрациях (1-5)·10-3 моль/дм3. Для оптимальной стабильности водно-липидного субстрата экспериментально подобран в качестве эмульгатора цетилтриметиламмоний бромид в концентрации (1-5)·10-3 моль/дм3, соответствующей критической концентрации мицеллообразования.
Волюмометрически определяют поглощение кислорода во времени. Оценку эффективности и механизма действия антиоксидантов проводят путем аппроксимации кинетических кривых поглощения кислорода функциями, определяя первую производную этих функций.
Известно [4, 6], что цепной радикальный процесс окисления молекулярным кислородом имеет три стадии: первая - медленное окисление протекает практически с постоянной скоростью до достижения критической концентрации гидропероксидов ˜10-4 моль/л; вторая - аутоускорение за счет распада гидропероксидов и разветвления цепей; третья - выход на максимальную скоростью, что соответствует квазистационарной концентрации радикалов и реакции продолжения цепей.
В присутствии антиоксидантов происходит увеличение начальной стадии за счет участия антиоксидантов в реакции обрыва цепей. Эффект антиоксидантов оценивают по увеличению этого периода (см. аналоги и прототип).
Антиоксиданты способны обрывать цепь и в стадии разветвления цепей. Но в известных способах тестирования антиоксидантов этот эффект не учитывается совсем или частично учитывается в графическом методе.
Продукты окисления антиоксиданта также способны тормозить процесс окисления, что не учитывается во всех известных способах тестирования антиоксидантов.
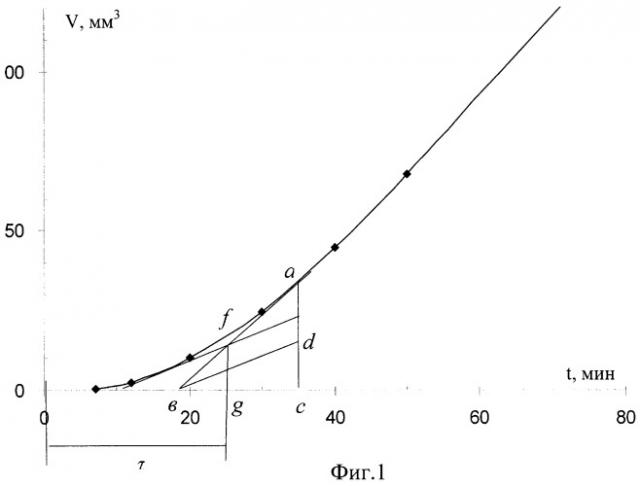
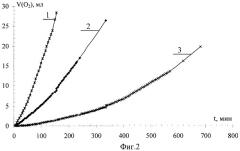
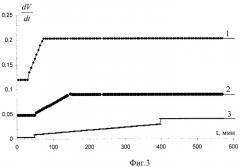
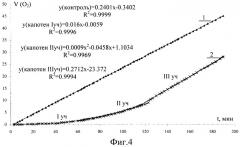
На прилагаемых графических изображениях приведены: на фиг.1 - известная схема расчета периода индукции; на фиг.2 - кинетические кривые этилолеата в водно-эмульсионной среде; на фиг.3 - график зависимостей производных скорости по времени; на фиг.4 - график зависимости поглощения кислорода во времени; на фиг.5 - схема определения кинетических параметров.
Предлагаемое решение позволяет оценить участие антиоксиданта и продуктов его окисления во всех стадиях. С этой целью в программе Microsoft Excel no экспериментальным данным строят кинетические кривые поглощения кислорода во времени, их делят на три участка, путем варьирования точек и определения оптимальных дисперсий (фиг.3). Первый и третий участки аппроксимируют прямой, второй - параболой. Функции дифференцируют, в координатах , t (фиг.4) получают три-четыре участка прямых с разным наклоном. Первый участок имеет нулевой наклон, а время, соответствующее первому перегибу, характеризует эффективность участия антиоксиданта в обрыве цепей. По тангенсу угла наклона второго участка оценивают эффективность разветвления цепей и участие антиоксиданта в этом процессе. Время, соответствующее второму перегибу, соответствует разветвлению цепей без участия антиоксиданта. Четвертый участок имеет нулевой наклон, а величина характеризует суммарную скорость процесса. Путем сравнения функции исследуемых антиоксидантов и контрольной пробы получают дополнительную информацию о механизме действия антиоксиданта. Путем сравнения функции нескольких антиоксидантов получают информацию о различии их эффективности и механизма действия.
Сущность предлагаемого способа состоит в том, что в 1 мл одного из эфиров ненасыщенных жирнокислотных компонентов липидов или их смеси (метилолеат, этилолеат, метиллинолеат и др.) добавляют по 1 мл водных растворов хлорида меди и цетилтриметиламмоний бромида с конечными концентрациями в растворе (1-5)·10-3 моль/дм3, добавляют навеску или раствор антиоксиданта, пробу доводят водой до 4 мл, термостатируют при 60,0±0,2°С, насыщают молекулярным кислородом. Волюмометрически при непрерывном перемешивании измеряют поглощение кислорода во времени. В аналогичных условиях определяют поглощение кислорода во времени в контрольной пробе (без добавок антиоксиданта).
По экспериментальным данным строят кинетические кривые поглощения кислорода во времени, каждую из которых делят на три участка путем варьирования точек и определения оптимальных дисперсий. Первый и второй участки аппроксимируют прямой, второй - параболой. Полученные функции дифференцируют и получают график зависимости в координатах , t. По времени, соответствующему первому перегибу, определяют эффективность участия антиоксиданта в обрыве цепей. Тангенс угла наклона второго участка характеризует участие антиоксиданта в разветвлении цепей. Время, соответствующее второму перегибу, соответствует полному расходованию антиоксиданта. Величина тангенса угла наклона третьего участка характеризует разветвление цепей без участия антиоксиданта. Величина четвертого участка определяет суммарную скорость процесса.
Предлагаемый способ превосходит прототип по точности за счет исключения соокисления, увеличения объема поглощенного кислорода и автоматической обработки результатов эксперимента.
Предлагаемый способ превосходит прототип по информативности и расширению области применения за счет использования водно-эмульсионных липидных субстратов, что позволяет тестировать водорастворимые и нерастворимые в воде антиоксиданты, за счет математической обработки результатов эксперимента позволяет оценивать эффективность и механизм действия антиоксидантов.
Результаты выявления преимуществ и эффективности предлагаемого способа по сравнению с прототипом приведены в табл.3.
Пример 1
Подбор катализатора
Исследована каталитическая активность солей меди(II), кобальта(II), никеля(II), железа(II) и (III) в интервале концентраций 1·10-6-1·10-1 моль/дм3 при окислении метиллинолеата. В зависимости от концентрации катализатора меняется характер каталитических кривых, что связано с участием катионов металлов в различных стадиях процесса, причем катионы меди являются самым активным катализатором. При концентрации (1-5)·10-3 моль/дм3 солей меди сокращается период аутоускорения и процесс ведется с максимальной скоростью. В табл.2 приведены кинетические параметры окисления метиллинолеата в присутствии катионов металлов
| Таблица 1 | ||||||||||
| Катион металла, концентрация, моль/л | 5·10-3 | 1·10-3 | ||||||||
| Скорость, 105, моль/л с Wмакс | Cu2+ | Со2+ | Fe2+ | Ni2+ | Fe3+ | Cu2+ | Со2+ | Fe2+ | Ni2+ | Fe3+ |
| 14,4 | 10,3 | 6,8 | 3,5 | 2,3 | 11,4 | 8,6 | 5,9 | 2,4 | 1,7 | |
| Сkat/Ссубстрат | 1:50 | 1:100 |
Получен ряд уменьшения каталитической активности катионов:
Cu2+>Со2+>Fe2+>Ni2+>Fe3+
Эти результаты определили выбор катионов меди в концентрации (1-5)·10-3 моль/дм3 в качестве катализатора.
Пример 2
Сравнение кинетики каталитического и гомогенного окисления
Проведено сравнение кинетики каталитического и гомогенного окисления метиллинолеата в присутствии ионола. В основе обоих моделей лежит представление о радикально-цепном механизме окисления эфиров ненасыщенных жирных кислот. Поглощение кислорода оценивали волюмометрически в термостатированной установке при 60,0±0,2°С.
Пробу метиллинолеата, цетилтриметиламмония бромида, соли меди, воды, насыщали кислородом и окисляли при непрерывном перемешивании. Измеряли объем (мл) поглощенного кислорода во времени в присутствии добавок 1·10-5-5·10-4 моль/л ионола и без добавок ионола (контроль). По периоду индукции оценивали суммарную антиоксидантную активность.
При инициированном окислении пробу метиллинолеата в хлорбензоле окисляли молекулярным кислородом при 60,0±0,2°С в режиме непрерывного перемешивания. Волюмометрически фиксируют объем (мм3) поглощенного кислорода во времени без добавок ионола (контроль) и в присутствии различных концентраций ионола 1·10-7-1·10-3 моль/л.
Показано, что в водно-эмульсионной среде ионол ведет себя как сильный ингибитор: наблюдается период полного торможения, период аутоускорения и достижение контрольной скорости процесса, продукты окисления не участвуют в разветвлении и обрыве цепей. Период индукции увеличивается пропорционально увеличению концентрации ионола. Показан идентичный характер кинетических кривых в обеих системах.
По наклону прямой в координатах τ (период индукции) от [InH] концентрации ингибитора были рассчитаны скорости инициирования, которые соответственно равны 6,7·10-5 и 6,7·10-8 моль/л при одинаковой концентрации ионола. Показано, что скорость каталитического окисления в 1000 раз выше, чем скорость инициированного окисления.
Пример 3
Эффективность применения способа для тестирования водорастворимых антиоксидантов
Исследована антиоксидантная активность фенола и осалмида по сравнению с контрольной пробой.
Окисление проводилось для пробы в 4 мл этилолеата и водных растворов цетилтриметиламмония бромида и хлорида меди с конечными концентрациями в растворе (1-5)·10-3 моль/дм3, добавляли водные растворы антиоксидантов с конечной концентрацией в пробе 1·10-3 моль/дм3. Пробу насыщали кислородом и при постоянном перемешивании окисляли при температуре 60,0±0,2°С. Волюмометрически определяли объем поглощенного кислорода во времени. В аналогичных условиях определяли объем поглощенного кислорода без добавок антиоксиданта (контроль).
По экспериментальным данным строились кинетические кривые, каждую из которых делили на три участка путем варьирования точек и выбора оптимальной дисперсии (фиг.2). Участки аппроксимировали: первый и третий участки - прямой; третий - параболой. Полученные функции дифференцировали и строили график зависимости от t (фиг.3).
Время (τ1), соответствующее первому перегибу для контрольной пробы, фенола и осалмида соответственно равно 30, 50 и 46 минут, что показывает более эффективный обрыв цепей в присутствии фенола. Тангенс угла наклона второго участка соответственно равен 34·10-8, 2,1·10-8, 1,1·10-8, что свидетельствует о более эффективном участии осалмида в обрыве и разветвлении цепей. Время (τ2), соответствующее второму перегибу, соответственно равно 65, 150, 395 минут и характеризует разветвление цепей без участия антиоксиданта. Четвертый участок имеет нулевой наклон, а величины соответственно равны 3,8·10-5, 1,7·10-5, 0,8·10-5 моль/л·с и характеризуют суммарную скорость процесса. В присутствии фенола и осалмида не достигается контрольная скорость процесса, а продукты окисления не участвуют в разветвлении и обрыве цепей.
Пример 4
Расширение области применения для исследования антиоксидантных свойств лекарственных препаратов
Исследовалась антиоксидантная активность капотена 1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин препарата с выраженным сосудосуживающим действием применяемого для лечения артериальной гипертонии и недостаточности кровообращения.
Окисление проводилось для пробы в 4 мл метиллинолеата и водных растворов цетилтриметиламмония бромида и хлорида меди с конечными концентрациями в растворе (1-5)·10-3 моль/дм3. Концентрация катализатора подобрана экспериментально (см. пример 1) и соответствует максимальной эффективности. Концентрация эмульгатора соответствует критической концентрации мицеллообразования. Пробу насыщали кислородом и при непрерывном перемешивании окисляли молекулярным кислородом при температуре 60,0±0,2°С. Волюмометрически определяли объем поглощенного кислорода во времени в присутствии добавок капотена в интервале концентраций 1·10-6-1·10-3 моль/дм3. В аналогичных условиях определяли объем поглощенного кислорода без добавок капотена (контроль). По экспериментальным данным строились кинетические кривые поглощения кислорода во времени (фиг.4). Проводилась аппроксимация кривых по трем участкам путем варьирования точек и определения оптимальных дисперсий. Первый и второй участки аппроксимировали прямой, второй - параболой. Полученные функции дифференцировали и строили график зависимости в координатах , t (фиг.5).
Результаты кинетических расчетов приведены в табл.2
| Таблица 2Кинетические параметры окисления этилолеата в водно-эмульсионной среде в присутствии различных концентраций капотена | |||
| № п/п | С (капотена), моль/дм3 | τ1, мин | Wmax·104, моль/дм3сек |
| 1 | 0 | 1,8 | |
| 2 | 1·10-6 | 8 | 1,8 |
| 3 | 1·10-5 | 10 | 1,1 |
| 4 | 1·10-4 | 25 | 1,7 |
| 5 | 1·10-3 | 33 | 1,9 |
| 6 | 1·10-2 | 42 | 2,0 |
| 7 | 1·10-1 | 82 | 1,2 |
Показано, что при низких концентрациях капотена 1·10-6-1·10-5 моль/дм3 наблюдается незначительное изменение периода индукции без полного торможения.
Добавки капотена 1·10-4-1·10-1 моль/дм3 вызывают эффективное торможение, появляется период полного торможения, который линейно возрастает с увеличением концентрации. После выхода из периода индукции скорость окисления метиллинолеата в присутствии антиоксиданта незначительно превосходит скорость контрольной пробы, то есть продукты окисления участвуют в реакции обрыва цепей. Капотен действует как сильный антиоксидант.
| Таблица 3Сравнительные данные, подтверждающие преимущества и эффективность предлагаемого способа тестирования антиоксидантов | |||
| Операции | Предлагаемый способ | Прототип | Показатели эффективности |
| Исследование водорастворимых антиоксидантов | да | нет | Расширение области применения для исследования биологически активных соединений, лекарственных препаратов, витаминов, которые могут быть антиоксидантами как in vivo, так и in vitro |
| Объем поглощенного кислорода | 0,4 моль/л | 0,002 моль/л | Увеличение точности за счет увеличения объема поглощеного кислорода |
| Оценка участия антиоксиданта в обрыве цепей | да | нет | Оценка эффективности участия антиоксиданта в обрыве цепей по времени, соответствующему первому перегибу |
| Оценка участия антиоксиданта в обрыве и разветвлении цепей | да | нет | Оценка эффективности участия антиоксиданта в обрыве и разветвлении цепей по тангенсу угла наклона второго участка |
| Оценка эффективности разветвления цепей без участия антиоксиданта | да | нет | Оценка эффективности разветвления цепей без участия антиоксиданта по времени, соответствующему второму перегибу |
| Оценка участия продуктов окисления в разветвлении и обрыве цепей | да | нет | Оценка участия продуктов окисления в разветвлении и обрыве цепей по величине , ответствующей суммарной скорости процесса |
| Математическая обработка экспериментальных данных | да | нет | Увеличение информативности за счет аппроксимации кинетической кривой функцией и определение нескольких кинетических параметров и механизма действия антиоксиданта |
Источники информации
[1] Н.М.Эмануэль, Ю.Н.Лясковская / Торможение процесса окисления жиров. - М., Пищепромиздат., 1961, 360 с.
[2] А.А.Харитонова, З.К.Козлова, В.Ф.Цепалов, Г.П.Гладышев / Кинетический анализ свойств антиоксидантов в сложных композициях с помощью модельной цепной реакции. // Кинетика и катализ, 1979, Т.20, №3, с.593-599.
[3] В.Н.Ушкалова и др. / Способ определения антиокислительной активности липидов. // А.С. №1051428 Бюллетень изобр. №40, 1983, с.154.
[4] В.Н.Ушкалова / Кинетика реакций, перспективных для тестирования гомолитических свойств липидов. // Бюлл. эксп. Биологии и медицины, 1984, Т.48, №9, с.384. Деп. ВИНИТИ - прототип.
[5] В.Ф.Цепалов, А.А.Харитонова, Г.П.Гладышев, Н.М.Эммануэль / Определение констант скорости и коэффициентов ингибирования стабилизаторов с помощью модельной цепной реакции. // Кинетика и катализ, 1977, Т.18, вып.6, с.1395-1403.
[6] Е.Т.Денисов / Элементарные реакции ингибиторов окисления. // Успехи химии, 1973, Т.42, №3, с.361-389.
Кинетический способ тестирования антиоксидантов путем насыщения пробы эфиров высших ненасыщенных жирных кислот и антиоксидантов кислородом с перемешиванием при 60,0±0,2°С и образованием цепей их окисленных радикалов, определения количества поглощенного кислорода во времени с построением графика во времени, отличающийся тем, что пробу эфиров ненасыщенных жирных кислот смешивают с водными растворами цетилтриметиламмония бромида и соли меди, добавляют навеску или раствор антиоксиданта, полученный образец доводят водой до 4 мл, насыщают кислородом, волюмометрически определяют объем поглощенного кислорода во времени, график во времени строят на основе дифференцирования полученных кинетических кривых, аппроксимируемых по трем участкам: первый и третий - прямыми, второй - параболой, на основе которых по времени, соответствующему первому перегибу, определяют эффективность участия антиоксиданта в обрыве цепей, по тангенсу угла наклона касательной второго участка судят об участии антиоксиданта в разветвлении цепей, и по времени второго перегиба судят о полном расходовании антиоксиданта, при этом величина четвертого участка определяет суммарную скорость процесса.