4 -замещенные нуклеозиды и содержащая их фармацевтическая композиция для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита c (hcv)
Иллюстрации
Показать всеИзобретение относится к применению 4'-замещенных нуклеозидов формулы (I), в которой R водород; R1 - алкил, возможно замещенный гидроксилом, алкенил, алкинил, алкокси, циано или азидо; R2 - водород или гидроксил; R3 и R4 - водород, гидроксил, алкокси или галоген, при условии, что как минимум один из R3 и R4 означает водород; В является 9-пуринильным остатком формулы (В1), где R5 - водород; R6 - гидроксил или NHR8; R7 - водород; R8 - водород или фенилкарбонил; или В является 1-пиримидильным остатком формулы (В2), где Z означает О; R10 - гидроксил или NHR8; R11 - водород; R8 является таким, как определено выше; и их фармацевтически приемлемых солей, для приготовления лекарственного средства для лечения заболеваний, опосредствованных вирусом гепатита С (HCV). Изобретение относится также к фармацевтической композиции для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита С (HCV), и к применению данной фармацевтической композиции для приготовления лекарственного средства для лечения заболеваний, опосредованных вирусом гепатита С (HCV). 3 н. и 4 з.п. ф-лы.
Реферат
Изобретение относится к производным нуклеозидов в качестве ингибиторов репликации РНК в составе репликона вируса гепатита С (HCV). В частности, изобретение относится к применению производных пуриновых и пиримидиновых нуклеозидов в качестве ингибиторов репликации субгеномной РНК вируса гепатита С (HCV) и к фармацевтическим композициям, содержащим такие соединения.
Вирус гепатита С во всем мире является главной причиной хронического заболевания печени. Больные, инфицированные вирусом гепатита С, подвержены риску развития цирроза печени и последующего печеночно-клеточного рака и поэтому HCV является главным показанием для пересадки печени. Только два апробированных вида терапии в настоящее время доступны для лечения инфицированных вирусом гепатита С (R.G. Gish, Sem. Liver. Dis., 1999, 19, 35). Это монотерапия интерфероном-α и применяемая совсем с недавнего времени комбинированная терапия аналогом нуклеозида, рибавирином (виразол), с интерфероном-α.
Многие из лекарственных средств, одобренных для лечения вирусных инфекций, являются нуклеозидами или аналогами нуклеозидов и большинство из этих, являющихся аналогами нуклеозидов, лекарственных средств ингибирует после превращения в соответствующие трифосфаты репликацию вирусов путем ингибирования вирусных полимераз. Это превращение в трифосфат обычно опосредуется клеточными киназами и поэтому прямую оценку нуклеозидов в качестве ингибиторов репликации HCV удобно проводить только применяя клеточный анализ. Для HCV не хватает наличия точного клеточного анализа вирусной репликации или модели инфицированного животного.
Вирус гепатита С относится к семейству Flaviridae. Это содержащий РНК вирус с РНК-геномом, кодирующим полипротеин большой длины, который после процессинга создает необходимый механизм репликации для обеспечения синтеза РНК потомства. Считают, что большинство неструктурированных протеинов, кодируемых РНК-геномом вируса гепатита С, вовлечено в репликацию РНК. Lohmann и др. [V. Lohmann и др., Science, 1999, 285, 110-113] описали конструкцию линии клеток гепатомы человека (Huh7), в которую вводили молекулы субгеномной РНК вируса гепатита С, и было показано, что репликация происходила с высокой эффективностью. Считают, что механизм репликации РНК в этих линиях клеток идентичен репликации полного РНК-генома вируса гепатита С в инфицированных гепатоцитах. Субгеномные клоны кДНК вируса гепатита С, используемые для выделения этих линий клеток, составляли основу для развития клеточного анализа для идентификации ингибиторов репликации HCV, являющихся аналогами нуклеозидов.
Было показано, что соединения формулы I являются ингибиторами субгеномной репликации вируса гепатита С в линии клеток гепатомы. Эти соединения могут потенциально рассматриваться эффективными в качестве противовирусных средств для лечения заражений вирусом гепатита С у людей.
Изобретение относится к применению соединений формулы I,
где
R означает водород или -[Р(O)(ОН)-O]nН и n является 1, 2 или 3;
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксикарбонил, гидроксиалкил, алкоксиалкил, алкоксигруппу, цианогруппу, азидогруппу, гидроксииминометил, алкоксииминометил, галоген, алкилкарбониламиногруппу, алкиламинокарбонил, азидоалкил, аминометил, алкиламинометил, диалкиламинометил или гетероциклил;
R2 означает водород, гидроксил, аминогруппу, алкил, гидроксиалкил, алкоксигруппу, галоген, цианогруппу или азидогруппу;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 вместе представляют =СН2 или =N-OH, или
R3 и R4 оба означают фтор;
Х означает О, S или СН2;
В является 9-пуринильным остатком В1 формулы
где
R5 означает водород, гидроксил, алкил, алкоксигруппу, алкилтиогруппу, NHR8, галоген или SH;
R6 означает гидроксил, NHR8, NHOR9, NHNR8, -NHC(O)OR9' или SH;
R7 означает водород, гидроксил, алкил, алкоксигруппу, алкилтиогруппу, NHR8, галоген, SH или цианогруппу;
R8 означает водород, алкил, гидроксиалкил, арилкарбонил или алкилкарбонил;
R9 означает водород или алкил;
R9' означает алкил; и
В является 1-пиримидильным остатком В2 формулы
где Z означает О или S;
R10 означает гидроксил, NHR8, NHOR9, NHNR8, -NHC(O)OR9' или SH;
R10 означает водород, алкил, гидроксил, гидроксиалкил, алкоксиалкил, галоидалкил или галоген;
R8, R9 и R10 являются такими, как определено выше;
и их фармацевтически приемлемых солей
для лечения заболеваний, опосредствованных вирусом гепатита С (HCV), или
для приготовления лекарственных средств для такого лечения.
В соединениях, где R является фосфатной группой -[Р(O)(ОН)-O]nН, n является предпочтительно 1. Фосфатная группа может входить в состав представляющего монофосфат устойчивого пролекарства или может быть в виде другой фармацевтически приемлемой уходящей группы, которая при применении пролекарства способна in vivo обеспечить соединение, где R означает монофосфат. Такие "пронуклеотиды" могут улучшить свойства, например активность, биодоступность или устойчивость родственного нуклеотида.
Примеры замещающих групп, которые могут заместить один или несколько атомов водорода в фосфатном участке, описаны C.R. Wagner и др. в Medicinal Research Reviews, 2000, 20 (6), 417, или R. Jones и N. Bischofberger в Antiviral Research 1995, 27, 1. Подобные пронуклеотиды включают алкильные и арильные фосфодиэфиры, стероидные фосфодиэфиры, алкильные и арильные фосфотриэфиры, циклические алкильные фосфотриэфиры, циклосалигениловые (CycloSal) фосфотриэфиры, S-ацил-2-тиоэтилпроизводные (SATE), дитиоэтильные производные (DTE), пивалоил-оксиметильные фосфоэфиры, параацилоксибензильные (РАОВ) фосфоэфиры, глицеролипидные фосфодиэфиры, гликозиллипидные фосфотриэфиры, динуклеозидилфосфодиэфиры, динуклеозидные фосфотриэфиры, фосфодиамидаты, циклические фосфоамидаты, сложные моноэфиры фосфоамидатов и сложные диэфиры фосфоамидатов.
Изобретение также включает пролекарства или биопредшественники родственного нуклеозида, которые превращаются in vivo в соединения формулы I, где R означает водород и, как минимум, один из R2, R3 и R4 означает гидроксил. Предпочтительные пролекарственные производные включают сложные эфиры карбоновых кислот, в которых некарбонильный участок сложноэфирной группы выбирается из алкила с прямой или разветвленной цепью (например, метил, н-пропил, н-бутил или трет-бутил), алкоксиалкила (например, метоксиметил), аралкила (например, бензил), арилоксиалкила (например, феноксиметил), арила (например, фенил, необязательно замещенный галогеном, (С1-С4)алкилом или (С1-С4)алкоксилом, или аминогруппой); сложные эфиры сульфокислот, как, например, алкилсульфокислот или арилсульфокислот (например, метансульфокислоты); сложные эфиры аминокислот (например, L-валина или L-изолейцина) или их фармацевтически приемлемые соли. Получение осуществляют согласно известным в данной области способам, например способами из учебников по органической химии (например, J. March (1992), "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4-oe издание, John Wiley & Sons).
Термин "алкил", как он используется в контексте, означает углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 12 атомов углерода. Предпочтительно термин "алкил" означает углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 атомов углерода. Наиболее предпочтительно это метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил или пентил. Алкил может быть незамещенным или замещенным. Заместители выбираются из одного или нескольких таких заместителей, как циклоалкил, нитро-, амино-, алкиламино-, диалкиламиногруппа, алкилкарбонил или циклоалкилкарбонил.
Термин "циклоалкил", как он используется в контексте, означает необязательно замещенную циклоалкильную группу, содержащую от 3 до 7 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин "алкоксигруппа", как он используется в контексте, означает необязательно замещенную алкилоксигруппу с прямой или разветвленной цепью, в которой алкильный остаток является таким, как определено выше, например метокси-, этокси-, н-пропилокси-, изопропилокси-, н-бутилокси-, изобутилокси-, трет-бутилокси-, пентилокси-, гексилокси-, гептилоксигруппу, включая их изомеры.
Термин "алкоксиалкил", как он используется в контексте, означает алкоксигруппу, как определено выше, которая связана с алкильной группой, как определено выше. Примерами являются метоксиметил, метоксиэтил, метоксипропил, этоксиметил, этоксиэтил, этоксипропил, пропилоксипропил, метоксибутил, этоксибутил, пропилоксибутил, бутилоксибутил, трет-бутилоксибутил, метоксипентил, этоксипентил, пропилоксипентил, включая их изомеры.
Термин "алкенил", как он используется в контексте, означает незамещенный или замещенный углеводородный радикал, содержащий в цепи от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, имеющий одну или две олефиновые двойные связи, предпочтительно одну олефиновую двойную связь. Примерами являются винил, 1-пропенил, 2-пропенил (аллил) или 2-бутенил (кротил).
Термин "алкинил", как он используется в контексте, означает незамещенный или замещенный углеводородный радикал, содержащий в цепи от 2 до 7 атомов углерода, предпочтительно от 2 до 4 атомов углерода, с одной или, где возможно, двумя тройными связями, предпочтительно с одной тройной связью. Примерами служат этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил или 3-бутинил.
Термин "гидроксиалкил", как он используется в контексте, означает алкильную группу с прямой или разветвленной цепью, как определено выше, где 1, 2, 3 или более атомов водорода замещены гидроксильной группой. Примерами являются гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил, гидроксиизопропил, гидроксибутил и им подобные.
Термин "галоидалкил", как он используется в контексте, означает алкильную группу с прямой или разветвленной цепью, как определено выше, где 1, 2, 3 или более атомов водорода замещены галогеном. Примерами являются 1-фторметил, 1-хлорметил, 1-бромметил, 1-иодметил, трифторметил, трихлорметил, трибромметил, трииодметил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 1-иодэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-иодэтил, 2,2-дихлорэтил, 3-бромпропил или 2,2,2-трифторэтил и им подобные.
Термин "алкилтиогруппа", как он используется в контексте, означает (алкил) S-группу с прямой или разветвленной цепью, где "алкил" является таким, как определено выше. Примерами являются метилтио-, этилтио-, н-пропилтио-, изопропилтио-, н-бутилтио-, изобутилтио- или трет-бутилтиогруппа.
Термин "арил", как он используется в контексте, означает необязательно замещенный фенил и нафтил (например, 1-нафтил, 2-нафтил или 3-нафтил). Подходящие заместители для арила могут быть выбраны из перечисленных для алкила, кроме этого, однако, галоген, гидроксил и необязательно замещенные алкил, галоидалкил, алкенил, алкинил и арилоксигруппа являются заместителями, которые могут быть добавлены к выбранным выше.
Термин "гетероциклил", как он используется в контексте, означает необязательно замещенные насыщенные, частично ненасыщенные или ароматические моноциклические, бициклические или трициклические гетероциклические системы, которые содержат один или несколько гетероатомов, выбранных из азота, кислорода и серы, которые также могут быть сконденсированы с необязательно замещенным насыщенным, частично ненасыщенным или ароматическим моноциклическим углеродным кольцом или гетероциклом.
Примерами подходящих гетероциклильных остатков являются оксазолил, изоксазолил, фурил, тетрагидрофурил, 1,3-диоксоланил, дигидропиранил, 2-тиенил, 3-тиенил, пиразинил, изотиазолил, дигидрооксазолил, пиримидинил, тетразолил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, пирролидинонил, (N-оксид)-пиридинил, 1-пирролил, 2-пирролил, триазолил, например 1,2,3-триазолил или 1,2,4-триазолил, 1-пиразолил, 2-пиразолил, 4-пиразолил, пиперидинил, морфолинил (например, 4-морфолинил), тиоморфолинил (например, 4-тиоморфолинил), тиазолил, пиридинил, дигидротиазолил, имидазолидинил, пиразолинил, пиперазинил, 1-имидазолил, 2-имидазолил, 4-имидазолил, тиадиазолил, например 1,2,3-тиадиазолил, 4-метилпиперазинил, 4-гидроксипиперидин-1-ил.
Подходящие заместители для гетероциклила могут быть выбраны из таковых, упомянутых для алкила, кроме этого, однако, необязательно замещенный алкил, алкенил, алкинил, оксогруппа (=O) или аминосульфонил являются заместителями, которые могут быть добавлены к выбранным выше.
Термин "ацил" ("алкилкарбонил"), как он используется в контексте, означает группу формулы C(=O)R, где R означает водород, незамещенный или замещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 7 атомов углерода, или фенильную группу. Наиболее предпочтительно ацильные группы являются такими, где R означает водород, незамещенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 4 углеродных атомов, или фенильную группу.
Термин галоген подразумевает фтор, хлор, бром или иод, предпочтительно фтор, хлор, бром.
В рамках изобретения термин "X" представляет О, S или СН2, предпочтительно О или СН2. Наиболее предпочтительно "X" означает О.
В рамках изобретения термин "Z" означает О или S, предпочтительно О.
При графическом изображении соединений, приведенных в этой заявке, утолщенная заостренная линия () указывает заместитель, расположенный над плоскостью кольца, которому принадлежит асимметрический атом углерода, а пунктирная линия () указывает заместитель, который расположен под плоскостью кольца, которому принадлежит асимметрический атом углерода.
Соединения формулы I обнаруживают стереоизомерию. Эти соединения могут быть любым изомером соединения формулы I или смесью таких изомеров. Соединения и промежуточные соединения по настоящему изобретению, имеющие один или несколько асимметрических атомов углерода, могут быть получены в виде рацемических смесей стереоизомеров, которые могут быть разделены.
Соединения формулы I проявляют таутомерию, что означает, что соединения по данному изобретению могут существовать в виде двух или нескольких химических соединений, способных к легкому взаимному превращению. Во многих случаях это означает только обмен атомом водорода между двумя другими атомами, с любым из которых он образует ковалентную связь. Таутомерные соединения существуют в подвижном равновесии друг с другом, так что попытки получить отдельные соединения обычно приводят в результате к образованию смеси, которая характеризуется всеми химическими и физическими свойствами, ожидаемыми на основании структур компонентов.
Наиболее обычным видом таутомерии является таутомерия, включающая карбонильные или содержащие кетогруппу соединения и ненасыщенные гидроксилсодержащие соединения, или енолы. Структурное изменение означает смещение атома водорода между атомами углерода и кислорода с перегруппировкой связей. Например, во многих алифатических альдегидах и кетонах, как, например, ацетальдегид, кето-форма является преобладающей; в фенолах енольная форма является главным компонентом.
Соединения формулы I, являющиеся основными, могут образовывать фармацевтически приемлемые соли с неорганическими кислотами, как, например, галоидводородные кислоты (например, соляная кислота и бромисто-водородная кислота), серная кислота, азотная кислота и фосфорная кислота, и им подобные кислоты, и с органическими кислотами (например, с уксусной кислотой, винной кислотой, янтарной кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, салициловой кислотой, лимонной кислотой, метансульфокислотой и п-толуолсульфокислотой и им подобными). Образование и выделение таких солей может быть осуществлено согласно способам, известным в данной области.
Предпочтительно применение соединений формулы I,
где R означает водород;
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксигруппу, гидроксиметил, цианогруппу, азидогруппу, алкоксииминометил, алкилкарбониламиногруппу, алкиламинометил или диалкиламинометил;
R2 означает водород, гидроксил, алкоксигруппу или галоген;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 представляют фтор;
Х означает О или СН2; и
В означает 9-пуринильный остаток В1 или 1-пиримидильный остаток В2, как определено выше.
Примеры предпочтительных соединений перечислены ниже:
| Соединение № | Структура | Название |
| соединение 6 | 4'-С-(гидроксиметил)цитидин | |
| соединение 7 | 5-фтор-4'-С-(гидроксиметил)-уридин | |
| соединение 8 | 4'-С-метоксиуридин | |
| соединение 10 | 4-оксим (Е и/или Z)-4'-C-азидоуридина | |
| соединение 11 | 4'-С-(трифторметил)цитидин | |
| соединение 12 | 4'-С-(трифторметил)-5-метил-цитидин |
| Соединение № | Структура | Название |
| соединение 13 | 1-[4(S)-азидо-2(S),3(R)-дигидрокси-4-(гидроксиметил)-1 (R)-циклопентил] цитозин | |
| соединение 14 | 4'-С-(гидроксиметил)аденозин | |
| соединение 15 | 9-[4-С-(гидроксиметил)-β-D-рибофуранозил]-6-меркапто-пурин | |
| соединение 16 | 4' -С-азидогуанозин | |
| соединение 16-1 | 4'-С-азидоинозин (9-(5-азидо-3,4-дигидрокси-5-гидроксиметилтетрагидрофуран-2-ил)-1,9-дигидропурин-6-он) | |
| соединение 17 | 2-амино-4'-С-азидоаденозин | |
| соединение 18 | 4'-С-азидоаденозин |
| Соединение № | Структура | Название |
| соединение 19 | 4'-С-(1-пропинил)гуанозин | |
| соединение 20 | 2-амино-4'-С-(1-пропинил)-аденозин | |
| соединение 21 | 4' -С-(1-пропинил)аденозин |
Особенно предпочтительной группой соединений для лечения HCV являются соединения формулы I-а,
где
R1 означает алкил, алкенил, алкинил, галоидалкил, алкилкарбонил, алкоксигруппу, гидроксиметил, цианогруппу, азидогруппу, алкоксииминометил, алкилкарбрниламиногруппу, алкиламинометил
или диалкиламинометил;
R2 означает водород, гидроксил, алкоксигруппу или галоген;
R3 и R4 означают водород, гидроксил, алкоксигруппу, галоген или
гидроксиалкил, при условии, что как минимум один из R3 и R4 означает водород; или
R3 и R4 представляют фтор;
и фармацевтически приемлемые соли.
Примеры таких особенно предпочтительных соединений перечислены ниже:
| Соединение № | Структура | Название |
| соединение 9 | 4'-С-метоксицитидин | |
| соединение 22 | 4' -С -(фторметил)цитидин | |
| соединение 23 | 4'-С-метилцитидин | |
| соединение 24 | 4'-C-азидо-2'-дезокси-2',2'-дифторцитидин | |
| соединение 25 | 2'-дезокси-4'-C-фтор-2',2'-дифторцитидин | |
| соединение 26 | 2'-дезокси-4'-C-этинил-2',2'-дифторцитидин |
| Соединение № | Структура | Название |
| соединение 27 | 4'-С-азидо-3'-O-метилцитидин | |
| соединение 28 | 4'-С-азидо-3'-дезоксицитидин | |
| соединение 29 | 4'-С-азидо-3'-дезокси-3'-фтор-цитидин | |
| соединение 30 | 4'-С-(1-пропинил)цитидин | |
| соединение 31 | 4'-С-(1-бутинил)цитидин | |
| соединение 32 | 4'-С-винилцитидин |
| Соединение № | Структура | Название |
| соединение 33 | (E)-4'-C-(1-пропенил)цитидин | |
| соединение 34 | (г)-4'-С-(1-пропенил)цитидин | |
| соединение 35 | 4' -С-этилцитидин | |
| соединение 36 | 4' -С-пропилцитидин | |
| соединение 37 | 4'-С-ацетамидоцитидин | |
| соединение 38 | (Е)-4'-С-(метоксиимино)питидин |
| Соединение № | Структура | Название |
| соединение 39 | (Е)-4'-С-(этоксиимино)цитидин | |
| соединение 40 | 4'-С-[(метиламино)метил]-цитидин | |
| соединение 41 | 4'-С-[(этиламино)метил]цитидин | |
| соединение 42 | 4'-С-[(диметиламино)метил] -цитидин | |
| соединение 43 | 4'-С-азидо-5-метилцитидин | |
| соединение 43-1 | 4'-С-азидо-5-метилуридин |
| Соединение № | Структура | Название |
| соединение 44 | 4'-С-азидо-5-фторцитидин | |
| соединение 44-1 | 4'-С-азидо-5-фторуридин | |
| соединение 45 | 4'-С-азидо-5-гидроксицитидин | |
| соединение 46 | 4'-азидо-2'-дезоксиаденозин | |
| соединение 47 | 4'-С-азидо-2'-дезоксиинозин | |
| соединение 48 | 4'-С-азидо-5-метилуридин |
Наиболее предпочтительные соединения для лечения HCV приведены ниже:
| Соединение № | Структура | Название |
| соединение 1 (Пример 1) | 4'-С-азидоцитидин | |
| соединение 2 (Пример 2) | 4'-С-цианцитидин | |
| соединение 3 (Пример 3) | 4' -С-этинилцитидин гидрохлорид (1:1) | |
| соединение 4 | 4' -С-этоксицитидин | |
| соединение 5 | 4'-С-ацетилцитидин |
Соединения формулы I могут быть получены различными способами, известными обычно в области органической химии, и, в частности, для синтеза аналогов нуклеозидов. Исходные вещества для синтеза или легко коммерчески доступны, или известны, или их легко получить, следуя известным в данной области методикам. Общие обзоры, касающиеся получения аналогов нуклеозидов, включены в следующие публикации:
A.M. Michelson "The Chemistry of Nucleosides and Nucleotides", изд. Academic Press, Нью-Йорк, 1963.
L. Goodman "Basic Principles in Nucleic Acid Chemistry", изд. POP Ts'O, Academic Press, Нью-Йорк, 1974, том 1, глава 2.
"Synthetic Procedures in Nucleic acid Chemistry" ред. W.W. Zorbach и R.S. Tipson, изд. Wiley, Нью-Йорк, 1973, тома 1 и 2.
Синтез карбоциклических нуклеозидов рассмотрен в обзоре L. Agrofoglio и др., Tetrahedron, 1994, 50, 10611.
Подходы, полезные для синтеза соединенней формулы I, включают:
1) модификацию или взаимопревращение полученных нуклеозидов, или
2) построение гетероциклического основания после гликозилирования, или
3) конденсацию защищенного производного фуранозы, тиофуранозы или циклопентана с пиримидиновым (В2) или пуриновым (В1) основанием.
Эти способы будут обсуждены ниже:
1. Модификация или взаимопревращение предварительно полученных нуклеозидов.
Такие способы включают, с одной стороны, модификацию 9-пуринильного или 1-пиримидильного остатка или, с другой стороны, модификацию углеводной составляющей.
А. Модификация пуринильной или пиримидильной составляющей:
а) Дезаминирование аминопуриновых или аминопиримидиновых нуклеозидов, как описано J.R. Tittensor и R.T. Walker в European Polymer J., 1968, 4, 39, и Н. Hayatsu в "Progress in Nucleic Acid Research and Molecular Biology", 1976, том 16, стр. 75.
б) Превращение 4-гидроксильной группы в 4-гидроксипиримидиновых нуклеозидах в уходящую группу и замещение нуклеофильными реагентами. Такие уходящие группы включают галоген, как описано J. Brokes и J. Beranek, Col. Czech. Chem. Comm., 1974, 39, 3100, или 1,2,4-триазол, как описано К. J. Divakar и С. В. Reece, J. Chem. Soc. Perkin Trans. I, 1982, 1171.
в) Замещение по положению 5 пиримидиновых нуклеозидов достигалось при использовании замещенных металлами по положению 5 производных, например, замещенных двухвалентной ртутью или палладием, как описано D. Е. Bergstrom и J. L. Ruth, J. Amer. Chem. Soc., 1976, 98, 1587. Введение фтора в положение 5 пиримидиновых нуклеозидов может быть осуществлено с помощью реагентов, как, например, трифторметилгипофлюорит, как описано М. J. Robins, Ann New York Acad. Sci., 1975, 255, 104.
г) Модифицированные пуриновые нуклеозиды могут быть получены из соответствующих производных пуриновых нуклеозидов, где заместитель в положении 2, 6 или 8 является подходящей уходящей группой, как, например, галоген или сульфонат, или 1,3,4-триазол. 6-Замещенные пуриновые нуклеозиды могут быть получены при обработке соответствующих 6-галоидпуриновых или 6-(1,2,4-триазол-4-ил)пуриновых производных нуклеозидов соответствующим нуклеофильным реагентом, как описано V. Nair и А. J. Fassbender, Tetrahedron, 1993, 49, 2169, и V. Samano, R. W. Miles и M. J. Robins, J. Am. Chem. Soc., 1994, 116, 9331. Подобным же образом 8-замещенные пуриновые нуклеозиды могут быть получены при обработке соответствующего 8-галоидпуринового нуклеозида подходящим нуклеофильным реагентом, как описано L. Tai-Shun, С. Jia-Chong, I. Kimiko и А. С. SartoreUi, J. Med. Chem., 1985, 28, 1481; Nandanan и др., J. Med. Chem:, 1999, 42, 1625; J. Jansons, Y. Maurinsh и M. Lidaks, Nucleosides Nucleotides, 1995, 14, 1709. Введение цианогруппы в положение 8 может быть осуществлено путем замещения с помощью цианида металла, как описано L-L. Gundersen, Acta. Chem. Scand. 1996, 50, 58. Модифицированный по положению 2 пуриновый нуклеозид может быть получен способом, аналогичным описанному Т. Steinbrecher, С. Wamelung, F. Oesch и A. Seidi, Angew. Chem. Int. Ed. EngL, 1993,32, 404.
д) Когда заместитель в положении 2 или 8 пуринового нуклеозида связан углерод-углеродной связью, например алкил, тогда могут быть применены методики, использующие катализируемое металлом поперечное связывания, исходя из соответствующего 2- или 8-галоидзамещенного производного пуринового нуклеозида, как описано A. A. Van Aerschott, и др., J. Med. Chem., 1993, 36, 2938; V. Nair и G.. S. Buenger, J. Am. Chem. Soc., 1989, 111(22), 8502; С. Tu, С; Keane и В.Е. Eaton, Nucleosides Nucleotides, 1995, 14, 1631.
Б. Модификация углеводной составляющей:
Нижеследующее введение защитных групп, совместимых с дальнейшими химическими реакциями:
- Азид может быть введен в положение 4' путем обработки 4',5'-дидегидронуклеозида азидом иода, как подтверждают примером H. Maag и др., J. Med. Chem., 1992, 35, 1440. Алкоксид может быть введен в положение 4' при обработке 4',5'-дидегидронуклеозида иодом, затем спиртом и карбонатом свинца(2), как показано J. P. Verheyden и J.G. Moffatt, J. Am. Chem. Soc., 1975, 97(15), 4386. Фтор может быть введен в положение 4' при обработке 4',5'-дидегидронуклеозида иодом, затем фторидом серебра(1), как описано G. R. Owen и др., J. Org. Chem., 1976, 41(8), 3010, или A. Maguire и. др., J. Chem. Soc. Perkin Trans. I, 1993, 1(15), 1795. 4'-Формильная группа может быть введена и затем превращена в широкий ряд заместителей, включая, но не ограничивая этим, 4'-галоидалкил, 4'-этинил, 4'-оксииминометил и 4'-циан, как подтверждается М. Nomura и др., J. Med. Chem., 1999, 42, 2901.
- Возможна модификация либо 2'-гидрокси-, либо 3'-гидроксизаместителя в аналоге нуклеозида.
- Превращение гидроксильной группы в положении 3 в уходящую группу, например галоид, при реакции, например, с трифенилфосфином и тетрагалоидалканом, как описано, например, L. De Napoli и др., Nucleosides Nucleotides, 1993, 12, 981, с последующим восстановлением, что приводит к производным 3-дезоксисахаров, как описано D. G. Norman и С. В. Reese, Synthesis 1983, 304.
- Превращение гидроксильной группы в положении 3 в трифторметансульфонильную группу с последующим восстановлением при использовании боргидрида натрия, как описано S. A. Surzhykov и др., Nucleosides Nucleotides, 1994, 13(10), 2283. Прямое введение фторного заместителя может быть проведено с помощью фторирующих средств, как, например, трифторид диэтиламиносеры, как описано Р. Herdewijn, A. Van Aerschot и L. Kerremans, Nucleosides Nucleotides, 1989, 8, 65.
- Превращение гидроксильного заместителя в уходящую группу, например, галоид или сульфонат, также возможно при замещении с использованием нуклеофильных реагентов, как, например, фтористый тетрабутиламмоний, азид лития или цианиды металлов, как поясняют примерами Н. Hrebabecky, A. Holy и Е. de Clercq, Collect. Czech. Chem. Comm., 1990, 55, 1800; К.Е. В. Parkes и К. Taylor, Tet. Lett., 1988, 29, 2995; H. M. Pfundheller и др., Helv. Chim. Acta, 2000, 83, 128.
- Реакция 2'-кетонуклеозидов с фторирующими средствами, например трифторид диэтиламиносеры, может быть применен для получения 2',2'-дифторнуклеозидов, как описано D. Bergstrom, E. Romo и Р. Shum, Nucleosides Nucleotides, 1987, 6, 53.
2. Построение гетероциклического основания после гликозилирования:
а) способы, в которых, например, используют производные фуранозиламина, как описано N. J. Cusack, В. J. Hildick, D. H. Robinson, P. W. Rugg и G. Shaw, J. Chem. Soc. Perkin Trans., I 1973, 1720, или G. Shaw, R. N. Warrener, M. H. Maguire и R. К. Ralph, J. Chem. Soc., 1958, 2294.
б) способы, в которых используют, например, фуранозилмочевины для синтеза пиримидиновых нуклеозидов, как описано J. Smejkal, J. Farkas и F. Sorm, Coil. Czech. Chem. Comm., 1966, 31, 291.
в) получение пуриновых нуклеозидов из имидазольных нуклеозидов рассматривается в обзоре L. В. Townsend, Chem. Rev., 1967, 67, 533.
г) получение соединений формулы I, где Х означает СН2, может быть осуществлено из производных 1-гидроксиметил-4-аминоциклопентана, как описано Y. F. Shealy и J. D. Clayton, J. Am. Chem. Soc., 1969, 91, 3075; R. Vince и S. Daluge, J. Org. Chem., 1980, 45, 531; R. С. Cermak и R. Vmce, Tet. Lett., 1981, 2331; R. D. Elliott и др., J. Med. Chem., 1994, 37, 739.
3. Конденсация защищенного производного фуранозы, тиофуранозы или циклопентана с производным пурина или пиримидина.
Реакция конденсации защищенного производного фуранозы, тиофуранозы или циклопентана с соответствующим производным пурина или пиримидина может быть проведена с использованием стандартных способов, включая применения в качестве катализатора кислоты Льюиса, как, например, двубромистая ртуть или четыреххлористое олово, или триметилсилилтрифторметансульфонат, в растворителях, например в ацетонитриле, 1,2-дихлорэтане, дихлорметане, хлороформе или толуоле, при пониженной температуре, при температуре окружающей среды или при повышенной температуре. Примеры реакции конденсации защищенной фуранозы или тиофуранозы
- с производными тяжелых металлов производных пурина или пиримидина (например, с производными хлорртути) описываются J. Davoll и В. A. Lowry, J. Am. Chem. Soc., 1951, 73, 1650; J. J. Fox, N. Yung, J. Davoll и G. В. Brown, J. Am. Chem. Soc., 1956, 78, 2117.
- с алкоксипиримидинами описываются К. A. Watanabe, D. H. Hollenberg и J. J. Fox., Carbohydrates. Nucleosides and Nucleotides. 1974, 1, 1.
- с силильными производными пуринов или пиримидинов, как описано U. Niedballa и H. Vorbruggen, J. Org. Chem., 1976, 41, 2084; U. Niedballa и Н. Vorbruggen, J. Org. Chem., 1974, 39, 3672. A. J. Hubbard, A. S. Jones и R. Т. Walker, Nucleic Acids Res., 1984, 12, 6827.
Кроме того,
- конденсация перацилированных Сахаров с пуринами под вакуумом в присутствии п-толуолсульфокислоты была описана Т. Simadate, Y. Ishudo и Т. Sato, Chem. Abs., 1962, 56, 11692, и W. Pfleiderer, R. К. Robins, Chem. Ber. 1965, 98, 1511.
- реакции конденсации были описаны К. A. Watanabe, D. H. Hollenberg и J. J. Fox, Carbohydrates Nucleosides and Nucleotides, 1974, 1, 1.
Примеры реакции конденсации защищенного производного циклопентана с соответствующим производным пурина или пиримидина приведены H. Kapeller, H. Baumgartner и H. Griengi, Monattsh Chem., 1997, 128, 191, и Р. Wang и др., Tet. Lett., -1997, 38, 4207, или Т. Jenny и др., Helv. Chim. Acta, 1992, 25, 1944.
Такие способы часто приводят в результате к смесям аномерных производных нуклеозидов, которые могут быть разделены с помощью стандартных методик, известных в данной области, как, например, перекристаллизация, колоночная хроматография, высокоэффективная жидкостная хроматография или сверхкритическая флюидная хроматография.
Производные пуринов и пиримидинов для описанных выше реакций конденсации могут быть приобретены или могут быть получены с применением известных в данной области методик.
Получение производных пурина рассматривается G. Shaw в сборнике "Comprehensive Heterocyclic Chemistry", изд-во Pergamon Press, том 5, глава 4.09, стр. 499, и "Comprehensive Heterocyclic Chemistry II", изд-во Pergamon Press, том 7, глава 7. 11, стр. 397.
Получение производных пиримидина рассматривает D. J. Brown в книге "The Chemistry of Heterocyclic Compounds -The Pyrimidines", 1962, и в Приложении 1, 1970, изд-во John Wiley and Sons, Нью-Йорк, D. J. Brown в "Comprehensive Heterocyclic Chemistry", изд-во Pergamon Press, том 5, глава 4. 09, стр. 499, и К. Unheim и Т. Benneche в "Comprehensive Heterocyclic Chemistry II", изд-во Pergamon Press, том 6 глава 6. 02, стр. 93.
Производные фуранозы могут быть получены из коммерчески доступного углеводного сырья, как, например, D-формы рибозы, арабинозы, ксилозы или ликсозы, с последующим введением защитных групп, которые химически совместимы.
4-Замещенные фуранозы с заместителем, содержащим углеродный атом, присоединенный в положении 4 фуранозы, например алкилом, алкенилом, алкинилом, галоидалкилом, ацилом, алкоксикарбонилом, гидроксиалкилом, алкоксиалкилом, цианогруппой, оксииминометилом, алкоксииминометилом, алкиламинокарбонилом и ацилом, могут быть получены из соответствующей 4-формилфуранозы. Получение одной из таких 4-формилфураноз описывается H. Ohrui и др., J. Med. Chem., 2000, 43, 5416. 4-Галоидалкилфуранозы могут быть получены из соответствующих 4-гидроксиметилфураноз (например, К. Kitano и др., Tetrahedron, 1997, 53(39), 13315). 4-Метилфуранозы могут быть получены способом, описанным Т. Waga и др., Biosci. Biotech. Biochem., 1993, 19(7), 408.
Производные 2,2-дифторфуранозы могут быть получено из D-глюкозы или D-маннозы, как описано R. Fernandez, M. I. Mateu, R. Echarri и S. Castillon, Tetrahedron, 1998, 54, 3523. Производные тиофуранозы могут быть получены при использовании известных из литературы методик, как, например, описанных L.Bellon, J. L. Barascut, J. L. Imbach, Nucleosides and Nucleotides, 1992, 11, 1467, и модифицированных таким же образом, как и в случае аналогов фуранозы, описанных выше.
Производные циклопентана могут быть получены известными в данной области органической химии способами и способами, на которые ссылаются и которые включены в статью L. Agrofolio и др. Tetrahedron, 1994, 50, 10611.
Предварительно приготовленные производные нуклеозидов либо коммерчески доступны, либо их синтезируют согласно описанным выше способам.
Способы, обсуждаемые выше, более подробно описываются далее:
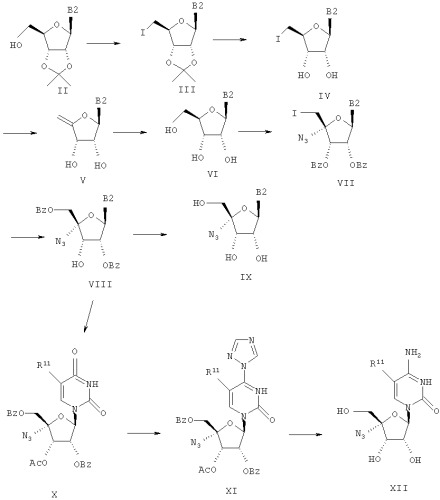
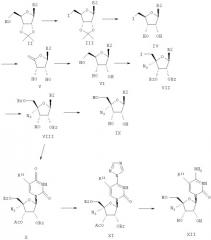
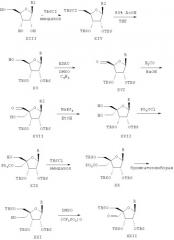
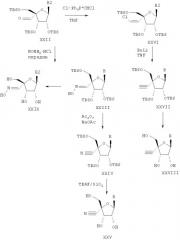
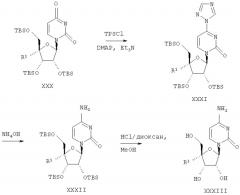
Соединения формулы I, где R1 означает N3, R2 и R3 являются гидроксильными группами и В означает В2, могут быть получены согласно реакционной схеме А:
Схема А
где Ас означает ацетил, Bz означает бен