Производные пирролидона в качестве ингибиторов моноаминоксидазы в (мао-в), содержащая их фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к новым производным пирролидона формулы I
где: Q означает =N, =C(R24)-; X-Y означает -СН2-СН2-, -СН=СН-, -СН2-О-; R1, R1.1 и R1.2 независимо друг от друга выбраны из группы, включающей Н, галоид, галоид(C1-C6)алкил, CN, (C1-C6)алкоксигруппу; R21, R22 и R23 независимо друг от друга выбраны из группы, включающей Н, галоид; R24 означает Н; R3 означает -NHR6; R4 означает Н; R6 означает -С(O)Н, -С(O)-(C1-C3)алкил, С(O)-галоид(C1-C3)алкил, -С(O)O(C1-C3)алкил, -C(O)NH2, -SO2-(C1-C3)алкил; а также его индивидуальные изомеры, рацемические и нерацемические смеси. Соединения ингибируют моноаминоксидазу В, что позволяет использовать их в фармацевтической композиции, предназначенной для профилактики и лечения заболевания, опосредованного ингибитором моноаминоксидазы В, в частности болезни Альцгеймера и старческого слабоумия. 3 н. и 12 з.п. ф-лы.
Реферат
Объектами настоящего изобретения являются рацемические или энантиомерно чистые производные 4-пирролидинов, способ их получения, фармацевтические композиции, включающие упомянутые производные, и их использование для профилактики и лечения заболеваний.
В частности, объектом настоящего изобретения являются соединения формулы I
в которых
Q обозначает=N- или=C(R24)-;
X-Y обозначает -СН2-СН2-, -СН=СН- или -СН2-О-;
R1, R1.1 и R1.2 независимо друг от друга выбраны из группы, включающей водород, галоид, галоид(С1-С6)алкил, цианогруппу, (С1-С6)алкоксигруппу или галоид-(С1-С6)алкоксигруппу;
R21, R22 и R23 независимо друг от друга выбраны из группы, включающей водород и галоид;
R24 обозначает водород, галоид или метил;
R3 обозначает -NHR6;
R4 обозначает водород; и
R6 обозначает -С(О)Н, -С(О)-(С1-С3)алкил, С(О)-галоид(С1-С3)алкил, -С(О)O(С1-С3)алкил, -С(О)NH2 или -SO2-(С1-С3)алкил;
а также их индивидуальные изомеры и рацемические или нерацемические смеси.
В особенности, объектом настоящего изобретения являются соединения формулы I*
в которых
R1 обозначает галоид, галоид(С1-С6)алкил, цианогруппу, (C1-С6)алкоксигруппу или галоид(С1-С6)алкоксигруппу;
R21, R22, R23 и R24 независимо друг от друга выбраны из группы, включающей водород и галоид;
R3 обозначает -NHR6;
R4 обозначает водород;
R6 обозначает -СО-(С1-С3)алкил или -SO2-(С1-С3)алкил; и
n принимает значения 0, 1, 2 или 3;
а также их индивидуальные изомеры и рацемические или нерацемические смеси.
Было обнаружено, что соединения общей формулы I и I*, а также их индивидуальные изомеры и рацемические или нерацемические смеси (здесь и далее: активные соединения), являются селективными ингибиторами моноаминоксидазы В.
Моноаминоксидаза (МАО, ЕС 1.4.3.4) является флавинсодержащим ферментом, отвечающим за окислительное дезаминирование эндогенных моноаминных нейромедиаторов, таких как допамин, серотонин, адреналин или норадреналин, а также следовых аминов, например, фенилэтиламина, равно как и ряда аминосодержащих ксенобиотиков. Фермент существует в двух формах, МАО-А и МАО-В, кодируемых разными генами (A.W.Bach и др., Proc. Natl. Acad. Sci. USA, 1988, т.85, cc.4934-4938) и различающихся распределением в тканях, структурой и субстратной специфичностью. МАО-А обладает большим сродством к серотонину, октопамину, адреналину и норадреналину, тогда как естественными субстратами для МАО-В являются фенилэтиламин и тирамин. Допамин, как полагают, окисляется обеими изоформами. МАО-В широко распространена в некоторых органах, включая мозг (А.М.Cesura и A.Pletscher, Prog. Drug Research, 1992, т.38, cc.171-297). Активность МАО-В в мозге, как оказывается, увеличивается с возрастом. Это увеличение приписывают связанному со старением глиозу (C.J.Fowler и др., J. Neural Transm., 1980, т.49, cc.1-20). Кроме того, активность МАО-В существенно выше в мозге пациентов с болезнью Альцгеймера (Р.Dostert и др., Biochem. Pharmacol. 1989, т.38, cc.555-561) и, как обнаружилось, высоко выражена в астроцитах вокруг старческих бляшек (Saura и др., Neuroscience, 1994, т.70, cc.755-774). В связи с этим, поскольку окислительное дезаминирование первичных моноаминов с помощью МАО приводит к образованию аммиака, альдегидов и перекиси водорода, веществ с установленной или потенциальной токсичностью, предполагается, что имеются логические основания для применения селективных ингибиторов МАО-В для лечения слабоумия и болезни Паркинсона. Ингибирование МАО-В вызывает снижение ферментативной инактивации допамина и, вследствие этого, пролонгирование доступности нейромедиатора в допаминовых нейронах. Дегенеративные процессы, связанные с возрастом и болезнями Альцгеймера и Паркинсона, могут быть также отнесены на счет окислительной нагрузки в результате увеличенной активности МАО и обусловленного ею повышения выработки перекиси водорода Н2O2 под воздействием МАО-В. Поэтому действие ингибиторов МАО-В может проявляться как в снижении выработки кислородных радикалов, так и в подъеме уровней моноаминов в мозгу.
Учитывая описанное выше значение МАО-В при неврологических расстройствах, существует значительный интерес к получению мощных и селективных ингибиторов, которые позволили бы контролировать эту ферментативную активность. Фармакология некоторых известных ингибиторов МАО-В обсуждается, например, D. Bentué-Ferrer и др. в CNS Drugs, 1996, т.6, сс.217-236. Тогда как главным ограничением активности необратимого и неселективного ингибитора МАО является необходимость соблюдения диетических предосторожностей вследствие риска вызвать гипертонический криз при приеме диетического тирамина, равно как и возможность взаимодействия с другими лекарственными средствами (D.M.Gardiner и др., J. Clin. Psychiatry, 1996, т.57, сс.99-104), эти побочные явления менее значимы для обратимых и селективных ингибиторов МАО, в частности МАО-В. Таким образом, существует потребность в ингибиторах МАО-В, обладающих высокой селективностью и не имеющих вредных побочных эффектов, типичных для необратимых ингибиторов МАО с низкой селективностью по отношению к ферменту.
Нижеследующие определения общих терминов, используемых в контексте, действительны вне зависимости от того, употреблены ли рассматриваемые термины по отдельности или в определенном сочетании. Следует учитывать, что употребленные в описании и пунктах формулы изобретения формы единственного числа подразумевают также формы множественного числа, если только из контекста однозначно не следует обратное.
Термин «их индивидуальные изомеры и рацемические или нерацемические смеси» означает Е- и Z-изомеры, их смеси, равно как и индивидуальные конфигурационные изомеры и их смеси, при этом термин "рацемические смеси" означает смеси двух энантиомеров в соотношении 1:1, а «нерацемические смеси» означает смеси двух энантиомеров в соотношении, отличном от 1:1.
Термин «(C1-C6)алкил», используемый в настоящей заявке, означает насыщенные углеводородные остатки с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и им подобные, предпочтительно содержащие от 1 до 3 атомов углерода. Соответственно, термин «(C1-C3)алкил» означает насыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 3 атомов углерода.
Термин «галоген» («галоид») означает фтор, хлор, бром и иод.
«Галоид(С1-С6)алкил» или «галоид(С1-С6)алкокси» означает (низш.)алкильный остаток или (низш.)алкоксильный остаток соответственно, как это определено в контексте, замещенный по любому положению одним или несколькими атомами галогена, как это определено в контексте. Примеры галоидалкильных остатков включают 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил и 3,3,3-трифторпропил и подобные им, но не ограничиваются перечисленными. «Галоидалкокси» включает трифторметоксигруппу.
«(С1-С6)алкокси» означает остаток -О-R, в котором R является низшим алкильным остатком, как это определено в контексте. Примеры алкоксильных радикалов включают метоксигруппу, этоксигруппу, изопропоксигруппу и подобные им, но не ограничиваются перечисленными.
«Фармацевтически приемлемые соли» соединения означают соли, являющиеся приемлемыми фармацевтически, то есть в общем смысле безопасными, не токсичными, не являющиеся нежелательными ни в биологическом, ни в каком-либо ином смысле, обладающие желаемой фармакологической активностью исходного соединения. Эти соли являются производными неорганической или органической кислоты или основания. Если это возможно, соединения формулы I могут быть преобразованы в фармацевтически приемлемые соли. Следует иметь в виду, что фармацевтически приемлемые соли включены в настоящее изобретение.
Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I*, в которых R3 обозначает -NHR6, R6 обозначает -СО-(С1-С6)алкил или -SO2-(С1-С6)алкил, а R4 обозначает водород. Примером подобного соединения является (RS)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид.
Соединения формулы I* могут быть замещены n заместителями R1, выбранными из группы, включающей галоид, галоид(С1-С6)алкил, цианогруппу, (С1-С6)алкоксигруппу или галоид(С1-С6)алкоксигруппу, где n является целым числом, выбранным из 0, 1, 2 и 3. Предпочтительно, n принимает значения 1 или 2. Предпочтительными соединениями формулы I* являются такие, в которых R1 обозначает галоид или галоид(С1-С6)алкил. Особенно предпочтительными являются такие соединения формулы I*, в которых R1 обозначает фтор, хлор или трифторметильную группу. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I*, в которых n принимает значения 0 или 1. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I*, в которых n принимает значение 1. В том случае, когда соединения замещены двумя или тремя заместителями R1, каждый R1 может быть тем же самым или иным. В одном из вариантов осуществления настоящего изобретения его объектами являются соединения формулы I, в которых Q обозначает =C(R24)-, где R24 обозначает водород, галоид или метил. В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых Q обозначает =СН-, =CF- или =С(СН3)-. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых Q обозначает =N-.
В одном из вариантов осуществления настоящего изобретения его объектами являются соединения формулы I, в которых -X-Y- обозначает -СН2-O-. В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых -X-Y- обозначает -СН2-СН2- или -СН=СН-.
В одном из вариантов осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1, R1.1 и R1.2 независимо друг от друга выбраны из группы, включающей водород, галоид, метил, галоидметил, цианогруппу, метоксигруппу или галоидметоксигруппу. В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1, R1.1 и R1.2 обозначают галоид, например, фтор, например, 2,4,6-трифтор-, 2,4,5-трифтор-, 2,3,6-трифтор-, 2,3,4-трифтор-или 3,4,5-трифтор-. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.2 обозначает водород, a R1 и R1.1 независимо друг от друга выбраны из группы, включающей водород, галоид, (С1-С6)алкил, галоид(С1-С6)алкил, цианогруппу, (С1-С6)алкоксигруппу или галоид(С1-С6)алкоксигруппу. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.2 обозначает водород, а R1 и R1.1 независимо друг от друга выбраны из группы, включающей галоид и (С1-С6)алкил. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.2 обозначает водород, R1.1 обозначает галоид, а R1 обозначает галоид или (С1-С6)алкил. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.1 и R1.2 обозначают водород, а R1 обозначает галоид, (С1-С6)алкил, галоид(С1-С6)алкил, цианогруппу, (С1-С6)алкоксигруппу или галоид(С1-С6)алкоксигруппу. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.1 и R1.2 обозначают водород, а R1 обозначает галоид, метил, галоидметил, цианогруппу, метоксигруппу или галоидметоксигруппу. Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1.1 и R1.2 обозначают водород, а R1 обозначает фтор, например, 2-фтор-, 3-фтор- или 4-фтор-, хлор, например, 3-хлор-, метил, например, 4-метил-, галоидметил, например, 3-трифторметил-, цианогруппу, метоксигруппу, например, 2-метокси-, 3-метокси- или 4-метокси-, или галоидметоксигруппу, например, 3-трифторметокси-. В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R1, R1.1 и R1.2 обозначают водород.
В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R21, R22 и R23 обозначают водород.
Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R24 обозначает водород.
Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых R24 обозначает -NHR6, где R6 обозначает -С(О)Н, -С(О)-СН3, -С(О)-CH2F, -С(О)-CHF2, -С(О)-CF3, -С(О)O-СН3, -С(О)-NH2 или -SO2-СН3.
В одном из вариантов осуществления настоящего изобретения его объектами являются соединения формулы I, имеющие (S)-конфигурацию.
В другом варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых Q обозначает =C(R24)-, где R24 обозначает водород, X-Y обозначает -СН2-O-, R1.1 и R1.2 обозначают водород, R1 обозначает водород или галоид, R21, R22 и R23 обозначают водород, R3 обозначает -NHR6, R4 обозначает водород, а R6 обозначает -С(О)Н, -С(О)-(C1-С3)алкил, С(О)-галоид(С1-С3)алкил, -С(О)O(С1-С3)алкил, -С(О)NH2 или -SO2-(С1-С3)алкил.
Еще в одном варианте осуществления настоящего изобретения его объектами являются соединения формулы I, в которых Q обозначает =C(R24)-, где R24 обозначает водород, X-Y обозначает -СН2-O-, R1.1 и R1.2 обозначают водород, R1 обозначает водород или галоид, R21, R22 и R23 обозначают водород, R3 обозначает -NHR6, R4 обозначает водород, а R6 обозначает -С(О)Н, -С(О)-СН3, -С(О)-CH2F, -С(О)-CHF2, -С(О)-CF3, -С(О)O-СН3, -С(О)-NH2 или -SO2-СН3.
Примеры соединений формулы I включают соединения, выбранные среди нижеследующих:
(RS)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(R)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(RS)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}формамид,
(S)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}формамид,
(R)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}формамид,
метиловый эфир (RS)-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}-карбаминовой кислоты,
(RS)-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}мочевина,
(RS)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}метансульфамид,
(S)-2-фтор-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-2,2-дифтор-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-2,2,2-трифтор-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(RS)-N-{1-[4-(4-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(R)-N-{1-[4-(4-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(4-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(RS)-N-{1-[4-(4-фторбензилокси)фенил]-5-оксопирролидин-3-ил}формамид,
(RS)-N-[1-(4-бензилоксифенил)-5-оксопирролидин-3-ил]ацетамид,
(RS)-N-{1-[4-(2-фторбензилоксифенил]-5-оксопирролидин-3-ил}ацетамид,
(RS)-(Е)-N-(1-{4-[2-(3-фторфенил)винил]фенил}-5-оксопирролидин-3-ил)ацетамид,
(RS)-N-(1-{4-[2-(3-фторфенил)этил]фенил}-5-оксопирролидин-3-ил)ацетамид,
(RS)-N-{1-[6-(4-фторбензилокси)пиридин-3-ил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(3-хлорбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(2,6-дифторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{5-оксо-1-[4-(2,4,6-трифторбензилокси)фенил]пирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(3-метоксибензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид,
(S)-N-{5-оксо-1-[4-(4-трифторметилбензилокси)фенил]пирролидин-3-ил}ацетамид,
(S)-N-{1-[4-(4-метилбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид и
(S)-N-{1-[4-(3-цианобензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид.
Еще в одном варианте осуществления настоящего изобретения его объектом является способ получения соединений формулы I, состоящий во введении соединения формулы II
в реакцию с изоцианатом или с ацилирующим агентом формулы Z-С(О)-(C1-С3)алкил, Z-С(О)-галоид(С1-С3)алкил, Z-С(О)O(С1-С3)алкил или Z-SO2-(C1-С3)алкил, где Z обозначает активирующую группу, например, галоид или ангидрид.
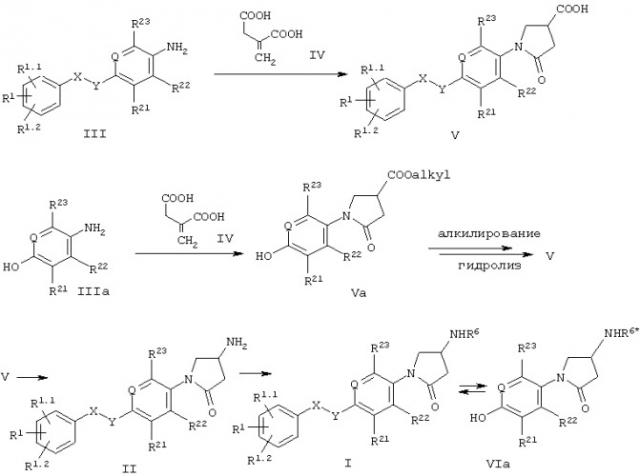
На схеме 1 показаны основные пути получения соединений формулы I. Промежуточные соединения III и IIIa могут быть введены в реакцию с неразбавленной итаконовой кислотой IV в диапазоне температур от 80°С до 200°С.
Соединения формулы Va могут быть подвергнуты алкилированию посредством синтеза простых эфиров по Вильямсону с использованием незамещенного или замещенного бензильного производного, выбранного из бензилгалогенидов, тозилатов, метансульфонатов (мезилатов) и трифторметансульфонатов (трифлатов). Используемыми при этом основаниями могут быть, например, алкоголяты или карбонаты, такие как карбонаты натрия, калия или цезия. Предпочтительными растворителями являются низшие спирты, ацетонитрил или низшие кетоны в температурном диапазоне от 20°С до температуры кипения с обратным холодильником.
Другим подходом является конденсация по Мицунобу: необязательно замещенный бензиловый спирт вводят в реакцию с соединением формулы Va в инертном растворителе, например, диэтиловом эфире или тетрагидрофуране, добавляя диалкилазодикарбоксилаты в присутствии фосфинов, например, трибутил- или трифенилфосфина. Гидролиз соединений формулы Va может быть осуществлен общепринятыми способами, такими как гидролиз в кислотных условиях, например с помощью соляной кислоты, или в основных условиях, например с помощью гидроксидов лития, натрия или калия в смесях со спиртами и водой в качестве растворителя.
Соединения формулы II и IIa могут быть получены исходя из кислотных производных формулы V путем нуклеофильных миграций от атома углерода к атому азота, таких как, например, перегруппировка Гофмана или Курциуса, через образование соответствующего изоцианата. Последующая обработка изоцианата водными растворами кислот приводит непосредственно к аминам формулы II. Обработка образующегося на промежуточной стадии изоцианата соответствующими спиртами приводит к защищенным аминопроизводным формулы IIa. Для обработки изоцианата выбирают такие спирты, которые приводят к типичным карбаматам, используемым в качестве защитных групп для аминов, например, трет-бутоксикарбонильной, бензилоксикарбонильной или флуоренилметоксикарбонильной группе. Снятие защиты с аминогрупп с целью получения соединений формулы II производят согласно хорошо известным из литературы методикам.
Дальнейшее преобразование полученных соединений в соединения формулы II может быть осуществлено с помощью стандартных способов, таких как, например, реакции с активированными ацильными производными, например, ацилгалогенидами или ангидридами, или реакций конденсации кислот с использованием, например, карбодиимидов в качестве конденсирующего агента, или реакции с изоцианатами.
В тех соединениях формулы I или IIa, где -X-Y- обозначает -СН2-О-, необязательно замещенный бензильный остаток может выступать в качестве промежуточной группы, которая может быть расщеплена посредством гидрогенолиза. Получаемые в результате соединения формулы VIa или VIб могут быть снова подвергнуты алкилированию с использованием другой бензильной группы в упомянутых выше условиях. Как известно специалистам в данной области, этот процесс возможен только при том условии, что R6* и PG (защитная группа) являются группами, устойчивыми в упомянутых выше условиях реакции по отношению к гидрогенолизу и реакции алкилирования.
Схема 1
Другой способ получения соединений формулы I включает реакции кросс-сочетания арилстаннанов [Lam и др.. Tetrahedron Lett., т.43, с.3091 (2002)], арилборонатов [Lam и др., Synlett, т.5, с.674 (2000); Chan и др., Tetrahedron Lett., т.39, с.2933 (1998)] или арилгалогенидов [Buchwald и др., J. Amer. Chem. Soc., т.118, с.7215 (1996)] с соответствущими пирролидонами (схема 2)
Схема 2
где LG обозначает уходящую группу, например, галоид, например, хлор, бром или иод, или SnR3 или В(ОН)2, a R3* обозначает -NHR6 или алкоксикарбонильную группу.
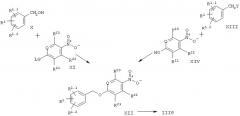
Согласно настоящему изобретению, возможность получения соединений общей формулы III, где -X-Y- является -СН2-О-, т.е. соединений формулы IIIб, представлена на схеме 3. Промежуточные соединения формулы XII могут быть получены путем нуклеофильного замещения исходя из ароматических нитросоединений формулы XI, содержащих уходящие группы в параположении, с помощью бензиловых спиртов формулы X. Примерами уходящих групп в параположении являются галоиды (F, Cl, Br, I), тозилаты, мезилаты или трифлаты. Эти реакции замещения могут быть осуществлены как без растворителя, так и в инертных растворителях, подобных, например, толуолу или ксилолу. Предпочтительная температура проведения реакции лежит в диапазоне от 50°С до 150°С. Альтернативно, соединения формулы XII могут быть получены путем синтеза простых эфиров по Вильямсону исходя из n-нитрофенолов формулы XIV и бензилгалогенидов, тозилатов, мезилатов или трифлатов формулы XIII. Используемыми при этом основаниями могут быть, например, алкоголяты или карбонаты (карбонат натрия, калия или цезия). Предпочтительными растворителями являются низшие спирты, ацетонитрил или низшие кетоны при температуре в диапазоне от 20°С до температуры кипения с обратным холодильником. Другим подходом является конденсация по Мицунобу бензиловых спиртов с n-нитрофенолами формулы XIV. Реакцию, как обычно, проводят в инертных растворителях, таких как, например, диэтиловый эфир или тетрагидрофуран, используя диалкилазодикарбоксилаты в присутствии фосфинов, например, трибутил- или трифенилфосфина.
Ключевые промежуточные соединения формулы XII восстанавливают до аминосоединений IIIб путем каталитического гидрирования, например, при использовании в качестве катализатора платины на угле в низших спиртах, этилацетате или тетрагидрофуране. Альтернативным способом является восстановление нитрогруппы металлами, такими как железо, олово или цинк, в кислой среде, такой как разбавленная соляная кислота или уксусная кислота. Металлы также могут быть заменены солями металлов, например, хлоридом олова (II).
Схема 3
где LG обозначает уходящую группу, например, галоид, OTf и т.д., a Y также обозначает уходящую группу, например, галоид, OTf и т.д. или ОН (в случае конденсации по Мицунобу).
Промежуточные соединения формулы III, где -X-Y- является -СН=СН-, т.е. соединение формулы IIIв, или где -X-Y- является -СН2-СН2-, т.е. соединение формулы IIIг, могут быть получены с помощью способа, представленного на схеме 4. Промежуточные соединения формулы XVII могут быть получены по реакции олефинизации необязательно замещенных ароматических альдегидов формулы XV с помощью диалкил-(4-нитробензил)фосфонатов формулы XVI в присутствии основания, например, гидрида натрия, приводящей к соответствующим нитроолефинам формулы XVII.
Ключевые промежуточные соединения формулы XVII могут быть селективно восстановлены до аминоолефина формулы IIIв с помощью металлов или солей металлов, таких как, например, хлорид олова (II), или посредством каталитического гидрирования, такого как, например, гидрирование с использованием платины на угле в качестве катализатора и низших спиртов, этилацетата или тетрагидрофурана в качестве растворителя. Аминопроизводные формулы IIIг могут быть получены из нитропроизводных формулы XVII или аминоолефинов формулы IIIв путем гидрирования с использованием палладия на угле в качестве катализатора и низших спиртов, этилацетата или тетрагидрофурана в качестве растворителя.
Схема 4
Соединения общей формулы I могут также существовать в оптически чистой форме. Разделение на энантиомеры может быть осуществлено с помощью общепринятых способов: или на ранней стадии синтеза, исходя из соединений формулы V, путем образования соли с оптически активным амином, таким как, например, (+)- или (-)-1-фенилэтиламин или (+)- или (-)-1-нафтилэтиламин, и разделения диастереомерных солей посредством фракционной кристаллизации; или путем образования производного с хиральным вспомогательным соединением, таким как, например, (+)- или (-)-2-бутанол, (+)- или (-)-1-фенилэтанол или (+)- или (-)-ментол, и разделения диастереомерных продуктов с помощью хроматографии и/или кристаллизации с последующим разрывом связи со вспомогательным хиральным соединением; или на самой последней стадии синтеза путем разделения энантиомеров формулы I с помощью хиральной хроматографии. Помимо этого, соединения формулы I также могут быть получены исходя из энантиомерно чистых интермедиатов, полученных с помощью биотрансформации, например, путем гидролиза сложных эфиров формулы Va ферментами, такими, как, например, холестераза, получаемая из Candida cylindracea. Определение абсолютной конфигурации получаемого производного пирролидинона можно осуществить посредством анализа чистых диастереомерных солей или производных общепринятыми спектроскопическими методами, среди которых наиболее подходящим является рентгеновская спектроскопия монокристаллов.
Соединения формулы I являются, как уже было упомянуто, ингибиторами моноаминоксидазы В и могут быть применены для лечения или профилактики заболеваний в тех случаях, когда ингибиторы МАО-В могли бы быть полезны. Подобные случаи включают острые и хронические неврологические расстройства, расстройства познавательной функции и расстройства памяти. К показанным к лечению неврологическим расстройствам относятся, например, травматические или хронические дегенеративные процессы в нервной системе, такие как болезнь Альцгеймера, другие виды слабоумия, снижение познавательной функции до минимума или болезнь Паркинсона. Другие показания включают психиатрические заболевания, такие как депрессия, беспокойство, беспричинное беспокойство, социофобия, шизофрения, расстройства питания и метаболические расстройства, такие как ожирение, а также профилактика и лечение абстинентных синдромов, вызванных злоупотреблением алкоголем, никотином и другими вырабатывающими привыкание средствами. Среди других показаний к лечению могут быть периферийная невропатия, вызванная химиотерапией рака (WO 97/33572), синдром недостатка оценки (WO 01/34172) или лечение рассеянного склероза (WO 96/40095) и других воспалительных неврологических заболеваний.
Соединения формулы I особенно полезны при лечении и профилактике болезни Альцгеймера и старческого слабоумия.
Фармакологическую активность соединений исследовали с помощью следующей методики.
Молекулы комплементарной ДНК, кодирующие МАО-А и МАО-В, временно трансфектировали в клетки ядерного антигена вируса Эпштейна-Барра (EBNA) согласно процедуре, описанной Schlaeger и Christensen (Cytotechnology, т.15, cc.1-13, (1998). После трансфекции клетки гомогенизировали с помощью гомогенизатора Polytron в 20 мМ буферном растворе трис-HCl, рН 8,0, содержащем 0,5 мМ этиленгликольтетрауксусной кислоты (ЭГТК) и 0,5 мМ фторангидрида фенилметансульфокислоты. Клеточные мембраны отделяли центрифугированием при 45000 xg, и после двух стадий промывания с помощью 20 мМ буферного раствора трис-HCl, рН 8,0, содержащего 0,5 мМ ЭГТК, мембраны снова суспендировали в вышеуказанном буферном растворе и сохраняли в виде аликвот при -80°С до дальнейшего использования.
Ферментативную активность МАО-А и МАО-В анализировали в 96-ячеечных планшетах посредством спектрофотометрического анализа, заимствованного из способа, описанного М.Zhou и N.Panchuk-Voloshina (Analytical Biochemistry, т.253, cc.159-164, (1997). В кратком изложении, аликвоты мембран инкубировали в буферном растворе, содержащем 0,1 М фосфата калия, рН 7,4, и различные концентрации соединений в течение 30 минут при 37°С. По истечении этого периода инициировали ферментативную реакцию путем добавления тирамина в качестве субстрата МАО совместно с 1 Ед./мл пероксидазы хрена (Roche Biochemicals) и 80 мкМ N-ацетил-3,7-дигидроксифеноксазина (Amplex Red, Molecular Probes). Образцы инкубировали еще в течение 30 минут при 37°С и окончательном объеме 200 мкл, после чего определяли поглощение при длине волны 570 нм с помощью считывающего устройства для планшетов SpectraMax (Molecular Devices). Фоновое (неспецифическое) поглощение определяли в присутствии 10 мкМ клоргилина в случае МАО-А или 10 мкМ L-депренила в случае МАО-В. Величины IC50 (концентрации вещества, обеспечивающей 50% ингибирование) определяли по кривым ингибирования, полученным исходя из девяти концентраций ингибитора в параллельных опытах, путем аппроксимации данных четырехпараметрическим логистическим уравнением с помощью компьютерной программы.
Соединения по настоящему изобретению являются специфическими ингибиторами МАО-В. Значения IC50 предпочтительных соединений формулы I, измеренные в ходе вышеописанного анализа, находятся в пределах 1 мкМ или меньшей величины, как правило, в пределах 0,1 мкМ или меньшей величины, в идеальном случае 0,02 мкМ или меньшей величины.
Соединения формулы I могут применяться в качестве лекарственных средств, например в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может также быть осуществлено через прямую кишку, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций.
Соединения формулы I могут обрабатываться совместно с фармацевтически инертными неорганическими или органическими носителями для производства фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и другие подобные вещества могут применяться, например, в качестве подобных носителей для таблеток, таблеток в оболочке, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и другие подобные вещества; однако, в зависимости от природы активной субстанции в случае мягких желатиновых капсул обычно не требуется никаких носителей. Подходящими носителями для производства растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и другие подобные вещества. Адъюванты, такие как спирты, полиолы, глицерин, растительные масла и другие подобные соединения, могут быть использованы для приготовления водных растворов для инъекций водорастворимых солей соединений формулы I, но, как правило, не являются необходимыми. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и другие подобные вещества.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие средства, эмульгаторы, подсластители, красители, ароматизаторы, соли для варьирования осмотического давления, буферные растворы, маскирующие средства или антиоксиданты. Они могут также содержать другие терапевтически полезные вещества.
Как было упомянуто ранее, лекарственные средства, содержащие соединение формулы I и терапевтически инертный наполнитель, также являются объектом настоящего изобретения, равно как и способ производства подобных лекарственных средств, включающий превращение одного или нескольких соединений формулы I и, если это требуется, одного или нескольких других терапевтически полезных веществ в дозированную галеновую форму совместно с одним или несколькими терапевтически инертными носителями.
Дозировка может варьироваться в широких пределах и будет, конечно, приспосабливаться к индивидуальным требованиям в каждом конкретном случае. В общем, эффективная дозировка для перорального или парентерального введения находится в пределах 0,01-20 мг/(кг·день), причем дозировка в пределах 0,1-10 мг/(кг·день) является предпочтительной для всех описанных показаний. Суточная дозировка для взрослого человека с массой тела 70 кг находится, соответственно, в пределах 0,7-1400 мг в сутки, предпочтительно от 7 до 700 мг в сутки.
Следующие примеры даны для иллюстрации настоящего изобретения. Их следует рассматривать не как ограничивающие объем изобретения, а как представляющие изобретение. Аббревиатура «КТ» означает «комнатная температура».
Пример 1: (RS)-N-{1-[4-(3-фторбензилокси)фенил]-5-оксопирролидин-3-ил}ацетамид
а) (RS)-1-(4-бензилоксифенил)-5-оксопирролидин-3-карбоновая кислота
Смешивают 18,8 г (94,4 ммоль) 4-бензилоксианилина с 12,28 г (94,4 ммоль) итаконовой кислоты. Твердую смесь нагревают до температуры 130°С. Через 20 минут расплавленный материал затвердевает. После охлаждения полученное твердое вещество растирают с этилацетатом, что приводит к 28,26 г (96% от теоретического) (RS)-1-(4-бензилоксифенил)-5-оксопирролидин-3-карбоновой кислоты в виде сероватого твердого вещества. Масс-спектр (МС): m/e=311 (М)+.
б) (RS)-1-[4-бензилоксифенил]-5-оксопирролидинкарбонилхлорид
Суспензию 9,50 г (30,5 ммоль) (RS)-1-[4-(3-бензилокси)фенил]-5-оксопирролидин-3-карбоновой кислоты в 100 мл дихлорметана обрабатывают 13,3 мл (183 ммоль) тионилхлорида при КТ в течение 18 часов. Для получения конечного продукта реакционную смесь упаривают досуха при пониженном давлении, затем диспергируют остаток в толуоле и снова упаривают досуха, что приводит к количественному выходу (RS)-1-[4-бензилоксифенил]-5-оксопирролидин-карбонилхлорида в виде желтоватого твердого вещества, которое используют на следующей стадии без дополнительной очистки и характеризации.
в) Трет-бутиловый эфир (RS)-[1-(4-бензилоксифенил)-5-оксопирролидин-3-ил]карбаминовой кислоты
Раствор 0,20 г (0,6 ммоль) (RS)-1-(4-бензилоксифенил)-5-оксопирролидин-3-карбонилхлорида в 12 мл толуола охлаждают до 0°С и добавляют 0,058 г (0,9 ммоль) азида натрия. Реакционной смеси дают нагреться до КТ и продолжают перемешивание в течение 1 часа. После этого смесь нагревают до температуры 80°С, добавляют 1,88 мл (20 ммоль) трет-бутанола и продолжают перемешивание еще в течение 1 часа. Для получения конечного продукта смесь охлаждают, разбавляют этилацетатом и последовательно экстрагируют насыщенным раствором бикарбоната натрия, водой и соляным раствором. Органическую фазу сушат над сульфатом натрия и упаривают при пониженном давлении, что приводит к неочищенному соединению в виде коричневатого твердого вещества. Полученный материал подвергают хроматографической очистке на силикагеле, используя смесь 2:1 н-гексана и этилацетата в качестве элюента. Получают 0,13 г (55% от теоретического) трет-бутилового эфира (RS)-[1-(4-бензилоксифенил)-5-оксопирролидин-3-ил]карбаминовой кислоты в виде твердого вещества белого цвета. МС: m/e=400 (М+NH4)+.
г) Трет-бутиловый эфир (RS)-[1-(4-гидроксифенил)-5-оксопирролидин-3-ил]карбаминовой кислоты
Раствор 82 мг (0,2 ммоль) трет-бутилового эфира (RS)-[1-(4-бензилоксифенил)-5-оксопирролидин-3-ил]карбаминовой кислоты в 2 мл тетрагидрофурана (ТГФ) гидрируют в присутствии 7 мг палладия на угле (10%) при давлении окружающей среды и КТ в течение 18 часов. Для получения конечного продукта реакционную смесь фильтруют над дикалитом, а затем упаривают пр