Вакцина против hcv
Иллюстрации
Показать всеИзобретение относится к способам и композициям, полезным для предупреждения и лечения инфекций, вызванных вирусом гепатита С (HCV). Предложены ДНК-вакцина против HCV, содержащая полинуклеотидные последовательности, кодирующие белки HCV, способ предупреждения и лечения HCV-инфекции, способ вакцинации индивида, а также применение вышеуказанной вакцины для изготовления лекарства. Изобретение может быть использовано для лечения или предупреждения HCV. 5 н. и 19 з.п. ф-лы, 23 ил.
Реферат
Настоящее изобретение относится к способам и композициям, полезным для лечения и предупреждения инфекций, вызванных вирусом гепатита С (HCV), и симптомов и заболеваний, ассоциированных с ними. В частности, настоящее изобретение относится к ДНК-вакцинам, содержащим полинуклеотидные последовательности, кодирующие белки HCV, и способам лечения индивидуумов, инфицированных HCV, включающим введение вакцин по настоящему изобретению.
HCV был идентифицирован недавно как главный причинный агент посттрансфузионного и внебольничного заражения гепатитом "ни А, ни В". Приблизительно 170 млн людей хронически инфицированы HCV с частотой заболеваний от 1 до 10%. Расходы на медицинскую помощь в США, где частота заболеваний составляет 1,8%, оцениваются в 2 миллиарда долларов. 40-60% случаев заболеваний печени обусловлены HCV и 30% трансплантаций в Великобритании обусловлены HCV-инфекциями. Хотя изначально HCV-инфекция является бессимптомной, у более чем 90% пациентов развивается хроническое заболевание. Патологический процесс обычно развивается из хронического активного гепатита (70%), фиброза, цирроза (40%) в гепатоцеллюлярную карциному (60%). Средняя продолжительность процесса от инфицирования до развития цирроза или гепатоцеллюлярной карциномы составляет 20 лет (Lauer G. and Walker В. 2001, Hepatitis C virus Infection. N. Engl. J. Med. 345, 41, Cohen J. 2001. The Scientific challenge of Hepatitis C. Science 285 (5424) 26).
Существует большая потребность в улучшенном лечении HCV. В настоящее время нет доступных низкомолекулярных ингибиторов репликации. Широко распространенный золотой стандарт рибовирина и пегилированного интерферона является основой при лечении HCV-инфекции. Однако доступные в настоящее время схемы лечения дают недостаточную защитную реакцию (в целом уровень реакции составляет 50% вплоть до 6 месяцев, однако для генотипа 1b уровень реакции ниже (27%)). Кроме того, это лечение связано с неприятными побочными эффектами. Это приводит к значительному снижению эффективности, особенно после первых 6 месяцев лечения.
В нескольких исследованиях показано, что индивидуальные белки HCV являются иммуногенными в нормальных мышах, включая последующую иммунизацию с использованием ДНК. Несколько вакцин для профилактики или лечения HCV в настоящее время проходят клинические испытания. Наиболее перспективные, в которых используются оболочечные белки Е1 или Е2, в настоящее время находятся в фазе 2 в Chiron и Innogenetics. Эпитопная вакцина, разрабатываемая Transvax, также находится в фазе 2. Несколько вакцин, в которых используют последовательности из коровых (core) и неструктурных антигенов с применением разнообразных систем доставки, включая ДНК, находятся на стадии доклинической разработки.
HCV является вирусом из семейства флавивирусов с нитью РНК, имеющей положительную полярность, чей геном имеет длину 9,4 т.п.н. с одной открытой рамкой считывания. Геном HCV транслируется в виде единственного полипротеина, который затем подвергается процессингу под действием хозяйских и вирусных протеаз с образованием структурных белков (core, оболочечных Е1 и Е2, и р7) и шести неструктурных белков с различными ферментативными активностями. Геном изолята HCV J4L6, который является примером генотипа 1b, имеет регистрационный номер AF054247 (Yanagi M., St Claire M., Shapiro M., Emerson S.U., Purcell R.H. and Bukh J. "Transcripts of a chimeric cDNA clone of hepatitis С virus genotype 1b are infectious in vivo". Virology 244 (1), 161-172 (1998)) и показан на Фиг.1 (а-д).
Оболочечные белки отвечают за распознавание, связывание и проникновение вируса в клетки-мишени. Главные неструктурные белки, вовлеченные в репликацию вируса, включают NS2 (Zn-зависимую металлопротеиназу), NS3 (сериновую протеазу/геликазу), NS4A (кофактор протеазы), NS5A и NS5B (РНК-полимеразу) (Bartenschlager В and Lohmann V. 2000. Replication of hepatitis С virus. J. Gen. Virol. 81, 1631).
Структура полипротеина HCV может быть представлена следующим образом (цифры относятся к положению первой аминокислоты каждого белка; полноразмерный полипротеин изолята J4L6 включает 3010 аминокислот):
| Core 1-191 | E1 | E2 | Р7 | NS2 | NS3 1027-1657 | NS4A | NS4B 1712-1972 | NS5A | NS5B 2420-3010 |
Вирус обладает высокой скоростью мутаций, и на основе нуклеотидной последовательности консервативных и неконсервативных областей было определено по меньшей мере шесть основных генотипов. Однако существует дополнительная гетерогенность, поскольку HCV, выделенный из одного пациента, всегда представляет собой смесь близкородственных геномов, или квази-видов.
Геном HCV демонстрирует высокую степень генетической изменчивости и был разделен на 6 основных генотипов (1а, 1b, 2, 3, 4, 5 и 6). Генотипы 1а, 1b, 2 и 3 наиболее распространены в Европе, Северной и Южной Америке, Азии, Китае, Японии и Австралии. Генотипы 4 и 5 преобладают в Африке, а генотип 6 - в Юго-Восточной Азии.
Поэтому существует большая потребность в улучшенных способах лечения HCV-инфекции, а также в обеспечении способов лечения, различающихся по способности лечить некоторые генотипы HCV. В первом аспекте настоящего изобретения предложены новые вакцинные препараты, различающиеся по их защитному действию в отношении различных генотипов.
Описаны вакцины против HCV, содержащие полинуклеотиды, кодирующие один или более чем один белок HCV. Вакцины, содержащие плазмидную ДНК или Semliki Forest Virus векторы, кодирующие NS3, описаны Brinster с соавт. (2002, Journal of General Virology, 83, 369-381). Полинуклеотидные вакцины, кодирующие NS5B, раскрыты в WO 99/51781. Кодон-оптимизированные гены и содержащие их вакцины, кодирующие E1, слитые белки Е1+Е2, белки NS5A и NS5B HCV, описаны в WO 97/47358. WO 01/04149 раскрывает полипептиды или полинуклеотиды, кодирующие мозаичные эпитопы HCV, происходящие из core, NS3, NS4 или NS5A. Слитые белки и ДНК, кодирующая такие слитые белки, содержащие NS3, NS4, NS5A и NS5B, которые полезны для получения вакцин, описаны в WO 01/30812; полагают, что слитые белки могут включать фрагменты core-белка. WO 03/031588 описывает пригодный для использования в качестве вакцины аденовирусный вектор, который кодирует белки NS3-NS4A-NS4B-NS5A-NS5B HCV.
В WO 96/37606 описаны вакцины, содержащие полипептиды, включающие "непроцессированный" core-белок и неструктурный белок.
Настоящее изобретение относится к получению полинуклеотидной вакцины, которая кодирует белки HCV: core, NS3, NS4B и NS5B. Полинуклеотидные вакцины по настоящему изобретению не кодируют белок NS4A HCV и/или белок NS5A. Предпочтительно полинуклеотидные вакцины по настоящему изобретению кодируют белки HCV: core, NS3, NS4B и NS5B, но не другие белки HCV. В настоящем изобретении также предложено применение полинуклеотидной вакцины, кодирующей эти антигены, в медицине и в изготовлении лекарства для лечения или предупреждения HCV-инфекции.
Полинуклеотидные последовательности, используемые в вакцинах по настоящему изобретению, представляют собой предпочтительно последовательности ДНК.
Полинуклеотиды, кодирующие белки HCV, могут быть во многих комбинациях или конфигурациях. Например, белки могут быть экспрессированы в виде индивидуальных белков или слитых белков. Примером слияния, которое может происходить как на уровне ДНК, так и на уровне белка, обычно является двойное слияние, состоящее из одного полипептида или полинуклеотида, содержащего или кодирующего аминокислотные последовательности NS4B и NS5B (NS4B-NS5B); тройное слияние, содержащее или кодирующее аминокислотные последовательности NS3-NS4B-NS5B, или слияние всех четырех антигенов по настоящему изобретению (Core-NS3-NS4B-NS5B).
Предпочтительные слияния по настоящему изобретению представляют собой полинуклеотиды, кодирующие двойное слияние между NS4B и NS5B (NS4B-NS5B или NS5B-NS4B); и между core и NS3 (NS3-Core или Core-NS3). Предпочтительные тройные слияния представляют собой полинуклеотиды, кодирующие аминокислотные последовательности NS3-NS4B-NS5B.
Полинуклеотиды по настоящему изобретению, кодирующие единичные антигены или слитые белки, могут быть представлены в виде единичных или множественных экспрессирующих векторов. Предпочтительно полинуклеотиды, кодирующие каждый антиген, представлены в одном и том же экспрессирующем векторе или плазмиде. В данном контексте полинуклеотиды, кодирующие белки HCV, могут находиться в единичной экспрессионной кассете или во множественных последовательно соединенных экспрессионных кассетах.
Для оптимизации экспрессии других белков HCV полинуклеотид, кодирующий core-белок HCV, предпочтительно находится в экспрессионной кассете, которая расположена в прямом направлении относительно экспрессионной кассеты, содержащей полинуклеотид, кодирующий по меньшей мере один другой белок HCV. Предпочтительно core-белок HCV находится в экспрессионной кассете, которая расположена в прямом направлении относительно экспрессионной кассеты, содержащей полинуклеотид, кодирующий NS5B.
Полипептиды, кодируемые олигонуклеотидными вакцинами по настоящему изобретению, могут содержать полноразмерную аминокислотную последовательность или, альтернативно, данные полипептиды могут быть короче, чем полноразмерные белки, в том смысле, что они содержат достаточную часть полноразмерной полинуклеотидной последовательности, которая позволяет экспрессировать продукт укороченного гена с целью получения иммунного ответа, дающего перекрестную реакцию с полноразмерным белком. Например, полинуклеотид по изобретению может кодировать фрагмент белка HCV, представляющий собой укороченный белок HCV, в котором участки исходной последовательности были делегированы, при этом конечный фрагмент содержит менее 90% исходной полноразмерной аминокислотной последовательности и, возможно, менее 70% или менее 50% исходной последовательности. Иными словами, считают, что полинуклеотид, кодирующий фрагмент длиной по меньшей мере 8, например 8-10 аминокислот или вплоть до 20, 50, 60, 70, 80, 100, 150 или 200 аминокислот, находится в пределах объема данного изобретения до тех пор, пока кодируемый им олиго- или полипептид демонстрирует HCV-антигенность. В частности, но не исключительно, данный аспект изобретения охватывает ситуацию, когда полинуклеотид кодирует фрагмент полной белковой последовательности HCV и может представлять один или более различных эпитопов данного белка.
В предпочтительных вакцинах по настоящему изобретению по меньшей мере один и предпочтительно все полипептиды HCV инактивированы в результате укорочения или мутации. Например, геликазная и протеазная активности NS3 предпочтительно снижены или аннулированы мутацией в соответствующем гене. Предпочтительно NS5В-полимеразная активность экспрессируемого полипептида снижена или аннулирована в результате мутации. Предпочтительно NS4В-активность экспрессируемого полипептида снижена или аннулирована в результате мутации. Предпочтительно активность core-белка экспрессируемого полипептида снижена или аннулирована в результате укорочения или мутации. В этом смысле мутация может быть результатом вставки, делеции, замены или перестройки в полинуклеотиде, кодирующем полипептид. Альтернативно, полноразмерная последовательность может быть экспрессирована в виде двух или более отдельных частей.
Функциональная структура и ферментативная функция полипептидов NS3 и NS5B HCV описаны в данной области техники.
NS5B был описан как РНК-зависимая РНК-полимераза (Qin et al., 2001, Hepatology, 33, р. 728-737; Lohmann et al., 2000, Journal of Viral Hepatitis; Lohmann et al., 1997, Nov., Journal of Virology, 8416-8428; De Francesco et al., 2000, Seminars in Liver Disease, 20(1), 69-83). Было показано, что полипептид NS5B имеет четыре функциональных мотива А, В, С и D.
Предпочтительно последовательность полипептида NS5B, кодируемую полинуклеотидными вакцинами по настоящему изобретению, подвергают мутации для того, что уменьшить или удалить РНК-зависимую РНК-полимеразную активность. Предпочтительно этот полипептид подвергают мутациям с целью нарушения мотива А NS5B, например, путем замены аспарагиновой кислоты (D) в положении 2639 на глицин (G); или замены аспарагиновой кислоты (D) в положении 2644 на глицин (G). Предпочтительно полипептид NS5B, кодируемый вакцинным полинуклеотидом, содержит обе эти мутации по аспарагиновой кислоте.
Предпочтительно кодируемый NS5B содержит нарушение в своем мотиве С. Например, мутация D2737, инвариантного остатка аспарагиновой кислоты, на Н, N или Е приводит к полной инактивации NS5B.
Предпочтительно NS5B, кодируемый ДНК-вакцинами по настоящему изобретению, содержит мутацию в мотиве А, который может возможно содержать мутацию в мотиве С. Предпочтительные мутации в мотиве А включают замену аспарагиновой кислоты (D) 2639 на глицин и аспарагиновой кислоты (D) 2644 на глицин. Предпочтительно присутствуют обе мутации. Кроме того, могут присутствовать дополнительные консенсусные мутации, как изложено ниже в Примере 1.
Было описано, что NS3 имеет и протеазную, и геликазную активность. Предпочтительно полипептиды NS3, кодируемые ДНК-вакцинами по настоящему изобретению, имеют мутации, нарушающие и протеазную, и геликазную активности NS3. Известно, что протеазная активность NS3 связана с "каталитической триадой" Н-1083, D-1107 и S-1165. Предпочтительно NS3, кодируемый вакцинами по настоящему изобретению, содержит мутацию в остатках каталитической триады, и наиболее предпочтительно NS3 содержит единичную точечную мутацию с заменой серина 1165 на валин (De Francesco R., Pessi, A and Steinkuhler С. 1998. The hepatitis С Virus NS3 proteinase: structure and function of zinc containing proteinase. Anti-Viral Therapy 3, 1-18).
Структура и функция NS3 могут быть представлены следующим образом:
| Протеаза | Геликаза | |||
| Каталитическая триада: | ||||
| Н-1083 | Установленные функциональные мотивы: | |||
| D-1107 | I | II | III | IV |
| S-1165 | GKS | DECH | TAT | QRrGRtGR |
Было идентифицировано четыре важных мотива, ответственных за геликазную активность NS3 - I, II, III и IV. Предпочтительно NS3, кодируемый ДНК-вакцинами по настоящему изобретению, содержит нарушающие мутации по меньшей мере в одном из этих мотивов. Более предпочтительно, когда имеется замена аспарагиновой кислоты 1316 на глутамин (Paolini С., Lahm A., De Francesco R. and Gallinari P. 2000, Mutational analysis of hepatitis С virus NS3-associated helicase. J. Gen. Virol. 81, 1649). Ни одна из этих наиболее предпочтительных мутаций NS3, S1165V или D1316Q не находится в пределах известных или предсказанных Т-клеточных эпитопов.
Наиболее предпочтительно, когда полипептид NS3, кодируемый ДНК-вакцинами по настоящему изобретению, содержит мутацию: серин (S) 1165 на валин (V) и аспарагиновая кислота (D) 1316 на глутамин (Q). Дополнительно может присутствовать одна или более чем одна консенсусная мутация, как изложено в Примере 1.
Биологические функции core-белка HCV являются сложными и не коррелируют с отдельными точечными мутациями (McLauchlan J. 2000. Properties of the hepatitis С virus core protein: a structural protein that modulate cellular processes. J. of Viral Hepatitis 7, 2-4). Имеются доказательства того, что core непосредственно взаимодействует с рецептором лимфотоксина β, а также может вмешиваться в NFkB- и PKR-пути и может оказывать влияние на клеточное выживание и апоптоз. Обнаружили, что рекомбинантная конструкция на основе вируса коровьей оспы, экспрессирующая core, ингибирует клеточные ответы на вирус коровьей оспы, делая его более вирулентным in vivo.
Во время инфицирования core-белок из вирусного полипротеина расщепляется по двум сайтам под действием протеаз клетки-хозяина. Первое расщепление, которое происходит в положении 191, дает N-терминальный конец Е1. Остаток, по которому происходит второе расщепление, точно не установлен и находится в интервале между аминокислотами 174 и 191, в результате чего высвобождается короткая последовательность core-пептида длиной приблизительно 17 аминокислот (McLauchlan J. (2000) J. Viral Hepatitis. 7, 2-14; Yasui К, Lau JYN, Mizokami M., et al., J. Virol. 1998. 726048-6055).
Core-полипептиды, используемые в вакцинах по настоящему изобретению, находятся как в полноразмерной, так и в укороченной форме. Core-полипептид может быть полноразмерным, но его последовательность перегруппирована таким образом, чтобы аннулировать какую-либо активность core-белка. Core-полипептид может быть расщеплен по меньшей мере на два фрагмента и наиболее предпочтительно образует полипептид, содержащий core-аминокислоты 66-191, следующие за аминокислотами 1-65, и, альтернативно, core-аминокислоты 105-191, следующие за core-аминокислотами 1-104.
Для минимизации отрицательного эффекта core на продукцию других белков HCV в той же клетке наиболее предпочтительно, чтобы используемый core-белок представлял собой укороченный белок. В предпочтительном аспекте настоящего изобретения кодируемый core-белок укорачивают с карбокситерминального конца на величину, достаточную для уменьшения ингибиторного эффекта core на экспрессию других белков HCV. Наиболее предпочтительно core-белок укорачивают с карбокситерминального конца таким образом, что в последовательности продуцируемого белка отсутствует высвобождающаяся в природных условиях С-концевая пептидная последовательность, появляющаяся в результате второго расщепления core; более предпочтительно, когда в белке отсутствуют по меньшей мере последние 10 аминокислот, предпочтительно отсутствуют по меньшей мере последние 15 аминокислот, более предпочтительно отсутствуют последние 20 аминокислот, более предпочтительно отсутствуют последние 26 аминокислот и наиболее предпочтительно отсутствуют последние 40 аминокислот. Наиболее предпочтительными полинуклеотидами, кодирующими core, которые подходят для использования в настоящем изобретении, являются те, которые кодируют укороченный core, содержащий аминокислоты 1-171, 1-165, 1-151. Наиболее предпочтительным полинуклеотидом, кодирующим core, который подходит для использования в настоящем изобретении, является такой, который кодирует укороченный core-белок между аминокислотами 1-151. Может присутствовать одна или более чем одна консенсусная мутация, как изложено в Примере 1.
Предпочтительный полипептид NS4B, кодируемый полинуклеотидами по настоящему изобретению, содержит N-терминальное укорочение для удаления участка, который является гипервариабельным среди изолятов и генотипов HCV. Предпочтительно полипептид NS4B содержит делецию 30-100 аминокислот с N-конца, более предпочтительно 40-80 аминокислот и наиболее предпочтительно делецию первых 48 N-концевых аминокислот (в контексте изолята J4L6 это соответствует укорочению по аминокислоте 1760, что означает потерю первых 48 аминокислот NS4B; эквивалентные укорочения в других изолятах HCV также составляют часть настоящего изобретения). Кроме того, последовательность NS4B может быть разделена на два или более фрагментов и экспрессирована с образованием полипептида, имеющего последовательность NS4B, организованную в другом порядке по сравнению с последовательностью, обнаруженной в молекуле дикого типа.
Полинуклеотиды, которые присутствуют в вакцинах по настоящему изобретению, могут содержать природную нуклеотидную последовательность, которая обнаружена у вируса HCV, однако предпочтительно, чтобы нуклеотидная последовательность была кодон-оптимизированной для экспрессии в клетках млекопитающих.
В дополнение к кодоновой оптимизации предпочтительно, чтобы использование кодонов в полинуклеотидах по настоящему изобретению, кодирующих core, NS3, NS4B и NS5B HCV, было изменено таким образом, чтобы редкие кодоны не появлялись в концентрированных кластерах и были, наоборот, либо относительно случайно распределены по всей полинуклеотидной последовательности, либо исключены из кодон-оптимизированного гена.
Код ДНК состоит из 4 букв (А, Т, С и G) и использует их для составления трехбуквенных "кодонов", которые отображают аминокислоты белков, закодированных в генах организма. Линейная последовательность кодонов вдоль молекулы ДНК транслируется в линейную последовательность аминокислот в белке(ах), кодируемом этими генами. Код является сильно вырожденным с 61 кодоном, кодирующим 20 природных аминокислот, и 3 кодонами, представляющими "стоп"-сигналы. Таким образом, большинство аминокислот кодируется более чем одним кодоном - фактически некоторые кодируются четырьмя или более различными кодонами.
Отмечено, что когда в распоряжении имеется более чем один кодон для кодирования данной аминокислоты, то картины использования кодонов в организмах являются далеко не случайными. Различные виды демонстрируют различное отклонение в выборе ими кодонов, и, более того, использование кодонов может заметно различаться в пределах одного вида между генами, которые экспрессируются с высокими и низкими уровнями. Такое отклонение различно в вирусах, растениях, бактериях и клетках млекопитающих, и некоторые виды демонстрируют более строгое, по сравнению со случайным, отклонение в выборе кодонов, чем другие виды. Например, у людей и других млекопитающих это отклонение является менее строгим, чем у некоторых видов бактерий или вирусов. По этим причинам существует большая вероятность того, что ген млекопитающих, экспрессируемый в E. coli, или вирусный ген, экспрессируемый в клетках млекопитающих, будет иметь неподходящее для эффективной экспрессии распределение кодонов. Однако ген с картиной использования кодонов, подходящей для экспрессии в Е. coli, также может эффективно экспрессироваться в клетках человека. Считают, что присутствие в гетерологической последовательности ДНК кластеров кодонов, которые редко наблюдаются у хозяина, в клетках которого происходит экспрессия, является прогностическим признаком низких уровней гетерологичной экспрессии в клетках этого хозяина.
Существует несколько примеров, в которых замена кодонов, которые редко встречаются в клетках хозяина, на кодоны, которые предпочитаются хозяином ("оптимизация кодонов"), усиливала уровни гетерологичной экспрессии, например поздние гены L1 и L2 BPV (вирус папилломы быка) были подвергнуты оптимизации кодонов относительно картин использования кодонов у млекопитающих, и было показано, что это приводит к повышенным уровням экспрессии в культуре клеток млекопитающих (Cos-1) по сравнению с последовательностями BPV дикого типа (Zhou et. al. J. Virol. 1999. 73, 4972-4982). В этой работе каждый кодон BPV, который присутствовал более чем в два раза чаще в BPV, чем в клетках млекопитающих (коэффициент использования более 2), и большинство кодонов с коэффициентом использования более 1,5 были консервативно заменены кодоном, предпочтительно используемым у млекопитающих. В WO 97/31115, WO 97/48370 и WO 98/34640 (Merk&Co., Inc.) было показано, что кодоновая оптимизация генов или сегментов генов ВИЧ приводит к усилению экспрессии белка и улучшенной иммуногенности в том случае, когда кодон-оптимизированные последовательности используются в качестве ДНК-вакцин в млекопитающем-хозяине, для которого разрабатывалась оптимизация. Согласно этим документам последовательности полностью состояли из оптимизированных кодонов (за исключением тех случаев, когда это привело бы к образованию нежелательного сайта рестрикции, сайта сплайсинга интрона и т.д.), так как каждый вирусный кодон консервативно заменяли оптимальным кодоном для предполагаемого хозяина.
Термин "картина использования кодонов" относится к средним частотам для всех кодонов в рассматриваемых нуклеотидной последовательности, гене или классе генов (например высокоэкспрессируемых генах млекопитающих). Картину использования кодонов для млекопитающих, включая людей, можно найти в литературе (см., например, Nakamura et al. Nucleic Acids Research 1996, 24: 214-215).
В полинуклеотидах по настоящему изобретению картина использования кодонов предпочтительно отличается от таковой, типичной для HCV, тем, что чаще представлено отклонение в использовании кодонов для организма-мишени, например E. coli или млекопитающего, в частности человека. "Коэффициент использования кодонов" или индекс адаптации кодонов (Sharp P.M., Li W.H. Nucleic Acids Research. 15 (3): 1281-95, 1987) является мерой того, насколько близко картина использования кодонов данной полинуклеотидной последовательности напоминает таковую в видах-мишенях. Частоты встречаемости кодонов для каждого из 61 кодона (выраженные как количество случаев наблюдения на 1000 кодонов для выбранного класса генов) нормируют для каждой из двадцати природных аминокислот таким образом, что величину для наиболее часто используемого кодона для каждой аминокислоты принимают за 1, а частоты для менее распространенных кодонов пропорционально наносят на шкалу в интервале от нуля до 1. Таким образом, каждому из 61 кодона присваивают величину, равную 1 или ниже для высокоэкспрессируемых генов видов-мишеней. Эту величину обозначают как показатель предпочтения (W). Для того чтобы подсчитать коэффициент использования кодонов для конкретного полинуклеотида относительно высокоэкспрессируемых генов этого вида, отмечают нормированную величину для каждого кодона конкретного полинуклеотида и берут среднее геометрическое всех этих величин (путем деления суммы натуральных логарифмов этих величин на общее количество кодонов и взятия антилогарифма). Этот коэффициент будет иметь величину в интервале от нуля до 1, и чем выше коэффициент, тем больше кодонов в полинуклеотиде являются часто используемыми кодонами. Если полинуклеотидная последовательность имеет коэффициент использования кодонов, равный 1, то все кодоны являются "наиболее частыми" кодонами для высокоэкспрессируемых генов видов-мишеней.
Согласно настоящему изобретению предложены полинуклеотидные последовательности, кодирующие аминокислотные последовательности core, NS3, NS4B или NS5B HCV, где картина использования кодонов полинуклеотидной последовательности похожа на таковую для высокоэкспрессируемых генов млекопитающих. Предпочтительно полинуклеотидная последовательность является последовательностью ДНК. Желательно, чтобы картина использования кодонов полинуклеотидной последовательности была похожа на таковую для высокоэкспрессируемых генов человека.
Кодон-оптимизированная полинуклеотидная последовательность, кодирующая core HCV (1-191), показана на Фиг.2. Кодон-оптимизированная полинуклеотидная последовательность, кодирующая NS3 HCV, содержащая полипептидные мутации S1165V и D1316Q, показана на Фиг.3. Кодон-оптимизированная полинуклеотидная последовательность, кодирующая NS4B HCV, содержащая N-концевое укорочение 1-48 полипептида, показана на Фиг.4. Кодон-оптимизированная полинуклеотидная последовательность, кодирующая NS5B HCV, содержащая полипептидные мутации D2639G и D2644G, показана на Фиг.5.
Таким образом, предложен синтетический ген, содержащий большое количество кодонов, совместно кодирующих аминокислотные последовательности core, NS3, NS4B или NS5B HCV, где выбор возможных кодонов, используемых для кодирования аминокислотной последовательности, изменен таким образом, чтобы иметь сходство с оптимальным вариантом использования кодонов у млекопитающих, так что частота использования кодонов в синтетическом гене более близка к таковой у высокоэкспрессируемых генов млекопитающих, чем у генов вируса гепатита С. Предпочтительно картина использования кодонов по существу такая же, как у высокоэкспрессируемых генов человека. "Природные" последовательности core, NS3, NS4B и NS5B HCV были проанализированы на предмет использования кодонов. Коэффициент использования кодонов для белков HCV составляет: core (0,487), NS3 (0,482), NS4B (0,481) и NS5B (0,459). Полинуклеотид по настоящему изобретению в общем случае будет иметь коэффициент использования кодонов (как определено выше) для высокоэкспрессируемых генов человека более чем 0,5, предпочтительно более чем 0,6, наиболее предпочтительно более чем 0,7, но менее 1. Желательно, когда полинуклеотид будет также иметь коэффициент использования кодонов для высокоэкспрессируемых генов E. coli более чем 0,5, предпочтительно более чем 0,6, наиболее предпочтительно более чем 0,7.
В дополнение к кодоновой оптимизации синтетические гены также подвергают мутациям таким образом, чтобы исключить появление кластеров редких кодонов. Это может быть достигнуто одним из двух путей. Предпочтительный путь достижения этого заключается в исключении редких кодонов из генной последовательности. Согласно одному способу определения редкими кодонами будут кодоны, представляющие менее 20% кодонов, используемых для конкретной аминокислоты, и предпочтительно менее 10% кодонов, используемых для конкретной аминокислоты в высокоэкспрессируемых генах организма-мишени. Альтернативно, редкие кодоны могут быть определены как кодоны с относительной величиной использования синонимичных кодонов (RSCU) менее 0,3 или предпочтительно менее 0,2 в высокоэкспрессируемых генах организма-мишени. Величина RSCU представляет собой наблюдаемое количество кодонов, деленное на ожидаемое количество, если все кодоны для данной аминокислоты были использованы с одинаковой частотой. Соответствующее определение редкого кодона будет очевидно для специалиста в данной области техники.
Альтернативно, полинуклеотиды core, NS3, NS4B и NS5B HCV оптимизируют таким образом, чтобы предотвратить кластеризацию редких, неоптимальных кодонов, присутствующих в концентрированных областях. Поэтому полинуклеотиды оптимизируют таким образом, чтобы отдельные редкие кодоны, такие как кодоны с RSCU менее 0,4 (и более предпочтительно с RSCU менее 0,3) равномерно располагались на всем протяжении полинуклеотидов.
Было показано, что уровни экспрессии кодон-оптимизированных мутантных core, NS3 и NS5B увеличены по сравнению с диким типом, как определено вестерн-блоттингом. Укороченный кодон-оптимизированный NS4B был экспрессирован в виде слияния с NS5B, и это слияние экспрессируется хорошо.
Вакцины по настоящему изобретению могут включать вектор, который направляет индивидуальную экспрессию полипептидов HCV, альтернативно полипептиды HCV могут быть экспрессированы в виде одного или более слитых белков.
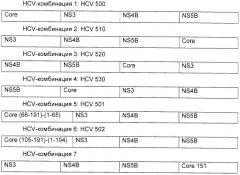
Предпочтительные вакцины по настоящему изобретению включают тетра-слияния либо на уровне белков, либо на уровне полинуклеотидов, в том числе:
Другие предпочтительные слияния аналогичны HCV-комбинациям 1, 2 и 3, но в них core-белок представляет собой укороченный core-белок, типично Core1-151. Другие предпочтительные вакцины по настоящему изобретению представлены ниже и включают полинуклеотидные двойные и тройные слияния, представленные в различных экспрессионных кассетах в пределах одной плазмиды, при этом каждая кассета находится под контролем независимой промоторной единицы (например, IE HCMV) (показано стрелкой). Такие двойные промоторные конструкции управляют экспрессией четырех белковых антигенов в виде двух отдельных белков (как показано ниже) в одной и той же клетке.
Предпочтительными конструкциями являются HCV-комбинации 7, 9, 11 или 12. Особенно предпочтительны 7 и 11.
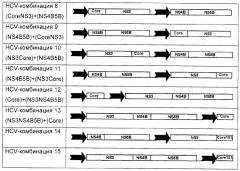
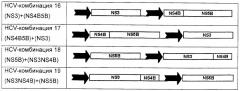
В альтернативном аспекте настоящего изобретения полинуклеотидные вакцины возможно не содержат полинуклеотид, кодирующий core-белок. Например, предпочтительные полинуклеотиды по этому аспекту настоящего изобретения включают:
Для представленных выше HCV-комбинаций 8-19 подразумевается, что используемая терминология, например (CoreNS3)+(NS4B5B), раскрывает полинуклеотидный вектор, содержащий две экспрессионные кассеты, каждая из которых управляется независимо индивидуальным промотором, и в случае этого примера содержащий одну экспрессионную кассету, кодирующую двойной слитый белок CoreNS3, и другую, кодирующую двойной слитый белок NS4B-NS5B. Каждую HCV-комбинацию 8-19 следует интерпретировать соответственно.
В представленных выше HCV-комбинациях 1-19 раскрыты относительные ориентации белков, полипротеиновых слияний или полинуклеотидов HCV. В частности, в данном описании также раскрыто, что все представленные выше HCV-комбинации 1-19 также раскрыты с каждой из предпочтительных мутаций или укорочений для удаления активности входящих в состав белков. Например, предпочтительные варианты комбинаций 1-19 (если не указано иначе в обратном смысле) включают нуклеотидные последовательности для core (1-191 (целую последовательность, но разделенную при этом на два или более фрагментов с ограниченной биологической активностью), или предпочтительно core, представленный в своих укороченных формах 1-151, или 1-165, или 1-171); NS3 1027-1657 (мутации с целью инактивации геликазной (аспарагиновая кислота 1316 на глутамин) и протеазной (серин 1165 на валин) активности; NS5B 2420-3010 (мутация с заменой аспарагиновой кислоты 2639 на глицин и аспарагиновой кислоты 2644 на глицин, мотив А, для инактивации полимеразной активности); и NS4B 1712-1972 (возможно укороченный до 1760-1972 с удалением N-концевого высоковариабельного фрагмента).
Согласно настоящему изобретению предложены новые ДНК-вакцины и полипептиды, которые описаны выше. Кроме того, в настоящем изобретении предложены аналоги описанных полипептидов и содержащие их ДНК-вакцины.
Термин "аналог" относится к полинуклеотиду, который кодирует ту же аминокислотную последовательность, что и другой полинуклеотид по настоящему изобретению, но который, вследствие избыточности генетического кода, имеет отличающуюся нуклеотидную последовательность, сохраняющую при этом ту же самую картину использования кодонов, например, имеющую тот же самый коэффициент использования кодонов или коэффициент использования кодонов в пределах 0,1, предпочтительно в пределах 0,05 от такового для другого полинуклеотида.
Полинуклеотидные последовательности HCV могут быть получены из любых различных генотипов, штаммов или изолятов HCV. Изоляты HCV можно классифицировать на следующие шесть основных генотипов, содержащих один или более подтипов: HCV 1 (1а, 1b или 1с), HCV 2 (2а, 2b или 2с), HCV 3 (3а, 3b, 10а), HCV 4 (4а), HCV 5 (5а) и HCV 6 (6а, 6b, 7b, 8b, 9а и 11а); Simmonds, J. Gen. Virol., 2001, 693-712. В контексте настоящего изобретения каждый белок HCV может быть получен из полинуклеотидной последовательности одного и того же генотипа или подтипа HCV либо, альтернативно, из любой комбинации генотипа или подтипа HCV, и белок HCV может быть использован. Предпочтительно данные гены происходят из генотипа типа 1b, например, инфекционного клона J4L6 (регистрационный № AF 0542478 - см. Фиг.1).
Конкретные штаммы, которые были секвенированы, включают HCV-J (Kato et al., 1990, PNAS, USA, 87: 9724-9528) и ВК (Takamizawa et al., 1991, J. Virol. 65: 1105-1113).
Полинуклеотиды согласно изобретению находят применение в получении посредством экспрессии кодируемых белков, при этом экспрессия может иметь место in vitro, in vivo или ex vivo. Таким образом, эти нуклеотиды могут быть вовлечены в рекомбинантный белковый синтез, например с целью увеличения выходов, или реально находить применение в качестве подходящих терапевтических агентов, используемых в способах ДНК-вакцинации. Когда полинуклеотиды по настоящему изобретению используют в получении кодируемых белков in vitro или ex vivo, клетки, например в клеточной культуре, будут модифицированы с включением полинуклеотида, который должен быть экспрессирован. Такие клетки включают временные или предпочтительно стабильные клеточные линии млекопитающих. Конкретные примеры клеток, которые могут быть модифицированы посредством вставки векторов, кодирующих полипротеины по изобретению, включают клетки млекопитающих НЕК293Т, СНО, HeLa, 293 и COS. Предпочтительно, когда выбранная клеточная линия будет представлять собой линию, являющуюся не только стабильной, но также разрешающей "зрелое" гликозилирование и экспрессию полипротеина на клеточной поверхности. Экспрессия может осуществляться в трансформированных ооцитах. Полипептид может быть экспрессирован из полинуклеотида по настоящему изобретению в клетках трансгенного, отличного от человека животного, предпочтительно мыши. Трансгенное, отличное от человека животное, экспрессирующее полипептид из полинуклеотида по изобретению, включено в объем данного изобретения.
Настоящее изобретение включает экспрессирующие векторы, которые содержат нуклеотидные последовательности по изобретению. Такие экспрессирующие векторы конструируют в области молекулярной биологии стандартными способами, и они могут, например вовлекать использование плазмидной ДНК и соответствующих инициаторов, промоторов, энхансеров и других элементов, таких как, например, сигналы полиаденилирования, которые могут быть необходимы, и которые располагаются в правильной ориентации для того, чтобы сделать возможной экспрессию белка. Другие подходящие векторы очевидны специалистам в данной области техники. В качестве дополнительного примера в этом отношении авторы ссылаются на Sambrook et al. Molecular Cloning: a Laboratory Manual. 2nd Edition. CSH Laboratory Press (1989).
Предпочтительно полинуклеотид по изобретению или для использования в данном изобретении в векторе функциональным образом связан с контролирующей последовательностью, способной обеспечивать экспрессию кодирующей