Способ получения ингибиторов фосфодиэстеразы-4
Иллюстрации
Показать всеИзобретение относится к новому способу получения соединения формулы IX и IXa, включающему стадию взаимодействия, в растворителе, соединения формулы Va, с соединением формулы VII или формулы VIIa, в присутствии палладиевого катализатора и фосфинового лиганда, в присутствии аминного основания, с получением соединения формулы VIII или формулы VIIIa, a также стадию взаимодействия, в растворителе, соединения формулы VIII или VIIIa с циклопропиламином, необязательно в присутствии катализатора, также изобретение относится к способу очистка соединения формулы IX и IXa. Технический результат: описан способ получения соединений, обладающих полезными биологическими свойствами. 2 н. и 15 з.п. ф-лы, 5 табл.
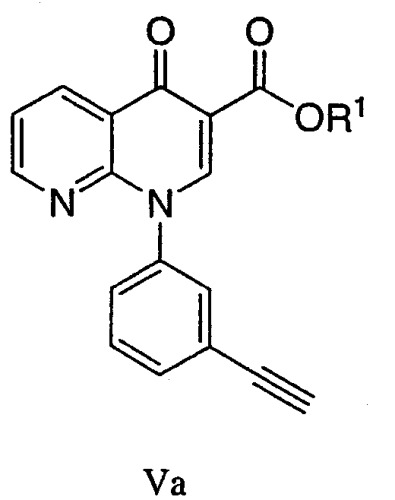
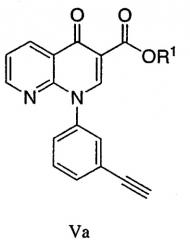
Va - R1 выбран из С1-8алкила, арила и гетероарила, необязательно замещенного арилом и/или С1-8алкилом; и
Реферат
Область техники
Данное изобретение относится к способу получения ингибиторов фосфодиэстеразы-4. В частности, данное изобретение относится к способу получения соединений, которые являются замещенными биарилом 1,8-нафтиридин-4(1Н)-онами.
Уровень техники
Гормоны представляют собой соединения, которые различным образом влияют на клеточную активность. Во многих отношениях гормоны являются мессенджерами для инициации определенных клеточных ответов и активностей. Однако многие эффекты, вызванные гормонами, не являются результатом действия только самого гормона. Наоборот, гормон сначала связывается с рецептором, тем самым инициируя выделение второго соединения, которое продолжает воздействие на клеточную активность. В случае такого сценария, гормон известен как первичный мессенджер, а второе соединение называется вторичным мессенджером. Циклический аденозинмонофосфат (аденозин 3',5'-циклический монофосфат, "цАМФ" или "циклический АМФ") известен как вторичный мессенджер для гормонов, включающих эпинефрин, глюкагон, кальцитонин, кортикотропин, липотропин, лютеинизирующий гормон, норэпинефрин, паратиреоидный гормон, тиреоид-стимулирующий гормон и вазопрессин. Таким образом, цАМФ опосредует клеточный ответ на гормоны. Циклический АМФ также опосредует клеточный ответ на различные нейротрансмиттеры.
Фосфодиэстеразы ("ФДЭ") представляют собой семейство ферментов, которые участвуют в метаболизме 3',5'-циклических нуклеотидов, превращая их в 5'нуклеозидмонофосфаты, тем самым ограничивая активность цМФ как вторичного мессенджера. Определенная фосфодиэстераза, фосфодиэстераза-4 ("ФДЭ4", также известная как "ФДЭ-IV"), которая имеет высокое сродство и специфичность к цАМФ, ФДЭ типа IV, особенно интересна как потенциальная мишень для разработки новых противоастматических и противовоспалительных соединений. Известно, что ФДЭ4 существует в виде, по крайней мере, четырех изоферментов, каждый из которых кодируется отдельным геном. Полагают, что все четыре известных ФДЭ4 генных продуктов играют различные роли в аллергических и/или воспалительных реакциях. Таким образом, полагают, что ингибирование ФДЭ4, особенно специфичных изоформ ФДЭ4, которые вызывают нежелательные реакции, может благоприятно влиять на симптомы аллергии и воспаления. Было бы желательно получить новые соединения и композиции, которые ингибируют активность ФДЭ4.
Основной проблемой применения ингибиторов ФДЭ4 является побочный эффект в виде рвоты, который наблюдается при приеме нескольких вариантов соединений, как описано у C. Burnouf et al., ("Burnouf"), Ann. Rep. In Med. Chem., 33:91-109 (1998). У B. Hughes et al., Br. J. Pharmacol., 118:1183-1191 (1996); M.J. Perry et al., Cell Biochem. Biophys., 29:113-132 (1998); S.B. Christensen et al., J. Med. Chem., 41:821-835 (1998) и Burnouf описаны нежелательные эффекты различной степени тяжести, вызываемые различными соединениями. Как описано у M.D.Houslay et al., Adv. In Pharmacol., 44:225-342 (1998) и D. Spina et al., Adv. In Pharmacol., 44:33-89 (1998), существует огромный интерес, и проводятся обширные исследования терапевтических ингибиторов ФДЭ4.
В публикации международной заявки WO9422852 описаны хинолины в качестве ингибиторов ФДЭ4. В публикации международной заявки WO 9907704 описаны производные 1-арил-1,8-нафтиридин-4-она в качестве ингибиторов ФДЭ4.
В A.H. Cook et al., J. Chem. Soc., 413-417 (1943) описаны гамма-пиридилхинолины. Другие хинолиновые соединения описаны у Kei Manabe et al., J. Org. Chem., 58(24):6692-6700 (1993); Kei manabe et al., J. Am. Chem. Soc., 115(12):5324-5325 (1993) и Kei Manabe et al., J. Am. Chem. Soc., 114(17):6940-6941 (1992).
Соединения, которые включают кольцевые системы, описаны у различных исследователей как эффективные при различных видах терапии и при других применениях. Например, в публикации международной заявки WO 98/25883 описаны кетобензамиды в качестве ингибиторов кальпаина, в публикации европейского патента ЕР 811610 и патентов США №5679712, 5693672 и 5747541 описаны замещенные бензоилгуанидиновые блокаторы натриевых каналов, в патенте США №5736297 описаны кольцевые системы, применяемые в качестве фоточувствительной композиции.
В патентах США №5491147, 5608070, 5622977, 5739144, 5776958, 5780477, 5786354, 5798373, 5849770, 5859034, 5866593, 5891896 и публикации международной заявки WO 95/35283 описаны ингибиторы ФДЭ4, которые представляют собой производные тризамещенного арила или гетероарилфенила. В патенте США №5580888 описаны ингибиторы ФДЭ4, которые представляют собой производные стирила. В патенте США №5550137 описаны ингибиторы ФДЭ4, которые представляют собой производные фениламинокарбонила. В патенте США №5340827 описаны ингибиторы ФДЭ4, которые представляют собой соединения феноксикарбоксамида. В патенте США №5780478 описаны ингибиторы ФДЭ4, которые представляют собой производные тетразамещенного фенила. В публикации международной заявки WO 96/00215 описаны производные замещенного оксима, применяемые в качестве ингибиторов ФДЭ4. В патенте США №5633257 описаны ингибиторы ФДЭ4, которые представляют собой соединения цикло(алкил и алкенил)фенил-алкенил(арил и гетероарил)а.
Сущность изобретения
В одном аспекте, данное изобретение относится к однореакторному способу получения промежуточных соединений формулы V, которые применяют при получении ингибиторов фосфодиэстеразы-4:
В другом аспекте, данное изобретение относится к способу получения соединений формулы IX и формулы IXa, которые являются ингибиторами фосфодиэстеразы-4:
Показано, что ингибиторы фосфодиэстеразы-4 являются полезными при лечении млекопитающих, например, от астмы, хронического бронхита, хронического обструктивного заболевания легких (ХОЗЛ), эозинофильной гранулемы, псориаза и других доброкачественных или злокачественных пролиферативных заболеваний кожи, эндотоксического шока (и связанных с ним состояний, таких как ламинит и колики у лошадей), септического шока, язвенного колита, болезни Крона, реперфузионного повреждения миокарда и мозга, воспалительного артрита, остеопороза, хронического гломерулонефрита, атопического дерматита, крапивницы, респираторного дистресс-синдрома у взрослых, респираторного дистерсс-синдрома у детей, хронического обструктивного заболевания легких у животных, не сахарного диабета, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, артериального рестеноза, атеросклероза, нейрогенного воспаления, боли, кашля, ревматоидного артрита, анкилозирующего спондилита, отторжения трансплантатов и заболевания "трансплантат против хозяина", гиперсекреции желудочной кислоты, вызванного бактериями, грибами или вирусами сепсиса или септического шока, воспалительной и цитокин-опосредованной хронической дегенерации тканей, остеоартрита, рака, кахексии, потери мышечной ткани, депрессии, ухудшения памяти, монополярной депрессии, острых и хронических нейродегенеративных заболеваний с воспалительными явлениями, болезни Паркинсона, болезни Альцгеймера, повреждения спинного мозга, травм головы, рассеянного склероза, роста опухоли и раковой инвазии нормальных тканей.
Подробное описание изобретения
В одном варианте получение соединений формулы IX может начинаться с получения промежуточного соединения формулы V:
где
-OR1 является подходящей уходящей группой, такой как описаны в стандартных текстах, таких как: Protective Groups in Organic Synthesis, 2nd edition, by Theodora W. Greene and Peter G M. Wust (1991) и Protecting Group, автор Philip J, Kocienski (1994). Например, R1 может быть необязательно С1-8алкилом, арилом, гетероарилом, где заместители выбирают из группы, включающей арил, С1-8алкил;
R3 является С1-8алкилом, арилом или гетероарилом, необязательно моно-, ди-, три- или тетразамещенным галогеном, В(ОН)2, -С≡, арилом, гетероарилом, С1-10алкилом, алкокси, кетоном, спиртом, трифлатом, мезилатом, амидом, сложным эфиром, кетоном, ацеталем, фосфатом, станнаном, силилом, B(OR)2, где R является С1-8алкилом или арилом;
включающего:
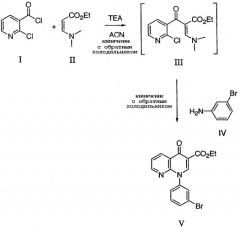
Стадию А: взаимодействие, в ненуклеофильном растворителе, соединения формулы II:
где
R2 каждый независимо является С1-8алкилом, необязательно моно- или дизамещенным С1-8алкилом, таким как метил или этил, или арилом, таким как фенил или гетероарил;
с соединением формулы I в присутствии основания:
где
R4 является бромом или хлором,
с получением соединения формулы III.
и
Стадию В: взаимодействие, в ненуклеофильном растворителе, соединения формулы III с аминосоединением формулы IV
в присутствии основания с получением соединения формулы V.
Определение ненуклеофильного растворителя на стадии В такое же, как дано выше для стадии А. Так же, определение основания на стадии В такое же, как описанное выше для стадии А.
На стадии А молярное соотношение основания к соединению формулы I может варьироваться от около 12:1 до около 3:1. Обычно применяют соотношение 8:1. Соотношение ниже 3:1 может вызвать тримеризацию аминоакрилата с получением 1,3,5-трикарбоксибензола. Молярное соотношение соединения формулы I к соединению формулы II может варьироваться от 1:1 до 1:3, обычно составляет около 1:1,5. Взаимодействие на стадии А может проводиться при температуре от 25 до 100°С; обычно используют интервал от 40 до около 60°С и продолжают реакцию до практически полного завершения в течение от 2 до 18 часов; обычно от 6 до 12 часов. Взаимодействие на стадии В проводят как описано выше.
В данном варианте имеется подвариант, в котором:
R1 необязательно является С1-8алкилом, арилом, гетероарилом, где заместители выбирают из группы, включающей арил, С1-8алкил;
R2 является метилом, этилом или фенилом;
R3 является С1-8алкилом, арилом или гетероарилом, необязательно моно-, ди-, три- или тетразамещенным галогеном, В(ОН)2, -С≡, арилом, гетероарилом;
В данном варианте имеется подвариант, в котором:
R1 является метилом или этилом;
R2 является метилом;
R3 является фенилом, замещенным галогеном, В(ОН)2, -С≡.
В данном варианте имеется подвариант, в котором: ненуклеофильный растворитель выбирают из диметилформамида, диметилацетамида, тетрагидрофурана, этилацетата, ацетонитрила, толуола, бензола, диоксана, метиленхлорида.
В указанном выше подварианте имеется подвариант, в котором ненуклеофильным растворителем является ацетонитрил.
В данном варианте имеется подвариант, в котором основание выбирают из карбоната натрия или калия, триэтиламина, диэтиламина и основания Хенига.
В данном варианте имеется подвариант в котором основание выбирают из карбоната натрия или триэтиламина.
В данном варианте имеется подвариант в котором молярное соотношение соединения формулы IV к соединению формулы III составляет от около 2:1 до 1:2.
В указанном выше подварианте имеется подвариант, в котором молярное соотношение соединения формулы IV к соединению формулы III составляет около 1:1.
В данном варианте имеется подвариант в котором молярное соотношение основания к соединению формулы IV составляет, по крайней мере, 1:1.
В указанном выше подварианте имеется подвариант, в котором молярное соотношение основания к соединению формулы IV составляет около 1:1.
В данном варианте имеется подвариант в котором взаимодействие проводят при температуре от около 20 до 100°С.
В указанном выше подварианте имеется подвариант, в котором реакцию проводят при температуре от около 40 до около 50°С.
Во втором варианте представлен способ получения соединения формулы V
где
-OR1 является подходящей уходящей группой;
R3 является С1-8алкилом, арилом или гетероарилом, необязательно моно-, ди-, три- или тетразамещенным галогеном, В(ОН)2, -С≡ (алкином), арилом, гетероарилом, С1-10алкилом, алкокси, кетоном, спиртом, трифлатом, мезилатом, амидом, сложным эфиром, кетоном, ацеталем, фосфатом, станнаном, силилом, B(OR)2, где R является С1-8алкилом или арилом;
включающий:
Стадию А: взаимодействие, в ненуклеофильном растворителе, соединения формулы II:
где
R2 каждый независимо является С1-8алкилом, необязательно моно- или дизамещенным С1-8алкилом, таким как метил или этил, или арилом или гетероарилом;
с соединением формулы I в присутствии основания:
где
R4 является бромом или хлором,
с получением соединения формулы III.
и
Стадию В: взаимодействие, в ненуклеофильном растворителе, соединения формулы III с аминосоединением формулы IV
в присутствии основания с получением соединения формулы V.
В данном варианте имеется подвариант, в котором:
R1 необязательно является С1-8алкилом, арилом, гетероарилом, где заместители выбирают из группы, включающей арил, С1-8алкил;
R2 является метилом, этилом или фенилом;
R3 является С1-8алкилом, арилом или гетероарилом, необязательно моно-, ди-, три- или тетразамещенным галогеном, В(ОН)2, -С≡, арилом, гетероарилом;
В данном втором варианте имеется под-вариант, в котором:
R4 является хлором.
В данном втором варианте имеется под-вариант, в котором:
R1 является метилом или этилом;
R2 является метилом;
R3 является фенилом, замещенным галогеном, В(ОН)2, -С≡.
В данном втором варианте имеется подвариант, в котором: ненуклеофильный растворитель выбирают из диметилформамида, диметилацетамида, тетрагидрофурана, этилацетата, ацетонитрила, толуола, бензола, диоксана, метиленхлорида.
В указанном выше подварианте имеется подвариант, в котором ненуклеофильным растворителем является ацетонитрил.
В данном втором варианте имеется подвариант в котором основание выбирают из карбоната натрия или калия, триэтиламина, диэтиламина и основания Хенига.
В данном варианте имеется подвариант в котором основание выбирают из карбоната натрия или триэтиламина.
В данном втором варианте имеется подвариант стадии А, в котором молярное соотношение основания в соединению формулы I составляет от около 12:1 до около 3:1.
В указанном выше под-варианте имеется подвариант стадии А, в котором молярное соотношение основания в соединению формулы I составляет от около 8:1 до около 3:1.
В данном втором варианте имеется подвариант стадии А, в котором молярное соотношение соединения формулы I к соединению формулы II составляет от около 1:1 до 1:3.
В данном втором варианте имеется подвариант стадии А, в котором реакцию проводят при температуре от около 25 до 100°С.
В данном втором варианте имеется подвариант стадии А, в котором реакцию проводят при температуре от около 40 до около 60°С.
В данном втором варианте имеется подвариант стадии В, в котором молярное соотношение соединения формулы IV к соединению формулы III составляет от около 2:1 до 1:2.
В указанном выше подварианте имеется подвариант стадии В, в котором молярное соотношение соединения формулы IV к соединению формулы III составляет около 1:1.
В данном втором варианте имеется подвариант стадии В, в котором молярное соотношение основания к соединению формулы IV составляет около 1:1 или более.
В указанном выше подварианте имеется подвариант стадии В, в котором молярное соотношение основания к соединению формулы IV составляет около 1:1.
В данном втором варианте имеется подвариант стадии В, в котором реакцию проводят при температуре от около 20 до 100°С.
В указанном выше подварианте имеется подвариант стадии В, в котором реакцию проводят при температуре от около 40 до 50°С.
В данном втором варианте имеется подвариант, в котором взаимодействие на стадии А и взаимодействие на стадии В проводят в одном реакторе без очистки или выделения продукта стадии А перед переходом на стадию В.
В другом варианте данное изобретение относится к способу получения ингибитора фосфодиэстеразы-4 формулы IX и IXa:
включающему
Стадию С: взаимодействие, в растворителе А, соединения формулы Va
где
-OR1 является подходящей уходящей группой, такой как описана в стандартных текстах, таких как: Protective Groups in Organic Synthesis, 2nd edition, by Theodora W. Greene and Peter G.M. Wuts (1991) и Protecting Groups, by Philip J. Kocienski (1994). Например, R1 может быть необязательно С1-8алкилом, арилом, гетероарилом, где заместители выбирают из группы, включающей арил, С1-8алкил;
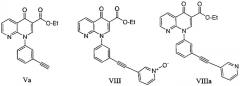
с соединением формулы VII или VIIa
в присутствии палладиевого катализатора и фосфинового лиганда, в аминном основании, с получением соединения формулы VIII или VIIIa
Предпочтительным соединением формулы Va, формулы VIII и VIIIa, соответственно, являются следующие соединения:
Для целей данного изобретения растворитель А выбирают из группы, включающей диметиламиноацетамид, диметилформамид, ацетонитрил, ДМСО, метилацетамид, простые эфиры или их смеси. Для целей данного изобретения, фосфиновый лиганд выбирают из группы, включающей Р(С1-6алкил)3, такой как Р(трет-бутил)3, Р(Cy)3 и Р(трет-бутил)2(бифенил). Для целей данного изобретения палладиевый катализатор включает катализатор Фу (например, Р(трет-бутил)3-Pd-Р(трет-бутил)3, [PdCl(аллил)]2, Pd2(дба)3 и [Р(трет-бутил)3PdBr]2 (катализатор Джонсона-Маттей). Для целей данного изобретения аминное основание представляет собой затрудненное аминное основание, такое как трет-амиламин, трет-бутиламин, изопропиламин или диизопрпоиламин.
На стадии С молярное соотношение соединения формулы Va к соединению формулы VII или VIIa может варьироваться в широком диапазоне, но, оптимально, составляет от около 1:1,5 до 1,5:1, обычно приблизительно 1:1. В качестве основного правила, желателен, по крайней мере, 1 молярный эквивалент основания на моль соединения формулы Va плюс 1 молярный эквивалент основания на молярный эквивалент соединения формулы VII или VIIa. Уменьшение данного соотношения снижает выход. Таким образом, в представленной выше реакции соотношение аминного основания к соединению формулы Va может быть 1,2:1 или более, но обычно бывает от 2:1 до 3,5:1. Молярное соотношение палладия к соединению формулы V составляет от 0,05:1 до 0,10:1. Если применяется, например, [PdCl(аллил)]2, который содержит два моля палладия на моль катализатора, соотношение будет от 0,025:1 до 0,05:1. Молярное соотношение фосфинового лиганда к палладию обычно составляет от 3:1 до 5:1, часто приблизительно 4:1. Реакция может проводиться при температуре от 25 до 125°С, обычно при температуре от 40 до 70°С, и проходит до тех пор, пока реакция практически не завершится. Присутствие кислорода минимизируется продуванием реакционного сосуда газообразным азотом перед добавлением реагентов.
Продукт со стадии С охлаждают до температуры от 0 до около 5°С. Затем к продукту со стадии С добавляют 3-6 объемов анти-растворителя на объем растворителя для осаждения соединения формулы VIII или VIIIa. Для целей данного изобретения, антирастворитель определен как не реакционно-способный растворитель, в котором соединение формулы VIII или VIIIa выпадает в осадок.
Суспензию, содержащую осажденное соединение формулы VIII или VIIIa, фильтруют или центрифугируют. Осадок на фильтре или в центрифуге, содержащий соединение формулы VIII или VIIIa, повторно суспендируют или непосредственно промывают изобутанолом или изопропанолом для удаления остаточного палладия. Например, осадок на фильтре, содержащий соединение формулы VIII или VIIIa, может быть промыт in situ (например, на фильтровальном прессе) от 40 до 60 объемами изобутанола на единицу веса сухого соединения формулы VIII или VIIIa.
В качестве альтернативы, остаточный палладий может быть удален повторным растворением соединения формулы I в С1-6алканольном растворителе (таком как метанол, этанол или пропанол) и обработкой суспензии, содержащей соединение формулы IX или IXa, активированным углем, таким как Darco G-60 или Ecosorb. Затем суспензию фильтруют для удаления активированного угля. Очевидно, что удобно повышать растворимость продукта в алканольном растворителе посредством нагревания алканола (например, до температуры от 25 до 70°С) либо до, либо после контакта с продуктом. Обычно суспензию выдерживают в теплом состоянии в течение от 1 до 6 часов и фильтруют еще теплой.
Функционально полное превращение, достигаемое на стадии С, является таким же, как и в типовой реакции сочетания по Соногашире. Как таковая, стадия С является эффективным одностадийным методом сочетания алкина с арилгалогенидом. С другой стороны, стадия С отличается от реакции сочетания по Соногашире по нескольким важным направлениям. Например, реакция сочетания по Соногашире обычно требует применения медного, цинкового, магниевого или циркониевого реагента в дополнение к палладиевому катализатору. Предпочтительна медь. Однако авторы данного изобретения обнаружили, что при сочетании по Санагашире (Sonogashira, K in Metal-Catalyzed Cross-Coupling Reactions; Diederich, F and Stang, P. eds; Wiley-VCH; Weinheim, Germany, 1998, глава 5. См. также, Littke, A and Fu, G. Angew. Chem. Int. Ed. 1998, 37, №24, стр. 3387-3388; Wolfe, J. Singer, R., Yang, B. and Buchwald, S., J. Am. Chem. Soc., 1999, 121, стр. 9550-9561.) соединений формулы Va и формулы VII образуется не менее 10% димера соединения формулы Va в продукте.
В Hermann, et al (Eur. J. Chem 2000, 3679-3681) описано, что если палладиевый катализатор выбран правильно, необходимость применения меди отпадает. Двумя такими катализаторами являются P(Cy)3-Pd-P(Cy)3 и Р(трет-бутил)3-Pd-Р(трет-бутил)3 (катализатор Фу). Такие катализаторы требуют особого обращения. Наоборот, катализаторы в соответствии с данным изобретением получают in situ реакцией устойчивого источника палладия (такого как [Pd(аллил)Cl]2) с устойчивым коммерчески доступным предварительно упакованным лигандом (таком как 10 мас.% три-(трет-бутил)фосфин в гексане). Более того, благодаря получению катализатора in situ, данное изобретение обеспечивает подходящее соотношение лиганда/палладия, обычно недоступное при применении коммерческих продуктов.
Стадия D: взаимодействие, в растворителе В, соединения формулы VIII с циклопропиламином, необязательно в присутствии фосфита или другого катализатора.
Для целей данного изобретения растворитель В определен как включающий алканольный растворитель, такой как С1-4алканольные растворители метанол, этанол, пропанолы и бутанолы, и трифторэтанол, или их смеси. Также может применяться ацетонитрил. Для целей данного изобретения катализатор включает бутилфосфит (BuO)3P), пиридин-N-оксиды, триалкилортоацетат, хлорид цинка, хлорид магния, трифлат магния, трифлат скандия, трифлат лантана, трифлат иттербия, дихлорид титаноцена или дихлорид цирконоцена. Необходимо отметить, что для целей данного изобретения термин "катализатор" означает реагент, который ускоряет реакцию, даже присутствуя в больших, чем классические "каталитические" количества.
Молярное соотношение циклопропиламина к соединению формулы VII или VIIIa обычно составляет более 1:1, часто 1,1:1 или более. Уменьшение указанного соотношения снижает выход. Соотношение катализатора к соединению формулы VIII или VIIIa обычно составляет от 0,025:1 до 0,075:1, часто около 0,05:1 или, возможно, от 0,10:1 до 1:1 или более. При применении хлорида магния типовое соотношение катализатора к соединению формулы VIII или VIIIa составляет от 0,9:1 до 1:1,5. Реакцию можно проводить при температуре от 40 до около 60°С, обычно при температуре 55-60°С, и ее проводят до тех пор, пока взаимодействие практически не завершится. Присутствие кислорода минимизируется продуванием реакционного сосуда газообразным азотом перед добавлением реагентов. Для получения оптимальных результатов желательно проводить стадию D при Kf, равном или ниже 3000 ч./млн.
Продукт со стадии D охлаждают до температуры от 0 до около 30°С, обычно до комнатной температуры. Затем растворитель заменяют антирастворителем (антирастворитель В), например, выпариванием растворителя с последующим добавлением избытка антирастворителя. Для целей данного изобретения антирастворитель В определен как растворитель в продукте реакции (в данном случае, соединении формулы IX), 3-6 объемов антирастворителя на объем растворителя добавляют к продукту со стадии С для осаждения соединения формулы VIII или VIIIa. Для целей данного изобретения антирастворитель определен как не реакционно-способный растворитель, в котором осаждается соединение формулы VIII или VIIIa.
Для удаления примесей суспензию, содержащую осажденное соединение формулы VIII или VIIIa, промывают растворителем, таким как вода, ацетонитрил, изопропилацетат, этилацетат, тетрагидрофуран, этанол, пропанолы и бутанолы. Затем растворитель удаляют, например, фильтрацией и вакуумной сушкой. Фильтрованное соединение формулы VIII или VIIIa может быть смешано с растворителем превращения, таким как сухой этанол, метанол, трифторэтанол, N-метилпирролидинон, метил-трет-бутиловый эфир или их смеси, необязательно нагрето и выдержано при температуре от 40 до 50°С, до тех пор, пока, по крайней мере, 95% соединения формулы VIII или VIIIa не примет желаемую форму. Затем растворитель превращения удаляют, например, фильтрацией или центрифугированием, и полученный продукт сушат в вакууме. Необходимое количество растворителя превращения должно быть достаточным для суспендирования или растворения соединения формулы VIII или VIIIa.
Термин "арил", если не указано иначе, включает системы с множеством колец, а также системы с одним кольцом, такие как, например, фенил или нафтил.
Термин "гетеро", если не указано иначе, включает один или более О, S или N атомов. Например, гетероциклоалкил и гетероарил включают системы колец, которые содержат один или более О, S или N атомов в кольце, включая смеси этих атомов. Гетероатомы заменяют атомы углерода в кольце. Таким образом, например, гетероциклоС5алкил представляет собой 5-членное кольцо, содержащее от 5 до 0 атомов углерода.
Примеры гетероарила включают, например, пиридинил, хинолинил, изохинолинил, пиридазинил, пиримидинил, пиразинил, хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензотиенил, пирролил, индолил, пиразолил, индазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил.
Соединения, описанные выше, могут включать один или более центров асимметрии и, таким образом, могут иметь диастереомеры и оптические изомеры. Данное изобретение включает все эти возможные диастереомеры, а также их рацемические смеси, их практически чистые разделенные энантиомеры, все возможные геометрические изомеры и их соли.
Осуществление данного изобретения иллюстрировано примерами ингибиторов фосфодиэстеразы-4, которые могут быть получены с применением данного изобретения.
Дозировка от около 0,001 мг/кг до около 140 мг/кг массы тела в день применяется при лечении таких состояний, как астма, хронический бронхит, хроническое обструктивное заболевание легких (ХОЗЛ), эозинофильная гранулема, псориаз и другие доброкачественные или злокачественные пролиферативные заболевания кожи, эндотоксический шок (и связанные с ним состояния, такие как ламинит и колики у лошадей), септический шок, язвенный колит, болезнь Крона, реперфузионное повреждение миокарда и мозга, воспалительный артрит, остеопороз, хронический гломерулонефрит, атопический дерматит, крапивница, респираторный дистресс-синдром у взрослых, респираторный дистресс-синдром у детей, хроническое обструктивное заболевание легких у животных, не сахарный диабет, аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, артериальный рестеноз, атеросклероз, нейрогенное воспаление, боль, кашель, ревматоидный артрит, анкилозирующий спондилит, отторжение трансплантатов и заболевание "трансплантат против хозяина", гиперсекреция желудочной кислоты, вызванный бактериями, грибами или вирусами сепсис или септический шок, воспалительная и цитокин-опосредованная хроническая дегенерация тканей, остеоартрит, рак, кахексия, потеря мышечной ткани, депрессия, ухудшение памяти, монополярная депрессия, острые и хронические нейродегенеративные заболевания с воспалительными явлениями, болезнь Паркинсона, болезнь Альцгеймера, повреждение спинного мозга, трава головы, рассеянный склероз, рост опухоли и раковая инвазия нормальных тканей, которые реагируют на ингибирование ФДЭ4, или, альтернативно, от 0,05 мг до около 7 г на пациента в день. Например, воспаление можно эффективно лечить введением от около 0,01 мг до 50 мг соединения на килограмм массы тела в день, или, альтернативно, от около 0,5 мг до около 2,5 г на пациента в день. Далее понятно, что ингибирующие ФДЭ4 соединения в соответствии с данным изобретением могут вводиться в профилактически эффективном количестве для профилактики указанных выше состояний.
Количество активного ингредиента, которое может быть объединено с носителем для получения стандартных лекарственных форм, варьируется в зависимости от подлежащего лечению пациента и способа ведения. Например, препаративные формы для перорального введения человеку могут содержать от около 0,5 мг до около 5 г активного агента, объединенного с соответствующим и удобным количеством носителя, которое может варьироваться от около 5 до около 95% от общей массы композиции. Стандартные лекарственные формы обычно содержит от около 0,01 мг до около 1000 мг активного ингредиента, обычно 0,01, 0,05 мг, 0,25 мг, 1 мг, 5 мг, 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг или 1000 мг.
Понятно, что определенный уровень дозировки для определенного пациента будет зависеть от таких факторов, как возраст, масса тела, общее состояние здоровья, пол, диета, время введения, способ введения, скорость выведения, сочетание лекарственных средств и тяжесть определенного подлежащего лечению заболевания.
Представленные ниже примеры предназначены для иллюстрации некоторых предпочтительных вариантов данного изобретения и не ограничивают данное изобретение.
Соединения в соответствии с данным изобретением могут быть получены следующими методами. Заместители такие же, как в формуле I, если не указано иначе.
Получение промежуточного соединения формулы V
НАФТИРИДОН 1
Стадия 1: Этил-1-(3-бромфенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
Смесь этил-2-хлорникотиноилацетата (коммерчески доступный или полученный по методике, описанной в J. Het. Chem., 30, 855, 1993) (1 экв.), триэтиламина (4 экв.) и этил 3,3-диметиламиноакрилата (1,5 экв.) в ацетонитриле (0,5М) кипятят с обратным холодильником в течение 3 ч, охлаждают до температуры 40-50°С и добавляют 3-броманилин (1 экв.). Реакционную смесь кипятят с обратным холодильником в течение ночи, охлаждают до комнатной температуры, разбавляют водой (2 объема). Продукт выделяют фильтрацией и промывают водой, эфиром или ацетонитрилом-водой (1:1).
1Н ЯМР (Ацетон-d6) (1,32 (т, 3Н), 4,29 (кв., 2Н), 7,54-7,63 (м, 2Н), 7,69 (дд, 1Н), 7,78 (дд, 1Н), 7,93 (с, 1Н), 8,66-8,71 (м, 3Н).
НАФТИРИДОН 2
Этил-1-(3-ацетиленилфенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 3-ацетилениланилином 3-броманилин, получают указанный в заголовке нафтиридон 2.
1Н ЯМР (CDCl3) (1,42 (т, 3Н), 3,19 (с, 1Н), 4,20 (кв., 2Н), 7,42-7,46 (м, 2Н), 7,53-7,59 (м, 2Н), 7,67 (дт, 1Н), 8,64 (дд, 1Н), 8,86 (с, 1Н), 8,83 (дд, 1Н).
НАФТИРИДОН 3
Этил-1-(3-цианофенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 3-цианоанилином 3-броманилин, получают указанный в заголовке нафтиридон 3.
1Н ЯМР (DMSO-d6) (1,27 (т, 3Н), 4,23 (кв., 2Н), 7,57 (дд, 1Н), 7,80 (т, 1Н), 7,96-8,04 (м, 2Н), 8,20 (т, 1Н), 8,61 (дд, 1Н), 8,86 (дд, 1Н), 8,70 (с, 1Н).
НАФТИРИДОН 4
Этил-1-(4-бромфенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 4-броманилином 3-броманилин, получают указанный в заголовке нафтиридон 4.
1Н ЯМР (DMSO-d6) (1,26 (т, 3Н), 4,22 (кв., 2Н), 7,54-7,59 (м, 3Н), 7,78 (д, 2Н), 8,61 (дд, 1Н), 8,63 (с, 1Н), 8,68 (дд,1Н).
НАФТИРИДОН 5
Этил-1-(2-бромфенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 2-броманилином 3-броманилин, получают указанный в заголовке нафтиридон 5.
1Н ЯМР (DMSO-d6) (1,26 (т, 3Н), 4,23 (кв., 2Н), 7,53-7,62 (м, 3Н), 7,75 (дд, 1Н), 7,78 (дд, 1Н), 8,61 (с, 1Н), 8,63 (дд,1Н), 8,68 (дд, 1Н).
НАФТИРИДОН 6
Этил-1-(2-трет-бутилфенил)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 1-бром-2-трет-бутилфениланилином 3-броманилин, получают указанный в заголовке нафтиридон 6.
1Н ЯМР (DMSO-d6) (1,08 (с, 9Н), 1,25 (т, 3Н), 4,22 (кв., 2Н), 7,30-7,40 (м, 2Н), 7,50-7,56 (м, 2Н), 7,73 (дд, 1Н), 8,59 (с, 1Н), 8,62 (дд, 1Н), 8,70 (дд, 1Н).
НАФТИРИДОН 7
Этил-1-(3-фенилборная кислота)-1,4-дигидро[1,8]нафтиридин-4-он-3-карбоксилат
По методике получения нафтиридона 1, но заменяя 3-аминофенилборной кислотой 3-броманилин, получают указанный в заголовке нафтиридон 7.
1Н ЯМР (DMSO-d6) (1,26 (т, 3Н), 4,22 (кв., 2Н), 7,56 (совпадение триплетов, 2Н), 7,60 (д, 1Н), 7,87 (c, 1Н), 7,94 (д, 1Н), 8,24 (с, 2Н, обменный), 8,61 (д,1Н), 8,62 (с, 1Н), 8,68 (д, 1Н).
Соединения ингибиторы ФДЭ-4
Далее представлены примеры соединений ингибиторов ФДЭ-4, которые могут быть получены по описанным ниже методикам. Необходимо отметить, что номера формул, применяемые в схемах 1-12 и описаниях данных схем, не следует смешивать с номерами формул, применяемыми где-либо еще в описании заявки. Соединения в примерах 1-13 получают с применением нафтиридона 1.
Схема 1
В первом способе, описанном в схеме 1 ниже, соответствующим образом замещенное производное этил-2-хлорникотиноилацетата формулы II подвергают взаимодействию с 1,5 эквивалентами триэтилортоформиата и 5 эквивалентами уксусного ангидрида при температуре 130°С, и после удаления летучих компонентов неочищенный 2-хлорникотиноилакрилат формулы III сразу же подвергают взаимодействию с 1,2 эквивалентами соответствующим образом замещенного галогенариламина формулы IV, такого как, например, 3-броманилин, в галогенированном углеводородном растворителе, таком как метиленхлорид, при температуре от 0°С до комнатной температуры. После необходимого для реакции промежутка времени, варьирующегося от 2 до 24 часов, полученный 3-ариламиноакрилат формулы V получают выпариванием растворителя и далее очищают хроматографией на силикагеле или кристаллизацией из подходящего растворителя.
Альтернативно, соединение формулы V может применяться на следующей стадии без дальнейшей очистки. Циклизацию соединения формулы V до 1-галогенарил-1,4-дигидро[1,8]нафтиридин-4-он карбоксилата формулы VI проводят обработкой небольшим избытком сильного основания, такого как гидрид щелочного металла, например, гидрид натрия, в подходящем растворителе, таком как тетрагидрофуран, при исходной температуре 0°С, нагревая до комнатной температуры, если это необходимо для завершения процесса. Продукт формулы VI выделяют в неочищенной форме разбавлением большим объемом воды с последующей фильтрацией или экстрагированием в подходящий органический растворитель, такой как диэтиловый эфир, этилацетат или галогенированный углеводородный растворитель, такой как хлороформ или метиленхлорид. Продукт может быть далее очищен хроматографией на силикагеле, кристаллизацией или продолжительным перемешиванием в подходящем ра