Мультимеры рецептор-связывающих лигандов
Иллюстрации
Показать всеДанное изобретение относится к области биотехнологии. Олигомерные полипептидные димеры включают в себя лиганд-связывающие домены лептина. Домены соединены посредством гибких полипептидных линкерных молекул. Линкерные молекулы, возможно, включают в себя сайты чувствительности к протеазам. Изобретение может быть использовано для модулирования высвобождения биологически активных цитокинов при введении субъекту человеку или животному. 11 н. и 20 з.п. ф-лы, 11 ил.
Реферат
Изобретение относится к полипептидам, которые включают в себя более чем два лиганд-связывающих домена цитокина, где указанные домены соединены гибким линкером, который, возможно, включает в себя сайт протеолитического расщепления.
Лиганды, которые взаимодействуют с рецепторами для того, чтобы вызвать подходящий биологический ответ, известны как агонисты, а лиганды, которые предотвращают биологический ответ или препятствуют ему, известны как антагонисты. В качестве примера, но не ограничения, факторы роста, специфичные для клеток, представляют собой лиганды, которые действуют как агонисты и связываются с рецепторами, расположенными на клеточной поверхности. Активация рецепторов посредством лиганд-специфичного связывания способствует пролиферации клеток путем активации внутриклеточных каскадов передачи сигнала, что приводит в результате к экспрессии, помимо прочего, специфических генов клеточного цикла и активации пролиферации покоящихся клеток. Факторы роста могут также активировать клеточную дифференцировку.
Большая группа факторов роста, называемая также цитокинами, вовлечена во множество различных клеточных функций. Последние включают в себя в качестве примера, но не ограничения, модулирование иммунной системы, регуляцию энергетического метаболизма и контроль роста и развития. Цитокины, которые секретируются лимфоцитами, называются лимфокинами (также известными как интерлейкины). Цитокины, секретируемые моноцитами и макрофагами, называются монокинами. Цитокины также секретируются эндокринными железами (например, гормон роста (ГР) секретируется гипофизом) и жировыми клетками (например, лептин). Цитокины опосредуют свое действие через рецепторы, экспрессирующиеся на клеточной поверхности клеток-мишеней.
Рецепторы, относящиеся к семейству рецепторов цитокинов, имеют один трансмембранный домен и не имеют собственной ферментативной активности (Kishimoto et al., 1994). После связывания цитокина с родственным рецептором происходит либо гомо- или гетеродимеризация, либо олигомеризация рецептора. Этот рецепторный комплекс интернализуется, и осуществляется передача сигнала посредством активации ассоциированных каскадов передачи сигнала, которые включают в себя пути Jak/Stat и Mapk. За интернализацией следует стадия рециклинга, посредством которой молекула рецептора регенерируется для дальнейшего использования в клетке.
Вышеуказанный пример описан в отношении ГР и его связывания с рецепторами гормона роста (РГР). Этот пример приведен только для иллюстрации, а не ограничения, и представляет собой пример цитокина, который активирует каскад передачи сигнала путем связывания, димеризации и интернализации комплекса рецептор:лиганд. Известно, что одна молекула гормона роста (ГР) связывается с двумя идентичными молекулами рецептора (Cunningham et al., 1991; de Vos et al., 1992; Sundstrom et al., 1996; Clackson et al., 1998). Это происходит посредством двух уникальных рецептор-связывающих сайтов на ГР и общего связывающего "кармана" на внеклеточном домене двух рецепторов. Сайт 1 в молекуле ГР обладает более высокой аффинностью, чем сайт 2, и димеризация рецептора, как полагают, происходит последовательно со связыванием одного рецептора с сайтом 1 на ГР с последующим привлечением второго рецептора к сайту 2.
Внеклеточный участок РГР существует в виде двух связанных доменов, каждый из которых состоит приблизительно из 100 аминокислот (SD-100), причем С-концевой домен SD-100 наиболее близок к клеточной поверхности, а N-концевой домен SD-100 наиболее удален. В этих двух доменах имеется конформационное изменение, которое возникает при связывании гормона, с образованием гетеро-тримерного комплекса РГР-ГР-РГР. Предположили, что лиганд-управляемая димеризация рецептора является ключевым событием, ведущим к активации сигнала (Cunningham et al., 1991), запуская каскады фосфорилирования, которые включают в себя путь Jak2/Stat5 (Argetsinger & Carter-Su, 1996). С использованием конфокальной микроскопии и флуоресцентного резонансного переноса энергии (Fluorescence Resonance Energy Transfer, FRET) известно, что происходит очень быстрая интернализация РГР после связывания лиганда и что эта интернализация и передача сигнала представляют собой независимые функции (Maamra et al., 1999). За интернализацией комплекса РГР-ГР-РГР следует стадия рециклинга, посредством которой молекула рецептора регенерируется для дальнейшего использования внутри клетки.
Примеры цитокинов, которые относятся к ГР, представляют собой лептин и эритропоэтин (ЕРО). Рецептор лептина и рецептор ЕРО демонстрируют значительную структурную гомологию с РГР и требуют подобного процесса димеризации для запуска процесса передачи сигнала. Лептин подавляет аппетит, и устойчивость к лептину ассоциирована с ожирением. Антагонист рецептора лептина будет обеспечивать лечение анорексии. Избыток ЕРО вызывает полицитемию, которая может быть вторичной по отношению к гипоксии (хроническое заболевание легких) или первичной в случае эритремии (расстройство, заключающееся в избытке эритроцитов). Агонист ЕРО будет обеспечивать лечение полицитемии.
Расстройства акромегалия и гигантизм возникают вследствие избытка гормона роста, обычно вследствие опухолей гипофиза. Находящееся в настоящее время на испытании лекарство представляет собой пегилированный антагонист ГР В2036, разработанный с использованием недавно полученного знания молекулярной структуры РГР.
К сожалению, для того чтобы антагонизировать действие ГР, требуются очень высокие уровни В2036, которые более чем в 1000 раз выше по сравнению с уровнями эндогенного ГР.
Данное изобретение, среди прочего, относится к предложению олигомерных полипептидов (димеров, тримеров и так далее), включающих в себя лиганд-связывающие домены цитокинов, которые соединены посредством гибких полипептидных линкерных молекул, которые, возможно, включают в себя сайты чувствительности к протеазам для модулирования высвобождения биологически активных цитокинов при введении животному.
В соответствии с первым аспектом данного изобретения предложен полипептид, включающий в себя более чем два лиганд-связывающих домена рецептора цитокина, где указанные домены соединены посредством линкерной молекулы.
Предпочтительно, линкерная молекула включает в себя по меньшей мере один сайт протеолитического расщепления.
Предпочтительно, указанный сайт расщепления чувствителен к сывороточной протеазе.
Предпочтительно, указанный сайт расщепления включает в себя последовательность аминокислот: LVPRGS или ее модификацию.
В еще одном предпочтительном воплощении данного изобретения указанный сайт расщепления включает в себя по меньшей мере одну копию последовательности аминокислот: SGGGG или ее функциональную модификацию. Предпочтительно, указанный сайт расщепления включает в себя последовательность аминокислот: PGISGGGGGG.
Более предпочтительно, указанный сайт расщепления включает в себя последовательность аминокислот: LVPRGSPGISGGGGGG или ее модификацию.
Альтернативно, указанный сайт расщепления включает в себя по меньшей мере две копии последовательности аминокислот: SGGGG или ее функциональной модификации, которые фланкируют указанный сайт расщепления.
В еще одном предпочтительном воплощении данного изобретения указанный сайт расщепления чувствителен к сывороточной протеазе тромбину.
В еще одном предпочтительном воплощении данного изобретения указанный полипептид включает в себя множество лиганд-связывающих доменов. Предпочтительно, указанный полипептид имеет 3, 4, 5, 6, 7, 8, 9 или 10 лиганд-связывающих доменов. Предпочтительно, указанный полипептид имеет более чем 10 лиганд-связывающих доменов.
В еще одном предпочтительном воплощении данного изобретения указанный полипептид имеет 4, 6, 8,10 или 12 лиганд-связывающих доменов.
В предпочтительном воплощении данного изобретения указанный полипептид включает в себя по меньшей мере четыре лиганд-связывающих домена.
В еще одном воплощении данного изобретения указанный полипептид представляет собой антагонист.
В альтернативном предпочтительном воплощении данного изобретения указанный полипептид представляет собой агонист.
В еще одном предпочтительном воплощении данного изобретения указанный лиганд-связывающий домен выбран из лиганд-связывающих доменов цитокинов, выбранных из группы, состоящей из: гормона роста; лептина; эритропоэтина; пролактина; интерлейкинов (ИЛ), ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-10, ИЛ-11; субъединицы р35 интерлейкинов ИЛ-12, ИЛ-13, ИЛ-15; гранулоцитарного колониестимулирующего фактора (Г-КСФ); гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ); цилиарного нейротрофического фактора (CNTF); кардиотропина-1 (СТ-1); фактора, ингибирующего лейкемию (LIF); онкостатина М (OSM); интерферона, ИФНα и ИФНγ.
В предпочтительном воплощении данного изобретения указанный лиганд-связывающий домен представляет собой лиганд-связывающий домен гормона роста.
Одна молекула гормона роста человека (чГР) связывается с двумя молекулами РГР. Молекула чГР взаимодействует с одной молекулой рецептора посредством сайта высокой аффинности и с другой молекулой посредством сайта низкой аффинности. Одна цепь белка, состоящая из чГР, связанного с чГР, содержит два сайта высокой аффинности, которые могут прочно связываться с парой молекул рецепторов и двумя сайтами низкой аффинности.
В одном воплощении данного изобретения две или более чем две копии лиганд-связывающего домена экспрессируются на одной полипептидной цепи, и последовательность тандема или олигомерного цитокина располагается в порядке лиганд-связывающий домен - линкер - лиганд-связывающий домен.
В еще одном предпочтительном воплощении данного изобретения указанный лиганд-связывающий домен представляет собой связывающий домен лептина.
Предпочтительно, линкер включает в себя по меньшей мере одну копию пептида:
Gly Gly Gly Gly Ser Ser Ser Ser (далее называемый как "Gly4Ser4").
В одном воплощении данного изобретения линкер имеет длину 8 аминокислот и состоит из одной копии линкера Gly4Ser4. В альтернативном воплощении данного изобретения линкер имеет длину 16 аминокислот и состоит из двух копий линкера Gly4Ser4. В еще одном альтернативном воплощении данного изобретения указанный линкер имеет длину 24 аминокислоты и состоит из трех копий линкера Gly4Ser4.
Более предпочтительно, линкер представляет собой полипептид, который включает в себя от 5 до 50 аминокислотных остатков. Наиболее предпочтительно, линкер включает в себя от 5 до 30 аминокислотных остатков.
Наиболее предпочтительно, линкер включает в себя по меньшей мере одну копию пептида:
Gly Gly Gly Gly Ser (далее называемый как "(Gly4Ser") или (G4S)).
В первом воплощении данного изобретения линкер имеет длину 5 аминокислот и состоит из одной копии линкера (Gly4Ser). В альтернативном воплощении данного изобретения линкер имеет длину 10 аминокислот и состоит из двух копий линкера (Gly4Ser)2. В еще одном альтернативном воплощении данного изобретения указанный линкер имеет длину 15 аминокислот и состоит из трех копий линкера (Gly4Ser). В еще одном альтернативном воплощении данного изобретения указанный линкер имеет длину 20 аминокислот и состоит из 4 копий линкера (Gly4Ser)4.
В альтернативном воплощении данного изобретения полипептид представляет собой слитый белок, включающий в себя внутри рамки считывания трансляционные слияния лиганд-связывающих доменов по данному изобретению.
Специалисту в данной области техники понятно, что для сшивки лиганд-связывающих доменов могут быть использованы альтернативные линкеры, например, могут быть использованы химические белковые кросс-линкеры. Например, гомобуфункциональный кросс-линкер, такой как дисукцинимидил-суберимидат-дигидрохлорид; диметил-адипимидат-дигидрохлорид; 1,5,-2,4-динитробензол; либо гетеробифункциональные кросс-линкеры, такие как N-гидроксисукцинимидил-2,3-дибромпропионат; гидрохлорид 1-этил-3-[3-диметиламинопропил]карбодиимида; сукцинимидил-4-[н-малеимидометил]-циклогексан-1-карбоксилат.
Дополнительные примеры химических кросс-линкеров включают в себя химически модифицированные линкерные молекулы и/или лиганд-связывающие домены. Например, если один конец линкерной молекулы оканчивается аминоконцевым остатком лизина, и лиганд связывается с карбоксиконцевым остатком глутамина, то лиганд-связывающие домены могут быть олигомеризованы с трансглутаминазой.
В соответствии с еще одним аспектом данного изобретения предложена молекула нуклеиновой кислоты, включающая в себя последовательность нуклеиновой кислоты, которая кодирует полипептид по данному изобретению.
В предпочтительном воплощении данного изобретения указанная молекула нуклеиновой кислоты включает в себя последовательность нуклеиновой кислоты, выбранную из группы, состоящей из:
1) последовательности, представленной на Фиг.4 или 6;
2) последовательности, которая гибридизуется с последовательностью (1), указанной выше, и которая обладает активностью модулирования рецептора цитокина; и
3) последовательности, которая является вырожденной в результате генетического кода до последовательностей, определенных в (1) и (2) выше.
В предпочтительном воплощении данного изобретения указанная нуклеиновая кислота гибридизуется в строгих условиях гибридизации до последовательностей, представленных на Фиг.4 или 6.
Хорошо известно из уровня техники, что оптимальные условия гибридизации могут быть рассчитаны в том случае, если известна последовательность нуклеиновой кислоты. Например, условия гибридизации могут быть определены по содержанию GC в нуклеиновой, кислоте, которая подвергается гибридизации. Описано в Sambrok et. al. (1989) Molecular Cloning; A Laboratory Approach. Общая формула для расчета строгости условий, необходимых для достижения гибридизации между молекулами нуклеиновой кислоты определенной гомологии, представляет собой:
Тm=81,5°С+16,6 Log [Na+]+0,41[%G+С]-0,63 (% формамид).
Типично, в условиях гибридизации используют 4-6x SSPE (20x SSPE содержит 175,3 г NaCl, 88,2 г NaH2PO4 Н2О и 7,4 г этилендиаминтетрауксусной кислоты (ЭДТА), растворенной в 1 литре, и рН доведен до 7,4); 5-10x раствора Денхардса (50х раствор Денхардса содержит 5 г фиколла (Ficoll, тип 400, Pharmacia), 5 г поливинилпирролидона и 5 г бычьего сывороточного альбумина/500 мл; 100 мкг-1,0 мг/мл обработанной ультразвуком ДНК лосося/сельди; 0,1-1,0% додецилсульфат натрия; возможно 40-60% деионизированный формальдегид. Температура гибридизации изменяется в зависимости от содержания GC в последовательности нуклеиновой кислоты - мишени, но, как правило, составляет от 42 до 65°С.
В соответствии с еще одним аспектом данного изобретения предложен полипептид, кодируемый молекулой нуклеиновой кислоты по данному изобретению.
В предпочтительном воплощении данного изобретения кодируемый таким образом полипептид модифицирован путем делеции, добавления или замещения по меньшей мере одного аминокислотного остатка. В идеале, указанная модификация усиливает антагонистическое или агонистическое действие указанного полипептида в отношении ингибирования или активации опосредованной рецептором передачи сигнала в клетке.
Альтернативно или предпочтительно указанная модификация включает в себя использование модифицированных аминокислот при получении рекомбинантных или синтетических форм полипептидов.
Специалисту в данной области техники понятно, что модифицированные аминокислоты включают в себя, в качестве примера, а не ограничения, 4-гидроксипролин, 5-гидроксилизин, N6-ацетиллизин, N6-метиллизин, N6,N6-диметиллизин, N6,N6,N6-триметиллизин, циклогексиаланин, D-аминокислоты, орнитин. Включение модифицированных аминокислот может обеспечить полипептидам благоприятные свойства. Например, включение модифицированных аминокислот может увеличить аффинность полипептида в отношении сайта его связывания, или модифицированные аминокислоты могут обеспечить полипептидам увеличенную стабильность in vivo, таким образом давая возможность для уменьшения эффективного количества терапевтического полипептида, вводимого пациенту.
В соответствии с еще одним аспектом данного изобретения предложен вектор, включающий в себя молекулу ДНК по любому предшествующему аспекту или воплощению данного изобретения.
В предпочтительном воплощении данного изобретения указанный вектор предложен для получения полипептида по данному изобретению рекомбинантным способом.
В предпочтительном воплощении данного изобретения указанный вектор представляет собой вектор экспрессии, адаптированный для экспрессии прокариотических генов.
Прокариотические системы экспрессии хорошо известны в уровне техники и включают в себя векторы, адаптированные для высокоуровневой конститутивной и индуцибельной экспрессии. Системы индуцибельной экспрессии особенно благоприятны в том случае, если рекомбинантный полипептид токсичен для бактериальной клетки. Индукция экспрессии строго регулируется промоторами, чувствительными к различным индукторам (например, изопропилтиогалактозид (IPTG)-индуцибельные). Бактериальные клетки могут расти до стационарной фазы перед индукцией, тем самым уменьшая вредные эффекты токсических полипептидов.
Кроме того, из уровня техники хорошо известно, что некоторые полипептиды сложно получать рекомбинантным способом вследствие, например, нестабильности белка или проблем агрегации. Хорошо известно, что доступны генетически модифицированные бактериальные штаммы, которые имеют мутации в генах (например, бактериальных протеаз), которые облегчают получение нативных и рекомбинантных бактериальных полипептидов.
В еще одном предпочтительном воплощении данного изобретения указанный вектор представляет собой вектор экспрессии, адаптированный для экспрессии эукариотических генов.
Типично указанная адаптация включает в себя в качестве примера, а не ограничения, последовательности контроля транскрипции (последовательности промотора), которые опосредуют экспрессию. Эти последовательности промотора могут быть клеточно/тканеспецифичными, индуцибельными или конститутивными.
Промотор представляет собой термин, признанный в области техники, и, для ясности, включает следующие признаки, которые приведены исключительно в качестве примера, а не ограничения. Энхансерные элементы представляют собой цис-действующие последовательности нуклеиновой кислоты, часто обнаруживаемые в положении 5' относительно сайта инициации транскрипции гена (энхансеры могут также быть обнаружены в положении 3' относительно последовательности гена или даже могут быть расположены в последовательностях интронов и поэтому независимы от положения). Функция энхансеров в том, чтобы усиливать степень транскрипции гена, с которым этот энхансер связан. Энхансерная активность чувствительна к транс-действующим факторам транскрипции (полипептидам), которые, как было показано, специфически связываются с энхансерными элементами. Связывающая активность факторов транскрипции (описано в Eukaryotic Transcription Factors, by David S. Latchman, Academic Press Ltd., San Diego) чувствительна к множеству сигналов из окружающей среды, которые включают в себя в качестве примера, а не ограничения, метаболиты-посредники (например, глюкоза, липиды), эффекторы окружающей среды (например, свет, тепло).
Промоторные элементы также включают в себя так называемую последовательность ТАТА и последовательности выбора РНК-полимеразы для инициации (RIS), которые действуют для выбора сайта инициации транскрипции. Эти последовательности также связываются с полипептидами, которые действуют, среди прочего, для облегчения выбора инициации транскрипции РНК-полимеразой.
Адаптации также включают в себя селектируемые маркеры и последовательности автономной репликации, которые оба способствуют поддержанию указанного вектора в эукариотической клетке или прокариотическом хозяине. Векторы, которые поддерживаются автономно, называют также эписомными векторами.
Адаптации, которые способствуют экспрессии генов, кодируемых в векторе, включают в себя транскрипцию последовательностей терминации/полиаденилирования. Они также включают в себя внутренние сайты вхождения в рибосому (IRES), которые действуют для максимизации экспрессии генов, кодируемых в векторе, расположенных в бицистроновых или мультицистроновых кассетах экспрессии.
Эти адаптации хорошо известны из уровня техники. В литературе имеется значительное количество публикаций, касающихся создания векторов экспрессии и общей технологии рекомбинантной ДНК. Описано в Sambrook et. al. (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory, Cold Spring Harbour, NY и ссылки в ней; Marston, F (1987) DNA Cloning Techniques: A Practical Approach Vol. Ill IRL Press, Oxford UK; DNA Cloning: F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994).
В еще одном аспекте данного изобретения предложен способ получения полипептида по данному изобретению, при котором:
1) культивируют клетку, трансформированную или трансфицированную нуклеиновой кислотой или вектором по настоящему изобретению, в условиях, благоприятных для получения указанного полипептида; и
2) очищают указанный полипептид от указанных клеток или культуральной среды.
В предпочтительном способе по данному изобретению указанный вектор кодирует сигнал секреции, и тем самым указанный рекомбинантный полипептид обеспечен таким сигналом секреции для облегчения очистки указанного связывающего агент полипептида.
В еще одном аспекте данного изобретения предложена клетка, трансформированная/трансфицированная вектором или нуклеиновой кислотой по данному изобретению.
Предпочтительно, указанная клетка является эукариотической и выбрана из: клетки грибов; насекомых (например, Spodoptera frugiperda), амфибий; растений; млекопитающих.
Более предпочтительно, указанная клетка является прокариотической и представляет собой клетку Е.coll.
В соответствии с еще одним аспектом данного изобретения предложено применение полипептида по данному изобретению в качестве фармацевтического препарата. Предпочтительно, предложена фармацевтическая композиция, включающая в себя полипептид по данному изобретению. Предпочтительно, указанная фармацевтическая композиция включает в себя носитель, эксципиент и/или разбавитель.
В еще одном воплощении настоящего изобретения указанный полипептид применяют для приготовления лекарства при лечении заболевания, выбранного из группы, состоящей из: акромегалии; гигантизма; дефицита гормона роста (ГР); синдрома Тернера; почечной недостаточности; остеопороза; сахарного диабета; рака; ожирения; инсулинорезистентности; гиперлипидемии; гипертензии; анемии; аутоиммунного и инфекционного заболевания; воспалительных заболеваний, включая ревматоидный артрит.
В данном изобретении также предложен способ лечения субъекта человека или животного, при котором указанному субъекту вводят эффективное количество полипептида, фармацевтической композиции или лекарства.
Полипептиды или композиции по данному изобретению могут быть введены любым общепринятым путем, включая инъекцию, или путем постепенной инфузии в течение периода времени. Введение может быть, например, пероральным, внутривенным, внутрибрюшинным, внутримышечным, внутриполостным, подкожным, трансдермальным, или представлять собой доставку посредством непатологического генетически модифицированного организма (genetically modified organism, GMO), сконструированного для секреции полипептида.
Фармацевтические композиции, применяемые в вышеупомянутых способах, предпочтительно являются стерильными и содержат эффективное количество полипептида по данному изобретению для получения желаемого ответа в единице массы или объема, подходящей для введения пациенту.
При введении фармацевтические препараты по данному изобретению применяют в фармацевтически приемлемых количествах и в фармацевтически приемлемых композициях. Термин "фармацевтически приемлемый" означает нетоксичное вещество, которое не влияет на проявление биологической активности активных ингредиентов. Такие препараты могут стандартно содержать соли, буферные агенты (например, уксусную кислоту в виде соли; лимонную кислоту в виде соли; борную кислоту в виде соли и фосфорную кислоту в виде соли), консерванты (например, хлорид бензалкония; хлорбутанол; парабены и тимеросал, совместимые носители и, возможно, другие терапевтические агенты).
Композиции могут быть объединены, если желательно, с фармацевтически приемлемым носителем. Используемый здесь термин "фармацевтически приемлемый носитель" означает один или более чем один совместимый твердый или жидкий наполнитель, разбавитель либо инкапсулирующее вещество, которые пригодны для введения человеку. Термин "носитель" означает органический или неорганический ингредиент, природный или синтетический, с которым объединяют активный ингредиент для облегчения применения.
Фармацевтические композиции могут для удобства быть представлены в виде лекарственной формы и могут быть приготовлены любым способом, хорошо известным в области фармации. Все способы включают в себя стадию объединения активного агента с носителем, который составляет один или более чем один дополнительный ингредиент. В общем композиции готовят путем равномерного и однородного объединения активного соединения с жидким носителем, мелкоизмельченным твердым носителем или обоими и затем, если необходимо, формования продукта.
Композиции, пригодные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, таблетки, лепешки, каждая из которых содержит определенное количество активного соединения. Другие композиции включают в себя суспензии в водных жидкостях или неводных жидкостях, таких как сироп, эликсир или эмульсия.
Композиции, пригодные для парентерального введения, для удобства включают в себя стерильный водный или неводный препарат полипептидов, который предпочтительно является изотоническим с кровью реципиента. Этот препарат может быть приготовлен в соответствии с известными способами с использованием диспергирующих агентов или увлажнителей и суспендирующих агентов. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут применяться, имеются вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение в качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла. Для этой цели может быть использовано любое мягкое жирное масло, включая синтетические моно- или диглицериды. В дополнение при приготовлении инъецируемых растворов могут быть использованы жирные кислоты, такие как олеиновая кислота. Препараты носителя, пригодные для перорального, подкожного, внутривенного, внутримышечного и другого введения, могут быть обнаружены в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA.
В соответствии с еще одним аспектом данного изобретения предложен способ лечения, при котором животному, предпочтительно человеку, вводят эффективное количество нуклеиновой кислоты или вектора по данному изобретению.
Воплощение данного изобретения далее будет описано только в качестве примера и со ссылкой на следующие чертежи, где:
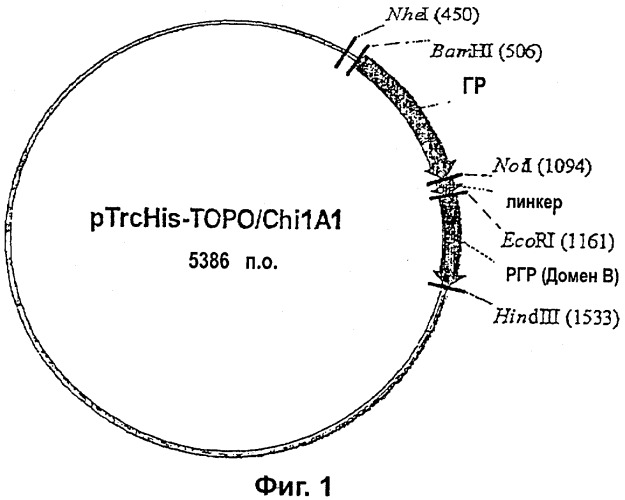
Фиг.1 иллюстрирует карту плазмиды pTrcHisχ1A1.
Фиг.2 иллюстрирует праймеры, использованные в синтезе тандемных конструкций.
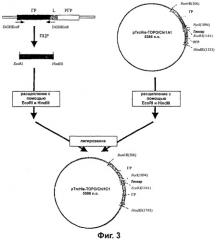
Фиг.3 представляет собой схематическую диаграмму конструкции pTrcHisχ1C1. pTrcHisχ1C2 сконструирован таким же образом, однако используемый прямой праймер представляет собой DiGHNotF, и используемые рестрикционные ферменты представляют собой NotI и HindIII.
Фиг.4 иллюстрирует последовательность ДНК для тандема гормона роста, разделенного тромбин-расщепляемым линкером. Линкерный участок показан курсивом, тогда как тромбин-расщепляемый сайт изображен жирным шрифтом.
Фиг.5 иллюстрирует белковую последовательность для тандема гормона роста, разделенного тромбин-расщепляемым линкером. Линкерный участок показан курсивом, тогда как тромбин-расщепляемый сайт изображен жирным шрифтом.
Фиг.6 иллюстрирует последовательность ДНК для тандема лептина, разделенного тромбин-расщепляемым линкером. Линкерный участок показан курсивом, тогда как тромбин-расщепляемый сайт изображен жирным шрифтом.
Фиг.7 иллюстрирует белковую последовательность для тандема лептина, разделенного тромбин-расщепляемым линкером. Линкерный участок показан курсивом, тогда как тромбин-расщепляемый сайт изображен жирным шрифтом. В этой конструкции возможен расщепляемый линкер.
Фиг.8 демонстрирует окрашенный Кумасси полиакриламидный гель с додецилсульфатом натрия (SDS-PAGE) и вестерн-блот очищенного ГР-тандема (χ1С1).
Фиг.9 представляет собой данные биологического анализа, полученные для χ1С1, вместе с данными для ГР собственной разработки и приобретенным ГР для сравнения. Активность тандема подобна активности ГР собственной разработки. В каждом случае используемые концентрации тестируемого белка составляли 0; 6,25; 12,5; 25; 50 и 100 нг.
Фиг.10 представляет собой схематическую диаграмму, иллюстрирующую конструкцию pTrcHisχd.
Фиг.11 демонстрирует вестерн-блот SDS-PAGE, на котором было осуществлено разделение белков, экспрессированных клонами клеток E. coli SURE:pTrcHisχ2C1. Ожидаемый размер лептинового тандема составляет приблизительно 37 кДа и при этом размере наблюдается слабая полоса. Основная полоса, тем не менее, приблизительно имеет размер в половину от этого размера. Это свидетельствует о том, что лептиновый тандем экспрессируется, но, наиболее вероятно, расщепляется до одиночных лептиновых доменов.
Материалы и методы
Последовательность, кодирующая РГР в pTrcHisχ1A1 (Фиг.1), была заменена другим геном ГР (остатки 1-191) с получением двух последовательных генов HP, соединенных линкером (G4S)4. Полученная в результате конструкция (pTrcHisχ1C1) была трансформирована в клетки Е. coli SURE, представляющую собой штамм Е. coli с дефицитной рекомбинантной ДНК. Клоны, экспрессирующие белок ГР-(G4S)4-ГР, были идентифицированы путем вестерн-блоттинга с использованием анти-ГР (10А7, lgG1 мыши), обнаруживаемых с помощью антител овцы против антител мыши, связанных с пероксидазой хрена (HRP) (Amersham). С использованием того же самого метода был также сконструирован другой ГР-тандем (ГР-ГР), который лишен линкера (G4S)4 (pTrcHisχ1C2).
ГР-тандемный белок был очищен от клеточных лизатов с использованием аффинной колонки, хелатирующей металлы (смола Probond, Invitrogen) с последующей ионообменной колонкой (Mono Q, Pharmacia).
Эффект ГР-тандемных белков анализировали с использованием общепризнанного биологического анализа (Ross et at., 1997).
Ген лептина изначально клонировали в рНЕАТ, представляющий собой вектор, индуцируемый температурой. Однако для экспрессии в клетках Е. coli SURE ген субклонировали в плазмиду pTrcHis. Затем вводили линкер (G4S)4 и, наконец, второй лептиновый домен встраивали в этот ген с получением конструкции которая будет экспрессировать тандем лептина. Конструкция pTrcHisχ2C1 затем была трансформирована в клетки Е. coli SURE. Экспрессию тандема лептина контролировали вестерн-блотом с использованием антилептиновых антител (Sigma), полученных у кролика, которые обнаруживали при помощи антител против антител кролика, связанных с HRP (Sigma).
Клонирование ГР-тандемов
Для получения фрагмента ДНК, состоящего из сайта рестрикции (NotI или EcoRI) с последующим геном ГР и затем сайтом рестрикции HindIII, использовали полимеразную цепную реакцию (ПЦР). Его встраивали в pTrcHisχ1A1, который расщепляли соответствующими рестрикционными ферментами, с получением конструкций χ1C1(ГР-(G4S)4-ГР) и χ1С2(ГР-ГР). Используемые праймеры для ПЦР показаны на Фиг.2, а схема реакции изображена на Фиг.3.
Очистка ГР-тандемов
Индуцированные клетки (ресуспендированные в 20 мМ буфере фосфата натрия, 500 мМ хлорида натрия, рН 7,8) подвергали лизису с использованием комбинации 100 мкг/мл (конечная концентрация) лизоцима яичного белка курицы и ультразвука. Нерастворимый материал удаляли путем центрифугирования при 4000 об/мин в течение 20 минут.
Очищенный клеточный лизат наносили на колонку 5 мл со смолой Probond (Invitrogen), уравновешенную 20 мМ буфером фосфата натрия, 500 мМ хлорида натрия, 5% глицерина, рН 7,8. Колонку затем промывали десятикратным объемом 20 мМ буфера фосфата натрия, 500 мМ хлорида натрия, 5% глицерина, рН 6,0. Связанный белок элюировали с использованием 5 мл 20 мМ буфера фосфата натрия, 500 мМ хлорида натрия, 5% глицерина, 500 мМ имидазола, рН 6,0.
Белок подвергали диализу в течение ночи против низкосолевого буфера (25 мМ TRIS, 1 мМ ЭДТА, 5% глицерин, рН 8,0) и затем центрифугировали для удаления материала в виде частиц. Образец белка затем наносили на колонку Mono-Q (Pharmacia), которую предварительно уравновешивали низкосолевым буфером. После десятикратной промывки колонки низкосолевым буфером связавшиеся белки элюировали 20 объемами колонки, используя градиент от 0М хлорида натрия до 1М хлорида натрия (в 25 мМ TRIS, 1 мМ ЭДТА, 5% глицерин, рН 8,0). Пики на профиле элюции анализировали, используя SDS-PAGE и вестерн-блоттинг.
ГР-тандемный белок затем концентрировали (если требуется) с использованием колонки Amicon Centiprep Y-10.
Чистоту очищенного χ1С1 подтверждали, используя SDS-PAGE с окрашиванием Кумасси и вестерн-блот (Фиг.8). Как только была подтверждена целостность этого образца, χ1С1 подвергали упомянутому ранее общепризнанному биологическому анализу (Ross el al., 1997) (Фиг.9).
Клонирование тандемов лептина
Для получения последовательности ДНК, состоящей из (NheI)-LEPTIN-(NotI)-(XhoI)-(SalI)-STOP-(EcoRI), из pHEATLeptin использовали ПЦР с применением праймеров Lep2TrcFOR и Lep2TrcREV (Фиг.2). Концевые сайты рестрикции вводили путем ПЦР, а внутренние сайты рестрикции уже присутствовали в векторе pHEATLeptin. Полученный продукт ПЦР встраивали в pTrcHisχ1A1 между сайтами рестрикции NheI и EcoRI с получением pTrcHisLeptin.
ПЦР затем использовали для получения (G4S)4-кодирующего линкера, фланкированного сайтами рестрикции NotI и XhoI, причем используемые праймеры представляли собой LepLinkFOR и LepLinkREV (Фиг.2). Его затем встраивали в pTrcHisLeptin между сайтами NotI и XhoI с получением pTrcHisLepLink.
Второй ген лептина, фланкированный сайтами рестрикции XhoI и Sail, был получен путем ПЦР с использованием праймеров Lep2FOR и Lep2REV (Фиг.2). Его встраивали между сайтами рестрикции XhoI и SalI с получением конструкции, которая будет экспрессировать тандем лептина, pTrcHisχ2C1. Этот процесс получения тандема лептина показан на Фиг.10.
Эту плазмиду трансформировали в клетки Е. coli SURE и осуществляли исследование экспрессии, причем визуализацию экспрессии осуществляли, используя вестерн-блот (Фиг.11).
Литература
1. ARGETSINGER, L.S. & CARTER-SU, С. (1996) Growth hormone signalling mechanisms: involvement of the tyrosine kinase JAK2. [Review] [19 refs]. Hormone Research, 45 Suppl1, 22-24
2. CHEN, C., BRINKWORTH, R. & WATERS, M.J. (1997) The role of receptor dimerization domain residues in growth hormone signaling. Journal of Biological Chemistry, 272, 5133-5140.
3. CHEN, W.Y., CHEN, N.Y., YUN, J., WAGNER, Т.Е. & KOPCHICK, J.J. (1994) In vitro and in vivo studies of antagonistic effects of human growth hormone analogs [published erratum appears in J Biol Chem 1994 Aug 12; 269(32):20806]. Journal of Biological Chemistry, 269, 15892-15897.
4. CHEN, W.Y., WHITE, M.E., WAGNER, Т.Е. & KOPCHICK, J.J. (1991) Functional antagonism between endogenous mouse growth hormone (GH) and a GH analog results in dwarf transgenic mice. Endocrinology, 129, 1402-1408.
5. CHEN, W.Y., WIGHT, D.C., MEHTA, B.V., WAGNER, Т.Е. & KOPCHICK, J.J. (1991) Glycine 119 of bovine growth hormone is critical for growth-promoting activity. Molecular Endocrinology, 5, 1845-1852.
6. CHEN, W.Y., WIGHT, D.C., WAGNER, Т.Е. & KOPCHICK. J.J. (1990) Expression of a mutated bovine growth hormone gene suppresses growth of transgenic mice. Proceedings of the National Academy of Sciences of the United States of America, 87, 5061-5065.
7. CLACKSON, Т., ULTSCH, M.H., WELLS, J.A., & DE VOS, A.M. (1998) Structural and functional analysis of the 1:1 growth hormone:receptor complex reveals the molecular basis for receptor affinity. Journal of Molecular Biology, 277, 1111-1128.
8. CUNNINGHAM, B.C., ULTSCH, M., DE VOS, A.M., MULKERRIN, M.G, CLAUSER, K.R., & WELLS, J.A. (1991) Dimerization of the extracellular domain of the human growth hormone receptor by a single hormone molecule. Science, 254, 821-825.
9. DE VOS, A.M., ULTSCH. M. & KOSSIAKOFF, A.A. (1992) Human growth hormone and extracellular domain of its receptor:crystal structure of the complex. Science, 255, 306-312.
10. FUH, G., CUNNINGHAM, B.C., FUKUNAGA, R., NAGATA, S., GOEDDEL, D.V. & WELLS, J.A, (1992) Rational design of potent antagonists to the human growth hormone receptor. Science, 256, 1677-1680.
11. HANIU, M., ARAKAWA, Т., BURES, E.J., YOUNG, Y., HUI, J.O., ROHDE, M.F., WELCHER, A.A. & HORAN, T. (1998) Human leptin receptor. Determination of disulfide structure and N-glycosylation sites of the extracellular domain. Journal of Biological Chemistry, 273, 28691-28699.
12. HIROIKE, Т., HIGO, J., JINGAMI, H. & ТОН, Н. (2.000) Homology modelin