Окса- и тиазолпроизводные в качестве антидиабетических агентов и агентов против ожирения
Иллюстрации
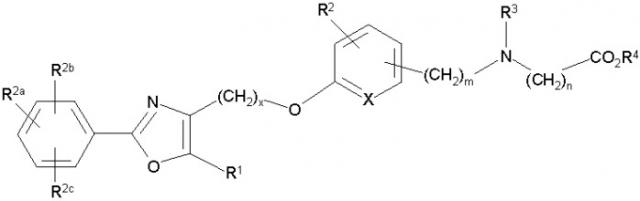
Показать всеИзобретение относится к окса- и тиазолпроизводным общей формулы
и их стереоизомерам и фармацевтически приемлемым солям, обладающим PPARα и PPARγ активностью. Соединения могут найти применение для лечения заболеваний, опосредованных PPARα и PPARγ активностью, например диабета и аномалий липопротеинов. В общей формуле x имеет значение 1, 2, 3 или 4; m имеет значение 1 или 2; n имеет значение 1 или 2; Q представляет собой С или N; А представляет собой О или S; Z представляет собой О или связь; R1 представляет собой Н или С1-8алкил; X представляет собой СН; R2 представляет собой Н; R2a, R2b и R2c могут быть одинаковыми или различными и их выбирают из Н, алкокси, галогена; R3 представляет собой арилоксикарбонил, алкилоксикарбонил, алкил(галоген)арилоксикарбонил, алкилокси(галоген)арилоксикарбонил, циклоалкиларилоксикарбонил, циклоалкилоксиарилоксикарбонил, арилкарбониламино, алкилсульфонил, циклогетероалкилоксикарбонил, гетероарилалкенил, алкоксиарилоксикарбонил, арилалкилоксикарбонил, алкиларилоксикарбонил, галогеналкоксиарилоксикарбонил, алкоксикарбониларилоксикарбонил, арилалкенилоксикарбонил, арилоксиарилалкилоксикарбонил, арилалкенилсульфонил, гетероарилсульфонил, арилсульфонил, арилалкениларилалкил, арилалкоксикарбонилгетероарилалкил, гетероарилоксиарилалкил, где алкил представляет собой С1-8алкил; Y представляет собой CO2R4, где R4 представляет собой Н или С1-8алкил; включая все их стереоизомеры и фармацевтически приемлемые соли, при условии, что если А представляет собой О, тогда R3 не является арилоксикарбонилом или алкоксиарилоксикарбонилом. 1 н. и 9 з.п. ф-лы, 12 табл.
Реферат
Область техники
Настоящее изобретение относится к новым замещенным производным кислоты, которые модулируют уровень глюкозы в крови, уровень триглицеридов, уровень инсулина и уровень неэтерифицированных жирных кислот (NEFA) и, следовательно, особенно полезны для лечения диабета и ожирения, а также к способу лечения диабета, особенно диабета типа 2, так же как и гипергликемии, гиперинсулинемии, гиперлипидемии, ожирения, атеросклероза и родственных болезней, при применении таких замещенных производных кислоты отдельно или в сочетании с другим антидиабетическим агентом и/или гиполипидемическим агентом.
Описание изобретения
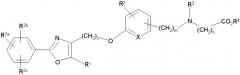
В соответствии с настоящим изобретением предложены замещенные производные кислоты формулы I
где x имеет значение 1, 2, 3 или 4; m имеет значение 1 или 2; n имеет значение 1 или 2;
Q представляет собой С или N;
А представляет собой О или S;
Z представляет собой О или связь;
R1 представляет собой низший алкил;
X представляет собой СН;
R2 представляет собой Н;
R2a, R2b и R2c могут быть одинаковыми или различными и их выбирают из Н, алкокси, галогена;
R3 представляет собой арилоксикарбонил, алкилоксикарбонил, алкил(галоген)арилоксикарбонил, алкилокси(галоген)арилоксикарбонил, циклоалкиларилоксикарбонил, циклоалкилоксиарилоксикарбонил, арилкарбониламино, алкилсульфонил, циклогетероалкилоксикарбонил, гетероарилалкенил, алкоксиарилоксикарбонил, арилалкилоксикарбонил, алкиларилоксикарбонил, галогеналкоксиарилоксикарбонил, алкоксикарбониларилоксикарбонил, арилалкенилоксикарбонил, арилоксиарилалкилоксикарбонил, арилалкенилсульфонил, гетероарилсульфонил, арилсульфонил, арилалкениларилалкил, арилалкоксикарбонилгетероарилалкил, гетероарилоксиарилалкил;
циклоалкил обозначает насыщенные или частично ненасыщенные (содержащие 1 или 2 двойные связи) циклические углеводородные группы, содержащие от 1 до 3 колец, включая моноциклоалкил, бициклоалкил и трициклоалкил, содержащие в общем от 3 до 20 атомов углерода, образующих кольца, предпочтительно от 3 до 10 атомов углерода, образующих кольца;
арил обозначает моноциклические или бициклические ароматические группы, содержащие от 6 до 10 атомов углерода в кольце, выбранном из фенила или нафтила, включая 1-нафтил и 2-нафтил и могут необязательно включать от одного до трех дополнительных колец, сконденсированных с карбоциклическим или гетероциклическим кольцом, выбранным из арильного, циклоалкильного, гетероарильного или циклогетероалкильного кольца;
гетероарил обозначает 5- или 6-членное ароматическое кольцо, которое содержит 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода или серы, и такие кольца сконденсированы с арильным кольцом;
циклогетероалкил обозначает циклогетероалкильную группу, 5- или 6-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, которое содержит 1, 2 или 3 гетероатома, выбранных из N, О или S, связанное через С атом или гетероатом с (СН2)p цепью; р имеет значение 0 или 1;
гетероарилалкенил обозначает гетероарильную группу, связанную через С атом или гетероатом с алкиленом или алкениленом;
Y представляет собой CO2R4, где R4 представляет собой Н или алкил,
где во всех указанных группах алкил представляет собой С1-8алкил, алкенил представляет собой С2-8алкенил, алкилен представляет собой C1-8алкилен, алкенилен представляет собой С2-8алкенилен,
включая все их стереоизомеры и фармацевтически приемлемые соли, при условии, что если А представляет собой О, тогда R3 не является арилоксикарбонилом или алкоксиарилоксикарбонилом.
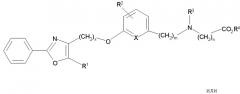
Соединения формулы I по изорбетению могут иметь структуру
или
Предпочтительными являются соединения формулы I по изобретению, имеющие структуру
Более предпочтительными являются соединения формулы I по изобретению, имеющие структуру
В указанных выше соединениях наиболее предпочтительно, когда R2а представляет собой алкокси, но более предпочтительно Н, Z представляет собой связь, но более предпочтительно О, (СН2)x представляет собой СН2, (СН2)2, (СН2)3 или , (СН2)m представляет собой СН2, или (где Ra представляет собой алкил, такой как метил, или алкенил, такой как или , (СН2)n представляет собой СН2, R1 представляет собой низший алкил, предпочтительно -СН3, R2 представляет собой Н, R2a представляет собой Н, R4 представляет собой Н, X представляет собой СН и R3 представляет собой арилалкилоксикарбонил, арилгетероарилалкил, арилоксиарилалкил, арилалкил, арилоксикарбонил, галогенарилоксикарбонил, алкоксиарилоксикарбонил, алкиларилоксикарбонил, арилоксиарилоксикарбонил, гетероарилоксиарилалкил, гетероарилоксикарбонил, арилоксиарилкарбонил, арилалкенилоксикарбонил, циклоалкиларилоксикарбонил, арилалкиларилкарбонил, гетероарил-гетероарилалкил, циклоалкилоксиарилоксикарбонил, гетероарил-гетероарилкарбонил, алкилоксиарилоксикарбонил, арилалкилсульфонил, арилалкенилсульфонил, алкоксиарилалкил, арилтиокарбонил, циклогетероалкилалкилоксикарбонил, циклогетероалкилоксикарбонил или полигалогеналкиларилоксикарбонил, где указанные выше предпочтительные группы могут быть необязательно замещены.
Предпочтительные соединения по изобретению включают следующие:
Подробное описание изобретения
Соединения формулы I настоящего изобретения могут быть получены в соответствии со следующими общими схемами синтеза, также как и с опубликованными в литературе релевантными способами, которые используют специалисты данного уровня техники. Примеры реагентов и методики этих реакций описаны здесь далее, а также в рабочих примерах. Защита и снятие защиты в схемах, приведенных ниже, может осуществляться способами, хорошо известными из уровня техники (см., например, Greene, Т. W. и Wuts, P. G. M., Protecting Groups in Organic Synthesis, 3rd Edition, 1999 [Wiley]).
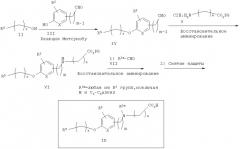
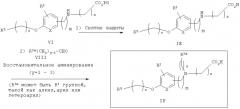
Схема 1 описывает общий синтез аминокислот, описанных в настоящем изобретении. Спирт II (R5(CH2)xOH) (наиболее предпочтительным является 2-фенил-5-метилоксазол-4-этанол) конденсируют с гидроксиарил- или гетероарилальдегидом III (предпочтительно 3- или 4-гидроксибензальдегидом) в стандартных условиях реакции Митсунобу (Mitsunobu) (например, Mitsunobu, О., Synthesis, 1981, 1). Образующийся альдегид IV затем подвергают восстановительному аминированию, используя методики, известные из уровня техники (например, Abdel-Magid и др., J. Org. Chem. 1996, 61, 3849), с гидрохлоридом α-аминоэфира V. PG на схеме 1 обозначает предпочтительную защитную группу для карбоновой кислоты, такую, как метиловый или трет-бутиловый эфир. Образующийся вторичный аминоэфир VI затем подвергают повторному восстановительному аминированию, используя способы, известные из уровня техники (например, Abdel-Magid и др., J. Org. Chem. 1996, 61, 3849), с R3a альдегидом VII. Конечное снятие защитных групп с эфира карбоновой кислоты в стандартных условиях, известных из уровня техники (Greene), при применении основных условий (для метиловых эфиров) или кислых условий (для трет-бутиловых эфиров) затем приводит к получению желаемых продуктов, которыми являются аминокислоты ID.
Альтернативный путь к альдегиду IV показан на схеме 1А. Спирт II (R5(CH2)хОН) (из которых наиболее предпочтительньм является 2-[2-фенил-5-метилоксазол-4-ил]этанол) обрабатывают метансульфонилхлоридом с получением соответствующего мезилата VIII. Мезилат затем алкилируют в стандартных основных условиях с помощью гидроксиарил- или гидроксигетероарилальдегида III с получением альдегида IV.
Альтернативный путь к аминокислотам IF показан на схеме 2. Со вторичного аминоэфира VI снимают защитные группы в стандартных условиях (основные условия, если защитной группой (PG) является метил; кислые условия, если PG является трет-бутилом) с получением соответствующей аминокислоты IE. Восстановительное аминирование с R3a альдегидом в аналогичных условиях, как описано на схеме 1, приводит к получению желаемых третичных продуктов аминокислот IF в качестве продуктов.
Альтернативно, как показано на схеме 3, третичные аминокислоты IF также могут быть получены алкилированием вторичного аминоэфира VI алкилирующим агентом IX (с подходящей уходящей группой (LG), такой, как галоген, мезилат или тозилат) в стандартных условиях, известных из уровня техники, с последующим стандартным снятием защитных групп с эфира карбоновой кислоты Х с получением аминокислот IF.
Как показано на схеме 4, третичная аминокислота IF может быть образована через восстановительное аминирование вначале R3a альдегида XI с подходящим гидрохлоридом аминоэфира V. Образующийся вторичный аминоэфир XII затем подвергают восстановительному аминированию с подходящим альдегидом алкила, арила или гетероарила IV (как на схеме 1) с последующим снятием защитных групп с эфира карбоновой кислоты с получением желаемых аналогов аминокислоты IF.
Дальнейшее замещение аминокислот показано на общей схеме синтеза 5. Восстановительное аминирование подходящего амина XIII арил- или гетероарилальдегидом XIV в стандартных условиях приводит к получению соответствующего вторичного амина XV, который затем подвергают реакции с галогенэфиром XVI (например, трет-бутилбромацетатом) с получением соответствующего α-аминоэфира XVII. У полученного аминоэфира XVII затем снимают защитные группы в стандартных условиях с получением желаемых аналогов аминокислоты IF.
Способ синтеза на схеме 5 также показывает общую схему синтеза соответствующих аминофосфорных кислот IFA, как показано на схеме 5а. Вторичный амин XV подвергают реакции с подходящим защищенным галогенфосфатом XVIA с получением соответствующего аминофосфатного эфира XVIIA, с которого затем снимают защитные группы в стандартных условиях (Greene & Wuts) с получением аминофосфорной кислоты IFA. На схеме 5b показан синтез аминофосфиновых кислот IFB, который также включают реакцию подходяще защищенного галогенфосфинатного эфира XVIB со вторичным амином XV. Снятие защитных групп образующегося аминофосфинатного эфира затем приводит к получению фосфиновой кислоты IFB.
Альтернативный способ к последовательности на схеме 5 показан на схеме 6. Гидроксиарил- или гетероариламин XVIII селективно защищают по азоту с получением защищенного амина XIX. Предпочтительный R5(CH2)nOH (II) затем подвергают реакции с XIX в условиях реакции Митсунобу (Mitsunobu) с получением соответствующего простого эфира, с последующим снятием защитных групп амина, с получением свободного амина XX. Свободный амин XX затем активируют стандартной активирующей группой (2,4-динитробензолсульфонамид; Т.Fukuyama и др., Tetrahedron Lett. 1997, 38, 5831) и затем обрабатывают α-галогенэфиром XVI, как показано на схеме 5. С 2,4-динитробензолсульфонамида XXI снимают защитные группы в условиях, известных из уровня техники (Т. Fukuyama и др., Tetrahedron Lett., 1997, 38, 5831) с получением вторичного α-аминоэфира XXII, который затем подвергают восстановительному аминированию с R3a альдегидом XI с последующим снятием защитных групп с эфира Х с получением желаемых аналогов IF.
Схема 7 описывает альтернативный общий путь к аналогам аминокислоты IG. Гидроксиарил или гетероарилальдегид III подвергают обычным условиям восстановительного аминирования с подходящим гидрохлоридом аминоэфира V. Образующийся вторичный аминоэфир XXIII функционализируют в данном случае повторным восстановительным аминированием с R3a альдегидом VII с получением соответствующего третичного гидроксиаминоэфира XXTV. Его можно подвергнуть реакции Митсунобу с соответствующим спиртом II (R5(CH2)nOH) с последующим снятием защитных групп эфира XXV, что приводит к получению желаемых аналогов IG.
Схема 8 описывает общий синтез диарил- и арилгетероарилзамещенных аналогов аминокислоты IH. Вторичный аминоэфир XXII подвергают восстановительному аминированию с подходяще замещенной формилфенилбороновой кислотой XXVI в стандартных условиях с получением соответствующего третичного аминоэфира бороновой кислоты XXVII. Арилбороновая кислота XXVII может затем подвергаться конденсации по Сузуки (Suzuki) (например, условия описаны в Gibson, S.E., Transition Metals in Organic Synthesis, A Practical Approach, pp.47-50, 1997) с арил- или гетероарилгалогенидами XXVIII (особенно бромидами) с получением подходящих межконденсированных диарильных продуктов XXIX. Снятие защитных групп с аминоэфира XXIX приводит к получению желаемых аналогов аминокислоты IH.
Схема 9 описывает общий синтез диарил- и арилгетероарилэфирозамещенных аналогов аминокислоты IJ. Третичный аминоэфир бороновой кислоты XXVII, который описан на схеме 8, может быть подвергут конденсации с подходяще замещенными фенолами XXX в условиях, известных из уровня техники (D.A.Evans и др., Tetrahedron Lett., 1998, 39, 2937) с получением соответствующих диарил- или арилгетероарилэфиров XXXI, которые после снятия защитных групп приводят к получению аналогов аминокислот IJ.
Альтернативно, как показано на схеме 10, восстановительное аминирование вторичного аминоэфира XXII с подходяще замещенным гидроксиарил- или гидроксигетероарилальдегидом XXXII приводит к получению соответствующего третичного феноламиноэфира XXXIII. Фенол XXXIII может далее подвергаться связыванию с подходящими арильными или гетероарильными бороновными кислотами XXXIV в условиях, известных из уровня техники (D.A.Evans и др., Tetrahedron Lett., 1998, 39, 2937) с получением соответствующих диарил- или арилгетероарилэфироамино сложных эфиров XXXI. Желаемые аналоги IJ могут затем быть получены снятием защитных групп аминоэфира XXXI.
На схеме 11 показан синтез карбаматокислотных аналогов IK. Вторичный аминоэфир XXII может реагировать с подходящими хлорформиатами XXXV в условиях, известных из уровня техники (оптимально в CH2Cl2 или CHCI3 в присутствии основания, такого, как Et3N) с получением соответствующих карбаматоэфиров. Желаемые аналоги IK затем получают после снятия защитных групп с карбаматоэфира. Альтернативно, вторичный аминоэфир XXII может реагировать с фосгеном с получением соответствующего карбамоилхлорида XXXVI. Указанный промежуточный карбамоилхлорид XXXVI может реагировать с R3a-OH (XXXVII) (оптимально замещенными фенолами) с получением соответствующих карбамат-кислот IK после снятия защитных групп.
На схеме 12 показана дальнейшая функционализация арильных карбаматокислотных аналогов IK. Вторичный аминоэфир XXII подвергают реакции с арилхлорформиатом XXXVIII (содержащим защищенную гидроксигруппу) с получением XXXIX. С гидроксильной группы затем селективно снимают защиту в присутствии эфира с получением XL, затем алкилируют подходящим R6-LG (XLI) (где LG представляет собой галонид, мезилат или тозилат и R6 представляет собой наиболее предпочтительно CHF2- или СН3СН2-) в присутствии основания. Снятие защитных групп с эфира затем приводит к получению желаемых карбаматокислотных аналогов IL.
Вторичный аминоэфир XXIIA может быть функционирован замещенными арильными или алифатическими карбоновыми кислотами XLII, в стандартных условиях получения пептида, как показано на схеме 13. Реакции образования амидной связи проводят в соответствии со стандартными методиками получения пептида, известными из уровня техники. Оптимально реакцию осуществляют в растворителе, таком, как ДМФА, при температуре от 0°С до комнатной, используя 1-этил-3-(3-диметиламинопропил)карбодиимид (EDAC или EDCI или WSC), 1-гидроксибензотриазол (НОВТ) или 1-гидрокси-7-азабензотриазол (НОАТ) и основание, например основание Ханига (Hunig) (диизопропилэтиламин), N-метилморфолин или триэтиламин. Снятие защитных групп с амидоэфира затем приводит к получению желаемых амидокислотных аналогов IM.
Вторичный аминоэфир XXIIA может также реагировать с алифатическими или арильными изоцианатами XLIII с получением соответствующих уреа-эфиров. Снятие защитных групп с уреа-эфиров приводит к получению желаемых уреа-кислотных аналогов IN, как показано на схеме 14. Альтернативно, как показано на схеме 15, промежуточный карбамоилхлорид XXXVI, описанный на схеме 11, может реагировать с подходящими алифатическими или арильньми аминами XLIV в присутствии третичного амина (например, Et3N) с получением три- или тетразамещенных мочевинокислотных аналогов IO или IP после снятия защитных групп с эфира.
Вторичный аминоэфир XXIIA может также реагировать с подходящими сульфонилхлоридами XL VI в стандартных условиях, известных из литературы (оптимально в присутствии основания, такого, как пиридин, чистого или в смеси с хлороформом в качестве сорастворителя), с последующим снятием защитных групп, с получением соответствующих сульфонамидных кислот IQ, как показано на схеме 16.
Замещение функциональной группы карбоновой кислоты в этих аналогах на тетразол может осуществляться, как показано на схеме 17. Кислотный аналог IK конденсируют с амином (содержащим подходящую тетразольную защитную группу) XLVII (предпочтительно 3-аминопропионитрил) в стандартных условиях получения пептида. Образующийся вторичный амид XLVIII затем подвергают реакции Митсунобу в стандартных условиях с триметилсилилазидом (TMSN3) с получением защищенного тетразола XLIX. Снятие защитных групп с цианоэтильной группы проводят предпочтительно в присутствии основания с получением желаемого свободного аналога тетразола IR.
Схема 18 описывает общий синтез гидразидокислотных аналогов IS. Замещенную арилкарбоновую кислоту 1 обрабатывают метансульфонилхлоридом в присутствии основания; промежуточное соединение затем подвергают реакции с защищенным гидразиноэфиром VA с получением соответствующего ацилированного гидразина 1а (см. Synthesis, 1989, 745-747).
Ацилгидразин 1а конденсируют с подходящим замещенным арилальдегидом IV в условиях восстановительного аминирования с получением соответствующего защищенного гидразида эфира 3 (см. Can. J. Chem., 1998, 76, 1180-1187).
Снятие защитных групп с эфира 3 затем приводит к получению гидразид-кислотных аналогов IS.
Альтернативный синтез, относящийся к гидразидокислотам IS, показан на схеме 19. Арилальдегид IV может быть восстановлен до соответствующего спирта в стандартных условиях (например, NaBH4), Указанный спирт затем превращают в соответствующий бромид 4, используя стандартные условия (например, Ph3Р/CBr4 или PBr3). Бромид 4 затем подвергают реакции с гидразинэфиром 1а (см. Tetrahedron Lett., 1993, 34, 207-210) с получением защищенного гидразидоэфира 3, с которого затем снимают защитные группы с получением гидразидокислотных аналогов IS.
Различные подходы к получению аналогов α-алкилбензиламинокислоты и карбамат-кислоты IT и IU представлены на следующих схемах синтеза. На схеме 20 подходящий замещенный арилальдегид IV обрабатывают подходящим органометаллическим реагентом (например, реактивом Гриньяра R10MgBr) в стандартных условиях с получением соответствующего вторичного спирта, который затем окисляют в стандартных условиях (например, окисление по Swern с (COCl)2/DMSO/Et3N или используя хлорхромат пиридиния) с получением соответствующего кетона 5. Восстановительное аминирование кетона 5 с подходяще замещенным аминоэфиром 6 приводит к получению соответствующего α-алкилбензиламиноэфира 7. Ясно, что в аминоэфире 6 остаток не обязательно представляет собой две повторяющееся единицы.
Ацилирование аминоэфира 7 с подходящим замещенным арил- или гетероарилхлорформиатом XXXV с последующим снятием защитных групп приводит к получению рацемических карбаматокислотных аналогов IT. Восстановительное аминирование алкилбензиламиноэфира 7 с арилальдегидом VII с последующим снятием защитных групп приводит к получению рацемических аминокислотных аналогов IU.
Альтернативно, как показано на схеме 21, асимметричное восстановление (например, с использованием способа оксазаборолидинового восстановления Corey; см. E.J. Corey & С. Helal, Angew. Chem. bit. Ed. Engl., 1998, 37, 1986-2012) арилкетона 5 приводит к получению любых желаемых энантиомерных спиртов 8 (хотя только один энантиомер показан на схеме). Обработка хирального спирта 8 азидом в реакции, подобной реакции Митсунобу (см. A.S. Thompson et. al, J. Org. Chem. 1993, 58, 5886-5888), приводит к получению соответствующего хирального азида (с обращением стереохимии в отношении исходного спирта). Азид затем превращают в амин 9 стандартными методами восстановления (например, гидрогенирование или Ph3Р/ТГФ/Н2О). Обработка хирального амина 9 эфиром XVIA (содержащим подходящую уходящую группу) приводит к получению вторичного аминоэфира 10. Ацилирование аминоэфира 10 с арил- или гетероарилхлорформиатом XXXV с последующим снятием защитных групп приводит к получению хиральных карбаматокислотных аналогов ITa (которые могут быть любыми энантиомерами в зависимости от стереохимии соединения 8). Восстановительное аминирование алкиламиноэфира 10 с арилальдегидами VII с последующим снятием защитных групп приводит к получению хиральных аминокислотных аналогов IIIa (которые могут быть любьми энантиомерами в зависимости от стереохимии соединения 8).
Альтернативный путь к схеме 21 показан на схеме 22. Подходяще защищенный оксиарилкетон 11 подвергают асимметричному восстановлению с получением хирального спирта 12. Его превращают в хиральный амин 13 в соответствии с методикой, аналогичной описанной на схеме 21 (через хиральный азид). Обработка хирального амина 13 эфиром XVIA (LG = галоген или мезилат) приводит к получению соответствующего вторичного аминоэфира 14. Ацилирование 14 арил- или гетероарилхлорформиатом XXXV приводит к получению соответствующего карбаматоэфира. Селективное снятие защитных групп приводит к получению свободного фенолкарбаматоэфира 15. Алкилирование фенола 15 галогенидом или мезилатом VIII с последующим снятием защитных групп приводит к получению карбаматокислотных аналогов ITa. Аналогичная последовательность (включающая восстановительное аминирование вторичного аминоэфира 14 с арил- или гетероарилальдегидом VII, затем селективное снятие защитных групп, алкилирование с VIII и конечное снятие защитных групп) приводит к получению аминокислотных аналогов IUa.
Очевидно, что (R)- или (S)-энантиомеры ITa или IIIa могут быть получены в соответствии со схемами 21 и 22 в зависимости от хиральности применяемого восстановительного агента.
Четвертая последовательность синтеза показана на схеме 23. Замещенный альдегид IV конденсируют с гидрохлоридом аминоэфира 6 с получением соответствующего имина 16, который затем обрабатывают in situ подходящим замещенным аллилгалогенидом 17 в присутствии металлического индия (см. Loh, T.-P. и др., Tetrahedron Lett., 1997, 38, 865-868) с получением α-аллилбензиламиноэфира 18. Ацилирование амина 18 с арил- или гетероарилхлорформиатом XXXV, с последующим снятием защитных групп приводит к получению карбаматокислотных аналогов I. Восстановительное аминирование алкиламиноэфира 18 с арил- или гетероарилальдегидом VII с последующим снятием защитных групп приводит к получению аминокислотных аналогов IW.
На схеме 24 показано получение желаемого промежуточного 2-арил-5-метилоксазол-4-илметилхлорида 21 (следуя общей процедуре, описанной в Malamas, М.S. и др., J. Med. Chem., 1996, 39, 237-245). Замещенный арилальдегид 19 конденсируют с бутан-2,3-дионмонооксимом в кислых условиях с получением соответствующего оксазол-N-оксида 20. Деоксигенирование оксазол-N-оксида 20 с сопутствующим хлорированием приводит к получению желаемых хлорметиларилоксазолов 21. Гидролиз хлорметилоксазола 21 в основных условиях приводит к получению соответствующего оксазолметанола 22. Окисление спирта 22 до соответствующего альдегида проводят с последующим превращением в соответствующий дибромалкен 23 (например, Ph3Р/CBr4). Дибромид 23 превращают в соответствующий алкиниллитиевый остаток (используют органолитиевый реагент, такой, как n-BuLi), который может быть подвергнут реакции in situ с подходящим электрофилом, таким, как формальдегид, с получением соответствующего ацетиленового спирта (см. Corey, E.J. и др., Tetrahedron Lett. 1972, 3769, или Gangakhedkar, К.К., Synth. Commun. 1996, 26, 1887-1896). Указанный спирт затем может быть превращен в соответствующий мезилат 24 и алкилирован подходящим фенолом 25 с получением аналогов 1Х. Дальнейшее стереоселективное восстановление (например. Н2/катализатор Линдлара) приводит к получению Е- или Z-алкениланалогов IV.
Схема 25 описывает общий синтез аминобензоксазольных аналогов IZ (общие ссылки: Sato, Y. и др., J. Med. Chem. 1998, 41, 3015-3021). Подходящий замещенный орто-аминофенол 26 обрабатывают с помощью CS2 в присутствии основания с получением соответствующего меркаптобензоксазола 27. Обработка полученного тиола 27 подходящим хлорирующим агентом (например, РСУ) приводит к получению ключевого промежуточного хлорбензоксазола 28, который подвергают реакции со вторичным аминоэфиром VI с получением, после снятия защитных групп, аминобензоксазолкислотных аналогов IZ.
Тиазоланалоги IZa синтезируют в соответствии с общей схемой синтеза, приведенной на схеме 26 (см. Collins, J.L. и др., J. Med. Chem. 1998, 41, 5037). Вторичный аминоэфир XXIII подвергают реакции с арил- или гетероарилхлорформиатом XXXV в присутствии подходящего основания (например, пиридина или триэтиламина) с получением соответствующего гидроксиарилкарбаматоэфира 29. Гидроксиарилэфир 29 затем подвергают реакции с подходящим замещенным α-бромвинилкетоном 29а (для S3=СН3, например, Weyerstahl, Р. и др., Flavour Fragr. J., 1998, 23, 177, или Sokolov, N. А. и др., Zh. Org. Khim., 1980, 16, 281-283) в присутствии подходящего основания (например, К2СО3) с получением соответствующего аддукта реакции Михаэля, α-бромкетонкарбаматэфира 30. α-Бромкетон 30 затем подвергают реакции конденсации с подходящим замещенным ариламидом 31 (А=О) или арилтиоамидом 31 (А=S) с получением или соответствующего оксазола (из амида) или тиазола (из тиоамида) (см. Malamas, M. S. и др., J. Med. Chem., 1996, 39, 237-245). Наконец, снятие защитных групп с эфиров 31 затем приводит к получению замещенных оксазол- и тиазолкарбаматокислотных аналогов IZa.
Очевидно, что в следующих схемах, где получают карбаматокислотные аналоги, соответствующие аналоги аминокислот могут также быть получены замещением реакции с хлорформиатом на альдегид в восстановительном аминировании (как на схеме 20 с промежуточным амином 7).
Схема 27 описывает общий синтез кислот IZb и IZc. Галогензамещенный арилальдегид 32 (предпочтительно йодид или бромид) подвергают восстановительному аминированию, используя методику, известную из уровня техники (например, Abdel-Magid и др., J. Org. Chem. 1996, 61, 3849) с гидрохлором α-аминокислотного эфира V. Образующийся вторичный аминоэфир 33 затем подвергают реакции с арил- или гетероарилхлорформиатом XXXV в присутствии подходящего основания (например, пиридина или триэтиламина) с получением соответствующего галогенарилкарбаматоэфира 34. Арилгалогенид 34 затем подвергают реакции с подходящим арил- или гетероарилзамещенным ацетиленом 35 (предпочтительным ацетиленом является 5-фенил-2-метилоксазол-4-илметилацетилен) в присутствии подходящего палладиевого катализатора (например, (Ph3Р)2PdCl2) и соли меди (I) (например, Cul) в реакции конденсации по Соногашира (Sonogashira) (см. Organocopper Reagents, a Practical Approach, R. J. К. Taylor, Ed., Chapter 10, pp 217-236, Campbell, I.B., Oxford University Press, 1994) с получением ключевого промежуточного арилацетиленкарбаматного эфира 36.
С арилацетиленового эфира 36 снимают защитные группы с получением соответствующих арилацетиленкислотных аналогов IZb. Ацетиленовая группа 36 может быть восстановлена стандартными методами (например, гидрогенированием, см. М. Hudlicky, Reductions in Organic Chemistry, 2nd Edition, ACS, 1996, Chapter 1) с получением соответствующего полностью насыщенного алкиларилкарбаматного эфира, с которого затем снимают защитные группы с получением алкиларилкарбаматокислотных аналогов IZc. Стереоселективное восстановление ацетиленового эфира 36 стандартными способами (например, катализатор Линдлара; см. Preparation of Alkenes, A Practical Approach, J.J. Williams, Ed., Chapter 6, pp 117-136, Oxford University Press, 1996) может быть проведено с получением соответствующего цис-алкениларилкарбаматоэфира, с которого затем снимают защитные группы с получением Z-алкениларилкарбаматкислотных аналогов IZd (схема 28). Альтернативно, эта последовательность может быть обращена, т.е. начальным шагом будет снятие защитных групп с ацетиленового эфира 36 с получением ацетиленовой кислоты с последующим стереоселективным восстановлением ацетиленовой группы с получением Z-алкенкислотных аналогов IZd.
Соответствующие транс-алкениларилкарбаматные кислоты IZe могут быть получены в соответствии с общим способом по схеме 29. Арил- или гетероарилацетилен 35 (предпочтительной группой опять является 5-фенил-2-метилоксазол-4-илметилацетилен) галогенируют в стандартных условиях (см. Boden, С. D. J. и др., J. Chem. Soc. Perkin Trans. I, 1996, 2417, или Lu, W. et. al., Tetrahedron Lett. 1998, 39, 9521) с получением соответствующего галогенацетилена, который затем превращают в соответствующий транс-алкенилстаннан 37 (см. Boden, С. D.J., J. Chem. Soc., Perkin Trans. I, 1996, 2417). Полученный арил- или гетероарилзамещенный транс-алкенилстаннан 37 затем связывают с галогенарилкарбаматным эфиром 34 в стандартных