Гетероарильные производные, как превосходные лиганды для рецептора ноцицептина orl-1
Иллюстрации
Показать всеИзобретение относится к новым гетероарильным производным 8-азабицикло-[3.2.1]-октан-3-ола общей формулы I, где R-R4-гетероарил, причем гетероарил представляет собой циклическую ароматическую группу с С5-С6 или бициклическую группу с С9-С10, которые включают 1, 2 или 3 гетероатома, независимо О, S или N, или остаток ,
R1-H, C1-С6-алкил, R2 и R3 независимо СН3, -ОСН3, F, Cl, Br, J, R4 - от 1 до 4 заместителей, -Н, галоген, C1-С6алкил, -CF3, -OCF3, -(СН2)n-OR5, -(CH2)n-NR5R6, -(CH2)n-NHSO2R5, -(CH2)n-NH(CH2)2NR5R6, -(CH2)n-NHC(O)NR5R7, -(CH2)n-NH(CH2)2OR5 или 1-пиперазинил; n - 0, 1, 2, 3; R5 и R6 - Н, C1-С3алкил, R7-H, C1-С3алкил, аминоалкил C1-С3, или к их фармацевтически приемлемым солям. Соединения являются агонистами рецептора ноцицептина ORL-1 и полезны при лечении кашля. 3 н. и 7 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к агонистам рецептора ноцицептина ORL-1 - 8-(бис-(галогенфенил)-метил)-3-гетероарил-8-азабицикло-[3.2.1]-октан-3-олам и его производным, используемых при лечении кашля, боли, состояния тревоги, астмы, алкогольной зависимости или депрессии. Также раскрыты фармацевтические композиции, включающие эти соединения и комбинации заявленных соединений с другими препаратами, предназначенными для симптоматического лечения кашля, аллергии или астмы.
8-(Бис-(галогенфенил)-метил)-3-гетероарил-8-азабицикло-[3.2.1]-октан-3-олы в целом, но не специфически, раскрыты в патенте США US 6262066 B1 и в международной заявке WO 01/07050, как используемые при лечении кашля, боли, состояния тревоги, астмы, алкогольной зависимости или депрессии. Соединения, соответствующие настоящему изобретению, представляют собой селективное изобретение по сравнению с патентом США US 6262066 B1 и WO 01/07050.
Соединения по настоящему изобретению представлены формулой I
или ее фармацевтически приемлемыми солями, где:
R означает R4-гетероарил или ;
R1 означает водород или алкил с 1-6 атомами углерода;
R2 и R3 независимо друг от друга выбирают из группы, включающей метил, метокси, фтор, хлор, бром и йод;
R4 означает от 1 до 4 заместителей, независимо выбранных из группы, включающей водород, галоген, алкил с 1-6 атомами углерода, циано, трифторметил, трифторметокси, -(CH2)n-OR5, -(CH2)n -NR5R6, -(CH2)n-NHSO2R5, -(CH2)n-NH(CH2)2NR5R6, -(CH2)n-NHC(O)NR5R7, -(CH2)n-NH(CH2)2OR5 и 1-пиперазинил;
n равно 0, 1, 2 или 3;
R5 и R6 независимо друг от друга выбирают из группы, включающей водород и алкил с 1-3 атомами углерода; и
R7 означает водород, алкил с 1-3 атомами углерода или аминоалкил с 1-3 атомами углерода.
В другом воплощении настоящее изобретение относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы I и фармацевтически приемлемый носитель.
Соединения, соответствующие настоящему изобретению, являются агонистами рецептора ORL-1 и поэтому в другом воплощении настоящее изобретение относится к способу лечения боли, состояния тревоги, кашля, астмы, алкогольной зависимости или депрессии, включающему назначение млекопитающему, нуждающемуся в таком лечении, эффективного количества, по меньшей мере, одного соединения формулы I.
В другом воплощении настоящее изобретение относится к способу лечения кашля, включающему назначение млекопитающему, нуждающемуся в таком лечении: (а) эффективного количества, по меньшей мере, одного соединения формулы I; и (b) эффективного количества одного или большего количества дополнительных препаратов, предназначенных для симптоматического лечения кашля, аллергии или астмы, выбранных из группы, включающей: антигистамины, ингибиторы 5-липоксигеназы, ингибиторы лейкотриена, ингибиторы Н3, агонисты β-адренергического рецептора, производные ксантина, агонисты α-адренергического рецептора, стабилизаторы тучных клеток, противокашлевые препараты, отхаркивающие препараты, антагонисты рецепторов тахикинина NK1, NK2 и NK3 и агонисты GABAB.
В еще одном воплощении настоящее изобретение относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы 1 и один или большее количество дополнительных препаратов, выбранных из группы, включающей: антигистамины, ингибиторы 5-липоксигеназы, ингибиторы лейкотриена, ингибиторы Н3, агонисты β-адренергического рецептора, производные ксантина, агонисты α-адренергического рецептора, стабилизаторы тучных клеток, противокашлевые препараты, отхаркивающие препараты, антагонисты рецепторов тахикинина NK1, NK2 и NK3 и агонисты GABAB.
Согласно приведенной выше формулы 1 предпочтительными соединениями по настоящему изобретению являются такие, в которых R2 и R3 находятся в 2-положении фенильных колец. Также предпочтительными являются соединения, в которых и для R2, и для R3 выбирают одинаковый атом галогена. Более предпочтительными являются соединения, в которых R2 означает хлор и R3 означает хлор, причем наиболее предпочтительными являются соединения, в которых R2 означает 2-хлор и R3 означает 2-хлор.
Также предпочтительными являются соединения, в которых R означает R4-гетероарил, где гетероарил означает пиридил, пиримидинил, пиразинил, пиридазинил, имидазолил, пиразолил или индолил, в частности, 2-пиридил или 2-пиримидинил. Предпочтительными значениями R4 является водород, алкил с 1-6 атомами углерода, -OR5 и 1-пиперазинил. Более предпочтительными значениями R являются 2-пиримидинил, 5-этил-2-пиримидинил, 4-(1-пиперазинил)-2-пиримидинил, 2-пиридил и 6-метокси-2-пиридил.
R1 предпочтительно означает водород или метил, а более предпочтительным является водород.
Особенно предпочтительными являются следующие конкретные соединения:
, , .
и
Предпочтительным для соединений формулы I является их использование для лечения кашля.
Если не указано иного, то при использовании в настоящем изобретении следующие термины имеют указанные ниже значения:
Галоген означает фтор, хлор, бром и йод.
Гетероарил означает циклические ароматические группы, содержащие от 5 до 6 атомов, или бициклические группы, содержащие от 9 до 10 атомов, включающие 1, 2 или 3 гетероатома, независимо выбранные из группы, включающей кислород, серу и азот, указанный гетероатом (указанные гетероатомы) входит в карбоциклическую кольцевую структуру и имеет количество делокализованных π-электронов, достаточным для придания ароматического характера, при условии, что циклы не включают соседних атомов кислорода и/или серы. Атомы азота могут образовать N-оксид. Включаются все региоизомеры, например, 2-пиридил, 3-пиридил и 4-пиридил. Типичными 6-членными гетероарильными группами являются пиридил, пиримидинил, пиразинил, пиридазинил и их N-оксиды. Типичными 5-членными гетероарильными циклами являются фурил, тиенил, пирролил, тиазолил, изотиазолил, имидазолил, пиразолил и изоксазолил. Типичными бициклическими группами являются сконденсированные с бензольным циклом системы, образованные из указанных выше гетероарильных групп, например, хинолил, фталазинил, хиназолинил, бензофуранил, бензотиенил и индолил. Гетероарильный цикл может в качестве заместителей содержать 1-4 группы R4, причем любые доступные и способные к замещению атомы углерода или азота в указанной гетероарильной группе могут быть необязательно и независимо замещены.
Некоторые соединения по настоящему изобретению могут существовать в различных стереоизомерных формах (например, энантиомерных, диастереоизомерных и атропомерных). Настоящее изобретение включает все такие стереоизомеры и в чистом виде и в смеси, включая рацемические смеси.
Некоторые соединения по природе являются кислыми (например, соединения, в которых содержится карбоксильная или фенольная гидроксильная группа). Эти соединения могут образовывать фармацевтически приемлемые соли. Примеры таких солей могут включать соли натрия, калия, кальция, алюминия, золота и серебра. Также включаются соли, образующиеся с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины, N-метилглюкамин и т.п.
Некоторые основные соединения также образуют фармацевтически приемлемые соли, например, кислотно-аддитивные соли. Например, пиридиновые атомы азота могут образовывать соли с сильными кислотами, тогда как соединения, содержащие основные заместители, такие как аминогруппы, также образуют соли с более слабыми кислотами. Примерами кислот, подходящих для образования солей, являются хлористоводородная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочная, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая и другие минеральные и карбоновые кислоты, хорошо известные специалистам в данной области техники. Соли получают путем взаимодействия свободного основания с достаточным количеством необходимой кислоты с образованием соли. Свободное основание можно выделить путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор NaOH, карбоната калия, аммиака и бикарбоната натрия. Свободное основание отличается от соответствующей соли по некоторым физическим характеристикам, таким как растворимость в полярных растворителях, однако для задач настоящего изобретения по остальным характеристикам соль эквивалентна соответствующему свободному основанию.
В соответствии с объемом настоящего изобретения предполагается, что все такие кислые и основные соли являются фармацевтически приемлемыми и для задач настоящего изобретения все кислые и основные соли считаются эквивалентными свободным формам соответствующих соединений.
Соединения по настоящему изобретению могут быть получены по известным методикам из исходных веществ или известных в данной области техники, или получаемых по методикам, известным в данной области техники.
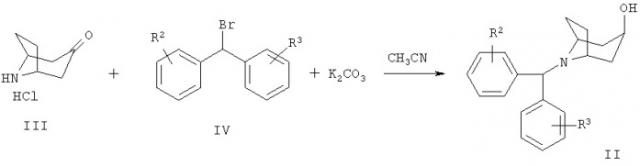
Типичная методика получения соединений формулы Ia, в которой R1 означает водород, включает взаимодействие 8-[бис-(галогенфенил)-метил]-8-азабицикло-[3.2.1]-октан-3-она формулы II с литиевым производным гетероарила:
Исходное вещество формулы II может быть получено по следующей реакционной схеме:
Соединение формулы II может быть получено алкилированием пиперидинового производного III производным дифенилбромметана IV в присутствии основания, такого как К2СО3, в растворителе, таком как СН3CN, при 80°С. Соединения формул III и IV известны в данной области техники или могут быть получены по известным методикам.
Соединения по настоящему изобретению и исходные вещества для их получения, приведенные ниже в качестве примеров, не следует рассматривать, как ограничивающие объем настоящего раскрытия.
Следующие растворители и реагенты в настоящем изобретении обозначены указанными аббревиатурами: тетрагидрофуран (THF); этанол (EtOH); метанол (МеОН); этилацетат (EtOAc); диизопропиламид лития (LDA); триэтиламин (Et3N) и N,N-диметилформамид (DMF).
Приготовление 1
8-Азабицикло-[3.2.1]-октан-3-он, гидрохлорид
К раствору тропинона (10 г, 71,84 ммоль) в дихлорэтане (200 мл) по каплям при 0°С прибавляют α-хлорэтилхлорформиат (15,4 г, 108 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 2 часов. Растворитель выпаривают и получают коричневый остаток. Остаток растворяют в МеОН (200 мл) и кипятят с обратным холодильником в течение 2 часов. МеОН выпаривают и твердое вещество перемешивают в EtOAc, фильтруют, собирают твердое вещество и промывают эфиром и получают продукт (7 г). Неочищенный продукт используют без дополнительной очистки. 1H ЯМР (CDCl3) δ 4,45 (s, br, 2H), 3,35 (dd, 2H), 2,58 (d, 2H), 2,49 (dd, 2H), 2,0 (m, 2H).
Приготовление 2
Бис-(2-хлорфенил)-бромметан
Стадия 1:
К раствору 2,2'-дихлорбензофенона (5 г, 19,9 ммоль) в МеОН (40 мл) при комнатной температуре прибавляют NaBH4 (1,5 г, 39,82 ммоль) и перемешивают в течение 2 часов. Реакцию останавливают с помощью H2O, нейтрализуют с помощью 1 N HCl и удаляют МеОН. Остаток экстрагируют с помощью EtOAc, промывают рассолом, сушат над MgSO4 и концентрируют и получают искомое соединение (5 г) в виде белого твердого вещества, которое используют на следующей стадии реакции без очистки. 1H ЯМР (CDCl3) δ 7,45 (m, 4H), 7,35 (m, 4H), 6,60 (d, 1H), 2,58 (d, 1H, ОН).
Стадия 2:
Продукт, полученный на стадии 1 (20,36 г, 80,47 ммоль), в CH2Cl2 обрабатывают с помощью SOBr2 (30,11 г, 144,85 ммоль) при 0°С и перемешивают при комнатной температуре в течение ночи. Реакцию останавливают с помощью льда и NaHCO3 (водный раствор), экстрагируют с помощью CH2Cl2, сушат и фильтруют. Удаляют растворитель и получают искомый бромид (23,6 г). 1H ЯМР (CDCl3) δ 7,6 (d, 2H), 7,4 (d, 2H), 7,13 (m, 4H), 7,0 (s, 1H).
Приготовление 3
8-[Бис-(2-хлорфенил)-метил]-8-азабицикло-[3.2.1]-октан-3-он
Смесь продуктов, полученных в Синтезе 1 (26 г, 161 ммоль) и в Приготовлении 2 (53 г, 168 ммоль), и K2СО3 (110 г, 796 ммоль) нагревают в безводном СН3CN (410 мл) при 80°С в течение 80 часов. Реакционную смесь охлаждают до комнатной температуры и фильтруют. Растворитель выпаривают и твердое вещество очищают с помощью флэшхроматографии на колонке (4%, 7% EtOAc/гексан) и получают искомый продукт.1H ЯМР (CDCl3) δ 7,9 (d, 2Н), 7,3 (m, 4H), 7,2 (m, 2H), 5,7 (s, 1H), 3,35 (s, br, 2H), 2,7 (dd, 2H), 2,3 (m, 2H), 2,2 (d, 2H), 1,65 (dd, 2H).
Пример 1
8-[Бис-(2-хлорфенил)-метил]-3-(2-пиримидинил)-8-азабицикло-[3.2.1]-октан-3-ол
Стадия 1: 2-Трибутилстаннилпиримидин
Это соединение получают по методике, описанной в работе Sandosham et al., Tetrahedron (1994), 50, 275-284). Из диизопропиламина (25 мл, 178 ммоль) и n-BuLi (2,5 M, 70 мл, 175 ммоль) в THF (230 мл) готовят свежий LDA. Раствор LDA по каплям при 0°С обрабатывают раствором трибутиллитийгидрида (142 мл, 156 ммоль) в THF (30 мл) и после завершения прибавления перемешивают в течение еще 15 минут. Реакционную смесь охлаждают до -78°С, по каплям прибавляют раствор 2-хлорпиримидина (15 г, 131 ммоль) в THF (100 мл) и перемешивают реакционную смесь в течение 3 часов при -78°С, затем реакционной смеси дают нагреться до 0°С в течение 30 минут. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Остаток очищают с помощью хроматографии на колонке и получают искомое соединение в виде светло-желтого масла. 1H ЯМР (CDCl3) δ 8,65 (d, 2H), 7,1 (t, 1H), 1,6 (m, 6H), 1,3 (m, 6H), 1,1 (m, 6H), 0.85 (t, 9H).
Стадия 2:
n-BuLi (2,5 M в гексане, 16,5 мл, 41,2 ммоль) по каплям прибавляют к раствору продукта, полученного на стадии 1 (15 г, 40,6 ммоль), в THF (80 мл) при -78°С и реакционную смесь выдерживают при этой температуре в течение 45 минут. К этому раствору по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (6 г, 16,7 ммоль), в THF (30 мл) и перемешивают реакционную смесь в течение еще 3 часов при -78°С. Реакционную смесь нагревают до комнатной температуры в течение 1,5 часов. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют.Очистка остатка с помощью хроматографии на колонке дает искомое соединение в виде легкого белого твердого вещества. 1Н ЯМР (CDCl3) δ 8,75 (d, 2H), 7,96 (d, 2H), 7,30 (m, 4H), 7,20 (t, 1H), 7,15 (m, 2H), 5,59 (s, 1H), 4,86 (s, 1H, ОН), 3,20 (m, br, 2H), 2,60 (dd, 2H), 2,40 (dd, 2H), 2,24 (m, 2H), 1,68 (d, 2H).
Пример 2
8-[Бис-(2-хлорфенил)-метил]-3-(5-этил-2-пиримидинил)-8-азабицикло-[3.2.1]-октан-3-ол
Стадия 1: 5-Этил-2-трибутилстаннилпиримидин
С использованием методики, описанной в Примере 1, стадия 1, с использованием LDA, трибутилгидрида олова (23,8 г, 81,78 ммоль) и 2-хлор-5-этилпиримидина (10 г, 70 ммоль)) получают искомое соединение (6 г). 1H ЯМР (CDCl3) δ 8,55 (s, 2H), 2,60 (q, 2H), 1,55 (m, 6H), 1,35 (m, 6H), 1,25 (t, 3H), 1,15 (t, 6H), 0,85 (t, 9H).
Стадия 2:
n-BuLi (2,5 M, 6,5 мл, 16,33 ммоль) по каплям прибавляют к раствору продукта, полученного на стадии 1 (5,9 г, 14,85 ммоль), в THF при -78°С температуру реакционной смеси поддерживают равной -78°С в течение 30 минут. К ней прибавляют продукт, полученный в Приготовлении 3 (5,34 г, 14,85 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение в виде белого твердого вещества. 1H ЯМР (CDCl3) δ 8,6 (s, 2Н), 8,0 (d, 2Н), 7,25 (m, 4Н), 7,15 (m, 2H), 5,6 (s, 1H), 4,85 (s, 1H, ОН), 3,2 (s, br, 2Н), 2,65 (q, 2Н), 2,60 (d, 2Н), 2,40 (m, 2Н), 2,25 (m, 2Н), 1,65 (d,2H), 1,30 (t, 3H).
Пример 3
8-[Бис-(2-хлорфенил)-метил]-3-[4-(1-пиперазинил)-2-пиримидинил]-8-аза-бицикло-[3.2.1]-октан-3-ол
Стадия 1: 4-Хлор-2-трибутилстаннилпиримидин
С использованием методики, описанной в Примере 1, стадия 1, с использованием LDA, трибутилгидрида олова (10,8 г, 37,2 ммоль) и 2,4-дихлорпиримидина (5,2 г, 34,9 ммоль)) получают искомое соединение (6,3 г). 1H ЯМР (CDCl3) δ 8,52 (d, 1H), 7,18 (d, 1H), 1,58 (m, 6H), 1,30 (q, 6H), 1,18 (t, 6H), 0,86 (t, 9H).
Стадия 2: 8-[Бис-(2-хлорфенил)-метил]-3-(4-хлор-2-пиримидинил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (2,5 M, 8,0 мл, 20,0 ммоль) по каплям прибавляют к раствору продукта, полученного на стадии 1 (6,3 г, 16,2 ммоль), в THF (30 мл) при -78°С и реакционную смесь выдерживают при этой температуре в течение 30 минут. К ней прибавляют продукт, полученный в Приготовлении 3 (4,0 г, 11,1 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение в виде светло-коричневого вспененного вещества. 1H ЯМР (CDCl3) δ 8,61(d, 1Н), 7,93 (d, 2Н), 7,25 (m, 5H), 7,12 (m, 2H), 5,65 (s, 1Н), 4,33 (s, 1Н, ОН), 3,18 (s, br, 2H), 2,58 (dd, 2H), 2,33 (m, 2H), 2,13 (m,2H), 1,65(d,br,2H).
Стадия 3:
К раствору продукта, полученного на стадии 2 (25 мг, 0,05 ммоль), в EtOH (4 мл) при комнатной температуре прибавляют пиперазин (20 мг, 0,23 ммоль). Реакционную смесь перемешивают при 80°С в течение ночи. Экстракция и очистка дает искомое соединение (20 мг). 1H ЯМР (CDCl3) δ 8,24 (d, 1Н), 7,93 (d, 2H), 7,26 (d, 2H), 7,22 (t, 2H), 7,10 (t, 2H), 6,33 (d, 1Н), 5,64 (s, 1Н), 3,67 (s, br, 4H), 3,15 (s, br, 2H), 2,95 (m, 4H), 2,59 (dd, 2H), 2,34 (m, 2H), 2,17 (m, 2H), 1,57 (d, br, 2H).
Пример 4
8-[Бис-(2-хлорфенил)-метил]-3-(2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (2,5 М в гексане, 1,5 мл, 3,8 ммоль) по каплям прибавляют к раствору 2-бромпиридина (0,50 г, 3,10 ммоль) в THF (1 мл) при -78°С и перемешивают в течение 1 часа. К нему прибавляют раствор продукта, полученного в Приготовлении 3 (0,5 г, 1,4 ммоль) в THF (1,5 мл) по каплям и перемешивают реакционную смесь в течение еще 3,5 часов при -78°С. Реакционную смесь нагревают до 0°С в течение 1 часа, выливают реакционную смесь в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение в виде бледно-желтого твердого вещества (400 мг). 1H ЯМР (CDCl3) δ 8,49 (d, 1H), 7,92 (d, 2H), 7,76 (t, 1H), 7,61 (d, 1H), 7,28 (m, 4H), 7,16 (m, 3H), 5,65 (s, 1H), 5,54 (s, 1H, ОН), 3,18 (s, br, 2H), 2,41 (m, 2H), 2,32 (dd, 2H), 2,21 (m, 2H), 1,72 (d, br, 2H).
Пример 5
8-[Бис-(2-хлорфенил)-метил]-3-(6-метокси-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (2,5 М в гексане, 1,5 мл, 3,8 ммоль) по каплям прибавляют к раствору 2-бром-6-метоксипиридина (700 мг, 3,7 ммоль) в THF (2 мл) при -78°С и перемешивают в течение 0,5 часа. К нему по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (600 мг, 1,7 ммоль), в THF (3 мл) и перемешивают реакционную смесь в течение еще 1 часа при -78°С. Реакционную смесь нагревают до 0°С в течение 2,5 часов. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение (0,5 г).). 1H ЯМР (CDCl3) δ 7,90 (d, 2Н), 7,65 (t, 1H), 7,31 (d, 2Н), 7,26 (t, 2Н), 7,13 (m, 3H), 6,63 (d, 1H), 5,64 (s, 1H), 5,15 (s, 1H, ОН), 3,96 (s, 3H), 3,17 (s, br, 2Н), 2,33 (m, 4H), 2,21 (m, 2Н), 1,74 (d, br, 2Н).
Пример 6
8-[Бис-(2-хлорфенил)-метил]-3-метокси-3-(2-пиримидинил)-8-азабицикло-[3.2.1]-октан
Продукт, полученный в Примере 1 (300 мг, 0,68 ммоль), в THF (3 мл) и DMF (1 мл) обрабатывают с помощью NaH (30 мг, 0,75 ммоль) при 0°С в течение 30 минут. Прибавляют СН3l и реакционную смесь нагревают до комнатной температуры. После перемешивания в течение ночи реакцию останавливают с помощью H2O, экстрагируют с помощью EtOAc, промывают рассолом, сушат и концентрируют. Полученный остаток очищают с помощью хроматографии на колонке и получают искомое соединение (0,25, г). 1H ЯМР (CDCl3) δ 8,77 (d, 2H), 7,83 (d, 2H), 7,27 (d, 2H), 7,18 (m, 3Н), 7,10 (t, 2H), 5,54 (s, 1H), 3,15 (s, br, 2H), 2,99 (s, 3Н), 2,38 (dd, 2H), 2,12 (m, 6H),
Пример 7
8-[Бис-(2-хлорсренил)-метил]-3-(1Н-пиразол-5-ил)-8-азабицикло-[3.2.1]-октан-3-ол
К пиразолу (0,68 г, 10 ммоль) в воде (4 мл) при комнатной температуре прибавляют формальдегид (37 мас.%, 1,5 мл, 50 ммоль), перемешивают при комнатной температуре в течение ночи. Экстрагируют с помощью CH2Cl2, сушат (Na2SO4) и концентрируют и получают 1-гидроксиметилпиразол. К раствору 1-гидроксиметилпиразота (129 мг, 1,31 ммоль) в THF (2 мл) при -78°С прибавляют свежеприготовленный LDA (2,63 ммоль) в THF, перемешивают при -20°С в течение 40 минут и охлаждают до -78°С. К нему по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (236 мг, 0,65 ммоль), в THF (3 мл) и перемешивают реакционную смесь в течение еще 2 часов при -78°С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют эфиром. Органические слои объединяют, сушат, фильтруют и концентрируют. Очистка остатка с помощью препаративной тонкослойной хроматографии и ВЭЖХ дает искомое соединение (25 мг). 1H ЯМР (CDCl3) δ 8,2 (s, br, 2H), 8,05 (d, 2H), 7,25-7,40 (m, 6H), 7,20 (t, 2H), 6,2 (s, br, 1H), 5,9 (s, 1H), 3,2 (s, br, 2H), 2,55 (d, 2H), 2,41 (dd, 2H), 2,3 (m, 2H), 1,95 (d, 2H).
Пример 8
8-[Бис(2-хлорфенил)-метил]-3-(1-метил-пиразол-5-ил)-8-азабицикло-[3.2.1]-октан-3-ол
К раствору продукта, полученного в Примере 8 (70 мг, 0,164 ммоль), в THF при 0°С прибавляют NaH (9,84 мг, 0,246 ммоль) и перемешивают в течение 30 минут. Прибавляют СН3I (34,89 мг, 0,246 ммоль), нагревают до комнатной температуры и перемешивают в течение ночи. Реакцию останавливают с помощью насыщенного водного раствора NH4Cl, экстрагируют с помощью EtOAc, сушат (Na2SO4), фильтруют и концентрируют. Очистка остатка с помощью препаративной тонкослойной хроматографии дает искомое соединение (51 мг). 1H ЯМР (CDCl3) δ 7,85 (d, 2H), 7,3 (m, 6H), 7,15 (t, 2H), 6,21 (s, 1H), 5,6 (s, 1H), 3,85 (s, 3Н), 3,15 (s, br, 2H), 2,6 (s, 1H), 2,2-2,4 (m, 6H), 1,85(d,2H).
Пример 9
8-[Бис(2-хлорфенил)-метил]-3-(1-метил-1Н-индол-2-ил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (1,6 М в гексане, 0,32 мл, 0,51 ммоль) по каплям прибавляют к раствору 1-метилиндола (67 мг, 0,51 ммоль) в THF (2 мл) при -20°С, нагревают до комнатной температуры, перемешивают в течение 3,5 часов и охлаждают до -78°С. К нему прибавляют раствор продукта, полученного в Синтезе 3 (92 мг, 0,26 ммоль), в THF (2 мл). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1,5 часов. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью препаративной тонкослойной хроматографии дает искомое соединение (5 мг). 1H ЯМР (CDCl3) δ 7,80 (d, 2Н), 7,60 (d, 1H), 7,05-7,35 (m, 9H), 6,45 (s, 1H), 5,55 (s, 1H), 3,20 (s, br, 2H), 2,55 (dd, 2H), 2,15 (br, s, 4H), 2,1 (d, 2H).
Пример 10
8-[Бис(2-хлорфенил)-метил]-3-(1-метил-1Н-имидазол-2-ил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (2,5 М в гексане, 0,60 мл, 1,50 ммоль) по каплям прибавляют к раствору 1-метилимидазола (0,15 г, 1,88 ммоль) в THF (2 мл) при -78°С и перемешивают в течение 1,5 часов. К нему по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (0,20 г, 0,55 ммоль), в THF (2 мл) и реакционную смесь перемешивают в течение еще 2 часов при -78°С. Реакционную смесь нагревают до комнатной температуры в течение в течение ночи, реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение в виде бледно-желтого твердого вещества (80 мг). 1H ЯМР (CDCl3) δ 7,79 (d, 2Н), 7,27 (d, 2H), 7,18 (t, 2H), 7,10 (t, 2H), 6,63 (d, 2H), 5,48 (s, 1H), 3,74 (s, 3H), 3,08 (br s, 2H), 2,45 (d, 2H),2,14(m,4H), 1,81 (d, 2H).
Пример 11
8-[Бис(2-хлорфенил)-метил]-3-(3-пиридазинил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (2,5 М в гексане, 4,8 мл, 12,0 ммоль) по каплям прибавляют к раствору 2,2,6,6-тетраметилпиперидина (1,67 г, 11,9 ммоль) в THF (40 мл) при -78°С и перемешивают в течение 0,5 часа. Реакционную смесь нагревают до 0°С в течение 0,5 часа. Реакционную смесь охлаждают до -78°С, по каплям прибавляют раствор пиридазина (0,94 г, 11,7 ммоль) в THF (5 мл) и перемешивают реакционную смесь в течение 15 минут при -78°С. К ней по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (1,0 г, 2,8 ммоль), в THF (5 мл) и перемешивают реакционную смесь в течение еще 1 часа при -78°С. Реакционную смесь нагревают до комнатной температуры в течение ночи. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение (300 мг). 1H ЯМР (CDCl3) δ 9,10 (dd, 1Н), 7,87 (d, 2H), 7,81 (dd, 1H), 7,53 (dd, 1H), 7,29 (d, 2H), 7,26 (t, 2H), 7,14 (t, 2H), 5,62 (s, 1H), 4,71 (br s, 1H), 3,20 (br s, 2H), 2,38 (m, 4H), 2,23 (m, 2H), 1,80 (d, 2H).
Пример 12
8-[Бис(2-хлорфенил)-метил]-3-(2-пиразинил)-8-азабицикло[3.2.1]октан-3-ол
t-BuLi (1,7 M в пентане, 6,0 мл, 10,2 ммоль) по каплям прибавляют к раствору йодпиразина (1,0 г, 4,9 ммоль) в диэтиловом эфире (20 мл) при -50°С и перемешивают в течение 0,5 часа. К нему по каплям прибавляют раствор продукта, полученного в Приготовлении 3 (1,0 г, 2,8 ммоль), в THF (4 мл) и перемешивают реакционную смесь в течение еще 1,5 часов при -50°С. Реакционную смесь нагревают до комнатной температуры в течение в течение ночи. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение (400 мг). 1H ЯМР (CDCl3) δ 8,96 (s, 1Н), 8,47 (m, 2H), 7,89 (d, 2H), 7,29 (d, 2H), 7,27 (t, 2H), 7,14 (t, 2H), 5,63 (s, 1Н), 4,34 (s, 1Н), 3,20 (br s, 2H), 2,37 (m, 4H), 2,22 (m, 2H), 1,76 (d, 2H).
Пример 13
8-[Бис(2-хлорфенил)-метил]-3-(4-пиримидинил)-8-азабицикло[3.2.1]октан-3-ол
Стадия 1: 8-[Бис(2-хлорфенил)метил]-3-(5-бром-4-пиримидинил)-8-азабицикло-[3.2.1]октан-3-ол
К раствору 5-бромпиридина (450 мг, 2,77 ммоль) и продукта, полученного в Приготовлении 3 (1 г, 2,77 ммоль), в THF (5 мл) по каплям прибавляют предварительно охлажденный (с помощью твердой углекислоты), свежеприготовленный LDA (2,77 ммоль) в THF (5 мл) и перемешивают при комнатной температуре в течение ночи. Реакцию останавливают с помощью льда-Н2O, экстрагируют с помощью EtOAc, сушат, фильтруют и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение (187 мг).
Стадия 2:
Продукт, полученный на стадии 1 (22 мг), в CH3ОН-EtOAc (1:1,10 мл) и NH3/CH3ОН (7 N, 1 мл) гидрируют в присутствии катализатора Линдлара при давлении 1 атм в течение 2 часов, фильтруют и концентрируют и получают искомое соединение. 1H ЯМР (CDCl3) δ 9,15 (s, 1H), 8,70 (d, 1H), 8,00 (m, 2H), 7,80 (d, 1H), 7,25 (m, 4H), 7,19 (t, 2H), 5,61 (s, 1H), 3,15 (br s, 2H), 2,50 (dd, 2H), 2,25 (m, 4H), 1,65 (d, 2H).
Пример 14
8-[Бис(2-хлорсренил)-метил]-3-(5-бром-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
BuLi (1,6 M в гексане, 1,59 мл, 2,54 ммоль) прибавляют к 2,5-дибромпиридину (501 мг, 2,12 ммоль) в толуоле (13 мл) при -78°С и перемешивают в течение 2 часов. Прибавляют продукт, полученный в Приготовлении 3 (501 мг, 2,12 ммоль), в толуоле (2 мл) при -78°С и перемешивают в течение 3 часов. Нагревают до комнатной температуры, реакцию останавливают с помощью насыщенного водного раствора NH4Cl, экстрагируют с помощью CH3Cl2, сушат и концентрируют. Очистка остатка с помощью препаративной тонкослойной хроматографии и ВЭЖХ дает искомое соединение. 1H ЯМР (CDCl3) δ 8,59 (s, 1H), 7,85 (m, 3H), 7,50 (d, 1H), 7,25 (m, 4H), 7,19 (t, 2H), 5,61 (s, 1H), 4,85 (s, 1H), 3,20 (br s, 2H), 2,15-2,40 (m,4H), 1,75(d,2H).
Пример 15
1,1-Диметилэтил-[2-[[[[[6-[8-[бис(2-хлорфенил)метил]-3-гидрокси-8-аза-би-цикло[3.2.1]-окт-3-ил]-2-пиридинил]метил]амино]карбонил]-амино]-этил]-карбамат
Стадия 1: 2-бром-6-гидроксиметилпиридин
NaBH4 (1,46 г, 38,58 ммоль) прибавляют к 6-бром-2-пиридин-карбоксилальдегиду (5,32 г, 28,58 ммоль) в CH3ОН при 0°С и перемешивают при 0°С в течение 1 часа, экстрагируют с помощью CH2Cl2, сушат над Na2SO4 и концентрируют и получают искомое соединение.
Стадия 2: 2-бром-6-(трет-бутилдиметилсилоксиметил)пиридин
К раствору продукта, полученного на стадии 1 (5,54 г, 29,46 ммоль), и трет-бутилдиметилсилилхлориду (4,97 г, 32,99 ммоль) в CH2Cl2 (60 мл) при комнатной температуре прибавляют имидазол (3,01 г, 44,19 ммоль) и перемешивают в течение ночи. Фильтруют реакционную смесь и фильтрат концентрируют. Остаток очищают с помощью хроматографии и получают искомое соединение.
Стадия 3: 8-[Бис(2-хлорфенил)-метил]-3-(6-(трет-бутилдиметилсилоксиметил)-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
n-BuLi (1,6 М в гексане, 7,2 мл, 11,49 ммоль) прибавляют к продукту, полученному на стадии 2 (3,29 г, 10,88 ммоль), в THF (5 мл) при -78°С и перемешивают в течение 1 часа. Прибавляют продукт, полученный в Приготовлении 3 (1,84 г, 5,11 ммоль), в THF (14 мл) при -78°С медленно нагревают до 0°С (˜2 часа). Реакцию останавливают с помощью насыщенного водного раствора NH4Cl, экстрагируют с помощью EtOAc, сушат и концентрируют. Остаток очищают с помощью хроматографии на колонке и получают искомое соединение.
Стадия 4: 8-[Бис(2-хлорфенил)-метил]-3-(6-гидроксиметил)-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
К раствору продукта, полученного на стадии 3 (2,34 г, 4,01 ммоль), в THF (30 мл) при комнатной температуре прибавляют тетрабутиламмонийфторид (2,1 г, 8,04 ммоль) и перемешивают в течение ночи. Реакцию останавливают с помощью насыщенного водного раствора NaHCO3, экстрагируют с помощью EtOAc, сушат над Na2SO4 и концентрируют. Остаток очищают с помощью хроматографии на колонке и получают искомое соединение.
Стадия 5: 3-[6-(Азидометил)-2-пиридинил]-8-[бис-(2-хлорфенил)-метил]-8-азабицикло-[3.2.1]-октан-3-ол
К продукту, полученному на стадии 4 (404 мг, 0,86 ммоль), при 0°С прибавляют дифенилфосфорилазид (272 мг, 0,99 ммоль) и 1,8-диазабицикло-[5,4,0]ундец-7-ен (150 мг, 0,99 ммоль), перемешивают в течение 20 минут, нагревают до комнатной температуры, затем перемешивают при 50°С в течение 1 часа. Охлаждают до комнатной температуры и перемешивают в течение ночи. Реакцию останавливают с помощью H2O и насыщенного водного раствора NH4Cl, экстрагируют с помощью CH2Cl2, сушат и концентрируют. Остаток очищают с помощью хроматографии на колонке и получают искомое соединение.
Стадия 6: 3-[6-(Аминометил)-2-пиридинил]-8-[бис-(2-хлорфенил)-метил]-8-азабицикло-[3.2.1]-октан-3-ол
К суспензии продукта, полученного на стадии 5 (279 мг), в смеси EtOAc и CH3ОН в присутствии 7 N NH3 в CH3ОН (1 мл) прибавляют катализатор Линдлара (44 мг). Смесь гидрируют при 1 атм в течение 1,5 часов, фильтруют через целит, промывая с помощью NH3/CH3ОН (3,5 N,) и концентрируют и получают искомое соединение.
Стадия 7:
К раствору продукта, полученного на стадии 7 (157 мг, 0,335 ммоль), в толуоле (10 мл) при комнатной температуре в атмосфере аргона прибавляют трифосген (34,8 мг, 0,117 ммоль) и диизопропилэтиламин (222 мг, 1,675 ммоль). Нагревают до 120°С и перемешивают в течение 2,5 часов. Охлаждают до комнатной температуры, прибавляют N-Boc-этилендиамин (65 мг, 0,42 ммоль) и перемешивают в течение ночи. Реакцию останавливают с помощью насыщенного водного раствора NH4Cl, экстрагируют с помощью EtOAc, сушат над Nа2SO4 и концентрируют. Остаток очищают с помощью препаративной тонкослойной хроматографии и получают искомое соединение. 1H ЯМР (CDCl3) δ 7,9 (d, 2Н), 7,75 (t, 1H), 725 (d, 1H), 7,1-7,4 (m, 4H), 5,65 (s, 1H), 5,25 (b, s, 1H), 4,45 (d, 2Н), 3,25 (m, 2Н), 3,1 (m, 4H), 2,15-2,45 (m, 6H), 1,65 (d, 2Н).
Пример 16
N-(2-(Аминоэтил)-N'-[[6-[8-[бис-(2-хлорфенил)-метил]-3-гидрокси-8-азабицикло-[3.2.1]-окт-3-ил]-2-пиридинил]-метил]-мочевина
К раствору продукта, полученного в Примере 15 (53 мг), в CH2Cl2 и CH3ОН при комнатной температуре прибавляют HCl (1 N в эфире, 1,0 мл) и перемешивают, пока ЖХ-МС (жидкостная хроматография-масс-спектроскопия) не укажет на полное использование продукта, полученного в Примере 15, и получают искомое соединение в виде гидрохлорида. МС-ИЭР (масс-спектроскопия с ионизацией электрораспылением) 554,1 (100, M+).
Пример 17
3-[3-(Аминометил)-2-пиридинил]-8-[бис-(2-хлорфенил)-метил]-8-азабицик-ло-[3.2.1]-октан-3-ол
Стадия 1: 2-Бром-3-гидроксиметилпиридин
К раствору 2-бром-3-пиридинкарбоновой кислоты (5,63 г, 27,89 ммоль) и Et3N (2,96 г, 29,28 ммоль) в толуоле (150 мл) при комнатной температуре прибавляют этилхлорформиат (3,17 г, 29,28 ммоль) и перемешивают в течение 1 часа, фильтруют и концентрируют. Остаток растворяют в THF (93 мл), при -78°С по каплям прибавляют к суспензии LiAIH4 (1,11 г, 29,28 ммоль) в THF (37 ммоль) и перемешивают в течение 30 минут. Реакцию останавливают с помощью насыщенного водного раствора NH4Cl, перемешивают при комнатной температуре в течение 1 часа, фильтруют через целит, экстрагируют с помощью EtOAc, сушат над Na2SO4 и концентрируют. Очистка остатка с помощью хроматографии на колонке дает искомое соединение.
Стадия 2: 2-бром-3-(трет-бутилдиметилсилоксиметил)пиридин
По методике, описанной на стадии 2 Примера 15, с использованием 2-бром-3-гидроксиметилпиридина (3,66 г, 19,48 ммоль), трет-бутилдиметилсилилхлорида (5,87 г, 38,97 ммоль) и имидазола (3,31 г, 48,71 ммоль) получают искомое соединение (6,38 г).
Стадия 3: 8-[Бис(2-хлорфенил)-метил]-3-(3-(трет-бутилдиметилсилоксиметил)-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
По методике, описанной на стадии 3 Примера 15, с использованием продукта, полученного на стадии 2 (6,38 г, 21,1 ммоль), n-BuLi (1,6 М в гексане, 14,5 мл, 21,1 ммоль) и продукта, полученного в Приготовлении 3 (7,60 г, 21,1 ммоль), получают искомый продукт.
Стадия 4: 8-[Бис-(2-хлорфенил)-метил]-3-(3-гидроксиметил)-2-пиридинил)-8-азабицикло-[3.2.1]-октан-3-ол
По методике, описанной на стадии 4 Примера 15, с использованием продукта, полученного на стадии 3 (12,3 г, 21,1 ммоль), и тетрабутиламмонийфторида (11 г, 42,2 ммоль) получают искомое соединение.
Стадия 5: 3-[3-(Азидометил)-2-пиридинил]-8-[бис(2-хлорфенил)-метил]-8-азабицикло-[3.2.1]-октан-3-ол
По методике, описанной на стадии 5 Примера 15, с использованием продукта, полученного на стадии 4 (95,2 мг, 0,213 ммоль), дифенилфосфорилазида (67,4 мг, 0,245 ммоль) и 1,8-диазабицикло-[5,4,0]-ундец-7-ена (52,96 мг, 0,32 ммоль) в качестве содержащегося в меньшем количестве продукта получают искомое соединение.
Стадия 6:
По методике, описанной на стадии 6 Примера 15, с использованием продукта, полученного на стадии 5 (69 мг) и катализатора Линдлара (7 мг) получают искомое соединение. 1H ЯМР (CDCl3) 8,40 (d, 1H), 7,95 (d, 2H), 775 (d, 1H), 7,05-7,15 (m, 7H), 5,60 (s, 1H), 5,25 (b, s, 1H), 4,40 (s, 2H), 3,20 (s, br, 2H), 2,50 (dd, 2H), 2,3 (m, 4H), 1,75 (d, 2H).
Пример 18
8-[Бис(2-хлорфенил)-метил]-3-[4-(метиламино)-2-пиридинил]-8-азабицикло-[3.2.1]-октан-3-ол
Стадия 1: 2-бром-4-(трет-бутоксикарбониламино)пиридин
Смесь 4-амино-2-бромпиридина (1,00 г, 5,79 ммоль), Et3N (1,75 г, 17,37 ммоль) и ди-трет-бутилдикарбоната (1,90 г, 8,69 ммоль) в CH2Cl2 (20 мл) перемешивают при комнатной температуре в течение ночи. Разбавляют с помощью CH2Cl2 (10 мл), промывают насыщенным водным раствором NaHCO3, сушат над MgSO4 и концентрируют. Остаток очищают с помощью хроматографии на колонке и получают искомое соединение.
Стадия 2: - Диметилэтил-[2-[8-[бис(2-хлорфенил)-метил]-3-гидрокси-8-аза-бицикло-3.2.1]-окт-3-ил]-4-пиридинил]-карбамат
n-BuLi (1,6 М в гексане, 1,12 мл, 1,81 ммоль) прибавляют к продукту, полученному