Схема приема erbb2 противоопухолевых агентов
Иллюстрации
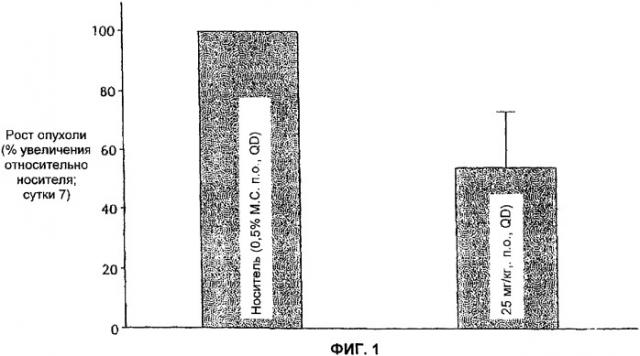
Показать всеГруппа изобретений относится к медицине, лечению аденокарциномы яичников у млекопитающего. Способы включают пероральное, трансбуккальное, сублинвальное, интраназальное, внутриглазное, внутрижелудочное, интрадуоденальное, местное, ректальное или вагинальное введение субъекту в пределах двадцати четырех часов первого терапевтически эффективного количества Е-2-Метокси-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида (соединение Е), составляющего 25-100 мг/кг, и второго терапевтически эффективного количества соединения Е, составляющего 25-100 мг/кг. Изобретение обеспечивает улучшенную схему лечения аденокарциномы яичников за счет выбора конкретных малых доз и режима введения соединения Е, позволяющих увеличить процент ингибирования клеток аденокарциномы по сравнению с иными дозами и режимами его введения. 2 н.п. ф-лы, 6 ил., 7 табл.
Реферат
Область изобретения
Изобретение относится в общем к способам введения лекарств. Более конкретно изобретение относится к введению противоопухолевых агентов, включая ингибиторы рецептора еrbВ2. Изобретение также относится к способам улучшенного введения ингибиторов рецепторных протеинтирозинкиназ, которые полезны в лечении аномального клеточного роста, такого как рак, у млекопитающих. Изобретение также относится к наборам, полезным для введения таких ингибиторов при лечении аномального клеточного роста у млекопитающих, в особенности у людей.
Предшествующий уровень техники
Известно, что клетка может становиться злокачественной путем трансформации части ее ДНК в онкоген, представляющий собой ген, который при активации приводит к образованию злокачественных опухолевых клеток. Многие онкогены кодируют белки, которые представляют собой аберрантные тирозинкиназы, способные вызывать клеточную трансформацию. Альтернативно сверхэкспрессия нормальной протоонкогенной тирозинкиназы также может иметь результатом пролиферативные нарушения, иногда дающие в результате злокачественный фенотип.
Рецепторные тирозинкиназы представляют собой ферменты, которые пронизывают клеточную мембрану и имеют внеклеточный домен для связывания факторов роста, таких как эпидермальный фактор роста, трансмембранный домен и внутриклеточный участок, который действует в качестве киназы, фосфорилирующей специфические остатки тирозина в белках и тем самым влияющей на клеточную пролиферациию. Кроме того, некоторые рецепторные тирозинкиназы представляют собой субстраты для тех же самых или других протеинкиназ в процессе, который может регулировать киназную функцию. Рецепторные тирозинкиназы классифицируются на семейства, одно из которых представляет собой семейство erb, включающее erbB1 и erbB2. Известно, что киназы, такие как erbB2, часто аберрантно экспрессируются при таких распространенных видах рака у людей, как рак молочной железы, рак желудочно-кишечного тракта, такой как рак толстой кишки, прямой кишки или желудка, лейкемия и рак яичников, бронхиальный рак и рак поджелудочной железы. Было показано, что рецептор эпидермального фактора роста (erbB1), который обладает тирозинкиназной активностью, мутирован и/или сверхэкспрессируется при многих типах рака у людей, таких как опухоли головного мозга, легких, плоскоклеточная опухоль, опухоль мочевого пузыря, желудка, молочной железы, головы и шеи, опухоль пищевода, гинекологические опухоли и опухоли щитовидной железы. Соответственно было признано, что ингибиторы рецепторных тирозинкиназ полезны в качестве избирательных ингибиторов роста раковых клеток у млекопитающих. Аномальный клеточный рост может быть ассоциирован с клеточной экспрессией рецепторов erb.
Тем не менее, в достаточной степени не было принято во внимание, что способ введения ингибитора может влиять на эффективность этого ингибитора.
Краткое изложение сущности изобретения
Изобретение относится в общем к способам и наборам для ингибирования аномального клеточного роста. Более конкретно изобретение относится к улучшенным схемам приема противоопухолевых агентов.
Настоящее изобретение относится к способу лечения сверхэкспрессии рецептора erbB2 у нуждающегося в таком лечении млекопитающего, включающему:
(а) введение указанному млекопитающему терапевтически эффективного количества первого ингибитора рецептора erbB2; и
(б) последующее введение указанному млекопитающему после промежутка времени меньше 24 часов от одного до шести терапевтически эффективных количеств второго ингибитора рецептора erbB2.
В первом предпочтительном воплощении настоящего изобретения на стадии (б) указанного способа могут быть введены от одного до четырех терапевтически эффективных количеств указанного второго ингибитора рецептора erbB2. В более предпочтительном воплощении на стадии (б) указанного способа вводят от одного до двух терапевтически эффективных количеств указанного второго ингибитора, рецептора erbB2. В еще одном воплощении на стадии (б) указанного способа вводят одно терапевтически эффективное количество указанного второго ингибитора рецептора erbB2.
В еще одном воплощении настоящего изобретения промежуток времени на стадии (б) указанного способа составляет менее 12 часов. В предпочтительном воплощении промежуток времени на стадии (б) указанного способа составляет менее 6 часов. В более предпочтительном воплощении промежуток времени на стадии (б) указанного способа составляет менее 3 часов. В наиболее предпочтительном воплощении промежуток времени на стадии (б) указанного способа составляет менее 1 часа.
Введение ингибитора на стадиях (а) и (б) может включать пероральное, трансбуккальное, сублингвальное, интраназальное, внутрижелудочное, интрадуоденальное, местное, внутриглазное, ректальное или вагинальное введение.
В одном воплощении изобретения первый ингибитор на стадии (а) является таким же, как второй ингибитор на стадии (б). В одном воплощении способа в соответствии с настоящим изобретением первое количество может отличаться от последующих одного-шести количеств. В еще одном воплощении настоящего изобретения ингибитор на стадии (а) может отличаться от ингибитора на стадии (б). В другом конкретном воплощении ингибитор на стадии (а) является таким же, как ингибитор на стадии (б), возможно, тем же самым стереоизомером или той же самой солевой формой. В еще одном воплощении лечения первый ингибитор на стадии (а) является синергистом второго ингибитора на стадии (б). Первый ингибитор на стадии (а), второй ингибитор на стадии (б) или оба могут являться антагонистами рецептора erbB2.
В одном воплощении настоящего изобретения терапевтически эффективное количество указанного первого ингибитора рецептора erbB2 отличается от одного-шести терапевтически эффективных количеств указанного второго ингибитора рецептора erbB2. В одном предпочтительном воплощении настоящего изобретения первый ингибитор на стадии (а) отличен от второго ингибитора на стадии (б). В еще одном предпочтительном воплощении первый ингибитор на стадии (а) является синергистом второго ингибитора на стадии (б). В еще одном предпочтительном воплощении настоящего изобретения первый ингибитор на стадии (а), второй ингибитор на стадии (б) или оба являются антагонистами рецептора erbB2.
В одном предпочтительном воплощении настоящего изобретения первый ингибитор на стадии (а) и второй ингибитор на стадии (б) независимо выбраны из небольших молекул и моноклональных антител. В одном предпочтительном воплощении как первый ингибитор на стадии (а), так и второй ингибитор на стадии (б) представляют собой небольшие молекулы или моноклональные антитела. В еще одном предпочтительном воплощении настоящего изобретения первый ингибитор на стадии (а), второй ингибитор на стадии (б) или оба являются избирательными в отношении рецепторов erbB2.
Способ лечения в соответствии с изобретением может дополнительно включать условие, что ингибитор на стадии (а), ингибитор на стадии (б) или оба они обладают периодом полувыведения in vivo от получаса до восьми часов.
Способ в соответствии с изобретением может включать введение ингибитора, где ингибитор на стадии (а), ингибитор на стадии (б) или оба они не являются существенно цитотоксичными.
Способ может включать введение ингибитора, где ингибитор на стадии (а), ингибитор на стадии (б) или оба они не являются по существу ингибиторами митоза.
В одном аспекте изобретения введение представляет собой контролируемое высвобождение. Препарат с контролируемым высвобождением может быть введен перорально, трансбуккально, сублингвально, интраназально, внутрижелудочно, интрадуоденально, местно, внутриглазным путем, ректально или вагинально.
В одном воплощении способа в соответствии с изобретением ингибитор на стадии (а) и ингибитор на стадии (б) независимо выбраны из небольших молекул и моноклональных антител. В одном предпочтительном воплощении как ингибитор на стадии (а), так и ингибитор на стадии (б) представляют собой небольшие молекулы или моноклональные антитела. Небольшие молекулы могут быть менее 4000 дальтон.
Первый ингибитор на стадии (а), второй ингибитор на стадии (б) или оба они могут быть избирательными в отношении рецепторов erbB2.
В еще одном воплощении изобретения первый ингибитор на стадии (а), второй ингибитор на стадии (б) или оба они включают соединение формулы 1:
или его фармацевтически приемлемую соль, сольват или пролекарство.
В формуле 1 m представляет собой целое число от 0 до 3;
р представляет собой целое число от 0 до 4;
каждый из R1 и R2 независимо выбран из Н и С1-С6алкила;
R3 представляет собой -(CR1R2)t(4-10-членный гетероцикл), где t представляет собой целое число от 0 до 5, причем указанная гетероциклическая труппа, возможно, конденсирована с бензольным кольцом или С5-С8циклоалкильной группой, группировка -(CR1R2)t вышеупомянутой группы R3, возможно, включает углерод-углеродную двойную или тройную связь, где t представляет собой целое число от 2 до 5, а вышеупомянутые группы R3, включающие любые вышеупомянутые возможные конденсированные кольца, возможно, замещены 1-5 группами R8;
R4 представляет собой -(CR16R17)m-C(C-(CR16R17)tR9, -(CR16R17)m-C=C-(CR16R17)tR9, -(CR16R17)m-C(C-(CR16R17)kR13, -(CR16R17)m-C=C-(CR16R17)kR13 или -(CR16R17)tR9, где точкой присоединения к R9 является углерод группы R9, каждый k представляет собой целое число от 1 до 3, каждый t представляет собой целое число от 0 до 5 и каждый m представляет собой целое число от 0 до 3;
каждый R5 независимо выбран из галогено, гидрокси, -NR1R2, C1-С6алкила, трифторметила, C1-С6алкокси, трифторметокси, -NR6C(O)R1, -C(O)NR6R7, -SO2NR6R7, -NR6C(O)NR7R1 и -NR6C(O)OR7;
каждый из R6, R6a и R7 независимо выбран из Н, C1-С6алкила, -(CR1R2)t(С6-С10арил) и -(CR1R2)t(4-10-членный гетероцикл), где t представляет собой целое число от 0 до 5, 1 или 2 кольцевых атома углерода гетероциклической группы, возможно, замещены группировкой оксо (=O), алкильные, арильные и гетероциклические группировки вышеупомянутых групп R6 и R7, возможно, замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, -NR1R2, трифторметила, трифторметокси, C1-С6алкила, С2-С6алкенила, С2-С6алкинила, гидрокси и С1-С6алкокси;
или R6 и R7 или R6a и R7, когда они присоединены к одному и тому же атому азота, могут быть взяты вместе с образованием 4-10-членного гетероциклического кольца, которое может включать 1-3 дополнительные гетерогруппировки в дополнение к атому азота, к которому присоединены указанные R6, R6a и R7, выбранные из N, N(R1), О и S, при условии, что два атома О, два атома S или атомы О и S не соединены непосредственно друг с другом;
каждый R8 независимо выбран из оксо (=O), галогено, циано, нитро, трифторметокси, трифторметила, азидо, гидрокси, C1-С6алкокси, C1-C10алкила, С2-С6алкенила, С2-С6алкинила, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -NR6SO2NR7R1, -NR6C(O)NR1R7, -NR6C(O)OR7, -C(O)NR6R7, -NR6R7, -NR6OR7, -SO2NR6R7, -S(O)j)(С1-С6алкил), где j представляет собой целое число от 0 до 2, -(CR1R2)t(С6-С10арил), -(CR1R2)t(4-10-членный гетероцикл), -(CR1R2)qС(O)(CR1R2)t(С6-С10арил), -(CR1R2)qC(O)(CR1R2)t(4-10-членный гетероцикл), -(CR1R2)tO(CR1R2)q(С6-С10арил), -(CR1R2)tO(CR1R2)q(4-10-членный гетероцикл), -(CR1R2)qS(O)j(CR1R2)t(C6-C10арил) и -(CR1R2)qS(O)j(CR1R2)t(4-10-членный гетероцикл), где j представляет собой 0, 1 или 2, q и t каждый независимо представляет собой целое число от 0 до 5, 1 или 2 кольцевых атома углерода гетероциклических группировок вышеупомянутых групп R8, возможно, замещены группировкой оксо (=O), а алкильные, алкенильные, алкинильные, арильные и гетероциклические группировки вышеупомянутых групп R8, возможно, замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -OR6, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -NR6OR7, C1-С6алкила, С2-С6алкенила, С2-С6алкинила, -(CR1R2)t(C6-C10арил) и -(CR1R2)t(4-10-членный гетероцикл), где t представляет собой целое число от 0 до 5;
R9 представляет собой неароматическое моноциклическое кольцо, конденсированное или мостиковое бициклическое кольцо или спироциклическое кольцо, где указанное кольцо содержит от 3 до 12 атомов углерода, причем от 0 до 3 атомов углерода, возможно, заменены гетерогруппировкой, независимо выбранной из N, О, S(O)j, где j представляет собой целое число от 0 до 2, и -NR1-, при условии, что два атома О, две группировки S(O)j, атом О и группировка S(O)j, атом N и атом S или атом N и атом О не соединены непосредственно друг с другом в пределах указанного кольца, и где атомы углерода указанного кольца, возможно, замещены 1 или 2 группами R8;
каждый R11 независимо выбран из заместителей, приведенных в определении R8, за исключением того, что R11 не представляет собой оксо (=O);
R12 представляет собой R6, -OR6, -OC(O)R6, -OC(O)NR6R7, -OCO2R6, -S(O)jR6, -S(O)jNR6R7, -NR6R7, -NR6C(O)R7, -NR6SO2R7, -NR6C(O)NR6aR7, -NR6SO2NR6aR7, -NR6CO2R7, CN, -C(O)R6 или галогено, где j представляет собой целое число от 0 до 2;
R13 представляет собой -N11R14 или -OR14;
R14 представляет собой Н, R15, -C(O)R15, -SO2R15, -C(O)NR15R7, -SO2NR15R7 или -CO2R15;
R15 представляет собой R18, -(CR1R2)t(C6-C10арил), -(CR1R2)t(4-10-членный гетероцикл), где t представляет собой целое число от 0 до 5, 1 или 2 кольцевых атома углерода гетероциклической группы, возможно, замещены группировкой оксо (=O), а арильные и гетероциклические группировки вышеупомянутых групп R15, возможно, замещены 1-3 заместителями R8;
каждый R16 и R17 независимо выбран из Н, С1-С6алкила и -CH2OH, или R16 и R17, взятые вместе, представляют собой -СН2СН2- или -СН2CH2СН2-;
R18 представляет собой С1-С6алкил, причем каждый атом углерода, не связанный с атомом N или О или с S(O)j, где j представляет собой целое число от 0 до 2, возможно, замещен группой R12;
и где любой из вышеупомянутых заместителей, включающих группу СН3 (метил), СН2 (метилен) или СН (метин), которая не связана с группой галогено, SO или SO2 или с атомом N, О или S, возможно, замещен группой, выбранной из гидрокси, галогено, С1-С4алкила, С1-С4алкокси и -NR1R2.
Используемый здесь термин "галогено", если не указано иначе, включает фторо, хлоро, бромо или йодо. Предпочтительные группы галогено представляют собой фторо и хлоро.
Используемый здесь термин "алкил", если не указано иначе, включает насыщенные одновалентные углеводородные радикалы, имеющие прямые, циклические (включая моно- или мультициклические группировки) или разветвленные группировки. Понятно, что для того, чтобы указанная алкильная группа включала циклические группировки, она должна содержать по меньшей мере три атома углерода.
Используемый здесь термин "циклоалкил", если не указано иначе, включает насыщенные одновалентные углеводородные радикалы, имеющие циклические (включая моно- или мультициклические) группировки.
Используемый здесь термин "алкенил", если не указано иначе, включает алкильные группы, как определено выше, имеющие по меньшей мере одну углерод-углеродную двойную связь.
Используемый здесь термин "алкинил", если не указано иначе, включает алкильные группы, как определено выше, имеющие по меньшей мере одну углерод-углеродную тройную связь.
Используемый здесь термин "арил", если не указано иначе, включает органический радикал, полученный из ароматического углеводорода путем удаления одного атома водорода, такой как фенил или нафтил.
Используемый здесь термин "алкокси", если не указано иначе, включает группы -O-алкил, где алкил является таким, как определено выше.
Используемый здесь термин "4-10-членный гетероцикл", если не указано иначе, включает ароматические и неароматические гетероциклические группы, содержащие один или более гетероатомов, каждый из которых выбран из О, S и N, где каждая гетероциклическая группа содержит от 4 до 10 атомов в своей кольцевой системе. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей кольцевой системе, а ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы и кольцевые системы, замещенные одной или более чем одной группировкой оксо. Примером 4-членной гетероциклической группы является азетидинил (полученный из азетидина). Примером 5-членной гетероциклической группы является тиазолил, а примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидине, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеупомянутые группы, получаемые из перечисленных выше соединений, могут быть присоединены по атому С или N, когда такое присоединение возможно. Например, группа, полученная из пиррола, может представлять собой пиррол-1-ил (присоединение по атому N) или пиррол-3-ил (присоединение по атому С).
Термин "Me" означает метил, "Et" означает этил, и "Ас" означает ацетил. Используемое здесь выражение "фармацевтически приемлемая(ые) соль(и)", если не указано иначе, включает соли кислых или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по природе, способны образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат (gentisinate), фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат и памоат [то есть 1,1'-метиленбис-(2-гидрокси-3-нафтоат)]. Соединения по настоящему изобретению, которые включают основную группировку, такую как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами в дополнение к вышеупомянутым кислотам.
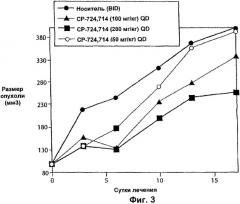
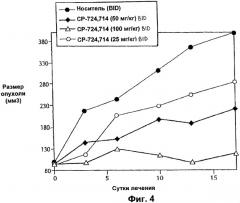
Способ лечения в соответствии с изобретением может включать введение ингибитора рецептора erbB2, где ингибитор на стадии (а), ингибитор на стадии (б) или оба включают соединение, выбранное из группы, состоящей из гефитиниба (IRESSA, ZD1839), трастузумаба, цетуксимаба, эрлотиниба, IDM-1, ABX-EGF, гидрохлорида канертиниба, вакцины EGF-P64k, EKB-569, EMD-72000, GW-572016, MDX-210, ME-103, YMB-1001, антитела 2С4, АРС-8024, СР-724714, Е75, вакцины Her-2/neu, Herzyme, ТАК-165, ADL-681, B-17, D-69491, Dab-720, EGFrvIII, EHT-102, FD-137, вакцины HER-1, HuMax-DGFr, ME-104, MR1-1, SC-100, трастузумаба-DM1, YMB-1005, AEE-788 (Novartis), ингибиторов мишени рипамицина млекопитающих (mTOR), включая рапамицин (Rapamune, Siolimus, Wyeth), CCI-779 (Wyeth), AP23573 (ARIAD) и RAD001 (Novartis).
В одном воплощении настоящего изобретения сверхэкспрессию рецептора erbB2 определяют с использованием цитогенетического теста, измерения флуоресцентной гибридизации in-situ, иммуногистохимического теста, теста с использованием проточной цитометрии, теста, основанного на полимеразной цепной реакции с обратной транскриптазой, или любой их комбинации.
В одном воплощении настоящего изобретения млекопитающее представляет собой человека, а аномальный клеточный рост представляет собой злокачественное новообразование. Млекопитающее также может представлять собой экспериментальное животное, домашнее животное, скот или любое другое млекопитающее.
Способ лечения в соответствии с изобретением может также включать достижение уровней в плазме первого ингибитора на стадии (а), второго ингибитора на стадии (б) или обоих, составляющих приблизительно от 10 нг/мл до 4000 нг/мл.
В одном воплощении изобретения первый ингибитор на стадии (а) и второй ингибитор на стадии (б) каждый независимо выбран из группы, состоящей из:
(±)-(3-Метил-4-(пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)амина;
(+)-(3-Метил-4-(пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)амина;
(-)-(3-Метил-4-(пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)амина;
2-Метокси-N-(3-{4-(3-метил-4-(пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)-ацетамида;
(±)-(3-Метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)-амина;
(+)-(3-Метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)-амина;
(-)-(3-Метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)-амина;
2-Метокси-N-(3-{4-(3-метил-4-(2-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-ацетамида;
(3-Метил-4-(2-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-4-илэтинил-хиназолин-4-ил)-амина;
(3-Метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-4-ил-этинил-хиназолин-4-ил)-амина;
2-Метокси-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-ацетамида;
2-Фтор-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)-ацетамида;
Е-2-Метокси-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида;
(3-Метил-4-(пиридин-3-илокси)-фенил)-(6-пиперидин-4-илэтинил-хиназолин-4-ил)-амина;
2-Метокси-N-(1-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-илэтинил}-циклопропил)-ацетамида;
Е-N-(3-{4-(3-Хлор-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-2-метокси-ацетамида;
N-(3-{4-(3-Хлор-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)-ацетамида;
N-(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)-ацетамида;
E-N-(3-{4-(3-Хлор-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида;
Е-2-Этокси-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида;
1-Этил-3-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)-мочевины;
(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)амида пиперазин-1-карбоновой кислоты;
(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)амида (±)-2-гидроксиметил-пирролидин-1-карбоновой кислоты;
(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-амида (+)-2-гидроксиметил-пирролидин-1-карбоновой кислоты;
(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-амида (-)-2-гидроксиметил-пирролидин-1-карбоновой кислоты;
2-Диметиламино-N-(3-{4-(3-метил-4-(пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-ацетамида;
Е-N-(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)метансульфонамида;
(3-{4-(3-Метил-4-(6-метил-пиридин-3-илокси)фениламино)-хиназолин-6-ил}проп-2-инил)-амида изоксазол-5-карбоновой кислоты;
1-(1,1-Диметил-3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-проп-2-инил)-3-этилмочевины.
Способ лечения включает применение одного агента, который ингибирует рецептор erbB2, а также применение двух различных агентов. Этот один агент и по меньшей мере один из двух агентов предпочтительно представляет собой агент формулы 1. Таким образом, в одном воплощении ингибитор выбран из группы, состоящей из (±)-(3-метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-3-илэтинил-хиназолин-4-ил)амина и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном воплощении ингибитор выбран из группы, состоящей из (3-метил-4-(6-метил-пиридин-3-илокси)-фенил)-(6-пиперидин-4-илэтинил-хиназолин-4-ил)амина и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном воплощении ингибитор выбран из группы, состоящей из E-2-метокси-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном воплощении ингибитор выбран из группы, состоящей из Е-N-(3-{4-(3-хлор-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-2-метокси-ацетамида и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном воплощении ингибитор выбран из группы, состоящей из Е-N-(3-{4-(3-хлор-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-ацетамида и его фармацевтически приемлемых солей, пролекарств и сольватов. В конкретном воплощении изобретения ингибитор выбран из группы, состоящей из (3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}проп-2-инил)амида пиперазин-1-карбоновой кислоты и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном конкретном воплощении изобретения ингибитор выбран из группы, состоящей из E-N-(3-{4-(3-метил-4-(6-метил-пиридин-3-илокси)-фениламино)-хиназолин-6-ил}-аллил)-метансульфонамида и его фармацевтически приемлемых солей, пролекарств и сольватов. В еще одном аспекте изобретения первый ингибитор со стадии (а), второй ингибитор со стадии (б) или оба находятся в фармацевтически приемлемом носителе.
В первом воплощении настоящего изобретения сверхэкспрессия рецептора erbB2 приводит в результате к аномальному клеточному росту. Аномальный клеточный рост, который лечат первым и вторым ингибитором рецептора erbB2, может представлять собой злокачественное новообразование. Злокачественное новообразование может быть выбрано из группы, состоящей из периферической лентигинозной меланомы, лучевого кератоза, аденокарциномы, аденокистозной карциномы, аденомы, аденосаркомы, железисто-плоскоклеточной карциномы, астроцитарной опухоли, карциномы бартолиновой железы, базально-клеточной карциномы, карциномы бронхиальных желез, капиллярной карциномы, карциноида, карциномы, карциносаркомы, кавернозной карциномы, холангиокарциномы, хондросаркомы; папилломы сосудистого сплетения, карциномы сосудистого сплетения, гипернефроидной опухоли почки, цистаденомы, эндодермальной полостной опухоли, эндометриальной гиперплазии, эндометриальной стромальной саркомы, эндометриоидной аденокарциномы, эпендимной карциномы, эпителиоидной саркомы, саркомы Юинга, фиброламеллярной, фокальной нодулярной гиперплазии, гастриномы, опухоли половых клеток, глиобластомы, глюкагономы, гемангиобластомы, гемангиоэндотелиомы, гемангиомы, печеночной аденомы, печеночного аденоматоза, печеночно-клеточного рака, инсулиномы, внутриэпителиальной неоплазии, межэпителиальной плоско клеточной неоплазии, инвазивного плоскоклеточного рака, крупноклеточного рака, лейомиосаркомы, злокачественного лентиго, злокачественной меланомы, злокачественной мезотелиальной опухоли, медуллобластомы, медулло-эпителиомы, меланомы, менингеальной мезотелиальной метастатической карциномы, слизеобразующего плоскоклеточного рака, нейробластомы, нейроэпителиальной аденокарциномы, узелковой меланомы, овсяно-клеточного рака, олигодендроглиальной остеосаркомы, панкреатического полипептида, серозной папиллярной аденокарциномы, пинеалоцита, опухоли гипофиза, плазмацитомы, псевдосаркомы, легочной бластомы, почечно-клеточной карциномы, ретинобластомы, рабдомиосаркомы, саркомы, серозной карциномы, мелкоклеточной карциномы, рака мягких тканей, соматостатин-секретирующей опухоли, плоскокого рака, сквамозной карциномы, сквамозноклеточной карциномы, субмезотелиальнои поверхностно-распространяющейся меланомы, недифференцированной карциномы, юношеской меланомы, сосочкового рака, випомы, высокодифференцированной карциномы, бронхиолоальвеолярного рака, опухоли Вильма.
В одном воплощении аномальный клеточный рост представляет собой злокачественное новообразование, выбранное из группы, состоящей из опухоли легкого, молочной железы, кожи, желудка, кишечника, пищевода, поджелудочной железы, печени, мочевого пузыря, головы, шеи, головного мозга, цервикальной опухоли и опухоли яичников. В одном предпочтительном воплощении аномальный клеточный рост представляет собой опухоль, выбранную из группы, состоящей из опухоли молочной железы, желудка, поджелудочной железы и яичников. В более предпочтительном воплощении аномальный клеточный рост представляет собой рак молочной железы.
В еще одном воплощении изобретения ингибитор рецептора erbB2 может быть избирательным в отношении рецептора erbB2. Способ по изобретению может дополнительно включать: (в) расчет соотношения аффинности связывания ингибитора для рецептора erbB2 и второй аффиности связывания ингибитора для рецептора erbB1, и (г) использование соотношения для оценки избирательности. В одном воплощении ингибитор по меньшей мере в два раза более избирателен в отношении рецептора erbB2. В еще одном воплощении ингибитор по меньшей мере в десять раз более избирателен в отношении рецептора erbB2.
Еще одно воплощение настоящего изобретения относится к способу лечения субъекта, страдающего от аномального клеточного роста, включающему пероральное, трансбуккальное, сублингвальное, интраназальное, внутриглазное, внутрижелудочное, интрадуоденальное, местное, ректальное или вагинальное введение указанному субъекту, нуждающемуся в лечении аномального клеточного роста, в пределах двадцати четырех часов первого количества ингибитора рецептора erbB2, терапевтически синергически эффективного второго количества ингибитора и возможно третьего или четвертого количества ингибитора. Ингибитор может представлять собой избирательный ингибитор рецептора erbB2.
В еще одном воплощении изобретение включает набор для лечения аномального клеточного роста, включающий по меньшей мере две дозы ингибитора рецептора erbB2, пригодные для перорального, трансбуккального, сублингвального, интраназального, внутриглазного, внутрижелудочного, интрадуоденального, местного, ректального или вагинального введения субъекту, и письменные инструкции по введению доз по меньшей мере дважды в сутки субъекту, страдающему от аномального клеточного роста. Целесообразно, если письменные инструкции находятся на этикетке или вложены в упаковку. В одном воплощении набора аномальный клеточный рост представляет собой опухоль, выбранную из группы, состоящей из опухоли легкого, молочной железы, кожи, желудка, кишечника, пищевода, мочевого пузыря, головы, шеи, головного мозга, цервикальной опухоли и опухоли яичников.
В еще одном воплощении изобретение включает способ лечения содержащей рецептор erbB2 опухоли у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества ингибитора рецептора erbB2 путем инфузии указанному субъекту в течение 1-8 часов таким образом, что инфузия оказывается более эффективным, чем болюсная инъекция. Инфузия может быть внутривенной, внутримышечной, интраперитонеальной или подкожной. В одном воплощении ингибитор может представлять собой соединение формулы 1.
В еще одном воплощении изобретение включает способ усиления эффективности ингибитора рецептора erbB2 у нуждающегося в этом субъекта, включающий: (а) определение базовой дозы ингибитора рецептора erbB2 и (б) деление дозы для повышения эффективности. Повышенная эффективность представляет собой форму синергизма, являющегося результатом деления дозы. В одном воплощении дозу делят на 2-6 суточных доз.
В еще одном воплощении базовая доза обладает побочным действием, а разделенная доза обладает уменьшенным побочным действием. Ингибитор может быть по меньшей мере в два раза более избирательным в отношении рецептора erbB2 по сравнению с рецептором erbB1. В еще одном воплощении ингибитор по меньшей мере в десять раз более избирателен в отношении рецептора erbB2 по сравнению с рецептором erbB1.
Способ повышения эффективности может дополнительно включать стадии: (в) расчета соотношения аффинности связывания ингибитора для рецептора erbB2 и второй аффиности связывания ингибитора для рецептора erbB1 и (г) использования соотношения для оценки избирательности.
В еще одном воплощении изобретение включает способ повышения эффективности ингибитора рецептора erbB2, включающий введение нуждающемуся в этом пациенту суточной дозы терапевтически эффективного количества ингибитора, где суточная доза разделена для обеспечения уровня ингибитора в плазме указанного пациента, который меньше, чем терапевтически эффективное количество разовой суточной дозы, а эффективность повышена.
В еще одном воплощении изобретение включает способ повышения безопасности введения ингибитора рецептора erbB2 нуждающемуся в этом субъекту, включающий ежедневное введение указанному субъекту от двух до шести терапевтически эффективных количеств ингибитора.
В еще одном воплощении изобретение включает способ повышения безопасности введения ингибитора рецептора erbB2 нуждающемуся в этом субъекту, включающий определение базовой суточной дозы ингибитора, имеющей профиль безопасности, и деление этой дозы для улучшения профиля безопасности.
В еще одном воплощении изобретение включает набор для лечения аномального клеточного роста у субъекта, включающий дозу ингибитора рецептора erbB2, которая подходит для внутривенной, внутримышечной, интраперитонеальной или подкожной инфузии, и письменные инструкции по инфузии этой дозы указанному субъекту в течение 1-8 часов. В одном воплощении набора аномальный клеточный рост может включать опухоль, выбранную из группы, состоящей из опухоли легкого, молочной железы, кожи, желудка, кишечника, пищевода, мочевого пузыря, поджелудочной железы, печени, головы, шеи, головного мозга, цервикальной опухоли и опухоли яичников.
В еще одном воплощении изобретение включает профилактическое лечение субъекта, имеющего риск развития опухоли, включающее введение указанному субъекту эффективного количества избирательного ингибитора рецептора erbB2 по меньшей мере дважды в сутки. В одном воплощении профилактического лечения ингибитор может быть отличным от ан