Индолы, полезные для лечения заболеваний, связанных с андрогеновыми рецепторами
Иллюстрации
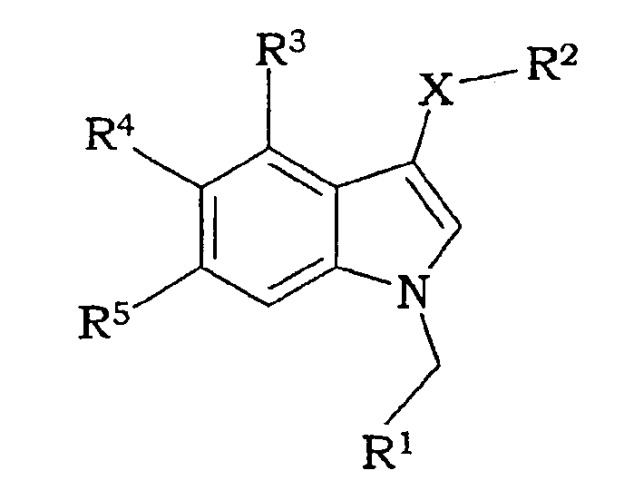
Показать всеИзобретение относится к новым производным индола формулы
Х означает S, SO, SO2;
R1 означает 6-членную моногомоциклическую насыщенную или ненасыщенную кольцевую структуру или 5-, 6-членную моногетероциклическую насыщенную или ненасыщенную кольцевую структуру с одним или двумя гетероатомами, выбранными из N, О, S, причем каждая из указанных структур необязательно замещена одним или более заместителями, выбранными из группы, состоящей из галогена, CN, (1С-4С)фторалкила, NO2, (1С-4С)алкила, (1С-4С)алкокси или (1С-4С)фторалкокси;
R2 означает 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 означает Н, галоген или (1С-4С)алкил;
R4 означает Н, ОН, (1С-4С) алкокси или галоген;
R5 означает Н, ОН, (1С-4С) алкокси, NH2, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, CO2H, СО2(1С-6С)алкил, или R5 означает NHR6, где R6 означает (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(O)2(1С-4С)алкил или S(O)2гетероарил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, где гетероарил представляет 5-членную моногетероциклическую ненасыщенную кольцевую структуру с одним атомом S или двумя атомами N, или
R5 означает C(O)N(R8,R9), где R8 и R9, каждый независимо, означают H, (3С-6С)циклоалкил или CH2R10, где R10 означает Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или фенил, или где R8 и R9 вместе с N образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее N или О в качестве второго гетероатома, необязательно замещенное (1С-4С)алкилом;
или его солевая или гидратная форма.
Соединения обладают андрогеновой активностью, что позволяет использовать их для получения лекарственного средства и в способе ингибирования активности в отношении 5α-дигидротестостерона. 3 н. и 14 з.п. ф-лы, 5 табл.
Реферат
Данное изобретение относится к производным индола, их получению и их применению для лечения патологических состояний, расстройств или заболеваний, связанных с андрогеновыми рецепторами, и другого лечения, связанного с андрогенами.
Соединения, обладающие андрогенной активностью, полезны для лечения мужчин с низким эндогенным уровнем циркулирующих андрогенных гормонов или мужчин с подавленными андрогенными эффектами. Такое лечение прописывают пожилым мужчинам, мужчинам с гипогонадизмом или мужчинам, которые получали прогестагены для мужской контрацепции. Кроме того, сильные андрогены угнетают сперматогенез и могут быть использованы в качестве мужских контрацептивов.
Таким образом, важно получить соединения с высокой аффинностью по отношению к андрогеновым рецепторам. Особенно полезны нестероидные соединения с высокой аффинностью по отношению к андрогеновым рецепторам, так как они могут обладать иными характеристиками распределения в ткани, чем стероидные андрогены, и могут быть разработаны путем надлежащего подбора заместителей, чтобы быть более или менее селективными в отношении определенных тканей. Например, действие на мозг обычно предотвращается, когда соединения являются сильно гидрофильными или несут ионный заряд.
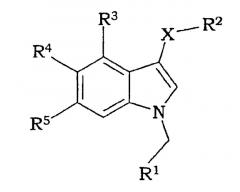
Рассматриваемое изобретение представляет нестероидные соединения с аффинностью по отношению к андрогеновым рецепторам. Эти соединения потенциально полезны для лечения заболеваний, связанных с андрогеновыми рецепторами, или заболеваний, которые можно лечить андрогенами. Соединения рассматриваемого изобретения имеют структуру, соответствующую формуле I:
где
Х представляет S, SO или SO2;
R1 представляет 5- или 6-членную моноциклическую, гетеро- или гомоциклическую, насыщенную или ненасыщенную кольцевую структуру, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, CN, (1С-4С)фторалкила, нитро, (1С-4С)алкила, (1С-4С)алкокси или (1С-4С)фторалкокси;
R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамид, метиловый эфир 2-бензойной кислоты или 2-метоксифенил;
R3 представляет Н, галоген или (1С-4С)алкил;
R4 представляет Н, ОН, (1С-4С)алкокси или галоген;
R5 представляет Н, ОН, (1С-4С)алкокси, NH2, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, СО2Н, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(О)2(1С-4С)алкил или S(О)2арил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, или R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С0-4С)алкил)аминокарбонил или 3-, 4-, 5- или 6-членное моноциклическое, гомо- или гетероциклическое, ароматическое или неароматическое кольцо, или где R8 и R9 образуют вместе с N 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно замещенное (1С-4С)алкилом;
их солевую или гидратную форму.
В одном из воплощений R1 представляет 5- или 6-членную моноциклическую, гетеро- или моноциклическую насыщенную или ненасыщенную кольцевую структуру, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, CN, CF3, нитро, метокси, трифторметокси или метила; R2 представляет 2-нитрофенил, 2-цианофенил, 2-гидроксиметилфенил, пиридин-2-ил, пиридин-2-ил-N-оксид, 2-бензамил, метиловый эфир 2-бензойной кислоты или 2-метоксифенил; R3 представляет Н, галоген или (1С-2С)алкил; R4 представляет Н или F.
В другом воплощении R5 представляет Н, ОН, (1С-4С)алкокси, CN, галоген, (1С-4С)фторалкил, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-6С)ацил, необязательно замещенный одним или более галогенами, S(О)2(1С-4С)алкил или S(О)2арил, необязательно замещенный (1С-4С)алкилом или одним или более галогенами, или R5 представляет собой С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-6С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-4С)алкиловый эфир карбокси(1С-4С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил или 3-, 4-, 5- или 6-членное моноциклическое, гомо- или гетероциклическое, ароматическое или неароматическое кольцо, или где R8 и R9, вместе образуют с N 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно замещенное (1С-4С)алкилом.
В еще одном воплощении R3 представляет Н или галоген; R4 представляет Н; R5 представляет Н, ОН, (1С-4С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет (1С-3С)ацил, необязательно замещенный одним или более галогенами, или R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н, (3С-5С)циклоалкил или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, сложный (1С-2С)алкиловый эфир карбокси(1С-2С)алкила, (1С-3С)алкокси(1С-3С)алкил, (моно- или ди(1С-4С)алкил)аминометил, (моно- или ди(1С-4С)алкил)аминокарбонил, (3С-5С)циклоалкил или 5-членное гетероциклическое кольцо.
В еще одном воплощении Х представляет S или SO2; R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-бензамид, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н или F; R5 представляет Н, ОН, (1С-2С)алкокси, CN, F, Cl, CF3, NO2, гидрокси(1С-4С)алкил, СО2(1С-6С)алкил, или R5 представляет NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил, или R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет Н, циклопропил, или R9 представляет СН2R10, где R10 представляет Н, (1С-2С)алкил, гидрокси(1С-2С)алкил, метокси(1С-2С)алкил, циклопропил.
В еще одном воплощении Х представляет S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил, пиразин-2-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет ОН, (1С-2С)алкокси, CN, CF3, NO2, гидрокси(1С-4С)алкил или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В еще одном воплощении R1 представляет собой 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил, пиримидин-4-ил или пиразин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет ОН, (1С-2С)алкокси, CN, гидрокси(1С-4С)алкил или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, пиримидин-5-ил или пиримидин-4-ил; R2 представляет собой 2-нитрофенил; R5 представляет ОН, (1С-2С)алкокси, CN или NHR6, где R6 представляет формил, ацетил, фторацетил, дифторацетил или трифторацетил.
В конкретном воплощении рассматриваемое изобретение представляет соединения:
6-метокси-3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол,
гидрохлорид 3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрила,
3-(2-нитрофенилсульфанил)-1-пиридин-2-илметил-1Н-индол-6-карбонитрил,
3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-карбонитрил,
3-(2-нитрофенилсульфанил)-1-пиримидин-4-илметил-1Н-индол-6-карбонитрил,
N-[1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-ил]-2-фторацетамид и
N-[3-(2-нитрофенилсульфанил)-1-пиримидин-5-илметил-1Н-индол-6-ил]формамид.
В другом воплощении Х является S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет Н или СН2R10, где R10 представляет Н, (1С-2С)алкил, гидрокси(1С-2С)алкил или метокси(1С-2С)алкил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет С(О)N(R8,R9), где R8 представляет Н, и R9 представляет СН2R10, где R10 представляет Н или (1С-2С)алкил.
В конкретном воплощении рассматриваемое изобретение представляет соединение: метиламид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты.
В еще одном воплощении Х является S; R1 представляет 3,5-дифторфенил, пиридин-2-ил, пиридин-3-ил, 3-фторфенил, 3-цианофенил или 3-нитрофенил; R2 представляет собой 2-нитрофенил, 2-гидроксиметилфенил, 2-метоксифенил, 2-цианофенил или пиридин-2-ил; R3 представляет Н; R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или СН2R10, где R10 представляет Н, (1С-5С)алкил, (1С-5С)алкенил, гидрокси(1С-3С)алкил, (1С-3С)алкокси(1С-3С)алкил или (моно- или ди(1С-4С)алкил)аминометил.
В еще одном воплощении R1 представляет 3,5-дифторфенил, пиридин-2-ил или пиридин-3-ил; R2 представляет собой 2-нитрофенил или 2-гидроксиметилфенил; R5 представляет С(О)N(R8,R9), где R8 и R9, каждый независимо, представляют Н или СН2R10, где R10 представляет Н, (1С-5С)алкил, гидрокси(1С-3С)алкил, или (1С-3С)алкокси(1С-3С)алкил.
В конкретном воплощении рассматриваемое изобретение представляет соединение: диметиламид 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты.
В тех случаях, когда соединение данного изобретения содержит основную аминную функцию, данное соединение может быть использовано в виде свободного основания или в виде фармацевтически приемлемой соли, такой как гидрохлорид, ацетат, оксалат, тартрат, цитрат, фосфат, малеат или фумарат.
Соединение по данному изобретению является соединением, которому дано определение выше, его солью, его гидратом или его пролекарством.
Термины, используемые в данном описании, имеют следующее значение:
алкил представляет собой разветвленную или неразветвленную алкильную группу, например метил, этил, пропил, изопропил, бутил, вторичный бутил, трет-бутил, гексил и тому подобное;
фторалкил представляет собой алкильную группу, замещенную одним или более атомами фтора;
циклоалкил представляет собой циклическую неразветвленную алкильную группу, такую как циклопропил, циклобутил, циклопентил и тому подобное;
алкенил представляет собой разветвленную или неразветвленную алкенильную группу, такую как этенил, 2-бутенил и т.д.;
алкокси представляет собой разветвленную или неразветвленную алкилоксигруппу, например, метилокси, этилокси, пропилокси, изопропилокси, бутилокси, вторичный бутилокси, трет-бутилокси и тому подобное;
фторалкокси представляет собой алкоксигруппу, замещенную одним или более атомами фтора;
арил представляет собой моно- или полициклическую, гомо- или гетероциклическую ароматическую кольцевую систему, такую как фенил, нафтил или пиридил; моноциклическое кольцо из 6 атомов является предпочтительным для использования;
ацил представляет собой (заместитель)карбонильную группу, такую как ароил или алканоил;
ароил является арилкарбонилом, таким как бензоильная группа;
алканоил означает формильную или алкилкарбонильную группу, такую как формил, ацетил и пропаноил;
карбокси представляет собой -СООН заместитель, делающий соединение органической кислотой;
карбоксилат представляет собой соль карбоксильного заместителя;
префиксы (1С-4С), (2С-4С) и т.д. имеют обычное значение для ограничения значения указанной группы группами с 1-4, 2-4 атомами углерода;
галоген относится к фтору, хлору, брому и йоду.
Аффинность по отношению к андрогеновым рецепторам и эффективность соединений по данному изобретению делает их полезными для применения при лечении связанных с андрогеновыми рецепторами заболеваний, заболеваний, которые можно лечить андрогенами, и для диагностических методов, нацеленных на определение количества и/или локализации андрогеновых рецепторов в различных тканях. Для последней цели может быть предпочтительно получать меченые варианты соединений по данному изобретению. Обычным лечением связанных с андрогеновыми рецепторами заболеваний является применение для мужской контрацепции и гормональной заместительной терапии мужчин и женщин. Таким образом, данное изобретение относится также к способу лечения недостаточности андрогенов введением мужчинам или женщинам или самцам и самкам животных эффективного количества любого из соединений рассматриваемого изобретения. Рассматриваемое изобретение также относится к применению любого из этих соединений для получения лекарственного средства для лечения недостаточности андрогенов. В контексте данного изобретения термин «недостаточность андрогенов» нужно понимать как относящийся ко всем видам заболеваний, расстройств и симптомов, при которых мужчина или женщина страдает от слишком низкого уровня тестостерона, таких как гипогонадизм у мужчин и мальчиков. В частности, андрогеновая недостаточность, которую нужно лечить соединением данного изобретения, представляет собой снижение уровня тестостерона, которое проявляется у мужского индивидуума с возрастом (соединение данного изобретения затем используют для гормонозаместительной терапии у мужчин), или когда он подвергается мужской контрацепции. В контексте мужской контрацепции соединение данного изобретения служит специально для нейтрализации эффекта режимов мужской гормональной контрацепции, при которых стерилизующее средство, такое как прогестерон или LHRH (релизинг-гормон лютеинизирующего гормона), вводят регулярно, например каждый день, или применяют в качестве единственного мужского контрацептивного вещества.
Таким образом, рассматриваемое изобретение представляет любое из соединений рассматриваемого изобретения для применения в терапии.
Рассматриваемое изобретение, кроме того, охватывает и фармацевтическую композицию, содержащую соединение рассматриваемого изобретения и фармацевтически приемлемый носитель. В воплощении рассматриваемого изобретения фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из связанного с андрогеновыми рецепторами заболевания, связанного с андрогенами заболевания и недостаточностью андрогенов.
Рассматриваемое изобретение, кроме того, представляет применение соединения данного изобретения для производства лекарственного средства для лечения связанных с андрогеновыми рецепторами заболеваний, связанных с андрогенами заболеваний и недостаточностью андрогенов.
Рассматриваемое изобретение, кроме того, представляет способ лечения заболевания, выбранного из группы, состоящей из связанного с андрогеновыми рецепторами заболевания, связанного с андрогенами заболевания и недостаточностью андрогенов, включающий введение фармацевтически эффективного количества соединения по данному изобретению субъекту, нуждающемуся в этом.
Соединения данного изобретения могут быть, кроме того, полезны при лечении остеопороза, а также других заболеваний костей, при восстановлении при переломе кости, лечении саркопении, слабости, старения кожи, гипогонадизма у мужчин, половой дисфункции у женщин, симптомов постменопаузы, атеросклероза, апластической анемии, атрофии мышц, липодистрофии, сниженной мышечной силы и функции, побочных эффектов химиотерапии, хронического синдрома усталости, доброкачественной гиперплазии простаты (ДГП), кахексии, хронического катаболического состояния, нарушения познавательной способности, контрацепции у мужчин и других.
Соединения данного изобретения можно вводить в сочетании с эстрогенами, прогестероном и другими андрогенами.
Соединения данного изобретения можно получить разными способами, в основном известными в области органической химии. Более конкретно, можно использовать пути синтеза, которые проиллюстрированы на следующих схемах и в примерах. На схемах и в примерах использованы следующие сокращения:
ДМФА = диметилформамид
mCPBA = мета-хлорпербензойная кислота
ТГФ = тетрагидрофуран
TBTU = тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
DIPEA = диизопропилэтиламин
EDCI = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
HOBt = 1-гидроксибензотриазол
NMM = N-метилморфолин
SPE = твердофазное экстрагирование
RP-SPE = твердофазное экстрагирование с обращенной фазой
ДМСО = диметилсульфоксид
ДХМ = дихлорметан
DHT = 5α-дигидротестостерон
NMP = 1-метил-2-пирролидинон
DMS = диметилсульфид
Что касается номенклатуры, взаимозаменяемо использованы следующие обычные наименования для заместителей R1 и R2:
| Общепринятое название | Официальное название |
| 2-пиридил | пиридин-2-ил |
| 3-пиридил | пиридин-3-ил |
| 4-пиридил | пиридин-4-ил |
| 3,5-пиримидил | пиримидин-5-ил |
| 2,4-пиримидил | пиримидин-4-ил |
| 2,5-пиразил | пиразин-2-ил |
На каждой из схем I-VII значения символов соответствуют обозначениям, представленным в предыдущих разделах.
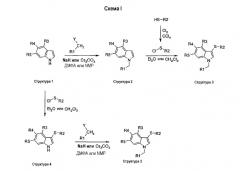
Замещенные индольные соединения структуры 3 получали в две стадии из соответственно замещенных индолов структуры 1 двумя разными путями. По первому пути соответственно замещенный индол структуры 1 является N-алкилированным галогенидом типа R1СН2Y, где Y является галогеном, мезилатом или тозилатом, с NaH или CsCO3 в качестве основания в ДМФА или NMP при 0°С при комнатной температуре с получением соединения структуры 2. Соединение структуры 2 затем сульфанилировали в положении С-3 индольного кольца реакцией с сульфенилхлоридом или в СН2Cl2 или диэтиловом эфире при комнатной температуре с получением соединения структуры 3. По второму пути две стадии первого пути идут в обратном порядке: соответственно замещенный индол структуры 1 сначала сульфанилируют в положении 3 индола с получением соединения структуры 4 с последующим N-алкилированием с помощью R1-СН2Y и получением соединения структуры 3 (схема I).
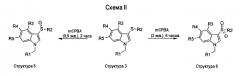
Сульфоксиды структуры 5 можно получить окислением соответствующего сульфида (структура 3) реакцией, например, с 0,9 эквивалента mCPBA. Сульфоны структуры 6 можно получить окислением соответствующего сульфида (структура 3) реакцией, например, с 3 эквивалентами mCPBA (схема II).
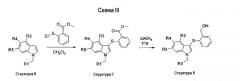
На схеме III описан синтез соединений структуры 3, у которых группа R2 является фенильным кольцом, замещенным в положении 2 или СО2Ме (структура 7), СН2ОН (структура 8), СО2Н (структура 9), CONHMe (структура 10), CONH2 (структура 11) или CN (структура 12).
На первой стадии замещенный индол структуры 6 сульфанилируют в положении 3 2-(карбоксиметил)фенилсульфенилхлоридом, который получали из метилтиосалицилата и газообразного хлора, с получением соединения структуры 7. Восстановление метильной сложноэфирной группы соединений структуры 7 с помощью LiAlH4 давало соответствующие гидроксиметильные соединения структуры 8. Омыление метильной сложноэфирной группы соединений структуры 7 с помощью гидроксида лития давало соответствующие соединения карбоновой кислоты структуры 9. Группа карбоновой кислоты структуры 9 может быть превращена в соответствующий карбоксамид по реакции с амином, TBTU и DIPEA в ДМФА при комнатной температуре. По этому способу соединение структуры 10 получали, когда в качестве амина использовали метиламин, и соединение структуры 11 получали, когда в качестве амина использовали NH3. Дегидратация бензамидной группы соединения структуры 11 с помощью Tf2О и триэтиламина в СН2Cl2 давала соответствующее бензонитрильное соединение структуры 12 (схема III).
На схеме IV описан синтез соединений структуры 3, в которых индольное кольцо замещено в положении 6 или СО2Ме (структура 13), СО2Н (структура 14), CONR8R9 (структура 15), CONH2 (структура 16) или CN (структура 17). Омыление метильной сложноэфирной группы структуры 13 гидроксидом лития давало соответствующую карбоновую кислоту структуры 14. Группу карбоновой кислоты структуры 14 можно превратить в соответствующие карбоксамиды структур 15 и 16 по реакции с амином или солью амина в присутствии EDCI и HOBt в смеси NMM и ДМФА или в присутствии TBTU и DIPEA в СН2Cl2 при комнатной температуре. Дегидратация бензамидной группы структуры 16 с помощью Tf2О и триэтиламина в СН2Cl2 давала соответствующее бензонитрильное соединение структуры 17 (схема IV).
На схеме V описан синтез соединений структуры 22, содержащих ацилированную аминную функциональную группу в положении 6 индольного кольца. Эти соединения могут быть синтезированы из 6-нитроиндолов структуры 18 в 4 стадии. На первой стадии индол структуры 18 алкилируют по атому азота реакцией галогенида типа R1СН2Y, в котором Y является галогеном, мезилатом или тозилатом, с NaH в качестве основания в ДМФА с получением соединений структуры 19. На второй стадии нитрогруппу соединения структуры 19 восстанавливают до аминогруппы с помощью SnCl2 с получением соединения структуры 20. Последующее ацилирование аминогруппы хлорангидридом кислоты типа ZCOCl давало соединение структуры 21, которое затем сульфанилировали в положении 3 индольного кольца реакцией сульфенилхлорида в СН2Cl2 или Et2О в качестве растворителя при комнатной температуре с получением соединений структуры 22. Прямое сульфанилирование соединения структуры 20 сульфенилхлоридом давало соединение структуры 23.
На схеме VI описано, как метиловые простые эфиры структуры 24 можно расщепить с помощью, например, BF3·DMS в ТГФ при комнатной температуре до гидрокси-соединений структуры 25.
На схеме VII описан синтез соединений, содержащих или ацилированную аминную функциональную группу (структура 28) или сульфонамидную функциональную группу (структура 29) в положении 6 индольного кольца. Эти соединения могут быть получены из 6-нитроиндолов структуры 18 в 6 стадий. На первой стадии индол структуры 18 алкилируют по N-1 реакцией галогенида типа R1СН2Y, в котором Y является галогеном, мезилатом или тозилатом, с NaH или Cs2СО3 в качестве основания в NMP или ДМФА с получением соединений структуры 19. На второй стадии нитрогруппу соединения структуры 19 восстанавливают до аминогруппы с помощью Fe и NH4Cl с получением соединения структуры 20. Последующее ацилирование аминогруппы ди-трет-бутилдикарбонатом давало соединение структуры 26, которое затем сульфанилировали в положении 3 индольного кольца реакцией с сульфенилхлоридом в СН2Cl2 или Et2О с получением соединений структуры 27. Затем амидную функциональную группу в положении 6 индола отщепляли с помощью трифторуксусной кислоты или НСООН с получением аминов структуры 23. Эти амины можно превратить в амиды структуры 28 реакцией или с триэтиламином и хлорангидридом кислоты в СН2Cl2 (способ а), или с кислотой, TBTU и DIPEA в СН2Cl2 (способ b). Сульфонамиды структуры 29 можно получить по реакции аминов структуры 23 с сульфонилхлоридами (способ с).
Данное изобретение относится также к фармацевтической композиции, содержащей нестероидное соединение по данному изобретению, смешанное с фармацевтически приемлемым вспомогательными веществами, такими как описано в стандартном справочнике Gennaro et al., Remmington: The Science and Practice of Pharmacy, (20th ed., Lippencott Williams & Wilkins, 2000, см., в частности, Part 5: Pharmaceutical Manufacturing). Подходящие вспомогательные вещества представлены, например, в Handbook of Pharmaceutical Excipients (2nd Edition, Editors A. Wade and P.J. Weller; American Pharmaceutical Association; Washington; The Pharmaceutical Press; London, 1994). Смесь соединения по данному изобретению и фармацевтически приемлемых вспомогательных веществ может быть спрессована в твердые дозированные единицы, такие как пилюли, таблетки, или может быть переработана в капсулы или суппозитории. С помощью фармацевтически подходящих жидкостей данные соединения могут также применяться в виде инъекционного препарата в форме раствора, суспензии, эмульсии или аэрозоля, например, назального аэрозоля. Для изготовления дозированных единиц, например, таблеток, предполагается использование общепринятых добавок, таких как наполнители, красители, полимерные связывающие вещества и тому подобное. В общем, можно использовать любую фармацевтически приемлемую добавку, которая не влияет на функцию активных соединений. Соединения данного изобретения можно также включить в имплантат, вагинальное кольцо, пластырь, гель и любой другой препарат для длительного высвобождения.
Подходящие носители, с которыми можно вводить данные композиции, включают лактозу, крахмал, производные целлюлозы и тому подобное, или их смеси, используемые в подходящих количествах.
Дозированные количества данных соединений будут обычного порядка для фармацевтически активных соединений, например, порядка от 0,001 до 50 мг/кг массы тела реципиента на введение. Реципиент может быть человеком или животным, нуждающимся в лечении, связанном с андрогеновыми рецепторами или в лечении андрогенами.
Данное изобретение иллюстрируется следующими примерами.
ПРИМЕРЫ
Пример 1
1-(3,5-Дифторбензил)-6-метокси-3-(2-нтрофенилсульфанил)-1Н-индол (соединение 63, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=Оме)
Общий способ 1: N-алкилирование (не)замещенного индола структуры 1 с получением N-алкилированного индола структуры 2, с последующим 3-сульфанилированием с получением замещенных индолов структуры 3 (схема I).
(а) 1-3,5-Дифторбензил)-6-метокси-1Н-индол (структура 2 со схемы I, где R1=3,5-дифторфенил, R3=R4=Н, R5=Оме)
В атмосфере азота к охлажденному (0°) раствору 6--метоксииндола (863 мг, 5,86 ммоль) в ДМФА (40 мл) добавляли NaH (60% в масле; 281 мг, 7,03 ммоль) небольшими порциями за 3-минутный период. Полученную зеленую суспензию перемешивали при 0°С в течение 10 минут. Затем добавляли 3,5-дифторбензилбромид (0,91 мл, 7,03 ммоль). Смесь перемешивали при 0°С в течение 1 часа и затем при комнатной температуре в течение еще 21 часа. Добавляли этилацетат (50 мл) и смесь промывали 3% водным раствором лимонной кислоты (3·50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением зеленого масла (1,43 г). Неочищенный продукт очищали на SPE картридже с 20 г диоксида кремния (этилацетат/гептан 1:9) с получением указанного в заголовке соединения в виде бесцветного масла (1,23 г, выход=77%).
ЖХМС: 4,01 мин (96,3%, МН+=274); ТСХ (этилацетат/гептан 1:4): Rf=0,46; 1Н ЯМР (CDCl3): 3,80 (с, 3Н, ОСН3), 5,24 (с, 2H, NCH2Ar), 6,51 (дд, 1H, J1=3,5 Гц, J2=0,8 Гц), 6,57-6,60 (м, 2H), 6,65 (д, 1H, J=3,1 Гц), 6,66-6,72 (м, 1H), 6,81 (дд, 1H, J1=8,6 Гц, J2=3,1 Гц), 7,01 (д, 1H, J=3,5 Гц), 7,53 (д, 1H, J=8,6 Гц).
(b) 1-(3,5-Дифторбензил)-6-метокси-3-(2-нитрофенилсульфанил)-1Н-индол (Соединение 63, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н; R5=Оме)
К раствору 1-(3,5-дифторбензил)-6-метокси-1Н-индола (900 мг, 3,29 ммоль) в диэтиловом эфире (20 мл) добавляли по каплям при комнатной температуре суспензию 2-нитробензолсульфенилхлорида (627 мг, 3,31 ммоль) в диэтиловом эфире (10 мл) за 2-минутный период. После перемешивания при комнатной температуре в течение 1 часа добавляли этилацетат (50 мл) и смесь промывали насыщенным раствором NaHCO3 (2·50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением оранжево-красного масла (1,54 г). Неочищенный продукт кристаллизовали из смеси толуол/ацетон с получением указанного в заголовке соединения в виде оранжево-красного кристаллического твердого вещества (900 мг, выход=64%).
ЖХМС: 4,25 мин (100%, МН+=427); ВЭЖХ: 4,86 мин (98,7%); 1Н ЯМР (CDCl3) δ: 3,82 (с, 3Н, ОСН3), 5,32 (с, 2Н, NCH2Ar), 6,63-6,69 (м, 2H), 6,72-6,79 (м, 1H), 6,75 (д, 1H, J=2,7 Гц), 6,85 (дд, 1H, J1=8,2 Гц, J2=2,7 Гц), 6,98 (дд, 1H, J1=6,7 Гц, J2=1,2 Гц), 7,16-7,20 (м, 1H), 7,26-7,30 (м, 1H), 7,34 (с, 1H), 7,39 (д, 1H, J=8,2 Гц), 8,27 (дд, 1H, J1=8,2 Гц, J2=1,6 Гц).
По общему способу 1 получали следующие соединения:
| Таблица 1Соединения, синтезированные по общему способу 1 | |||||||||
| №соед. | Х | R1 | R2 | R3 | R4 | R5 | Молекулярная масса | ЖХМС(МН+) | ЖХМСВремяудерживания(мин) |
| 21 | S | 3,5-дифторфенил | 2-метоксифенил | Н | Н | ОМе | 411,47 | 446с | 5,14b |
| 22 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | Br | 475,32 | 476 | 4,89 |
| 23 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | CF3 | 464,41 | 465 | 5,34b |
| 24 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | СН2ОН | 426,44 | Н.О. | 3,88b |
| 25 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | Cl | 430,86 | 431 | 4,89 |
| 50 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | F | 414,40 | 415 | 4,79 |
| 51 | S | 3,5-дифторфенил | 2-нитрофенил | F | Н | Н | 414,40 | 415 | 4,72 |
| 52 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | Н | 396,41 | 397 | 4,22 |
| 53 | S | 3,5-дифторфенил | 2-нитрофенил | Н | F | Н | 414,40 | 415 | 4,75 |
| 54 | S | 3,5-дифторфенил | 2-нитрофенил | Cl | Н | Н | 430,86 | 431 | 5,14b |
| 55 | S | 3,5-дифторфенил | 2-нитрофенил | Ме | Н | Н | 410,44 | 411 | 5,24b |
| 56 | S | 3,5-дифторфенил | 2-нитрофенил | Н | ОН | Н | 412,41 | 413 | 4,50b |
| 60 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | NO2 | 441,41 | 442 | 4,7 |
| 61 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | ОН | 412,41 | 413 | 4,54b |
| 63 | S | 3,5-дифторфенил | 2-нитрофенил | Н | Н | ОМе | 426,45 | 274d | 4,01 |
| 66 | S | 3,5-дифторфенил | 2-пиридил-N-оксид | Н | Н | ОМе | 398,43 | 399 | 3,96 |
| 90 | S | Фенил | 2-нитрофенил | Н | Н | Н | 360,43 | 361 | 4,19 |
| 91 | S | Фенил | 2-нитрофенил | Н | ОМе | Н | 390,46 | 391 | 4,14 |
| 92 | S | Фенил | 2-нитрофенил | Н | Н | ОМе | 390,46 | 391 | 4,12 |
| а) Использовали метод 7 мин ЖХМС, если не указано иначе. b) использовали метод 10 мин ЖХМС.с) М+Cl н.о.=не определяли. d) =[М-S(PhNO2)]Н+. |
Пример 2
Метиловый эфир 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 31, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н, R5=СО2Ме)
(а) Метиловый эфир 1Н-индол-6-карбоновой кислоты (структура 1 со схемы 1, где R3=R4=Н, R5=СО2Ме)
К раствору 1Н-индол-6-карбоновой кислоты (1500 г, 9,31 ммоль) в метаноле (50 мл) добавляли концентрированную Н2SO4 (550 мкл, 10,24 ммоль). Смесь перемешивали в течение ночи при температуре кипения с обратным холодильником. Смесь затем нейтрализовали до рН 7 добавлением насыщенного водного раствора NaHCO3 и смесь дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме с получением желтого порошка. Данный продукт перекристаллизовывали из смеси гептан/этилацетат с получением указанного в заголовке соединения в виде зелено/желтых кристаллов (688 мг, выход 53%).
1Н-ЯМР (CDCl3) δ: 3,94 (с, 3Н, СН3ОСО), 6,60 (м, 1Н), 7,37 (т, 1Н, J=4,7 Гц), 7,66 (д, 1Н, J=8,2 Гц), 7,82 (дд, 1Н, J1=8,2 Гц, J2=1,0 Гц), 8,18 (с, 1Н), 8,73 (с, 1Н, NH).
(b) Метиловый эфир 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (структура 2 со схемы I, где R1=3,5-дифторфенил, R3=R4=Н, R5=СО2Ме)
В атмосфере азота к раствору метилового эфира 1Н-индол-6-карбоновой кислоты (367 мг, 2,09 ммоль) в ДМФА (10 мл) добавляли NaH (60% в масле, 101 мг, 2,52 ммоль) при комнатной температуре. После перемешивания в течение 15 минут добавляли 1-бромметил-3,5-дифторбензол (325 мкл, 2,51 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь гасили 3% водным раствором лимонной кислоты (10 мл) и добавляли этилацетат (30 мл). Смесь промывали 3% водным раствором лимонной кислоты (3·20 мл) и насыщенным раствором соли (20 мл). Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением бледно-желтого масла (702 мг). Неочищенный продукт очищали на картридже SPE с 20 г диоксида кремния (этилацетат/гептан 1:9) с получением указанного в заголовке соединения в виде бесцветного масла, которое медленно кристаллизовалось при стоянии (530 мг, выход=84%).
ЖХМС: 4,08 мин (99%, МН+=302); 1Н ЯМР (CDCl3) δ: 3,92 (3, 3Н, СО2СН3), 5,37 (с, 2H, NCH2Ar), 6,54-6,60 (м, 2H), 6,64 (д, 1H, J=3,1 Гц), 6,67-6,74 (м, 1H), 7,27 (д, 1H, J=3,1 Гц), 7,68 (д, 1H, J=8,6 Гц), 7,83 (д, 1H, J=8,6 Гц), 8,01 (с, 1H).
(с) Метиловый эфир 1-(3,5-дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновой кислоты (соединение 31, структура 3 со схемы I, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=H, R5=CO2Me)
К раствору метилового эфира 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (330 мг, 1,10 ммоль) в дихлорметане (30 мл) при комнатной температуре добавляли раствор 2-нитробензолсульфенилхлорида (210 мг, 1,11 ммоль) в дихлорметане (10 мл). Смесь перемешивали при комнатной температуре 4 дня. Реакционную смесь концентрировали и неочищенный продукт очищали на картридже SPE c 20 г диоксида кремния (этилацетат/гептан 1:5-1:2) с получением указанного в заголовке соединения в виде твердого желтого цвета (392 мг, выход=78%).
ЖХМС: 4,60 мин (97,8%); 1Н ЯМР (CDCl3) δ: 3,93 (с, 3Н, СО2СН3), 5,45 (с, 2H, NCH2Ar), 6,63-6,69 (м, 2H), 6,74-6,80 (м, 1H), 6,88 (дд, 1H, J1=8,2 Гц, J2=1,2 Гц), 7,18-7,23 (м, 1H), 7,26-7,30 (м, 1H), 7,57 (д, 1H, J=7,8 Гц), 7,58 (с, 1H), 7,89 (дд, 1H, J1=7,8 Гц, J2=1,2 Гц), 8,12 (с, 1H), 8,28 (дд, 1H, J1=7,8 Гц, J2=1,2 Гц).
Пример 3
1-(3,5-Дифторбензил)-3-(2-нитрофенилсульфанил)-1Н-индол-6-карбоновая кислота (соединение 30, структура 14 со схемы IV, где R1=3,5-дифторфенил, R2=2-нитрофенил, R3=R4=Н)
К раствору метилового эфира 1-(3,5-дифторбензил)-1Н-индол-6-карбоновой кислоты (150,0 мг, 0,33 ммоль) в диоксане (20 мл) и воде (15 мл) добавляли LiOH·Н2О (83,1 мг, 0,33 ммоль) в 5 мл воды. Реакционную смесь перемешивали в течение ночи при 60°С. Затем смесь подкисляли до рН 4 добавлением 15% водного раствора HCl и смесь дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме с получением желтого порошка. Продукт перекристаллизовывали из смеси гептан/этилацетат с получением указанного в заголовке соединения в виде желто/оранжевых кристаллов (129,3 мг, выход=89%).
1Н-ЯМР (ДМСО) δ: 5,62 (с, 2H, CH2Ar), 6,85 (дд, 1H, J1=8,6 Гц, J2=шир), 7,05 (м, 2H, шир), 7,20 (м, 1H, шир), 7,32-7,38 (м, 1H), 7,40 (д, 1H, J=8,2 Гц), 7,44-7,50 (м, 1H), 7,68 (дд, 1H, J1=8,6 Гц, J2=шир),