Производные тетрагидрохинолина, фармацевтическая композиция на их основе, их применение в качестве регуляторов фертильности
Иллюстрации
Показать всеДанное изобретение относится к производным тетрагидрохинолина общей формулы (I)
или их фармацевтически приемлемым солям, где R1 и R2 представляют собой Н или Me; R3 представляет собой Н, гидрокси или (1-4С)алкокси; R4 представляет собой Н, ОН, (1-4С)алкокси; R5 представляет собой ОН, (1-4С)алкокси или R7; при условии, что если R4 представляет собой Н, то R5 отличен от ОН или (1-4С)алкокси; R6 представляет собой (2-5С)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из (1-4С)алкила, брома или хлора; (6С)арил, необязательно замещенный одним или несколькими заместителями, выбранными из (1-4С)алкила, (1-4С)алкокси, брома, хлора, фенила или (1-4С)(ди)алкиламино; (3-8С)циклоалкил, (2-6С)гетероциклоалкил или (1-6С)-алкил; R7 представляет собой амино, (ди)(1-4С)алкиламино, (6С)арилкарбониламино, (2-5С)гетероарилкарбониламино, (2-5С)гетероарил-карбонилокси, R8-(2-4С)алкокси, R9-метиламино или R9-метокси; R8 представляет собой амино, (1-4С)алкокси, (ди)(1-4С)-алкиламино, (2-6С)-гетероциклоалкил, (2-6С)гетероциклоалкилкарбониламино или (1-4С)-алкоксикарбониламино; и R9 представляет собой аминокарбонил, (ди)(1-4С)алкиламинокарбонил, (2-5С)гетероарил или (6С)арил. Также изобретение относится к фармацевтической композиции, содержащей указанные производные, и применению данных производных для регуляции фертильности. Технический результат: получены новые производные тетрагидрохинолина, обладающие модулирующей активностью в отношении FSH рецептора. 4 н. и 11 з.п. ф-лы.
Реферат
Данное изобретение относится к соединению, обладающему модуляторной активностью в отношении FSH рецептора, в частности, к производному тетрагидрохинолина, фармацевтической композиции, содержащей данное соединения, а также к применению указанного соединения в терапии.
Гонадотропины выполняют функции, важные для различных процессов в организме, включая метаболизм, регуляцию температуры и репродуктивный процесс. Гонадотропины воздействуют на специфические клетки гонадного типа, инициируя овариальную и тестикулярную дифференциацию и стероидогенез. Например, гипофизарный гонадотропный FSH (фолликулостимулирующий гормон) играет ключевую роль в стимулировании развития и созревания фолликул, в то время как LH (лютеинизирующий гормон) индуцирует овуляцию (Sharp, R.M. Clin Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35:301-342, 1979). В настоящее время FSH клинически применяется в сочетании с LH или hCG для овариального стимулирования, то есть овариального гиперстимулирования для in vitro оплодотворения (in vitro fertilization - IVF), и индукции овуляции у женщин, страдающих бесплодием вследствие отсутствия овуляции (Insler, V., Int. J. Fertility 33:85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Enbryo Transfer 5:3-13, 1988), а также для лечения мужского гипогонадизма и мужского бесплодия.
Гонадотропный FSH высвобождается из передней доли гипофиза под влиянием гонадотропин-высвобождающего гормона и эстрогенов и из плаценты во время беременности. В женском организме FSH воздействует на яичники, ускоряя развитие фолликул, и является основным гормоном, регулирующим секрецию эстрогенов. В мужском организме FSH является ответственным за целостность семенных канальцев и воздействует на клетки Сертоли для поддержки гаметогенеза. Очищенный FSH используется для лечения женского бесплодия и некоторых типов нарушений сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтических целей, могут быть выделены из мочи человека и имеют низкий уровень чистоты (Morse et al., Amer. J. Reproduct. Immunol. and Microbiology 17:143, 1988). Альтернативно, они могут быть получены в виде рекомбинантных гонадотропинов. Рекомбинантный FSH человека является коммерчески доступным и используется для вспомогательной репродукции. (Olijve et al. Mol. Hum. Reprod. 2:371, 1996; Devroey et al. Lancet 339:1170, 1992).
Действия FSH гормона опосредуются специфическим плазменным мембранным рецептором, который является представителем большого семейства рецепторов, связываемых G-белком. Эти рецепторы состоят из единственного полипептида с семью трансмембранными доменами и способны взаимодействовать с G-белком, что приводит, например, к активации аденилатциклазы.
FSH рецептор является высоко специфической мишенью в процессе роста овариального фолликула и экспрессирован только в яичнике. Блокирование данного рецептора или ингибирование передачи сигнала, который обычно индуцируется после активации FSH-опосредуемого рецептора, будет нарушать развитие фолликула и, как следствие, приводить к нарушению овуляции и фертильности. Поэтому FSH антагонисты с низкой молекулярной массой составили основу новых контрацептивных средств. Такие FSH антагонисты способны вызывать задержку развития фолликулы (отсутствие овуляции) с сохранением выработки эстрогена на уровне, достаточном для предотвращения неблагоприятных эффектов, например, на костную массу. С другой стороны, соединения, которые стимулируют активность FSH рецептора, могут имитировать гонадотропное действие на природный лиганд.
Данное изобретение описывает получение низкомолекулярных аналогов гормона, которые обладают селективной модуляторной активностью в отношении FSH рецептора. Соединения данного изобретения могут использоваться в качестве либо (частичных) агонистов, либо (частичных) антагонистов FSH рецептора.
Итак, в настоящее время установлено, что представленный далее класс производных тетрагидрохинолина формулы I или их фармацевтически приемлемые соли обладают модуляторной активностью в отношении FSH.
Формула I
где
R1 и R2 представляют собой Н или Ме;
R3 представляет собой Н, гидрокси, (1-4С)алкокси, (ди)(1-4С)алкиламино(2-4С)алкокси или (2-6)гетероциклоалкил(2-4С)алкокси;
R4 представляет собой Н, ОН, (1-4С)алкокси или R7;
R5 представляет собой Н, ОН, (1-4С)алкокси или R7;
при условии, что если R4 представляет собой Н, то R5 отличен от Н, ОН или (1-4С)алкокси, и если R5 представляет собой Н, то R4 отличен от Н, ОН или (1-4С)алкокси;
R6 представляет собой (2-5С)гетероарил, (6С)арил, (3-8С)циклоалкил, (2-6С)гетероциклоалкил или (1-6С)алкил;
R7 представляет собой амино, (ди)(1-4С)алкиламино, (6С)арилкарбониламино, (6С)арилкарбонилокси, (2-5С)гетероарилкарбониламино, (2-5С)гетероарилкарбонилокси, R8-(2-4С)алкиламино, R8-(2-4С)алкокси, R9-метиламино или R9-метокси;
R8 представляет собой гидрокси, амино, (1-4С)алкокси, (ди)(1-4С)алкиламино, (2-6С)гетероциклоалкил, (2-6С)гетероциклоалкилкарбониламино, (ди)(1-4С)алкиламинокарбониламино или (1-4С)алкоксикарбониламино; и
R9 представляет собой аминокарбонил, (ди)(1-4С)алкиламинокарбонил, (2-5С)гетероарил или (6С)арил.
R4 и R5 могут быть независимо выбраны из каждой из групп, описанных выше, и не должны быть одинаковыми.
Соединения согласно данному изобретению модулируют функцию FSH рецептора и могут использоваться для таких же клинических задач, что и природный FSH, если они ведут себя подобно агонистам, с тем преимуществом, что они проявляют свойства измененной стабильности и могут вводиться иначе. Если они блокируют FSH рецептор, то могут использоваться, например, в качестве контрацептивного средства.
Следовательно, модуляторы FSH рецептора данного изобретения могут использоваться для лечения бесплодия, для контрацепции и для лечения гормон-зависимых расстройств, таких как рак молочной железы, рак предстательной железы и эндометриоз.
Представленные далее термины, которые используются в описании и формуле данного изобретения, как подразумевается, имеют следующие значения.
Термин «(1-4С)алкил», используемый в данном описании, означает разветвленную или неразветвленную алкильную группу, содержащую 1-4 атома углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
Термин «(1-6С)алкил», используемый в данном описании, означает разветвленную или неразветвленную алкильную группу, содержащую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил и гексил. (1-5С)Алкильные группы являются предпочтительными, причем наиболее предпочтителен (1-4С)алкил.
Термин «(3-8С)циклоалкил» означает циклоалкильную группу, содержащую 3-8 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Предпочтительными являются (3-6С)циклоалкильные группы.
Термин «(2-6С)гетероциклоалкил» означает гетероциклоалкильную группу, содержащую 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и включающую, по меньшей мере, один гетероатом, выбранный из атомов N, O и/или S, которая может присоединяться через гетероатом, если это выполнимо, или через атом углерода. Предпочтительными гетероатомами являются N или О. Наиболее предпочтительными являются пиперидил, пиперазинил, морфолинил и пирролидинил.
Термин «(1-4С)алкокси» означает алкоксигруппу, содержащую 1-4 атома углерода, причем алкильный фрагмент принимает значение, определенное выше. (1-2С)Алкоксигруппы являются предпочтительными.
Термин «(2-4С)алкокси» означает алкоксигруппу, содержащую 2-4 атома углерода, причем алкильный фрагмент принимает значение, определенное выше.
Термин «(ди)(1-4С)алкиламино» в данном описании означает аминогруппу, монозамещенную или дизамещенную алкильными группами, каждая из которых содержит 1-4 атома углерода и принимает значение, определенные выше.
Термин «(6С)арил» в данном описании означает фенильную группу, которая может быть необязательно замещенной одним или несколькими заместителями, выбранными из гидрокси, амино, йода, брома, хлора, фтора, нитро, трифторметила, циано, фенила, (1-4С)алкила, (1-4С)алкокси, (1-4С)(ди)алкиламино, алкила, алкокси и (ди)алкиламиногрупп, значения которых определены выше, например фенила, 3,5-дибромфенила, 4-бифенила, 3,5-дихлорфенила, 3-бром-6-метиламинофенила, 3-хлор-2,6-диметоксифенила и 3,5-диметилфенила.
Термин «(2-5С)гетероарил» означает замещенную или незамещенную ароматическую группу, содержащую 2-5 атомов углерода и, по меньшей мере, один гетероатом, выбранный из N, O и/или S, например, имидазолил, пиридил, пиримидил, тиенил или фурил. Заместители на гетероарильной группе могут выбираться из группы заместителей, указанных для (6С)арильной группы. Гетероарильная группа может присоединяться через атом углерода или гетероатом, если это возможно. Предпочтительными гетероарильными группами являются тиенил, фурил и пиридил.
Термин «ди(1-4С)алкиламино(2-4С)алкокси» в данном описании означает (ди)алкиламиногруппу, в которой алкильный фрагмент или алкильные фрагменты, каждый из которых содержит 1-4 атома углерода, присоединен(ы) через аминогруппу к алкильному фрагменту алкоксигруппы, содержащей 2-4 атома углерода, где (ди)алкиламиногруппа и алкоксигруппа принимают значения, определенные выше.
Термин «(2-6С)гетероциклоалкил(2-4С)алкокси» в данном описании означает гетероциклоалкильную группу, содержащую 2-6 атомов углерода и присоединенную к алкильному фрагменту алкоксигруппы, содержащей 2-4 атома углерода, где алкоксигруппа и гетероциклоалкильная группа принимают значения, определенные выше.
Термин «(6С)арилкарбониламино» в данном описании означает фенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы заместителей, указанных для (6С)арильной группы, которая присоединена к карбонильному фрагменту карбониламиногруппы, где (6С)арильный фрагмент принимает значения, определенные выше.
Термин «(6С)арилкарбонилокси» в данном описании означает фенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы заместителей, указанных для (6С)арильной группы, которая присоединена к карбонильному фрагменту карбонилоксигруппы, где (6С)арильный фрагмент принимает значения, определенные выше.
Термин «(2-5С)гетероарилкарбониламино» в данном описании означает гетероарильную группу, содержащую 2-5 атомов углерода, необязательно замещенную одним или несколькими заместителями, выбранными из группы заместителей, указанных для (6С)арильной группы, и присоединенную к карбонильному фрагменту карбониламиногруппы. Гетероарильный фрагмент в гетероарилкарбониламиногруппе принимает значения, определенные выше.
Термин «(2-5С)гетероарилкарбонилокси» в данном описании означает гетероарильную группу, содержащую 2-5 атомов углерода, необязательно замещенную одним или несколькими заместителями, выбранными из группы заместителей, указанных для (6С)арильной группы, и присоединенную к карбонильному фрагменту карбонилоксигруппы. Гетероарильный фрагмент в гетероарилкарбонилоксигруппе принимает значения, определенные выше.
Термин «(2-6С)гетероциклоалкилкарбониламино» в данном описании означает гетероциклоалкильную группу, содержащую 2-6 атомов углерода и присоединенную к карбонильному фрагменту карбониламиногруппы, где гетероциклоалкильная группа принимает значения, определенные выше.
Термин «(ди)(1-4С)алкиламинокарбонил» в данном описании означает (ди)алкиламиногруппу, в которой алкильная(ые) группа(ы) содержит(ат) 1-4 атома углерода и которая присоединена к карбонильной группе через аминогруппу, где (ди)алкиламиногруппа принимает значения, определенные выше.
Термин «(ди)(1-4С)алкиламинокарбониламино» в данном описании означает (ди)алкиламиногруппу, в которой алкильная(ые) группа(ы) содержит(ат) 1-4 атома углерода и которая присоединена через аминогруппу к карбонильному фрагменту карбониламиногруппы, обеспечивая, таким образом, функциональность мочевины, где (ди)алкиламиногруппа принимает значения, определенные выше.
Термин «(1-4С)алкоксикарбониламино» в данном описании означает алкоксигруппу, содержащую 1-4 атома углерода, присоединенную к карбонильному фрагменту карбониламиногруппы, обеспечивая, таким образом, карбаматную функциональность, где алкоксигруппа принимает значения, определенные выше.
Термин «R8-(2-4C)алкиламино» в данном описании означает группу R8, присоединенную к алкильному фрагменту (2-4С)алкиламиногруппы, значения которой определенные выше.
Термин «R8-(2-4С)алкокси» в данном описании означает группу R8, присоединенную к алкильному фрагменту (2-4С)алкоксигруппы, значения которой определены выше.
Термин «R9-метиламино» в данном описании означает группу R9, присоединенную к метильному фрагменту метиламиногруппы.
Термин «R9-метокси» в данном описании означает группу R9, присоединенную к метильному фрагменту метоксигруппы.
Термин «фармацевтически приемлемая соль» относится к таким солям, которые в области медицинского применения подходят для использования в контакте с тканями людей и низших животных без избыточной токсичности, раздражения, аллергической реакции и т.п. и характеризуются разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Они могут быть получены в процессе конечного выделения и очистки соединений данного изобретения или отдельно взаимодействием функциональной группы свободного основания, если она присутствует, с подходящей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и т.п. Функциональная группа кислоты, если таковая присутствует, может подвергаться взаимодействию с органическим или минеральным основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития.
Таким образом, изобретение относится к соединениям формулы I, которые определены выше.
В другом примере осуществления данного изобретения оно относится к соединениям формулы I, где R3 представляет собой Н, гидрокси или (1-4С)алкокси.
Изобретение также относится к соединениям формулы I, где R4 представляет собой Н, ОН или (1-4С)алкокси.
В еще одном варианте осуществления данного изобретения оно предоставляет соединения формулы I, где R5 представляет собой ОН, (1-4С)алкокси или R7.
В еще одном варианте осуществления данного изобретения оно предоставляет соединения формулы I, где R6 представляет собой (2-5С)гетероарил, (6С)арил, (3-8С)циклоалкил или (1-6С)алкил.
В еще одном аспекте данное изобретение относится к соединениям формулы I, где R6 представляет собой (2-5С)гетероарил или (6С)арил.
В еще одном аспекте гетероарильная группа в R6 состоит из 4 или 5 атомов углерода.
Изобретение также относится к соединениям формулы I, где R7 представляет собой (ди)(1-4С)алкиламино, (2-5С)гетероарилкарбониламино, (2-5С)гетероарилкарбонилокси, R8-(2-4C)алкокси, R9-метиламино или R9-метокси.
Еще одним аспектом данного изобретения являются соединения согласно формуле I, где R7 представляет собой (ди)(1-4С)алкиламино, (2-5С)гетерарилкарбонилокси, R8-(2-4C)алкокси, R9-метиламино или R9-метокси.
В еще одном аспекте данное изобретение относится к соединениям формулы I, где R7 представляет собой (ди)(1-4С)алкиламино, R8-(2-4С)алкокси, R9-метиламино или R9-метокси.
В еще одном аспекте данное изобретение относится к соединениям формулы I, где R8-(2-4С)алкокси в группе R7 представляет собой R8-этокси.
В еще одном аспекте данное изобретение относится к соединениям формулы I, где R8-(2-4С)алкиламино в группе R7 представляет собой R8-этиламино.
В еще одном аспекте данное изобретение предоставляет соединения формулы I, где R8 представляет собой амино, (ди)(1-4С)алкиламино, (2-6С)гетероциклоалкил, (2-6С)гетероциклоалкилкарбониламино или (1-4С)алкоксикарбониламино.
В еще одном примере осуществления данного изобретения оно предоставляет соединения формулы I, где R8 представляет собой амино, (ди)(1-4С)алкиламино, (2-6С)гетероциклоалкил или (1-4С)алкоксикарбониламино.
В еще одном примере осуществления данного изобретения оно предоставляет соединения формулы I, где R8 представляет собой амино, (ди)(1-4С)алкиламино, (2-6С)гетероциклоалкил или (2-6С)гетероциклоалкилкарбониламино.
Изобретение относится также к соединениям согласно формуле I, где R8 представляет собой амино, (ди)(1-4С)алкиламино или (2-6С)гетероциклоалкил.
В еще одном аспекте данного изобретения R8 в соединениях формулы I представляет собой (ди)(1-4С)алкиламино или (2-6С)гетероциклоалкил.
В еще одном аспекте данное изобретение относится к соединениям согласно формуле I, где гетероциклоалкильная группа в R8 состоит из 4 или 5 атомов С.
Согласно еще одному примеру осуществления данного изобретения R9 в соединениях согласно формуле I представляет собой аминокарбонил, (2-5С)гетероарил или (6С)арил.
Согласно еще одному примеру осуществления данного изобретения гетероарильная группа в R9 соединений согласно формуле I состоит из 3, 4 или 5 атомов С.
Еще один аспект данного изобретения относится к соединениям, в которых все конкретные значения групп R1-R9, определенные в описании выше, объединены в соединении формулы I.
Далее представлены приемлемые способы получения соединений данного изобретения.
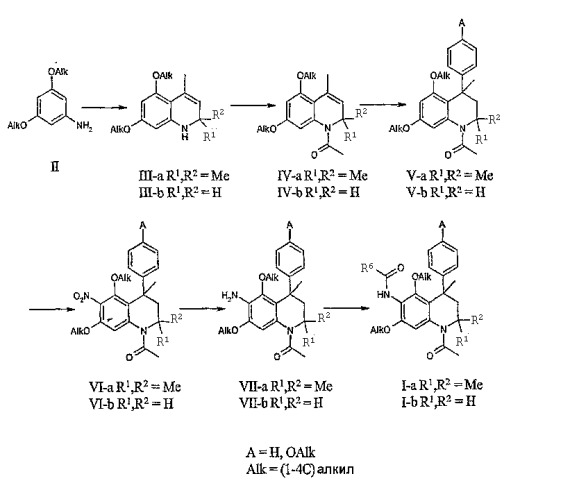
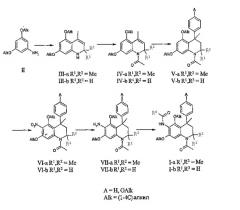
Соединения данного изобретения, в которых R4 и R5 представляют собой (1-4С)алкокси, R1 и R2 представляют собой метил и R6 принимает значения, определенные выше, могут быть получены исходя из подходящих замещенных анилинов общей формулы II в соответствии с реакцией Скраупа (Skraup), подробно описанной в литературе, с получением производных 2,2,4-триметил-1,2-дигидрохинолина формулы IIIa.
Аналогичные реакции циклоконденсации Скраупа описаны в литературе: A. Knoevenagel, Chem. Ber. 54:1726, 1921; R.L. Atkins and D.E. Bliss, J. Org. Chem. 43:1975, 1978; J.V. Johnson, B.S. Rauckman, D.P. Baccanari, B. Roth, J.Med. Chem. 32:1942, 1989; W.C. Lin, S.-T. Huang, S.-T. Lin, J. Chin. Chem. Soc. 43:497, 1996; J.P. Edwards, S.J. West, K.B. Marschke, D.E. Mais, M.M. Gottardis and T.K. Jones, J. Med. Chem. 41:303, 1998.
Описанная выше реакция обычно проводится при повышенной температуре в ацетоне или мезитилоксиде в присутствии йода или протонной кислоты, такой как хлористоводородная кислота, п-толуолсульфокислота или водный йодистый водород. Альтернативно 1,2-дигидро-2,2,4-триметилхинолины формулы III-a могут быть получены взаимодействием соответствующего анилина формулы II с ацетоном в присутствии MgSO4, 4-трет-бутилкатехола и йода (L.G. Hamann, R.I. Higuchi, L. Zhi, J.P. Edwards and X.-N. Wang, J. Med. Chem., 41:623, 1998). В соответствии с другой методикой реакция может проводиться в ацетоне с использованием трифлатов лантанидов (например, трифлата скандия) в качестве катализаторов. В этом случае реакция может проводиться при комнатной температуре или при повышенных температурах с использованием обычного нагрева или микроволнового облучения (M.E. Theoclitou, L.A. Robinson, Tetrahedron Lett. 43:3907, 2002).
Исходные вещества могут быть легко получены непосредственно из коммерческих источников или легко синтезированы квалифицированными специалистами в данной области техники.
Соединения формулы III-b могут быть получены из анилинов общей формулы II взаимодействием с метилвинилкетоном. Аналогичные реакции циклизации описаны в патенте США № 2686182 (Badische Anilin- & Soda-Fabric Aktiengesellschaft).
Последующее 1-N-ацетилирование соединений формулы III-a-b, где R1 и R2 принимают значения, описанные выше, может проводиться с использованием стандартных условий. В обычном эксперименте соединения формулы III кипятят с обратным холодильником в уксусном ангидриде или подвергают взаимодействию в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или пиридин, с хлорангидридом уксусной кислоты в присутствии основания, такого как N,N-диизопропилэтиламин, триэтиламин или гидрид натрия, с получением N-ацетилированных 4-метил-1,2-дигидрохинолин-производных формулы IV-a-b.
Аналогичные реакции N-ацилирования дигидрохинолиновой основы описаны в литературе: G. Reddelien, A. Thurm, Chem. Ber. 65:1511, 1932; Zh. V. Shmyreva, Kh. S. Shikhaliev, E.B. Shpanig, Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Teknol. 31:45, 1988; Zh. V. Shmyreva, Kh. S. Shikhaliev, L.P. Zalukaev, Y.A. Ivanov, Y.S. Ryabokobylko, I.E. Pokrovskaya, Zh. Obshch. Khim. 59:1391, 1989.
Введение необходимой (замещенной) фенильной группы в положение 4 дигидрохинолиновой основы может проводиться посредством алкилирования бензола или подходящего замещенного бензола соединениями общей структуры IV-a-b в соответствии с реакцией Фриделя-Крафтса. Данная реакция обычно проводится при повышенных температурах в чистом бензоле или в подходящем замещенном бензоле, либо в подходящем инертном растворителе, таком как гептан или гексан, с бензолом, или подходящим замещенным бензолом в качестве реагента, в присутствии катализатора - кислоты Льюиса (например, AlCl3, AlBr3, FeCl3 или SnCl4). Реакции алкилирования Фриделя-Крафтса с 2,2,4-триметил-1,2-дигидрохинолинами описаны в литературе: B.A. Lugovik, L.G. Yudin, A.N. Kost, Dokl. Akad. Nauk SSSR, 170:340, 1966; B.A. Lugovik, L.G. Yudin, S.M. Vinogradova, A.N. Kost, Khim. Geterosikl. Soedin., 7:795, 1971.
Алтернативно анилины общей структуры II могут подвергаться взаимодействию с подходящим замещенным производным 1-метилстирола и формальдегидом в ацетонитриле при температуре окружающей среды или при повышенной температуре для получения соединений общей формулы V-b. Аналогичные реакции циклизации описаны в литературе: J.M. Mellor, G.D. Merriman, Tetrahedron, 51:6115, 1995.
Соединения общей структуры V-a-b после этого могут подвергаться региоселективному нитрованию в положение 6 тетрагидрохинолиновой основы для получения соединений общей структуры VI-a-b. Данная реакция обычно проводится при температурах в интервале от -10°С до комнатной температуры в дихлорметане с использованием смеси азотной кислоты и уксусного ангидрида в качестве нитрующего агента. Альтернативно азотная кислота может добавляться в раствор соединений общей структуры V-a-b в ледяной уксусной кислоте или в смеси уксусной кислоты и дихлорметана. Аналогичные реакции региоселективного нитрования тетрагидрохинолинов описаны в литературе: B. Golankiewicz, Pol. J. Chem., 54:355, 1980; Zh. V. Shmyreva, Kh. S. Shikhaliev, L.P. Zalukaev, Y.A. Ivanov, Y.S. Ryabokobylko, I.E. Pokrovskaya, Zh. Obshch. Khim. 59:1391, 1989.
Восстановление нитрогруппы соединений общей структуры VI-a-b может проводиться с использованием различных способов, хорошо известных в данной области техники для восстановления ароматических нитросоединений, таких как каталитическое гидрирование с использованием в качестве катализаторов переходных металлов, обработка сульфидами, обработка железом или другими металлами и (слабой) кислотой, обработка дихлоридом в кислотных условиях и т.п. В частности, восстановление нитрогруппы соединений общей формулы VI-a-b может осуществляться обработкой порошкообразным цинком и уксусной кислотой в ТГФ или 1,4-диоксане при температуре в интервале от 0 до 100°С.
Последующее 6-N-ацилирование соединений формулы VII-a-b может проводиться в стандартных условиях, хорошо известных квалифицированным специалистам в данной области техники, для получения соединений общей структуры I-a-b. Например, соединения формулы VII подвергаются взаимодействию в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или пиридин, с ацилгалогенидом (R6-C(O)-Cl) или ангидридом кислоты (R6-C(O)-O-C(O)-R6) в присутствии основания
такого как N,N-диизопропиленэтиламин, триэтиламин, пиридин или гидрид натрия, для получения 6-N-ацилированных производных 1,2,3,4-тетрагидрохинолина формулы I-a-b. Альтернативно ацилирование соединений общей формулы VII-a-b для получения соединений общей формулы I-a-b может проводиться взаимодействием с подходящей карбоновой кислотой (R6-CO2H) в присутствии связывающего реагента, такого как тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или гексафторфосфат бромтрипирролидинфосфония (PyBrOP) и третичное основание, например, N,N-диизопропилэтиламин, в растворителе, таком как N,N-диметилформамид или дихлорметан, при температуре окружающей среды или при повышенной температуре.
Соединения данного изобретения, в которых R3 = H, OH или (1-4С)алкокси, R4 = ОН, R5 = OH или (1-4С)алкокси и R1, R2 и R6 принимают значения, определенные выше, могут быть получены реакциями деметилирования соединений общей формулы I-c-d. Реакции деметилирования простых ароматических метиловых эфиров хорошо известны специалистам в данной области техники. Обычно деметилирование осуществляется при взаимодействии соединения формулы I-c-d c BBr3 в инертном растворителе, таком как дихлорметан, при температуре в интервале от пониженной до температуры окружающей среды для получения деметилированных соединений общей формулы I-e-i. Альтернативно деметилирование может осуществляться при взаимодействии соединений формулы I-c-d с BF3·Me2S комплексом при температуре окружающей среды. Степень деметилирования может отчасти контролироваться осторожным регулированием температуры реакции и количеством деметилирующего реагента. Обычно получают смеси моно-, ди- и, если это возможно, тригидрокси-производных общей формулы I-e-i, которые могут разделяться хроматографически. Реакция деметилирования обычно протекает со средней степенью селективности с предпочтительным деметилированием в положение 5 тетрагидрохинолиновой основы. Скорость реакции деметилирования (деалкилирования) соединений общей формулы I-c-d соответствует соотношению 5-OMe>4-(п-ОАлк-фенил)>7-OMe.
Соединения данного изобретения, в которых R3 представляет собой Н или (функционализированную) алкоксигруппу и R4 и/или R5 представляют собой (функционализированные) алкоксигруппы или ацилоксигруппы, могут быть получены реакциями реалкилирования или ацилирования гидроксильных групп соединений общей формулы I-e-i (функционализированными) алкилгалогенидами (например, хлорэтилпирролидином) или ацилгалогенидами (например 2-фуроилхлоридом или метилхлорформиатом), соответственно, в стандартных условиях.
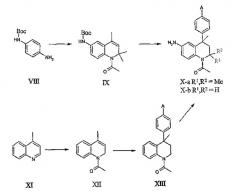
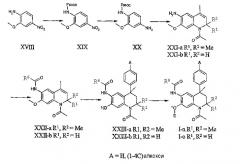
Соединения данного изобретения, в которых R4 = H и R5 присоединены к тетрагидрохинолиновой основе через атом азота и R1, R2 и R6 принимают значения, определенные выше, могут быть получены из N-Boc-1,4-фенилендиамина (VIII). Последовательность реакций (а) Скраупа, (b) ацилирования и (с) алкилирования бензола или замещенного бензола в соответствии с реакцией Фриделя-Крафтса, как описано выше, приводит к получению соединений общей формулы Х-а. Следует отметить, что защитная Вос-группа отщепляется в условиях реакции Фриделя-Крафтса.
Альтернативно N-Boc-1,4-фенилендиамин может подвергаться обработке метилвинилкетоном с последующим ацилированием и реакцией Фриделя-Крафтса, как описано выше, для получения соединений общей формулы X-b.
В еще одной методике соединения общей формулы X-b могут быть получены исходя из частичного восстановления 4-метилхинолина (XI) с BH3·THF комплексом и бис(2-метоксиэтокси)алюмодигидридом натрия для получения 4-метил-1,2-дигидрохинолина и последующим ацетилированием, как описано выше, для получения соединения XII. Реакции восстановления аналогичных хинолинов с получением 1,2-дигидрохинолинов описаны в литературе: см., например, D. Roberts, J.A. Joule, J. Org. Chem. 62:568, 1997; R.F. Heier, L.A. Dolak, J.N. Duncan, D.K. Hyslop, M.F. Lipton, I.J. Martin, M.A. Mauragis, M.F. Piercey, N.F. Nichols, P.J.K.D. Schreur, M.W. Smith, M.W. Moon, J. Med. Chem. 40: 639, 1997. Реакция Фриделя-Крафтса соединения XII с бензолом или подходящим замещенным бензолом приводит к получению соединений общей формулы XIII, которые могут подвергаться превращению в соединения общей формулы X-b региоселективным нитрованием в положение 6 и восстановлением до соответствующего 6-амино-производного с использованием описанных выше условий. Реакции региоселективного нитрования аналогичных структур были описаны в литературе, например, в публикации Zh. V. Shmyreva et al., J. Gen. Chem. USSR (англ. перевод) 59:1234, 1989.
Соединения общей формулы X-a-b после этого могут подвергаться реакции введения защитной 9-флуоренилметилоксикарбонильной группы (Fmoc-группа), см., например: T.W. Greene and P.M.Wuts, Protective groups in organic synthesis (3rd ed., John Wiley & Sons, Inc., 1999, см., в частности, стр. 506). Указанная выше защита обычно вводится с использованием FmocCl в ТГФ с пиридином в качестве основания.
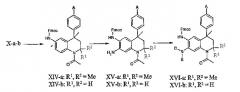
Региоселективное нитрование в положение 7 тетрагидрохинолиновой основы соединений общей формулы XIV-a-b с последующим восстановлением нитрогруппы (см. выше) приводит к получению производных 7-амино-1,2,3,4-тетрагидрохинолина общей формулы XV-a-b. Реакции региоселективного нитрования аналогичных основ с аналогичным замещением описаны в литературе; см., например: S.H. Reich. M.A. Fuhly, D. Nguyen, M.J. Pino et al., J. Med. Chem. 35:847, 1992; A. Ivobe, M. Uchida, K. Kamata, Y. Hotei, H. Kusama, H. Harada, Chem. Pharm. Bull. 49:822, 2001. Условия нитрования аналогичны условиям, описанным выше.
Восстановительное алкилирование аминогруппы в положении 7 тетрагидрохинолин-производных общей формулы XV-a-b с использованием соответствующих замещенных альдегидов и подходящего восстановителя (например, цианоборгидрида натрия или триацетоксиборгидрида натрия) в подходящем растворителе, таком как метанол или N,N-диметилформамид, приводит к получению соединений общей формулы XVIa-b. Обычно формальдегид приводит к преобладающему получению 7-диметиламинотетрагидрохинолиновых производных (D = E = Me), в то время как применение других альдегидов приводит к преимущественному получению моноалкилированных соединений общей формулы XVIa-b (D = H, E = (функционализированный)алкил). Реакции восстановительного алкилирования ароматических аминов хорошо знакомы специалистам в данной области.
Стандартное отщепление защитной Fmoc группы с использованием пиперидина в дихлорметане приводит к получению 6-аминотетрагидрохинолин-производных общей формулы XVII-a-b, которые могут подвергаться селективному алкилированию в положение 6, как описано выше для соединений данного изобретения общей формулы I-j-k.
В соответствии с другой методикой аминогруппа в положении 7 тетрагидрохинолин-производных общей формулы XV-a-b может подвергаться ацилированию (гетеро)арилкарбоновыми кислотами (G-CO2H) или ацилхлоридами (G-C(O)-Cl), как описано выше. На последующих стадиях стратегия удаления защиты-ацилирования (удаление защитной 6-N-Fmoc группы и ацилирование полученной 6-NH2 группы), описанная выше, приводит к получению соединений данного изобретения общей формулы I-l-m.
Соединения данного изобретения, в которых R4 = H, R5 присоединен к тетрагидрохинолиновой основе через атом кислорода и R1, R2 и R6 принимают значения, определенные выше, могут быть получены, исходя из 2-метокси-4-нитроанилина (XVII). Последовательность реакций (a) введения защитной Fmoc-группы для получения XIX, (b) восстановления нитрогруппы с получением ХХ, (с) региоселективная реакция Скраупа, (d) ацетилирование и (е) удаление защитной Fmoc-группы, как описано выше, приводит к получению соединений общей формулы XXI-a.
Соединения общей формулы XXI-b могут быть получены обработкой соединения ХХ метилвинилкетоном в условиях, описанных выше, для превращения соединений формулы II в соединения III-b с последующим 1-N-ацетилированием и удалением защитной Fmoc-группы, как описано выше.
Последующее превращение соединений общей формулы XXI в соединения XXIII может осуществляться ацилированием 6-аминогруппы с использованием подходящего ацилирующего агента, например, ацилхлорида R6-C(O)-Cl, и последующей реакцией Фриделя-Крафтса с бензолом или подходящим производным бензола в условиях, описанных выше. При проведении реакции Фриделя-Крафтса в присутствии кислоты Льюиса имеет место сопутствующее деметилирование 7-Оме функциональной группы в соединениях общей формулы XII. Полученная таким образом свободная 7-ОН группа в соединениях общей формулы XXIII может подвергаться повторному алкилированию или ацилированию (функционализированными) алкилгалогенидами (например, хлорэтилпирролидином) или ацилгалогенидами (например, 2-фуроилхлоридом или метилхлорформиатом), соответственно, в стандартных условиях для получения соединений общей формулы I-n-o (E = функционализированный алкил, ацил или карбамат).
Соединения данного изобретения, в которых R4 и R5 присоединены к тетрагидрохинолиновой основе через атом азота, могут быть получены из соединений общей формулы XXIV, где PG представляет собой защитную группу атома азота, например, Вос, ацетил, метилкарбамат или Fmoc, посредством описанных выше реакций, например, реакции Скраупа или циклоконденсации с метилвинилкетоном, 1-N-ацетилирования, расщепления защитной группы, N-алкилирования, реакции Фриделя-Крафтса, нитрования, восстановления нитрогруппы и ацилирования (см. выше).
Взаимодействие соединений общей формулы XXV с ацетоном или мезитилоксидом в соответствии с реакцией Скраупа может приводить к двум различным региоизомерным продуктам общей формулы XXVI-a и XXVII-a соответственно. Превращение соединений общей формулы XXV с использованием метилвинилкетона в описанных выше условиях может приводить к региоизомерным продуктам общей формулы XXVI-b или XXVII-b соответственно. Обычно такие региоизомерные дигидрохинолины могут разделяться хроматографическими методами (силикагель, ВЭЖХ) или кристаллизацией и могут впоследствии подвергаться превращению в соединения данного изобретения описанными выше способами.
Соединения данного изобретения, в которых R5 = Н, могут быть получены восстановительным 7-деоксигенерированием соединений общей формулы XXVIII или XXXI (L и/или М представляет собой подходящий (замещенный) алкил, ацил, алкилоксикарбонил или алкиламинокарбнил) через селективное 7-О-трифлатирование и последующее восстановление группы 7-OTf (Tf = трифторметилсульфонил). Целевые соединения общей формулы XXXI доступны из производных общей формулы XXVII с использованием описанных выше условий. Реакция (региоселективного) трифлатирования может осуществляться в контролируемых условиях с использованием Tf2N-фенила и N,N-диизопропилэтиламина в ДМФА при комнатной температуре. Обычно имеет место предпочтительное трифлатирование 7-ОН группы. Последующее восстановление может осуществляться с использованием смеси трифетилфосфина, триэтиламина, муравьиной кислоты и ацетата палладия (II), как описано в литературе (см., например, K.A. Parker, O. Ding, Tetrahedron 56:10249, 2000). Последующее превращение полученных таким образом соединений общей формулы XXX или XXXII с использованием описанных выше условий приводит к получению соединений общей формулы I-p-q, в которых R5 = H.
Некоторые соединения данного изобретения, которые могут находиться в форме свободного основания, могут выделяться из реакционной смеси в форме фармацевтически приемлемой соли. Фармацевтически приемлемые соли также могут быть получены обработкой свободного основания формулы I органической или неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота и аскорбиновая кислота.
Соединения данного изобретения обладают, по меньшей мере, одним хиральным атомом углерода и, следовательно, могут быть получены в виде чистых энантиомеров, в виде смеси энантиомеров или в виде смеси диастереомеров. Способы получения чистых энантиомеров хорошо известны в данной обла