Противоопухолевые аналоги ламелларина
Иллюстрации
Показать всеИзобретение относится к новым соединениям общей формулы III:
где, когда Х выбран из группы, включающей NH и S,
R1, R2, R3, R4, R5, R6, R7, R8 и R9, каждый независимо, выбран из группы, включающей Н, ОН, OR', незамещенный или замещенный арил, где заместители независимо представляют собой Н, ОН, C1-C12 алкокси;
где, когда Х означает О,
R1, R2, R3, R4, R5, R6, R7 и R8, каждый независимо, выбран из группы, включающей Н, ОН, OR', SH, SR', SOR', SO2R', OSO2R', NHR', N(R')2, CO2R, OC(=O)R';
и R9 независимо выбран из группы, включающей Н, OR', незамещенный или замещенный аминогруппой или галогеном С2-С12 алкенил, незамещенный С2-С12 алкинил, незамещенный тиенил и галоген;
где каждая из R' групп независимо выбрана из группы, включающей Н, замещенный или незамещенный C1-C18 алкил, замещенный или незамещенный арил;
где заместители независимо выбраны из группы, включающей галоген, ОН, CN, C1-C12 алкокси, фенил;
и пунктирная линия представляет простую или двойную связь;
или его фармацевтически приемлемая соль или сложный эфир. Описаны и другие новые аналоги ламелларина. Соединения проявляют противоопухолевую активность, являются ингибиторами топоизомеразы I, что позволяет использовать их в фармацевтической композиции и в качестве лекарственного средства. 7 н. и 17 з.п. ф-лы, 2 табл.
Реферат
Область изобретения
Настоящее изобретение относится к противоопухолевым соединениям и, в частности, к новым противоопухолевым аналогам ламелларинов, фармацевтическим композициям, содержащим такие соединения, и к их применению для лечения рака.
Предпосылки изобретения
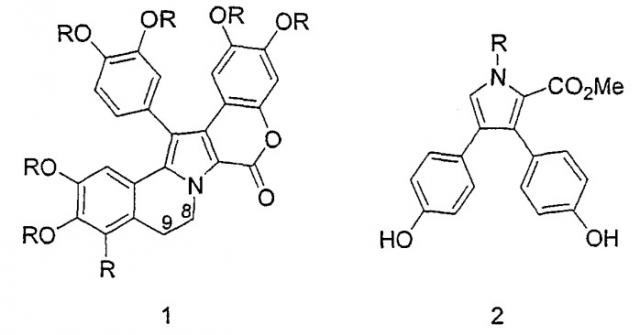
Ламелларины являются полиароматическими алкалоидами, впервые выделенными из морских источников, и включающие конденсированный полиароматический каркас. Семейство ламелларинов состоит из двух основных структур:
Обе структуры имеют пиррольное кольцо, замещенное арильными звеньями. Гексациклическая структура 1 представляет собой 14-фенил-6Н-[1]бензопиран[4',3',4,5]пирроло[2,1-а]изохинолин-6-он. В зависимости от заместителей и присутствия двойной связи между С8-С9 члены этого семейства обозначаются разными буквами.
| R1 | R2 | R3 | R4 | R5 | R6 | R7 | R8 | |
| A | OCH3 | CH3 | CH3 | H | CH3 | CH3 | H | OH |
| C | OCH3 | CH3 | CH3 | H | CH3 | CH3 | H | H |
| E | OH | CH3 | CH3 | CH3 | H | CH3 | H | H |
| F | OH | CH3 | CH3 | CH3 | CH3 | CH3 | H | H |
| G | H | H | CH3 | CH3 | H | H | CH3 | H |
| I | OCH3 | CH3 | CH3 | CH3 | CH3 | CH3 | H | H |
| J | H | H | CH3 | CH3 | CH3 | CH3 | H | H |
| K | OH | CH3 | CH3 | H | CH3 | CH3 | H | H |
| L | H | H | CH3 | CH3 | H | CH3 | H | H |
| S | H | H | CH3 | H | H | H | H | H |
| T | OCH3 | CH3 | CH3 | CH3 | H | CH3 | H | H |
| U | H | CH3 | CH3 | CH3 | H | CH3 | H | H |
| V | OCH3 | CH3 | CH3 | CH3 | H | CH3 | H | OH |
| Y | H | CH3 | H | CH3 | H | CH3 | SO3Na | H |
| Z | H | H | CH3 | H | H | H | CH3 | H |
| β | H | H | H | CH3 | H | H | H | H |
| R1 | R2 | R3 | R4 | R5 | R6 | R7 | |
| B | OCH3 | CH3 | CH3 | H | CH3 | CH3 | H |
| D | H | H | CH3 | H | CH3 | CH3 | H |
| H | H | H | H | H | H | H | H |
| M | OH | CH3 | CH3 | H | CH3 | CH3 | H |
| N | H | H | CH3 | CH3 | H | CH3 | H |
| W | OCH3 | CH3 | CH3 | CH3 | H | CH3 | H |
| X | OH | CH3 | CH3 | CH3 | H | CH3 | H |
| α | H | CH3 | CH3 | CH3 | H | CH3 | SO3Na |
R.J. Anderson et al., J. Am. Chem. Soc. 1985, 107, 5492, описывает выделение и характеристики четырех полиароматических метаболитов, ламелларинов A-D, полученных из морского двустворчатого моллюска Lamellaria sp. Структура ламелларина А была определена в исследовании с использованием рентгеноструктурного анализа, а структуры ламелларинов B-D были соотнесены путем интерпретации спектральных данных.
N. Lindquist et al., J. Org. Chem. 1988, 53, 4570, описывает выделение и характеристики четырех новых ламелларинов: Е-Н, выделенных из морской асцидии Didemnum chartaceum, которую добывали в Индийском океане. Структура ламелларина Е была определена в исследовании с использованием рентгеноструктурного анализа.
A.R. Carroll et al., Aust. J. Chem. 1993, 46, 489, выделили шесть новых ламелларинов: I, J, K, L, M и триацетат ламелларина N, и четыре известных ламелларина этого типа: А, В, С и триацетат ламелларина D, выделенные из морской асцидии Didemnum sp.
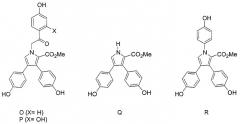
S. Urban et al., Aust. J. Chem. 1994, 47, 1919 и Aust. J. Chem. 1995, 48, 1419, описывают выделение и характеристики четырех новых ламелларинов, O, P, Q, R, с субструктурой типа 2, полученных из морской губки Dendrilla cactos. Позднее S. Urban et al., Aust. J. Chem. 1996, 49, 711, описали структуру ламелларина S из асцидии Didemnum sp.
M.V.R. Reddy et al., Tetrahedron 1997, 53, 3457, выделили пять новых ламелларинов: T, U, V, W и Х, и первый пример сульфированного ламелларина, Y, которые были выделены из морской асцидии Didemnum sp, добытой в Аравийском море.
R.A. Davis et al., J. Nat. Prod. 1999, 62, 419, описали один новый ламелларин, Z, и различные примеры сульфированных ламелларинов, которые были выделены из морской асцидии Didemnum chartaceum.
M.V.R. Reddy et al., J. Med. Chem. 1999, 42, 1901, выделили новый ламелларин, α, который был выделен из морской асцидии Didemnum sp.
Наконец, J. Ham et al., Bull. Korean Chem. Soc. 2002, 23, 163, описали выделение и характеристики ламелларина β, который был получен из морской асцидии Didemnum sp.
Как было показано, ламелларины С и D вызывают ингибирование деления клеток в анализе оплодотворенного морского ежа, тогда как ламелларины I, K и L все демонстрируют сопоставимую цитотоксичность против клеточных линий Р388 и А549 в культуре клеток. Недавно было показано, что ламелларин N проявляет активность в клеточных линиях рака легкого, действуя как микротрубчатый токсин Типа IV.
Кроме того, J.L. Fernandez-Puentes et al., Международная заявка РСТ WO 97/01336, описали, что эти соединения также обладают цитотоксической активностью в отношении клеток, резистентных к множеству лекарственных средств, а также эффективны как нетоксичные модуляторы фенотипа, резистентного к множеству лекарственных средств, и поэтому представляют собой привлекательный потенциальный источник химиотерапевтических средств.
Ограниченная доступность природного материала явилась причиной поиска альтернативных синтетических способов, который предпринят с целью найти альтернативу природным соединениям и соответствующим аналогам. M.G. Bandwell et al., Международная патентная заявка WO 98/50365 и Международная патентная заявка WO 99/67250, описали синтез ламелларина К через 1,3-биполярное циклоприсоединение между алкином и N-илидом изохинолина.
Триметиловый эфир ламелларина G также был синтезирован S. Ruchirawat et al., Tetrahedron Lett. 2001, 42, 1250. Синтез включал образование ядра пирроло[2,1-а]изохинолина с последующим образованием лактонового кольца.
Ламелларины I и К (1) были получены L. Castedo et al., Synlett 2001, 7, 1164, с использованием нового подхода, основанного на 1,3-биполярном циклоприсоединении нитрона к алкину. Ключевое циклоприсоединение дает изоксазолин, в результате перегруппировки которого получают центральное пиррольное кольцо.
F. Albericio et al., Org. Lett 2003, 5, 2959, описали полный процесс твердофазного синтеза ламелларинов U и L.
Ishibashi F. et al., J. Natl. Prod., 2002, 65, 500-504 описывают синтез и взаимосвязь структуры и активности для некоторых производных ламелларинов.
Определение главной мишени для противоракового средства является основным элементом для лучшего понимания его механизма действия и для направления пути разработки клинически полезных аналогов. Для иллюстрации этого можно привести пример камптотецина (СРТ), открытого в начале 1960-х, но успешно разработанного только спустя четверть века, когда была определена его главная и, возможно, единственная молекулярная мишень: топоизомераза I. Данные наблюдений, полученные в 1985 году, что СРТ стабилизирует комплексы ДНК-топоизомераза I, обеспечили стартовую точку для рациональной разработки безопасных аналогов СРТ, кульминация которой произошла в середине 1990-х, когда были одобрены топотекан и иринотекан для лечения рака яичников и толстой кишки.
Поиск не-СРТ ингибиторов топоизомеразы I в последние десять лет был очень активным, но было найдено лишь очень ограниченное количество сильных ингибиторов топоизомеразы I.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что ламелларины представляют собой новый и перспективный ряд ингибиторов топоизомеразы I. Взаимозависимость между способностью лекарственных средств стимулировать опосредованное топоизомеразой I расщепление ДНК и их цитотоксическим потенциалом делает их полезными противораковыми средствами.
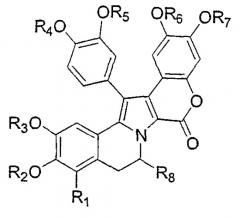
Настоящее изобретение направлено на соединения общей формулы III:
где Х выбран из группы, включающей N, O и S;
где R1, R2, R3, R4, R5, R6, R7, R8 и R9, каждый независимо, выбран из группы, включающей Н, ОН, OR', SH, SR', SOR', SO2R', NHR', N(R')2, N=R', NHCOR', N(COR')2, NHSO2R', NO2, PO(R')2, PO2R', C(=O)H, C(=O)R', CO2H, CO2R', OPO(R')2,OPO2R', OC(=O)H, OC(=O)R', N=C(R')2, замещенный или незамещенный С1-С12 алкил, замещенный или незамещенный С1-С12 галогеналкил, замещенный или незамещенный С2-С12 алкенил, замещенный или незамещенный С2-С12 алкинил, замещенный или незамещенный арил, замещенный или незамещенный аралкил и замещенную или незамещенную гетероароматическую группу;
где каждая из R' групп независимо выбрана из группы, включающей Н, ОН, NO2, NH2, SH, CN, галоген, =О, С(=О)Н, С(=О)СН3, СО2Н, С(=О)R', замещенный или незамещенный С1-С18 алкил, замещенный или незамещенный С2-С18 алкенил, замещенный или незамещенный С2-С18 алкинил, замещенный или незамещенный арил, замещенный или незамещенный С1-С18 алкоксил, замещенный или незамещенный С1-С18 аминоалкил, замещенную или незамещенную С1-С18 аминокислоту, замещенный или незамещенный С1-С18 тиоалкил, замещенный или незамещенный С1-С18 алкилсульфинил, замещенный или незамещенный С1-С18 алкилсульфонил;
где пары групп R1 и R2, R2 и R3, R3 и R4, R3 и R9, R4 и R9, R9 и R5, R9 и R6 или R6 и R7, R7 и R8 могут объединяться с образованием карбоциклической или гетероциклической кольцевой системы;
и пунктирная линия представляет простую или двойную связь;
или их фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры.
Исключаются соединения, которые являются известными ламелларинами, особенно известными ламелларинами, описанными в литературе, которые указаны во вступительной части настоящего описания, и более конкретно, ламелларины A-N и S-Z или ламелларины α или β, а также ламелларины D, K, L, M или N триацетат, триметиловый эфир ламелларина G и соединения, описанные в WO 9850365. В этой связи, каждый из документов предшествующего уровня техники ясно и недвусмысленно включен в настоящую заявку посредством ссылки, особенно в том, что касается какого-либо раскрытия известного соединения, которое должно быть исключено из притязаний по настоящей заявке.
Предпочтительные варианты воплощения изобретения
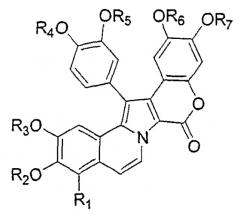
Предпочтительные соединения по настоящему изобретению представляют собой соединения формулы IV:
где R1-R8 определены выше и R'2-R'6 и пунктирная линия имеют те же значения, которые определены выше для R1-R8. В этой связи, соответствующие пары R'2-R'6 могут объединяться с образованием карбоциклической или гетероциклической кольцевой системы.
В формулах III или IV Х предпочтительно представляет собой О или N, наиболее предпочтительно О.
Предпочтительными соединениями являются те, которые имеют двойную связь между С-8 и С-9 (пунктирная линия), они показали самую сильную противоопухолевую активность.
В предпочтительном аспекте настоящего изобретения каждый из R1-R8 независимо выбран из Н, OR', ОС(=О)R'.
R3 предпочтительно выбран из группы, включающей Н, ОН, алкокси, наиболее предпочтительно метокси.
R4, R5, R6 и R8, каждый независимо предпочтительно выбран из группы, включающей Н или алкокси, наиболее предпочтительно Н. Подходяще, когда, по меньшей мере, 2, 3 или предпочтительно все 4, из групп R4, R5, R6 и R8 являются одинаковыми, и R3 предпочтительно является такой группой.
R1, R2 и R7, предпочтительно, каждый независимо выбран из группы, включающей Н, ОН, алкокси, ОС(=О)R', SO2R', PO(R')2, алкил, NO2, NH2.
В наиболее предпочтительном варианте осуществления настоящего изобретения R1, R2 и R7 представляют собой OC(=O)R', где R' представляет собой замещенную или незамещенную аминокислоту или цепь аминокислот, предпочтительно с катионной группой. Подходяще, когда, по меньшей мере, 2, или предпочтительно все 3, из групп R1, R2 и R7 являются одинаковыми.
В формуле IV R'2, R'3 и R'6, предпочтительно, каждый независимо, выбран из группы, включающей Н или алкокси, наиболее предпочтительно Н; и R'5 предпочтительно выбран из группы, включающей Н или алкокси, наиболее предпочтительно метокси.
R'4 предпочтительно выбран из группы, включающей Н, ОН, алкокси, ОС(=О)R', SO2R', PO(R')2, алкил, NO2, NH2. Наиболее предпочтительно R'4 представляет собой C(=O)R', где R' представляет собой замещенную или незамещенную аминокислоту или цепь аминокислот, предпочтительно с катионной группой.
Часто R'4, R7 и любой из R1 или R2 являются одинаковыми.
Любая из групп с гидрокси или аминозаместителем, который может быть защищен, может быть в защищенной форме при использовании доступных защитных групп.
Подходящие защитные группы для фенолов и гидроксигрупп включают простые и сложные эфиры, такие как алкиловый, алкоксиалкиловый, арилоксиалкиловый, алкоксиалкоксиалкиловый, алкилсилилалкоксиалкиловый, алкилтиоалкиловый, арилтиоалкиловый, азидоалкиловый, цианоалкиловый, хлоралкиловый, гетероциклический, арилациловый, галогенарилациловый, циклоалкилалкиловый, алкениловый, циклоалкиловый, алкиларилалкиловый, алкоксиарилалкиловый, нитроарилалкиловый, галогенарилалкиловый, алкиламинокарбониларилалкиловый, алкилсульфиниларилалкиловый, алкилсилиловый и другие простые эфиры, и арилацил, арилалкилкарбонат, алифатический карбонат, алкилсульфиниларилалкилкарбонат, алкилкарбонат, арилгалогеналкилкарбонат, арилалкенилкарбонат, арилкарбамат, алкилфосфинил, алкилфосфинотиоил, арилфосфинотиоил, арилалкилсульфонат и другие сложные эфиры. Такие группы могут необязательно быть замещены указанными выше группами в R1.
Подходящие защитные группы для аминов включают карбаматы, амиды и другие защитные группы, такие как алкил, арилалкил, сульфо- и галогенарилалкил, галогеналкил, алкилсилилалкил, арилалкил, циклоалкилалкил, алкиларилалкил, гетероциклилалкил, нитроарилалкил, ациламиноалкил, нитроарилдитиоарилалкил, дициклоалкилкарбоксамидоалкил, циклоалкил, алкенил, арилалкенил, нитроарилалкенил, гетероциклилалкенил, гетероциклил, гидроксигетероциклил, алкилдитио, алкокси-, или галоген-, или алкилсульфиниларилалкил, гетероциклилацил и другие карбаматы, и алканоил, галогеналканоил, арилалканоил, алкеноил, гетероциклилацил, ароил, арилароил, галогенароил, нитроароил и другие амиды, а также алкил, алкенил, алкилсилилалкоксиалкил, алкоксиалкил, цианоалкил, гетероциклил, алкоксиарилалкил, циклоалкил, нитроарил, арилалкил, алкокси- или гидроксиарилалкил и многие другие группы. Такие группы могут необязательно быть замещены указанными выше группами в R1.
Примеры таких защитных групп представлены в следующих таблицах.
| Защита для -ОН группы | |
| Простые эфиры | Сокращенное наименование |
| метил | |
| метоксиметил | МОМ |
| бензилоксиметил | BOM |
| метоксиэтоксиметил | MEM |
| 2-(триметилсилил)этоксиметил | SEM |
| метилтиометил | MTM |
| фенилтиометил | PTM |
| азидометил | |
| цианометил | |
| 2,2-дихлор-1,1-дифторэтил | |
| 2-хлорэтил | |
| 2-бромэтил | |
| тетрагидропиранил | THP |
| 1-этоксиэтил | EE |
| Фенацил | |
| 4-бромфенацил | |
| Циклопропилметил | |
| Аллил | |
| Пропаргил | |
| Изопропил | |
| Циклогексил | |
| трет-бутил | |
| Бензил | |
| 2,6-диметилбензил | |
| 4-метоксибензил | MPM или PMB |
| О-нитробензил | |
| 2,6-дихлорбензил | |
| 3,4-дихлорбензил | |
| 4-(диметиламино)карбонилбензил | |
| 4-метилсульфинилбензил | Msib |
| 9-антрилметил | |
| 4-пиколил | |
| Гептафтор-п-толил | |
| Тетрафтор-4-пиридил | |
| Триметилсилил | TMS |
| трет-бутилдиметилсилил | TBDMS |
| трет-бутилдифенилсилил | TBDPS |
| Триизопропилсилил | TIPS |
| Сложные эфиры | |
| Арилформиат | |
| Арилацетат | |
| Ариллевулинат | |
| Арилпивалоат | ArOPv |
| АрилбензоатАрил 9-фторкарбоксилат | |
| Арилметилкарбонат | |
| 1-адамантилкарбонат | |
| трет-бутилкарбонат | BOC-OAr |
| 4-метилсульфинилбензилкарбонат | Msz-Oar |
| 2,4-диметилпент-3-илкарбонат | Doc-Oar |
| Арил 2,2,2-трихлорэтилкарбонат | |
| Арилвинилкарбонат | |
| Арилбензилкарбонат | |
| Арилкарбамат | |
| Диметилфосфинил | Dmp-OAr |
| Диметилфосфинотиоил | Mpt-OAr |
| Дифенилфосфинотиоил | Dpt-Oar |
| Арилметансульфонат | |
| Арилтолуолсульфонат | |
| Арил 2-формилбензолсульфонат | |
| Защита для -NH2 группы | |
| карбаматы | Сокращенное наименование |
| Метил | |
| Этил | |
| 9-флуоренилметил | Fmoc |
| 9-(2-сульфо)флуоренилметил | |
| 9-(2,7-дибром)флуоренилметил | |
| 17-тетрабензо[a,c,g,i]флуоренилметил | Tbfmoc |
| 2-хлор-3-инденилметил | Climoc |
| Бенз[f]инден-3-илметил | Bimoc |
| 2,7-ди-трет-бутил[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метил | DBD-Tmoc |
| 2,2,2-трихлорэтил | Troc |
| 2-триметилсилилэтил | Teoc |
| 2-фенилэтил | hZ |
| 1-(1-адамантил)-1-метилэтил | Adpoc |
| 2-хлорэтил | |
| 1,1-диметил-2-хлорэтил | |
| 1,1-диметил-2-бромэтил | |
| 1,1-диметил-2,2-дибромэтил | DB-t-BOC |
| 1,1-диметил-2,2,2-трихлорэтил | TCBOC |
| 1-метил-1-(4-бифенил)этил | Bpoc |
| 1-(3,5-ди-трет-бутилфенил)-1-1-метилэтил | t-Burmeoc |
| 2-(2'- и 4'-пиридил)этил | Pyoc |
| 2,2-бис(4'-нитрофенил)этил | Bnpeoc |
| н-(2-пивалоиламино)-1,1-диметилэтил | |
| 2-[(2-нитрофенил)дитио]-1-фенилэтил | NpSSPeoc |
| 2-(н,н-дициклогексилкарбоксамидо)этил | |
| трет-бутил | BOC |
| 1-адамантил | 1-Adoc |
| 2-адамантил | 2-Adoc |
| Винил | Voc |
| Аллил | Aloc или Alloc |
| 1-изопропилаллил | Ipaoc |
| Циннамил | Coc |
| 4-нитроциннамил | Noc |
| 3-(3'-пиридил)проп-2-енил | Paloc |
| 8-хинолил | |
| Н-гидроксипиперидинил | |
| Алкилдитио | |
| Бензил | Cbz или Z |
| п-метоксибензил | Moz |
| п-нитробензил | PNZ |
| п-бромбензил | |
| п-хлорбензил | |
| 2,4-дихлорбензил | |
| 4-метилсульфинилбензил | Msz |
| 9-антрилметил | |
| Дифенилметил | |
| Фенотиазинил-(10)-карбонил | |
| н'-п-толуолсульфониламинокарбонил | |
| н'-фениламинотиокарбонил | |
| Амиды | |
| Формамид | |
| Ацетамид | |
| Хлорацетамид | |
| Трифторацетамид | TFA |
| Фенилацетамид | |
| 3-фенилпропанамид | |
| Пент-4-енамид | |
| Пиколинамид | |
| 3-пиридилкарбоксамид | |
| Бензамид | |
| п-фенилбензамид | |
| н-фталимид | |
| н-тетрахлорфталимид | TCP |
| 4-нитро-н-фталимид | |
| н-дитиасукцинимид | Dts |
| н-2,3-дифенилмалеимид | |
| н-2,5-диметилпиррол | |
| н-2,5-бис(триизопропилсилокси)пиррол | BIPSOP |
| н-1,1,4,4-тетраметилдисилиазациклопентановый аддукт | STABASE |
| 1,1,3,3-тетраметил-1,3-дисилаизоиндолин | BSB |
| Специальные -NH защитные группы | |
| н-метиламин | |
| н-трет-бутиламин | |
| н-аллиламин | |
| н-[2-триметилсилил)этокси]метиламин | SEM |
| н-3-ацетоксипропиламин | |
| н-цианометиламин | |
| н-цианометиламин | |
| н-(1-изопропил-4-нитро-2-оксо-3-пирролин-3-ил)амин | |
| н-2,4-диметоксибензиламин | Dmb |
| 2-азанорборнены | |
| н-2,4-динитрофениламин | |
| н-бензиламин | Bn |
| н-4-метоксибензиламин | MPM |
| н-2,4-диметоксибензиламин | DMPM |
| н-2-гидроксибензиламин | Hbn |
| н-(дифенилметил)амино | DPM |
| н-бис(4-метоксифенил)метиламин | |
| н-5-дибензосубериламин | DBS |
| н-трифенилметиламин | Tr |
| н-[(4-метоксифенил)дифенилметил]амин | MMTr |
| н-9-фенилфлурениламин | Pf |
| н-ферроценилметиламин | Fcm |
| н-2-пиколиламин н'-оксид | |
| н-1,1-диметилтиометиленамин | |
| н-бензилиденамин | |
| н-п-метоксибензилиденамин | |
| н-дифенилметиленамин | |
| н-(5,5-диметил-3-оксо-1-циклогексенил)амин | |
| н-нитроамин | |
| н-нитрозоамин | |
| Дифенилфосфинамид | Dpp |
| диметилтиофосфинамид | Mpt |
| Дифенилтиофосфинамид | Ppt |
| Дибензилфосфорамидат | |
| 2-нитробензолсульфенамид | Nps |
| н-1-(2,2,2-трифтор-1,1-дифенил)этилсульфенамид | TDE |
| 3-нитро-2-пиридинсульфенамид | Npys |
| п-толуолсульфонамид | Ts |
| бензолсульфонамид |
Предпочтительно, когда, по меньшей мере, один из R1-R8 и R'2-R'6 не является Н, ОН, ОСН3, SO3Na, наиболее предпочтительно, когда, по меньшей мере, два из них не являются Н, ОН, ОСН3, SO3Na. Также предпочтительно, когда, по меньшей мере, один из этих заместителей имеет, по меньшей мере, 2, более предпочтительно 3, еще более предпочтительно, по меньшей мере, 4 атома углерода. В частности, предпочтительно, когда R'4 и R7, а возможно также и R1, имеют такое минимальное количество атомов углерода.
Противоопухолевая активность этих соединений включает лейкозы, рак легкого, рак толстой кишки, рак почки, рак предстательной железы, рак поджелудочной железы, рак шейки матки, рак яичников, рак молочной железы, саркомы и меланомы.
В другом аспекте настоящее изобретение направлено на фармацевтические композиции, полезные в качестве противоопухолевых средств, которые содержат в качестве активного ингредиента соединение или соединения по настоящему изобретению или их фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры и фармацевтически приемлемый носитель.
Настоящее изобретение также направлено на применение соединений формулы III, указанной выше, или их фармацевтически приемлемых солей, производных, пролекарств или стереоизомеров при лечении рака или для получения лекарственного средства для лечения рака.
В следующем аспекте настоящее изобретение также направлено на применение соединений формулы III, указанной выше, или их фармацевтически приемлемых солей, производных, пролекарств или стереоизомеров в качестве ингибиторов топоизомеразы I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пятнадцать лет, в течение которых предпринимались попытки нацеливания на топоизомеразу I для открытия противораковых средств, привели к идентификации некоторых семейств соединений, способных стабилизировать ковалентные комплексы ДНК-топоизомераза I. В первом ряду, без сомнения, находится семейство камптотецина, где два лекарственных средства, топотекан и иринотекан, были одобрены для лечения рака, и несколько аналогов камптотецина второго (например, луртотекан, эксатекан) и третьего (например, дифломотекан) поколения в настоящее время проходят клинические испытания. Однако, помимо камптотецина, лишь немногие ингибиторы топоизомеразы I достигли фазы I клинических испытаний. Были сообщения об обещающих результатах, полученных для гликозилиндолкарбазолов, но до сих пор ни один ингибитор топоизомеразы I, не относящийся к ряду СРТ, не прошел успешно клинические испытания. Остается насущная потребность в новых сериях ингибиторов топоизомеразы I.
В настоящее время, к удивлению, было обнаружено, что природные ламелларины и их аналоги являются сильными ингибиторами топоизомеразы I и что они демонстрируют профили специфичности в отношении последовательности, отличные от камптотецина, являющегося широко известным ингибитором топоизомеразы I и химиотерапевтическим средством, что дает основание предполагать, что происходит иное распознавание на поверхности раздела топоизомераза I-ДНК.
Поэтому настоящее изобретение направлено на соединения формулы III, указанной выше, их применение в качестве противоопухолевых средств и на фармацевтические композиции, содержащие такие соединения.
Далее представлены указания в отношении заместителей в формулах III и IV:
Предпочтительные группы R' присутствуют в группах R', COR' или OCOR' и включают алкил или алкенил, который может быть замещен по одному или нескольким доступным положениям одной или несколькими подходящими группами, такими как галоген, например фтор, хлор, бром или иод, в частности ω-хлор или перхлор; аминоалкильные группы, такие как группы, содержащие один или несколько N атомов и от 1 до 12 атомов углерода или от 1 до 6 атомов углерода, и, в частности, включающие замещенные или незамещенные аминокислоты или аминокислотные цепи, например глицин, аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин, в частности защищенные формы таких аминокислот; карбоциклический арил, содержащий 6 или более атомов углерода, в частности фенил; и аралкил, такой как бензил; гетероциклические группы, включая гетероалициклические и гетероароматические группы, в частности с 5-10 кольцевыми атомами, из которых 1-4 являются гетероатомами, более предпочтительно гетероциклические группы с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами или с 10 кольцевыми атомами и 1-3 гетероатомами, при этом гетероциклические группы необязательно являются замещенными одним или несколькими заместителями, которые возможны для группы R', и, в частности, амино, например диметиламино или кето.
Подходящие галогенные заместители в соединениях по настоящему изобретению включают F, Cl, Br и I.
Алкильные группы предпочтительно содержат от 1 до 24 атомов углерода. Один более предпочтительный класс алкильных групп содержит от 1 до около 12 атомов углерода, еще более предпочтительно от 1 до около 8 атомов углерода, и еще предпочтительнее от 1 до около 6 атомов углерода, и наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Другой более предпочтительный класс алкильных групп содержит от 12 до около 24 атомов углерода, еще более предпочтительно от 12 до около 18 атомов углерода, и наиболее предпочтительно 13, 15 или 17 атомов углерода. Особенно предпочтительными алкильными группами в соединениях по настоящему изобретению являются метил, этил и пропил, включая изопропил. Как используется в настоящем описании, термин алкил, если не указаны какие-либо изменения, относится как к циклическим, так и нециклическим группам, хотя циклические группы должны включать, по меньшей мере, три кольцевых атома углерода.
Предпочтительные алкенильные и алкинильные группы в соединениях по настоящему изобретению имеют одну или несколько ненасыщенных связей и от 2 до около 12 атомов углерода, более предпочтительно от 2 до около 8 атомов углерода, еще более предпочтительно от 2 до около 6 атомов углерода и даже более предпочтительно 2, 3 или 4 атома углерода. Термины алкенил и алкинил, как они используются в настоящем описании, относятся как к циклическим, так и нециклическим группам, хотя линейные или разветвленные нециклические группы, как правило, являются более предпочтительными.
Алкилиденовые группы могут быть разветвленными или неразветвленными и, предпочтительно, содержат от 1 до 12 атомов углерода. Один более предпочтительный класс алкилиденовых групп содержит от 1 до около 8 атомов углерода, еще более предпочтительно от 1 до около 6 атомов углерода и наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Особенно предпочтительными алкилиденовыми группами в соединениях по настоящему изобретению являются метилиден, этилиден и пропилиден, включая изопропилиден.
Предпочтительные алкилсульфинильные группы в соединениях по настоящему изобретению включают такие группы, которые содержат одну или несколько сульфоксидных (SO) групп и от 1 до около 12 атомов углерода, более предпочтительно от 1 до около 8 атомов углерода, и еще более предпочтительно от 1 до около 6 атомов углерода. Особенно предпочтительными являются алкилсульфинильные группы, содержащие 1, 2, 3 или 4 атомов углерода.
Предпочтительные алкилсульфонильные группы в соединениях по настоящему изобретению включают такие группы, которые содержат одну или несколько сульфонильных (SO2) групп и от 1 до около 12 атомов углерода, более предпочтительно от 1 до около 8 атомов углерода, и еще более предпочтительно от 1 до около 6 атомов углерода. Особенно предпочтительными являются алкилсульфонильные группы, содержащие 1, 2, 3 или 4 атома углерода.
Предпочтительные аминоалкильные группы в соединениях по настоящему изобретению включают такие группы, которые содержат одну или несколько первичных, вторичных и/или третичных аминовых групп и от 1 до около 12 атомов углерода, более предпочтительно от 1 до около 8 атомов углерода, и еще более предпочтительно от 1 до около 6 атомов углерода, и даже более предпочтительно 1, 2, 3 или 4 атома углерода. Вторичные и третичные аминовые группы, как правило, являются более предпочтительными, чем первичные аминовые группы.
Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы. Подходящие гетероароматические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, О или S, и включают, например, кумаринил, включая 8-кумаринил, хинолинил, включая 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазол. Подходящие гетероциклические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, О или S, и включают, например, тетрагидрофуранил, тетрагидропиранил, пиперидинил, морфолино и пирролидинильную группы.
Подходящие карбоциклические арильные группы в соединениях по настоящему изобретению включают соединения, состоящие из одного или нескольких колец, включая соединения из нескольких колец, содержащие отдельные и/или конденсированные арильные группы. Типичные карбоциклические арильные группы содержат 1-3 отдельных или конденсированных кольца и от 6 до около 18 кольцевых атомов углерода. Особо предпочтительные карбоциклические арильные группы включают фенил, включая замещенный фенил, такой как 2-замещенный фенил, 3-замещенный фенил, 2,3-замещенный фенил, 2,5-замещенный фенил, 2,3,5-замещенный и 2,4,5-замещенный фенил, включая случаи, когда один или несколько заместителей фенила представляют собой электроноакцепторную группу, такую как галоген, циано, нитро, алканоил, сульфинил, сульфонил и т.п.; нафтил, включая 1-нафтил и 2-нафтил; бифенил; фенантрил; и антрацил.
При ссылке в данном описании на замещенные R' группы в соединениях по настоящему изобретению, имеется в виду определенная группа, обычно, алкил или алкенил, которая может быть замещена по одному или нескольким доступным положениям одной или несколькими подходящими группами, такой как галоген, например фтор, хлор, бром и иод; циано; гидроксил; нитро; азидо; алканоил, например С1-6 алканоильная группа, такая как ацил и т.п.; карбоксамидо; алкильные группы, включающие группы, содержащие от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода, и более предпочтительно 1-3 атома углерода; алкенильные и алкинильные группы, включающие группы, имеющие одну или несколько ненасыщенных связей и от 2 до около 12 атомов углерода или от 2 до около 6 атомов углерода; алкоксигруппы, включающие группы, имеющие одну или несколько кислородных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; арилокси, например фенокси; алкилтиогруппы, включающие группы, имеющие одну или несколько тиоэфирных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; алкилсульфинильные группы, включающие группы, имеющие одну или несколько сульфинильных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; алкилсульфонильные группы, включающие группы, имеющие одну или несколько сульфонильных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; аминоалкильные группы, включающие группы, содержащие один или несколько N атомов и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; карбоциклический арил, содержащий 6 или более атомов углерода, в частности, фенил (например, когда R представляет собой замещенную или незамещенную бифенильную группу); и аралкил, такой как бензил; гетероциклические группы, включающие гетероалициклические и гетероароматические группы, в частности с 5-10 кольцевыми атомами, из которых 1-4 являются гетероатомами, более предпочтительно гетероциклические группы с 5 или 6 кольцевыми атомами, из которых 1 или 2 являются гетероатомами, или с 10 кольцевыми атомами и 1-3 гетероатомами.
Далее указаны предпочтительные заместители для R1-R9 и R'2-R'6:
аминокислоты и пептиды
(L)-Val-OH; (L)-N-Boc-Val-OH
(D)-Val-OH; (D)-N-Boc-Val-OH
(L)-Ala-OH; (L)-N-Boc-Ala-OH;
(L)-N-Alloc-Ala-OH; (L)-N-Fmoc-Ala-OH
(L)-Phe-OH; (L)-N-Boc-Phe-OH
(L)-N-Boc-Lys(Cbz)-OH
(L)-Leu-OH; (L)-N-Boc-Leu-OH
(L)-Pro-OH; (L)-N-Boc-Pro-OH
(L)-Trp-OH; (L)-N-Boc-Trp-OH
(L)-Ile-OH; (L)-N-Boc-Ile-OH
(L)-Ser(Bn)-OH; (L)-N-Boc-Ser(Bn)-OH
(L)-Cys(Fm)-OH; (L)-N-Boc-Cys(Fm)-OH
(L)-N-Boc-β-Leu-OH
(L)-N-Boc-Lys(Boc)Gly-OH
(L)-AlaAla-OH; (L)-N-Boc-AlaAla-OH
Сложные эфиры
Гидроксициннамоил
Циклогексилпропил
Метансульфонил (Ms)
Трифторметансульфонил (Tf)
Октаноил
Биотин
Ацетил
Кумарин 3-карбоксил
2-[(4-фторфенил)тио]ацетил
4-флуоренкарбоксил
9Н-флуорен-4-карбоксил
2,3,4,5-тетрафторбензоил
4-пентиноил
4-метилциннамоил
3,5-дибромбензоил
5-(2-фенилэт-1-инил)никотинил
6-(Вос-амино)капроил
6-аминокапроил
3-(Вос-амино)пропил
3-аминопропил
Простые эфиры
Метил
Изопропил
Бензил
4-Метоксибензил
Метоксиметил
Метилендиокси
трет-бутилдифенилсилил
Азотсодержащие соединения
Нитро
Амино
Метиламино
Диметиламино
Бензофенонимин
Фосфаты
Диэтилфосфат
Галогены
Cl, Br, I
Цианиды
CN
Термин "фармацевтически приемлемые соли, производные, пролекарства" относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению, которое при введении реципиенту способно обеспечивать (прямо или косвенно) соединение, описанное в настоящей заявке. Однако должно быть понятно, что соли, не являющиеся фармацевтически приемлемыми, также охватываются настоящим изобретением, поскольку они могут быть полезны для получения фармацевтически приемлемых солей. Получение солей, пролекарств и производных можно осуществлять способами, известными из уровня техники.
Например, фармацевтически приемлемые соли соединений по настоящему изобретению синтезируют из исходного соединения, которое содержит основную или кислотную группу, традиционными химическими