Непептидные антагонисты gnrh
Иллюстрации
Показать всеИзобретение относится к непептидным антагонистам GnRH, имеющим общую формулу 1
где каждый А1, А2 и А3 независимо выбран из А5 и А6; и А4 представляет собой либо ковалентную связь, либо А5, при условии, что если А4 представляет собой ковалентную связь, то один из А1-А3 представляет собой А6, а два других представляют собой А5, и что если А4 представляет собой А5, то все A1-A3 представляют собой А5; А5 выбран из C-R13 и N; А6 выбран из N-R14, S и О; R1 выбран из Н, NHY1 и COY2, и R2 представляет собой Н; или и R1, и R2 представляют собой метил или вместе представляют собой =O; каждый R3, R4 и R5 независимо представляет собой Н или низший алкил; каждый R6, R7, R8, R9, R10, R11 и R12 независимо выбран из Н, NH2, F, Cl, Br, O-алкил и CH2NMe2; R13 выбран из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe и NMe2; R14 выбран из Н, метила и этила; W выбран из СН и N; Х выбран из СН2, О и NH; Y1 выбран из СО-низший алкил, CO(CH2)bY3, СО(СН2)bCOY3 и CO(CH2)bNHCOY3; Y2 выбран из OR15, NR16R17 и NH(CH2)cCOY3; Y3 выбран из алкила, OR15 и NR16R17; R15 представляет собой Н; каждый R16 и R17 независимо выбран из Н, низшего алкила и (CH2)aR18 или вместе они представляют собой -(CH2)2-Z-(СН2)2-; R18 выбран из ОН, пиридила, пиразинила и оксадиазолила; Z представляет собой NH; а означает 0-4; b и с означают 1-3. Также изобретение относится к применению соединений формулы 1 в качестве терапевтического агента и фармацевтической композиции, проявляющей активность антагониста рецептора GnRH. Также в данном изобретении описывается способ получения соединений формулы 1. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 5 н. и 22 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к группе соединений, которые действуют как антагонисты рецептора GnRH. Эти соединения полезны в лечении эндометриоза и гормон-зависимых видов рака и в регуляции овуляции в протоколах оплодотворения in vitro.
Предшествующий уровень техники
Гонадотропин-высвобождающий гормон (GnRH, также известный как рилизинг-фактор лютеинизирующего гормона, LHRH) представляет собой декапептидный гормон, продуцирующийся в гипоталамусе. После высвобождения он транспортируется в гипофиз, где вызывает секрецию фолликулостимулирующего гормона (FSH) и лютеинизирующего гормона (LH). Эти два гормона затем воздействуют на яичники (у женщин) или яички (у мужчин). Они регулируют фолликулогенез и овуляцию у женщин и высвобождение стероидных гормонов как у мужчин, так и у женщин.
Широко известно, что избыточная секреция стероидных гормонов может быть вредна для здоровья. Например, некоторые новообразования (такие как рак молочной железы или предстательной железы) и эндометриоз вызваны высокими уровнями стероидов. Поэтому агенты, которые модулируют систему гипоталамус-гипофиз-половые железы, представляют терапевтический интерес. Первые клинически использованные соединения представляли собой супер-агонисты GnRH. Они являются аналогами GnRH, которые сохраняют все биологические действия нативного гормона, но их вводят таким образом, чтобы вызвать хроническую активацию рецепторов GnRH. В течение нескольких дней эта хроническая активация вызывает отрицательную негативную регуляцию рецептор-опосредованной передачи сигнала и падение уровней FSH и LH. Недостаток этих агентов состоит в том, что в течение первых нескольких дней они вызывают сверхпродукцию FSH и LH, которая может привести к аллергической реакции ("flare" reaction). Поэтому внимание было сосредоточено на разработке антагонистов GnRH. Модификация пептидной последовательности привела к открытию ряда пептидных антагонистов, которые в настоящее время проходят клинические испытания. Однако, поскольку эти соединения все же являются пептидами, их следует вводить парентерально (обычно путем подкожной или внутримышечной инъекции). Эти соединения являются также относительно дорогостоящими для производства и очистки. Таким образом, существует потребность в терапевтически эффективных непептидных антагонистах GnRH и, особенно, в соединениях, которые можно вводить перорально и которые являются недорогими.
Краткое описание изобретения
Здесь описан ряд арилсульфонамидов, которые являются мощными и избирательными антагонистами рецептора GnRH. Соответственно, в первом аспекте настоящего изобретения предложены соединения, которые представляют собой производные общей формулы 1, и их фармацевтически приемлемые соли.
В этой общей структуре каждый А1-А3 может быть выбран из А5 и А6, где А5 может представлять собой либо =CR13-, либо =N-, и А6 может представлять собой -NR14-, -О- или -S-. А4 может представлять собой либо ковалентную связь, либо А5. Если А4 представляет собой ковалентную связь, так что кольцо, включающее в себя А1-А4, представляет собой пятичленное кольцо, то один из А1-А3 должен представлять собой А6, а два других должны представлять собой А5. Если А4 представляет собой А5, так что указанное кольцо представляет собой шестичленное кольцо, то все А1-А3 должны представлять собой А5. Группа R1 может быть выбрана из Н (атома водорода), NHY1 и COY2. В любом из этих случаев группа R2 представляет собой Н. Альтернативно и R1, и R2 могут представлять собой метильные группы или вместе могут представлять собой =O, чтобы образовать карбонильную группу. Каждая из групп R3, R4 и R5 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил. Каждая из групп R6, R7, R8, R9, R10, R11 и R12 независимо выбрана из Н, групп, представляющих собой низший алкил, низший алкенил, NH2, галогена (F, Cl и Br), O-алкил, O-низший алкил, O-низший алкенил, CH2NMe2 и CF3. Группа R13 выбрана из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe, NMe2 и CF3. Группа R14 выбрана из Н, метила и этила. W выбран из =СН- и =N-. X выбран из СН2, О, S, SO2, NH, групп, представляющих собой N - низший алкил и N - низший алкенил. Группа Y1 выбрана из СО - низший алкил, СО - низший алкенил, СО(СН2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3, где b означает 1-3. Группа Y2 выбрана из OR15, NR16R17 и NH(CH2)cCOY3, где с означает 1-3. Группа Y3 выбрана из алкила, низшего алкенила, OR15 и NR16R17. Группа R15 выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, где а означает 0-4. Каждая из групп R16 и R17 независимо выбрана из Н, низшего алкила и (CH2)aR18 или вместе они представляют собой -(CH2)2-Z-(CH2)2-. Группа R18 представляет собой ОН, фенильную группу или ароматический гетероцикл, выбранный из пиридила, пиримидинила, пиразинила, фурила, тиенила, пирролила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, триазолила, оксадиазолила и тиадиазолила, каждый из которых возможно может иметь заместитель, представляющий собой группу низший алкил или алкенил. Z выбран из О, СН2, S, SO2, NH, N - низший алкил и N - низший алкенил.
В других аспектах настоящего изобретения предложены фармацевтическая композиция, в которой одним из активных агентов является соединение общей формулы 1, применение соединения общей формулы 1 для приготовления такой фармацевтической композиции и способы лечения некоторых медицинских состояний.
Подробное описание изобретения
В первом аспекте настоящего изобретения предложены соединения, которые представляют собой производные общей формулы 1
Кольцо, включающее в себя А1-А4, представляет собой пяти- или шестичленную карбоциклическую или гетероциклическую группу. Окружность из точек внутри этой группы предназначена для того, чтобы показать, что кольцо содержит соответствующее для ароматического кольца определенного размера количество двойных и одинарных связей, а именно две двойные связи и три одинарные связи для пятичленного кольца и три двойные связи и три одинарные связи для шестичленного кольца. При определенных условиях, зависящих от природы А4, каждый из А1-А3 может быть выбран из А5 и А6, где А5 может представлять собой либо =CR13-, либо =N-, и А6 может представлять собой -NR14-, -О- или -S-. А4 может представлять собой либо ковалентную связь, либо А5. Если А4 представляет собой ковалентную связь, так что кольцо, включающее в себя А1-А4, представляет собой пятичленное кольцо, то один из А1-А3 должен представлять собой А6, а два других должны представлять собой А5. Если А4 представляет собой А5, так что указанное кольцо представляет собой шестичленное кольцо, то все А1-А3 должны представлять собой А5. Эти ограничения учитывают, что кольцо имеет одну из следующих четырех частичных структур:
Для частичных структур 2-4 две группы, представленные А5, не зависят друг от друга, так что обе могут представлять собой =N- или =CR13-, или одна может представлять собой =N-, а другая =CR13-. Аналогично в частичной структуре 5 четыре группы, представленные А5, являются независимыми, так что все группы могут представлять собой =N-, все группы могут представлять собой =CR13-, или от одной до трех групп могут представлять собой =N-, a остальные =CR13-. Кроме того, если =CR13- появляется в соединении более одного раза, то значение R13 при каждом появлении не зависит от других. Во всех случаях 1,3-связь между карбонильным и аминометильным заместителями сохраняется.
Группа R1 может быть выбрана из Н (атома водорода), NHY1 и COY2. В любом из этих случаев группа R2 представляет собой Н. Альтернативно и R1, и R2 могут представлять собой метил или вместе могут представлять собой =O, чтобы образовать карбонильную группу.
Каждая из групп R3, R4 и R5 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил.
Каждая из групп R6, R7, R8, R9, R10, R11 и R12 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил, NH2, галогенов (F, Cl и Br), O-алкил, CH2NMe2 и CF3.
Группа R13 выбрана из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe, NMe2 и CF3.
Группа R14 выбрана из Н, метила и этила.
W выбран из =СН- и =N-.
Х выбран из CH2, О, S, SO2, NH, N - низший алкил и N - низший алкенил.
Группа Y1 выбрана из СО - низший алкил, СО - низший алкенил, CO(CH2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3, где b означает 1-3.
Группа Y2 выбрана из OR15, NR16R17 и NH(CH2)cCOY3, где с означает 1-3.
Группа Y3 выбрана из низшего алкила, низшего алкенила, OR15 и NR16R17.
Группа R15 выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, где а означает 0-4.
Каждая из групп R16 и R17 независимо выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, или вместе они представляют собой -(CH2)2-Z-(СН2)2-.
Группа R18 представляет собой ОН, фенильную группу или ароматический гетероцикл, выбранный из пиридила, пиримидинила, пиразинила, фурила, тиенила, пирролила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, триазолила, оксадиазолила и тиадиазолила, каждый из которых возможно может иметь заместитель, представляющий собой группу низший алкил или низший алкенил.
Z выбран из О, СН2, S, SO2, NH, групп, представляющих собой N - низший алкил и N - низший алкенил.
В контексте настоящего описания группы, представляющие собой низший алкил, включают в себя линейные, разветвленные и циклические алкильные группы, содержащие до шести атомов углерода, включая метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, трет-амил, неопентил, циклопропил, циклогексил, циклопропилметил и тому подобное, но не ограничиваясь этим. Группы, представляющие собой низший алкенил, включают в себя мононенасыщенные линейные, разветвленные и циклические алкенильные группы, содержащие до шести атомов углерода, включая аллил, бут-2-енил, циклопент-3-енил и тому подобное, но не ограничиваясь этим. Алкенильные группы, где двойная связь находится в точке присоединения, такие как винил и 1-пропенил, не рассматриваются в качестве групп, представляющих собой низший алкенил, в контексте настоящего описания.
Некоторые соединения общей формулы 1 способны образовывать соли с кислотами или основаниями. Например, соединения общей формулы 1, которые имеют кислотную функциональную группу, могут образовывать натриевые, калиевые, кальциевые, магниевые или тетраалкиламмониевые соли после обработки соответствующим гидроксидом, карбонатом или бикарбонатом, или триалкиламмониевые соли после взаимодействия с соответствующим амином. Альтернативно соединения общей формулы 1, которые имеют основную группу, могут образовывать соли присоединения с неорганическими и органическими кислотами, такими как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, бензойная кислота, памовая кислота, лимонная кислота, фумаровая кислота, метансульфоновая кислота и тому подобное. В той степени, в какой эти соли являются фармацевтически приемлемыми, они включены в объем настоящего изобретения.
Соединения общей формулы 1 могут содержать один или более чем один стереогенный ("асимметрический") центр. Такие соединения проявляют оптическую изомерию и поэтому могут существовать в виде энантиомеров или диастереомеров. Такие изомеры, в чистом виде или в виде смесей, включая рацемические смеси, но не ограничиваясь ими, также включены в объем настоящего изобретения.
В предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где и R3 и R4 представляют собой Н.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где R5 представляет собой группу, представляющую собой низший алкил или низший алкенил и более предпочтительно метильную группу.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где все А1, А2, А3 и А4 представляют собой А5. Более предпочтительно все они представляют собой =CR13- или три из них представляют собой =CR13- и один представляет собой =N-. Еще более предпочтительно А1, А3 и А4 представляют собой =СН- и А2 представляет собой =CR13-. Наиболее предпочтительно А1, А3 и А4 представляют собой =СН- и А2 представляет собой =CF- или =CCl-. В альтернативном, более предпочтительном воплощении один из А1, А2, А3 и А4 представляет собой =N-, а другие представляют собой =СН-. Наиболее предпочтительно А1 представляет собой =N-, а А2, А3 и А4 представляют собой =СН-.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где А4 представляет собой ковалентную связь. Более предпочтительно А1 и один из А2 и А3 представляют собой А5, а другой представляет собой А6. Наиболее предпочтительно А1 представляет собой А5, один из А2 и А3 представляет собой =СН-, а другой представляет собой -S-.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где по меньшей мере три из R6-R10 представляют собой Н. Более предпочтительно четыре из R6-R10 представляют собой Н и один представляет собой галоген или трифторметил. Наиболее предпочтительно R6, R7, R9 и R10 представляют собой Н и R8 представляет собой галоген или трифторметил.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где R1 представляет собой COY2 и R2 представляет собой Н. Более предпочтительно Y2 представляет собой NR16R17 или NHCH2COY3. Наиболее предпочтительно Y2 представляет собой NH-CH2-R18 или NHCH2CONHCH3, где R18 представляет собой пиридил или 3-метил-1,2,4-оксадиазол-5-ил.
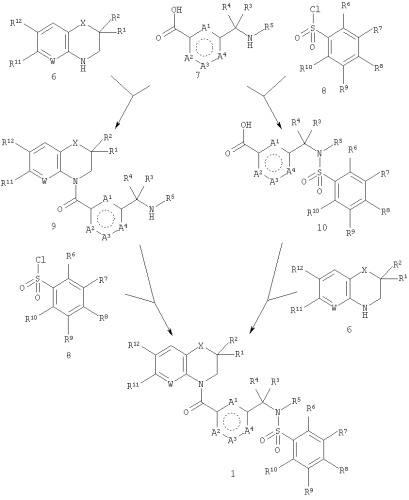
Соединения общей формулы 1 могут быть получены двумя способами, как описано в следующей схеме.
Требуются три исходных соединения, соответствующих общим формулам 6, 7 и 8. Либо 6 и 7 объединяют с получением промежуточного соединения общей формулы 9, либо 7 и 8 объединяют с получением промежуточного соединения общей формулы 10. Затем либо 8 и 9, либо 6 и 10 объединяют с получением продукта общей формулы 1. На определенных стадиях синтеза обычно необходимо использовать подходящие защитные группы, чтобы избежать побочных реакций. Использование таких защитных групп хорошо известно в данной области техники. Например, см. Greene, TW; "Protective Groups in Organic Synthesis", Wiley, New York, 1999. В частности, аминогруппа исходного вещества 7, вероятно, будет несовместима с условиями, необходимыми для осуществления взаимодействия 6 с 7, и, следовательно, должна быть защищена. Подходящие защитные группы представляют собой, например, трет-бутилоксикарбонильную (Boc) и бензилоксикарбонильную (Z) группы. Для группы карбоновой кислоты соединения 7 также может потребоваться защита. Если это так, то она может быть защищена в виде сложного эфира, такого как метиловый, этиловый, трет-бутиловый или бензиловый эфир.
Из схемы видно, что две стратегии синтеза требуют одинаковых химических превращений и отличаются только порядком, в котором они выполняются. Эти два превращения представляют собой
1) образование амида из карбоновой кислоты и циклического амина (6+7→9; 6+10→1) и
2) образование сульфонамида из сульфонилхлорида и амина (7+8→10; 8+9→1).
Образование амида представляет собой хорошо известную реакцию. Карбоновую кислоту и амин смешивают в подходящем растворителе, который обычно представляет собой апротонный растворитель, такой как дихлорметан или диметилформамид, и добавляют агент конденсации. В настоящее время большинство таких агентов доступно. Подходящие агенты включают в себя карбодиимиды, такие как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC) и N-(диметиламинопропил)-N'-(этил)карбодиимид (водорастворимый карбодиимид, WSC·HCl), производные фосфора, такие как гексафтор-фосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония (ВОР), гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (товарный знак РуВОР) и бис-(2-оксо-3-оксазолидинил)фосфинхлорид (BOP-CI), и производные мочевины, такие как гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU). Третичный амин также может быть включен в реакционную смесь. Примеры таких третичных аминов включают в себя триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. Взаимодействие обычно осуществляют при комнатной температуре или при более низкой температуре, такой как 0°С или -20°С. В тех случаях, когда реакция протекает медленно, смесь также можно нагревать до температуры, не превышающей точку кипения растворителя.
Образование сульфонамида также представляет собой хорошо известную реакцию. Обычно сульфонилхлорид и амин смешивают в апротонном растворителе, таком как дихлорметан или диметилформамид, в присутствии третичного амина (например, триэтиламина, диизопропилэтиламина и 4-диметиламинопиридина). Добавлять агент конденсации не нужно. Реакцию обычно проводят приблизительно при комнатной температуре.
Исходные соединения (6, 7 и 8) получают согласно опубликованным способам или путем модификации этих способов. В некоторых случаях может быть необходимо или желательно выполнять заключительные модификации молекулы после того, как эти три компонента будут объединены. Такие дополнения и модификации будут очевидны для специалиста в данной области техники.
Соединения общей формулы 1 являются мощными и специфическими антагонистами рецептора GnRH. Поэтому они полезны в лечении состояний, где GnRH вовлечен в патофизиологию. Например, эти соединения могут быть использованы для лечения некоторых гормон-зависимых видов рака, таких как рак молочной железы или предстательной железы. Они также могут быть использованы для лечения нераковых состояний, таких как доброкачественная гиперплазия предстательной железы и эндометриоз. Благодаря их способности блокировать высвобождение LH и FSH эти соединения могут быть использованы для регуляции фертильности. Они могут быть использованы в качестве контрацептивных агентов либо для мужчин, либо для женщин. Они также могут быть использованы при осуществлении программ искусственного оплодотворения, где необходимо регулировать уровни циркулирующих гормонов с целью оптимизации возможности получения зрелых яйцеклеток. Они также могут быть использованы для контроля криминального антиобщественного поведения.
Поэтому во втором аспекте настоящего изобретения предложено применение соединения общей формулы 1 в качестве терапевтического агента в медицине или ветеринарии. При использовании по этому назначению соединение будут приготавливать и вводить так же, как уже известно в данной области техники и как более подробно будет описано ниже.
В предпочтительном воплощении это соединение используют для лечения гормон-зависимого рака, доброкачественной гиперплазии предстательной железы или эндометриоза, в качестве контрацептивного агента, в качестве вспомогательного средства при осуществлении программы искусственного оплодотворения или в качестве агента, модифицирующего поведение. В другом предпочтительном воплощении это соединение используют в медицине.
В третьем аспекте настоящего изобретения предложена фармацевтическая композиция, отличающаяся тем, что в качестве активного агента она включает в себя по меньшей мере одно соединение общей формулы 1. Композиция может быть твердой, такой как таблетка, капсула, порошок, суппозиторий или тому подобное, или жидкой, такой как раствор, суспензия, эмульсия или крем. Композиция может включать в себя такие эксципиенты, которые обычно известны в данной области техники, включая наполнители, связывающие агенты, разбавители, диспергирующие агенты, смазывающие агенты, растворители, консерванты и корригенты.
В предпочтительном воплощении композиция представляет собой таблетку или капсулу, подходящую для перорального введения.
В другом предпочтительном воплощении композиция предназначена для лечения гормон-зависимого рака, доброкачественной гиперплазии предстательной железы или эндометриоза, в качестве контрацептивного агента, в качестве вспомогательного средства при осуществлении программы искусственного оплодотворения или в качестве агента, модифицирующего поведение.
В четвертом аспекте настоящего изобретения предложено применение соединения общей формулы 1 в качестве компонента фармацевтической композиции.
В пятом аспекте настоящего изобретения предложен новый способ лечения в медицине или ветеринарии, отличающийся тем, что субъекту вводят терапевтически эффективное количество соединения общей формулы 1, для того чтобы достичь желаемого результата.
Соединение, приготовленное в виде подходящей фармацевтической композиции, может быть введено любым подходящим путем, включая пероральное, трансбуккальное, назальное, легочное, ректальное, вагинальное, трансдермальное, внутримышечное, подкожное и внутривенное введение. Вводимое количество и частота, с которой повторяют введение, будут определены лечащим врачом (или ветеринаром) с учетом состояния и истории болезни субъекта и желаемого терапевтического результата. Обычная доза для человека будет находиться в диапазоне от 0,1 до 500 мг. Дозу можно вводить один раз в день или до четырех раз в день. Курс лечения может включать в себя однократное введение или повторное введение в течение периода от нескольких дней или недель до нескольких лет, если состояние, подлежащее лечению, является хроническим.
В предпочтительном воплощении субъект представляет собой мужчину или женщину.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой гормон-зависимый рак. Более предпочтительно оно представляет собой рак предстательной железы или рак молочной железы.
В другом предпочтительном воплощении, состояние, подлежащее лечению, представляет собой эндометриоз.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой доброкачественную гиперплазию предстательной железы.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой бесплодие. В частности, лечение является частью программы искусственного оплодотворения.
В другом предпочтительном воплощении целью лечения является обеспечение контрацепции.
В другом предпочтительном воплощении субъект представляет собой "лицо, совершившее половое преступление", то есть субъект, совершивший сексуальные нападения на других людей.
Настоящее изобретение, описанное выше, далее описано с помощью следующих примеров, которые предназначены для иллюстрации изобретения, а не для ограничения каким-либо образом объема изобретения.
Примеры
Хроматография означает флэш-хроматографию на силикагеле, если не указано иначе.
А. Синтез промежуточных соединений.
Бензоморфолин
2H-1,4-Бензоксазин-3(4Н)-он (4,5 г, 30 ммоль) добавляли порциями к перемешиваемой суспензии алюмогидрида лития (4,7 г, 120 ммоль) в тетрагидрофуране (ТГФ) (100 мл) и кипятили с обратным холодильником в течение 3 ч. Смесь охлаждали на бане лед/вода и при перемешивании добавляли раствор аммиака (8 мл) и воду (40 мл). Смесь фильтровали через целит и концентрировали. Хроматография (50% EtOAc/50% 60-80 петролейного эфира) дала бензоморфолин (3,7 г, 91%) в виде светло-коричневого масла.
Пиридо[3,2-b]морфолин
2H-Пиридо[3,2-b]-1,4-оксазин-3(4H)-он (1,9 г, 12,6 ммоль) добавляли к суспензии алюмогидрида лития (2,0 г, 53 ммоль) в сухом ТГФ (100 мл) при охлаждении на бане лед/вода. Смесь нагревали до 60°С и перемешивали в течение 4 ч. Смесь снова охлаждали на бане лед/вода и медленно добавляли воду (20 мл), затем этилацетат (200 мл). Смесь фильтровали и разделяли. Органическую фазу промывали водой и рассолом, сушили и концентрировали с получением пиридо[3,2-b]морфолина (1,5 г, 89%) в виде белого твердого вещества.
Этилбензоморфолин-2-карбоксилат
Этил-2,3-дибромпропионат (24 г, 92 ммоль) добавляли по каплям к кипящему при температуре дефлегмации раствору о-аминофенола (10 г, 92 ммоль) и карбоната калия (15 г, 110 ммоль) в ацетоне (100 мл). Через 18 ч смесь охлаждали и концентрировали. Добавляли этилацетат и воду и смесь разделяли. Органическую фазу промывали рассолом, фильтровали и концентрировали. Хроматография (30% EtOAc/70% 60-80 петролейного эфира) дала этилбензоморфолин-2-карбоксилат (4,5 г, 24%) в виде красного масла.
Бензоморфолин-2-карбоновая кислота
Раствор гидроксида лития (290 мл, 7,0 ммоль) в воде (10 мл) добавляли к раствору этилбензоморфолин-2-карбоксилата (750 мг, 3,6 ммоль) в диоксане (15 мл). Смесь перемешивали в течение 18 ч и концентрировали с получением бензоморфолин-2-карбоновой кислоты в виде литиевой соли, которую использовали без дополнительной очистки.
1,2,3,4-Тетрагидрохиноксалин-2-он
а) Гидрохлорид метилового эфира глицина (2,2 г, 18 ммоль), диизопропилэтиламин (2,9 г, 29 ммоль), 18-краун-6 (370 мг, 1,4 ммоль) и фторид калия (1,6 г, 28 ммоль) добавляли к раствору 1-фтор-2-нитробензола (2 г, 14 ммоль) в ацетонитриле (150 мл). Смесь нагревали при 80°С в течение 48 ч и охлаждали. Добавляли 0,3 н. гидросульфат калия и этилацетат и смесь разделяли. Органическую фазу промывали водой и рассолом, фильтровали через бумагу для разделения фаз и концентрировали. Хроматография (15% EtOAc/85% 60-80 петролейного эфира) дала метиловый эфир N-(2-нитрофенил)глицина в виде желтого твердого вещества (2,5 г, 85%).
б) Раствор метилового эфира N-(2-нитрофенил)глицина (740 мг, 3,6 ммоль) в этилацетате (50 мл) и метаноле (25 мл) гидрировали при атмосферном давлении над каталитическим количеством 10%-ного палладия на углероде. Через 1 ч смесь фильтровали и концентрировали с получением 1,2,3,4-тетрагидрохиноксалин-2-она в виде желтого твердого вещества (530 мг, 99%).
3-Ацетамидо-1,2,3,4-тетрагидрохинолин
а) Ацетилхлорид (410 мг, 5,2 ммоль) и триэтиламин (620 мг, 6,2 ммоль) добавляли к раствору 3-аминохинолина (710 мг, 4,9 ммоль) в дихлорметане (50 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли хлороформ (100 мл), смесь подкисляли 1 н. соляной кислотой (50 мл) и фазы разделяли. Водную фазу подщелачивали 1 н. раствором гидроксида натрия и экстрагировали смесью хлороформ/изопропанол (IPA) (85:15, 175 мл). Органический экстракт промывали водой, рассолом, сушили и концентрировали с получением 3-ацетамидохинолина (780 мг, 84%) в виде желтого твердого вещества.
б) Боран-пиридиновый комплекс (320 мг, 3,5 ммоль) добавляли к раствору 3-ацетамидохинолина (320 мг, 1,7 ммоль) в уксусной кислоте (20 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли хлороформ (150 мл) и смесь промывали 2 н. раствором гидроксида натрия, водой и рассолом. Органическую фазу сушили и концентрировали.
Хроматография (80% EtOAc/20% 60-80 петролейного эфира) дала 3-ацетамидо-1,2,3,4-тетрагидрохинолин (180 мг, 55%) в виде бледно-желтого твердого вещества.
N-(2-Гидроксиэтил)бензоморфолин-2-карбоксамид
НОВТ (1-гидроксибензотриазол) (3,1 г, 20 ммоль) добавляли к раствору бензоморфолин-2-карбоксилата лития (2,6 г, 15 ммоль) в дихлорметане (75 мл) и диметилформамиде (ДМФ) (7,0 мл) и охлаждали на бане лед/вода. Добавляли WSC·HCl (3,2 г, 17 ммоль), смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Смесь снова охлаждали на бане лед/вода и добавляли этаноламин (1,0 г, 17 ммоль) и триэтиламин (2,8 мл, 2,0 г, 20 ммоль).
Перемешивание продолжали при комнатной температуре в течение 3 дней. Смесь концентрировали и растворяли в этилацетате и 0,3 н. растворе гидросульфата калия. Фазы разделяли. Органическую фазу промывали насыщенным раствором гидрокарбоната натрия и водную фазу снова экстрагировали этилацетатом и хлороформом. Объединенные органические фазы сушили и концентрировали. Хроматография (6% метанола/94% хлороформа) дала N-(2-гидроксиэтил)бензоморфолин-2-карбоксамид (1,1 г, 33%) в виде коричневой смолы.
N-(3-Метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамид
НОВТ (1,0 г, 6,5 ммоль) и WSC·HCl (1,1 г, 5,8 ммоль) добавляли к раствору бензоморфолин-2-карбоксилата лития (900 мг, 5,0 ммоль) в дихлорметане (25 мл) и ДМФ (4,0 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 45 мин. Добавляли триэтиламин (0,73 мл, 530 мг, 5,2 ммоль) и раствор 3-метил-1,2,4-оксадиазол-5-илметиламина (590 мг, 5,2 ммоль, полученного согласно Н.Biere et al., Liebigs Ann. Chem. 1749 (1986)) в дихлорметане (5,0 мл) и смесь перемешивали в течение 18 ч. Смесь концентрировали, растворяли в этилацетате и промывали 0,3 н. гидросульфатом калия, насыщенным гидрокарбонатом натрия и рассолом. Органическую фазу сушили и концентрировали. Хроматография (80% этилацетата/20% 60-80 петролейного эфира) дала N-(3-метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамид (900 мг, 65%) в виде коричневой смолы.
трет-Бутил-N-(3-хлор-2-(метилоксикарбонил)тиофен-4-метил)-N-метилкарбамат
а) Раствор метил-3-хлор-4-метилтиофенкарбоксилата (10 г, 53 ммоль), N-бромсукцинимида (9,4 г, 53 ммоль) и азо-бис-(изобутиронитрила) (860 мг, 5,3 ммоль) в тетрахлориде углерода (300 мл) кипятили с обратным холодильником в течение 18 ч. Смесь фильтровали и концентрировали. Хроматография (10% EtOAc/90% гексанов) дала метил-4-бромметил-3-хлортиофен-2-карбоксилат (5,5 г, 39%) в виде белого твердого вещества.
б) Раствор метил-4-бромметил-3-хлортиофен-2-карбоксилата (7,6 г, 28 ммоль) в смеси насыщенный аммиак/этанол (200 мл) перемешивали при комнатной температуре в течение 18 ч. Смесь концентрировали в вакууме, растирали в диэтиловом эфире и растворяли в диоксане (200 мл). Добавляли гидроксид натрия (3,4 г, 85 ммоль), ди-трет-бутилдикарбонат (9,2 г, 42 ммоль) и воду (200 мл) и смесь перемешивали в течение 18 ч. Добавляли избыток гидроксида натрия и смесь нагревали при 70°С в течение 3 ч. Смесь промывали диэтиловым эфиром и подкисляли твердым гидросульфатом калия. Смесь экстрагировали этилацетатом и дихлорметаном, сушили и концентрировали с получением трет-бутил-N-(3-хлор-2-карбокситиофен-4-метил)карбамата (6,0 г, 73%) в виде коричневого масла.
в) Гидрид натрия (60%-ная дисперсия, 820 мг, 21 ммоль) добавляли к раствору трет-бутил-N-(3-хлор-2-карбокситиофен-4-метил)карбамата (2,0 г, 6,8 ммоль) в ДМФ (30 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры в течение 1 ч. Добавляли йодметан (4,0 мл) и смесь перемешивали в течение 18 ч. Добавляли воду и смесь подкисляли разбавленным раствором гидросульфата калия и экстрагировали EtOAc. Органическую фазу промывали водой и рассолом, сушили и концентрировали. Хроматография (20% EtOAc/80% гексанов) дала трет-бутил-N-(3-хлор-2-(метилоксикарбонил)тиофен-4-метил)-N-метилкарбамат (1,52 г, 70%) в виде коричневого масла.
Этил-2-(метиламинометил)тиазол-4-карбоксилат
а) Раствор этил-2-метилтиазол-4-карбоксилата (5,0 г, 29 ммоль), N-бромсукцинимида (6,2 г, 35 ммоль) и азо-бис-(изобутиронитрила) (480 мг, 2,9 ммоль) в тетрахлориде углерода (150 мл) кипятили с обратным холодильником в течение 18 ч. Смесь фильтровали и концентрировали. Хроматография (20% EtOAc/80% гексанов и 30% EtOAc/70% гексанов) дала этил-2-бромметилтиазол-4-карбоксилат (3,25 г, 44%).
б) Раствор этил-2-бромметилтиазол-4-карбоксилата (4,25 г, 17 ммоль) в ТГФ (50 мл) по каплям добавляли к раствору метиламина в ТГФ (2 М, 30 мл, 60 ммоль) при охлаждении до -10°С. Смесь оставляли нагреваться до комнатной температуры и перемешивали еще в течение 30 мин. Смесь разбавляли EtOAc и промывали 0,3 н. раствором гидросульфата калия и рассолом. Органическую фазу сушили и концентрировали с получением этил-2-(метиламинометил)тиазол-4-карбоксилата (3,06 г, 70%) в виде оранжевого масла, которое использовали без дополнительной очистки.
трет-Бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамат
а) Смесь 3-цианобензойной кислоты (5,0 г, 34 ммоль), 10%-ного палладия на углероде (1 г) и концентрированной соляной кислоты (3 мл) в метаноле (150 мл) перемешивали в токе газообразного водорода при атмосферном давлении в течение 6 ч. Смесь фильтровали через Celite®, концентрировали и подвергали азеотропной перегонке с толуолом. Остаток растворяли в 1 М растворе гидрокарбоната калия (105 мл) и диоксане (50 мл) и охлаждали на бане лед/вода. Добавляли раствор ди-трет-бутилдикарбоната (7,9 г, 36 ммоль) в диоксане (25 мл) и смесь оставляли нагреваться до комнатной температуры. После перемешивания в течение 3 дней диоксан удаляли в вакууме. Водный остаток промывали 60-80 петролейным эфиром, подкисляли 1 н. соляной кислотой и экстрагировали этилацетатом. Органическую фазу промывали рассолом, сушили и концентрировали с получением трет-бутил-N-(3-карбоксибензил)карбамата (8,2 г, 86%) в виде белого твердого вещества.
б) Гидрид натрия (60%-ная дисперсия, 700 мг, 18 ммоль) добавляли к раствору трет-бутил-N-(3-карбоксибензил)карбамата (2,0 г, 8,0 ммоль) в ДМФ (40 мл) при охлаждении на бане лед/вода. Через 15 мин смесь оставляли нагреваться до комнатной температуры в течение 15 мин. Смесь снова охлаждали на бане лед/вода и добавляли йодметан (3,7 мл, 8,4 г, 60 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли воду и смесь концентрировали в вакууме. Добавляли этилацетат и 0,3 н. гидросульфат калия, смесь разделяли. Органическую фазу промывали рассолом, сушили и концентрировали. Хроматография (20% EtOAc, 80% 60-80 петролейного эфира) дала трет-бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамат (1,6 г, 69%) в виде бесцветного масла.
трет-Бутил-N-(3-карбоксибензил)-N-метилкарбамат
Моногидрат гидроксида лития (420 мг, 10 ммоль) и воду (15 мл) добавляли к раствору трет-бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамата (1,6 г, 5,6 ммоль) в диоксане (20 мл) и смесь перемешивали в течение 2 ч. Диоксан удаляли в вакууме и остаток растворяли в 0,3 н. гидросульфате калия. Смесь экстрагировали этилацетатом, органическую фазу промывали водой и рассолом, сушили и концентрировали с получением трет-бутил-N-(3-карбоксибензил)-N-метилкарбамата (1,4 г, 95%).
трет-Бутил-(1-(4-карбокситиазол-2-ил)этил)карбамат
а) Гидрокарбонат калия (1,58 г, 15,7 ммоль) и этилбромпируват (2,1 мл, 16,9 ммоль) добавляли к раствору (R,S)-2-(трет-бутилоксикарбониламино)тиопропионамида (800 мг, 3,9 ммоль) в 1,2-диметоксиэтане (10 мл) при -10°С. Смесь перемешивали и оставляли нагреваться до 0°С в течение 2 ч и до комнатной температуры в течение 1,5 ч. Смесь фильтровали и твердое вещество промывали диэтиловым эфиром. Фильтрат концентрировали, растворяли в 1,2-диметоксиэтане (10 мл) и охлаждали до -30°С. К этому раствору добавляли трифторуксусный ангидрид (1,8 мл, 12,8 ммоль) и 2,6-лутидин (3,2 мл, 27,2 ммоль). Через 50 мин раствор концентрировали и распределяли между хлороформом и водой. Органический слой сушили и концентрировали с получением трет-бутил-(1-(4-(этилоксикарбонил)тиазол-2-ил)этил)карбамата (1,4 г) в виде сырого вещества, ко