Замещенные бензоксазолы и аналоги в качестве эстрогенных агентов
Иллюстрации
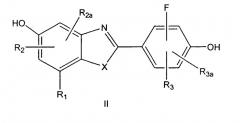
Показать всеИзобретение относится к модуляторам эстрогенного рецептора формулы (II), имеющим структуру
где
R1 означает алкенил из 2-7 атомов углерода, где группа алкенил необязательно замещена -CN или галогеном; R2 и R2а, каждый независимо, означают водород или галоген; R3 и R3а, каждый независимо, означают водород или галоген; Х означает О; или их фармацевтически приемлемым солям. Изобретение также относится к способу получения заявленных соединений, к фармацевтической композиции и способам лечения различных заболеваний. 14 н. и 25 з.п. ф-лы, 23 табл.
Реферат
Предпосылки к созданию изобретения
Это изобретение относится к замещенным бензоксазолам, которые могут применяться в качестве эстрогенных агентов.
Плейотропные эффекты эстрогенов в тканях млекопитающих получили хорошее документальное подтверждение, и в настоящее время признано, что эстрогены влияют на многие системы органов [Mendelsohn and Karas, New England Journal of Medicine 340: 1801-1811 (1999), Epperson, et al., Psychosomatic Medicine 61: 676-697 (1999), Crandall, Journal of Womens Health & Gender Based Medicine 8: 1155-1166 (1999), Monk and Brodaty, Dementia & Geriatric Cognitive Disorders 11: 1-10 (2000), Hurn and Macrae, Journal of Cerebral Blood Flow & Metabolism 20: 631-652 (2000), Calvin, Maturitas 34: 195-210 (2000), Finking, et al., Zeitschrift fur Kardiologie 89: 442-453 (2000), Brincat, Maturitas 35: 107-117 (2000), Al-Azzawi, Postgraduate Medical Journal 77: 292-304 (2001)]. Эстрогены могут оказывать влияния на ткани различными путями, и наиболее хорошо охарактеризованным механизмом действия является их взаимодействие с эстрогенными рецепторами, ведущее к альтерациям в генной транскрипции. Эстрогенные рецепторы являются лиганд-активируемыми факторами транскрипции и принадлежат к надсемейству нуклеарных гормональных рецепторов. К другим членам указанного семейства относятся рецепторы прогестерона, андрогена, глюкокортикостероида и минералокортикоида. Под действием связывающего лиганда указанные рецепторы димеризуются и могут активировать генную транскрипцию либо непосредственным связыванием со специфическими последовательностями DNA (известными как чувствительные элементы), либо путем взаимодействия с другими факторами транскрипции (такими как АР1), которые, в свою очередь, связываются непосредственно со специфическими последовательностями DNA [Moggs and Orphanides, EMBO Reports 2: 775-781 (2001), Hall, et al., Journal of Biological Chemistry 276: 36869-36872 (2001), McDonnell, Principles of Molecular Regulation, p351-361 (2000)]. Класс "корегуляторных" протеинов, которые могут также взаимодействовать с лиганд-связывающим рецептором и далее модулировать его транскрипционную активность (McKenna, et al., Endocrine Reviews 20: 321-344 (1999)]. Было также показано, что эстрогенные рецепторы могут подавлять NFkB-опосредуемую транскрипцию как зависимым от лиганда, так и независимым образом [Quaedackers, et al., Endocrinology 142: 1156-1166 (2001), Bhat, et al., Journal of Sreroid Biochemistry & Molecular Biology 67: 233-240 (1998), Pelzer, et al., Biochemical & Biophysical Research Communications 286: 1153-7 (2001)].
Эстрогенные рецепторы также могут быть активированы фосфорилированием. Это фосфорилирование опосредуется ростовыми факторами, такими как EGF, и вызывает изменения в генной транскрипции в отсутствие лиганда [Moggs and Orphanides, EMBO Reports 2: 775-781 (2001), Hall, et al., Journal of Biological Chemistry 276: 36869-36872 (2001)].
Менее хорошо охарактеризованные механизмы, посредством которых эстрогены могут воздействовать на клетки, - это через так называемый мембранный рецептор. Существование такого рецептора является спорным, но документально хорошо подтверждено, что эстрогены могут вызывать очень быстрые негеномные отклики от клеток. Молекулярная сущность, ответственная за трансдукцию указанных эффектов, окончательно не выделена, но есть основания утверждать, что она по меньшей мере относится к нуклеарным формам эстрогенных рецепторов [Levin, Journal of Applied Physiology 91: 1860-1867 (2001), Levin, Trends in Endocrinolody & Metabolism 10: 374-377(1999)].
На данный момент открыто два эстрогенных рецептора. Первый эстрогенный рецептор клонирован около 15 лет назад и в настоящее время упоминается как ERα [Green, et al., Nature 320: 134-9 (1986)]. Вторая форма эстрогенного рецептора обнаружена сравнительно недавно и названа как ERβ [Kuiper, et al., Proceedings of the National Academy of Sciences of the United States of America 93: 5925-5930 (1996)]. Начальная работа по ERβ была сфокусирована на определении его сродства к разнообразным лигандам, и действительно были обнаружены некоторые различия с ERα. Тканевое распределение ERβ было хорошо картировано на грызунах, и оно не совпадает с ERα. Ткани, такие как матка мышей и крыс, экспрессирует преимущественно ERα, тогда как легкое мышей и крыс экспрессируют преимущественно ERβ [Couse, et al., Endocrinolody 138: 4613-4621 (1997), Kuiper, et al., Endocrinolody 138: 863-870 (1997)]. Даже внутри одного и того же органа распределение ERα и ERβ может быть разграничено. Например, в яичнике мышей ERβ высоко экспрессируется в зернистых клетках и ERα ограничивается оболочковыми и относящимися к строме клетками [Sar and Welsch, Endocrinolody 140: 963-971 (1999), Fitzpatrick, et al., Endocrinolody 140: 2581-2591 (1999)]. Однако есть примеры, где рецепторы совместно экпрессируются, и есть основание, исходя из исследований in vitro, полагать, что ERα и ERβ могут образовывать гетеродимеры [Cowley, et al., Journal of Biological Chemistry 272: 19858-19862 (1997)].
Было описано большое число соединений, которые или стимулируют, или блокируют активность 17β-эстрадиола. Соединения, имеющие приблизительно такие же биологические эффекты, как 17β-эстрадиол, наиболее сильный эндогенный эстроген, названы как "агонисты эстрогенного рецептора". Те же, которые в сочетании с 17β-эстрадиолом блокируют его эффекты, названы "антагонистами эстрогенного рецептора". В реальности же существует континиум между активностью агониста эстрогенного рецептора и антагониста эстрогенного рецептора, и на самом деле некоторые соединения ведут себя как агонисты эстрогенного рецептора в некоторых тканях и как антагонисты эстрогенного рецептора в других. Такие соединения со смешанной активностью названы селективными модуляторами эстрогенного рецептора (SERMS) и являются терапевтически применимыми агентами (напр. EVISTA)[McDonnell, Journal of the Society for Gynecologic Investigation 7: S10-S15 (2000), Goldstein, et al., Human Reproduction Update 6: 212-224 (2000)]. Точная причина, почему одно и то же соединение может иметь специфические в отношении клеток эффекты, не выяснена, но различия в конформации рецептора и/или среди корегуляторных протеинов подтверждены.
Известно, что на какое-то время эстрогенные рецепторы принимают различные конформации, когда связываются с лигандами. Однако последствие и тонкое различие указанных изменений обнаружены только недавно. Трехмерные структуры ERα и ERβ были разделены совместной кристаллизацией с различными лигандами и ясно показали репозиционирование спирали 12 в присутствии антагониста эстрогенного рецептора, которое стерически затрудняет последовательности протеина, необходимые для взаимодействия рецептор-корегуляторный протеин [Pike, et al., Embo 18: 4608-4618 (1999), Shiau, et al., Cell 95: 927-937 (1998)]. В дополнение, методика демонстрации фагов была применена для идентификации пептидов, которые взаимодействуют с эстрогенными рецепторами в присутствии различных лигандов [Paige, et al., Proceedings of the National Academy of Sciences of the United States of America 96: 3999-4004 (1999)]. Например, был идентифицирован пептид, который проводит различие между ERα, связанным с полными агонистами эстрогенного рецептора 17β-эстрадиолом и диэтилстилбестеролом. Был обнаружен другой пептид, который проводит различие между кломифеном, связанным с ERα и ERβ. Эти данные показывают, что каждый лиганд потенциально располагает рецептор в уникальной и непредсказуемой конформации, которая, вероятно, имеет различающиеся биологические активности.
Как упоминалось выше, эстрогены влияют на облачение биологических процессов. В дополнение, когда родовые отличия описаны (напр., частота заболеваний, отклики на вызов и т.п.), возможно, что объяснение предусматривает различие в уровнях содержания эстрогена между мужскими и женскими особями.
Описание изобретения
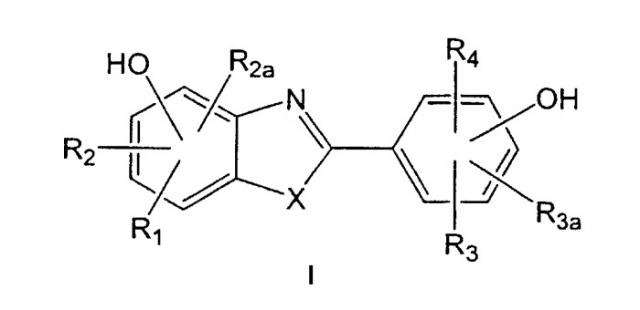
Изобретение относится к эстрогенному соединению формулы (I), имеющему структуру
где R1 означает водород, гидроксил, галоген, алкил из 1-6 атомов углерода, трифторалкил из 1-6 атомов углерода, циклоалкил из 3-8 атомов углерода, алкокси из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, тиоалкил из 1-6 атомов углерода, сульфоксоалкил из 1-6 атомов углерода, сульфоноалкил из 1-6 атомов углерода, арил из 6-10 атомов углерода, 5- или 6-членное гетероциклическое кольцо, имеющее от 1 до 4 гетероатомов, выбранных из О, N или S, -NO2, -NR5R6, -N(R5)COR6, -CN, -CHFCN, -CF2CN, алкинил из 2-7 атомов углерода или алкенил из 2-7 атомов углерода, где группы алкил или алкенил необязательно замещены гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
R2 и R2а, каждый независимо, означают водород, гидроксил, галоген, алкил из 1-6 атомов углерода, алкокси из 1-4 атомов углерода, алкенил из 2-7 атомов углерода или алкинил из 2-7 атомов углерода, трифторалкил из 1-6 атомов углерода или трифторалкокси из 1-6 атомов углерода, где группы алкил или алкенил необязательно замещены гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
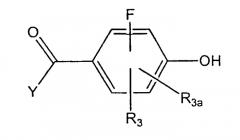
R3, R3а и R4, каждый независимо, означают водород, алкил из 1-6 атомов углерода, алкенил из 2-7 атомов углерода, алкинил из 2-7 атомов углерода, галоген, алкокси из 1-4 атомов углерода, трифторалкил из 1-6 атомов углерода или трифторалкокси из 1-6 атомов углерода, где группы алкил или алкенил необязательно замещены гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
R5, R6, каждый независимо, означают водород, алкил из 1-6 атомов углерода, арил из 6-10 атомов углерода;
Х означает О, S или NR7;
R7 означает водород, алкил из 1-6 атомов углерода, арил из 6-10 атомов углерода, -COR5, -СО2R5 или -SO2R5;
или к его фармацевтически приемлемой соли.
Фармацевтически приемлемые соли могут быть образованы из органических и неорганических кислот, например уксусной, пропионовой, молочной, лимонной, винной, янтарной, фумаровой, малеиновой, малоновой, миндальной, яблочной, фталевой, хлористоводородной, бромистоводородной, фосфорной, азотной, серной, метансульфоновой, нафталинсульфоновой, бензолсульфоновой, толуолсульфоновой, камфорсульфоновой и подобных известных приемлемых кислот, когда соединение по изобретению содержит группу основного характера. Соли также могут быть образованы из органических и неорганических оснований, такие как соли щелочных металлов (например, натрия, лития или калия), соли щелочно-земельных металлов, соли аммония, соли алкиламмония, содержащего 1-6 атомов углерода или соли диалкиламмония, содержащего 1-6 атомов углерода в каждой алкилгруппе, и соли триалкиламмония, содержащего 1-6 атомов углерода в каждой алкилгруппе, когда соединение по изобретению содержит кислотную группу.
Термины алкил, алкенил и алкинил включают группы как с разветвленной, так и с прямой цепью. Примеры включают метил, этил, пропил, бутил, изопропил, втор-бутил, трет-бутил, винил, аллил, ацетилен, 1-метилвинил и тому подобное. Когда группы алкил и алкенил замещены, они обычно могут быть моно-, ди-, три- и пер-замещенными. Примеры для галоген-заместителя включают 1-бромвинил, 1-фторвинил, 1,2-дифторвинил, 2,2-дифторвинил, 1,2,2-трифторвинил, 1,2-дибромэтан, 1,2-дифторэтан, 1-фтор-2-бромэтан, CF2CF3, CF2CF2CF3 и тому подобное. Термин галоген включает бром, хлор, фтор и иод. Термин арил означает фенил, 1-нафтил или 2-нафтил. Предпочтительные 5-6-членные гетероциклические кольца включают фуран, тиофен, пиррол, изопиррол, пиразол, имидазол, триазол, дитиол, оксатиол, изоксазол, оксазол, тиазол, изотиазолем, оксадиазол, фуразан, оксатриазол, диоксазол, оксатиазол, тетразол, пиран, пиридин, пиридазин, пиримидин, пиразин, триазин, оксазин, оксатиазин или оксадиазин. Более предпочтительно, когда гетероциклическим кольцом является фуран, тиофен или тиазол.
Из соединений по данному изобретению предпочтительно соединение формулы (I), которое имеет структуру
где R1 означает алкенил из 2-7 атомов углерода, где группа алкенил необязательно замещена гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
R2 и R2а, каждый независимо, означают водород, гидроксил, галоген, алкил из 1-6 атомов углерода, алкокси из 1-4 атомов углерода, алкенил из 2-7 атомов углерода, алкинил из 2-7 атомов углерода, трифторалкил из 1-6 атомов углерода или трифторалкокси из 1-6 атомов углерода, где группы алкил, алкенил или алкинил необязательно замещены гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
R3 и R3а, каждый независимо, означают водород, алкил из 1-6 атомов углерода, алкенил из 2-7 атомов углерода, алкинил из 2-7 атомов углерода, галоген, алкокси из 1-4 атомов углерода, трифторалкил из 1-6 атомов углерода или трифторалкокси из 1-6 атомов углерода, где группы алкил, алкенил или алкинил необязательно замещены гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или N(R5)COR6;
R5, R6, каждый независимо, означают водород, алкил из 1-6 атомов углерода, арил из 6-10 атомов углерода;
X означает О, S или NR7;
R7 означает водород, алкил из 1-6 атомов углерода, арил из 6-10 атомов углерода, -COR5, -СО2R5 или -SO2R5;
или его фармацевтически приемлемая соль.
Более предпочтительно, когда Х означает О, и еще более предпочтительно, когда Х означает О и R1 означает алкенил из 2-3 атомов углерода, который необязательно замещен гидроксилом, -CN, галогеном, трифторалкилом из 1-6 атомов углерода, трифторалкокси из 1-6 атомов углерода, -COR5, -СО2R5, -NO2, CONR5R6, NR5R6 или -N(R5)COR6.
Используемый в соответствии с данным изобретением термин "обеспечение" по отношению к обеспечению соединения или вещества, охватываемого данным изобретением, означает либо непосредственно введение такого соединения или вещества, либо введение пролекарства, производного или аналога, которые будут образовывать эффективное количество соединения или вещества внутри организма.
Используемый в соответствии с данным изобретением термин "селективный в отношении ERβ лиганд" означает, что сродство связывания (которое измеряют по IC50, где IC50 17β-эстрадиола равно не более чем 3-кратной дифференте между ERα и ERβ) лиганда с ERβ по меньшей мере приблизительно в 10 раз больше, чем его сродство связывания с ERα в стандартной фармакологической тест-процедуре, которая служит для измерения величин сродства связывания с ERα и ERβ. Предпочтительно, когда селективный в отношении ERβ лиганд будет иметь сродство связывания с ERβ, которое по меньшей мере приблизительно в 20 раз больше, чем его сродство связывания с ERα. Более предпочтительно, когда селективный в отношении ERβ лиганд будет иметь сродство связывания с ERβ, которое по меньшей мере приблизительно в 50 раз больше, чем его сродство связывания с ERα. Дополнительно предпочтительно, когда селективный в отношении ERβ лиганд является неутеротрофическим и немаммотрофическим.
Используемый в соответствии с данным изобретением термин "неутеротрофический" означает увеличение массы влажной матки в стандартной фармакологической тест-процедуре на менее чем около 50% от увеличения массы матки, наблюдаемого для максимально эффективной дозы 17β-эстрадиола или 17α-этинил-17β-эстрадиола в такой же процедуре. Предпочтительно, чтобы увеличение массы влажной матки было бы менее чем около 25% от наблюдаемого для эстрадиола и более предпочтительно, чтобы увеличение массы влажной матки было бы менее чем около 10% от наблюдаемого для эстрадиола. Наиболее предпочтительно, чтобы неутеротрофический селективный в отношении ERβ лиганд не увеличивал бы заметно влажную массу матки (р>0,05) по сравнению с контролем, который не имеет утеротрофической активности (например, носитель).
Используемый в соответствии с данным изобретением термин "немаммотрофический" означает формирование увеличения mRNA казеин-киназы II в стандартной фармакологической тест-процедуре менее чем около 50% от увеличения mRNA казеин-киназы II, наблюдаемого для максимально эффективной дозы 17β-эстрадиола или 17α-этинил-17β-эстрадиола в такой же процедуре. Предпочтительно, чтобы увеличение mRNA казеин-киназы II было бы менее чем около 25% от наблюдаемого для эстрадиола и более предпочтительно, чтобы увеличение mRNA казеин-киназы II было бы менее чем около 10% от наблюдаемого для эстрадиола. Наиболее предпочтительно, чтобы немаммотрофический селективный в отношении ERβ лиганд не увеличивал бы заметно mRNA казеин-киназы II (р>0,05) по сравнению с контролем, который лишен маммотрофической активности (например, носитель).
Изобретение также относится к применению селективного в отношении ERβ лиганда в лечении или подавлении артрита, воспалительной болезни кишечника и эндометриоза. Более конкретно, селективные в отношении ERβ лиганды применимы в лечении или подавлении ревматоидного артрита, остеоартрита или спондилоартропатий и болезни Крона, язвенного колита, недетерминантного колита, инфекционного колита или язвенного проктита. Данное изобретение дополнительно относится к применению селективного в отношении ERβ лиганда в лечении или подавлении опухания или эрозии суставов, или в лечении или подавлении поражения сустава после артроскопических или хирургических процедур. Предпочтительно, чтобы селективный в отношении ERβ лиганд был бы неутеротрофическым и немаммотрофическим.
Реагенты, используемые для получения соединений по данному изобретению, могут быть либо коммерчески доступны, либо могут быть получены стандартными процедурами, описанными в литературе.
В другом аспекте данное изобретение относится к способу получения соединения по изобретению, содержащему одно из следующего:
а) взаимодействие соединения формулы
где R1, R2, R2а и Х являются такими, как определено выше, с соединением формулы
где R3 и R3а являются такими, как определено выше, и Y означает галоген, -ОН или алкокси из 1-6 атомов углерода;
или
b) превращение соединения формулы (II), как определено выше, в фармацевтически приемлемую соль его;
или
с) разделение изомерной смеси соединений формулы (II), чтобы изолировать энантиомер соединения формулы (II) или его фармацевтически приемлемой соли.
Соединения по данному изобретению могут быть получены, например, согласно следующим схемам синтеза (I-VIII)
Схема I
На схеме I, коммерчески доступный диметоксианилин 1 обрабатывают коммерчески доступным бензоилхлоридом 2 в присутствии триэтиламина, чтобы получить амид 3. Необходимый бензоилхлорид 2 также получают из коммерчески доступной бензойной кислоты 4 при кипячении с тионилхлоридом с обратным холодильником. Амид 3 превращают в фенольный бензоксазол 5 путем обработки гидрохлоридом пиридина при высокой температуре (200оС).
Схема II
На схеме II, коммерчески доступный нитрофенол 6 подвергают бромированию Br2/NaOAc в уксусной кислоте, чтобы получить бромфенол 7. Каталитическое гидрирование бромфенола 7 с использованием Ra-Ni в EtOAc дает анилин 8. Соединение анилина 8 с бензоилхлоридом 9 (коммерчески доступным или полученным из соответствующей бензойной кислоты и тионилхлорида) в присутствии пиридина дает амид-сложный эфир 10. Превращение соединения 10 в бензоксазол 11 осуществляют в кислотных условиях (п-толуолсульфоновая кислота) при высокой температуре (150°С). Деметилирование соединения 11 трибромидом бора в дихлорметане дает фенольный бензоксазол 12.
Схема III
На схеме III, анилин 8 превращают в бензоксазол 14 при обработке бензойной кислотой 13 и борной кислотой в п-ксилоле при высокой температуре (150°С). Деметилирование соединения 14 трибромидом бора в дихлорметане дает фенольный бензоксазол 15.
Схема IV
На схеме IV, нитрование соединения 16 азотной кислотой в уксусной кислоте дает соединение 17, которое восстанавливают водородом в присутствии Ra-Ni, чтобы получить анилин 18. Анилин 18 превращают в бензоксазол 19 подобно тому, как описано на схеме II, за исключением того, что стадию деметилирования осуществляют с гидрохлоридом пиридина при высокой температуре (200°С).
Схема V
На схеме V, гидроксильные группы бензоксазола 20 защищают либо как простые силил-эфиры 21 (R3=Ме3С(СН3)2Si), используя трет-бутилдиметилсилилхлорид/имидазол/4-диметиламинопиридин в N,N-диметилформамиде, или как сложные эфиры 21 (R3=СН3СО), используя уксусный ангидрид/4-диметиламинопиридин в дихлорметане. Бензоксазолы 20 и 21 соединяют с различными реагентами олова (такими как трибутил(винил)олово, трибутил(аллил)олово, трибутил(2-фурил)олово), бороновыми кислотами или хлоридами цинка в присутствии палладиевого катализатора [напр., дихлор-бис(три-о-толилфосфин)палладия(II) или тетракис(трифенилфосфин)палладия(0)] в п-ксилоле, толуоле, тетрагидрофуране, диметоксиметане или 1,2-диметоксиэтане в присутствии основания (напр., Na2CO3) для реакции соединения с борной кислотой при температурах в пределах от 20°С до 150°С, чтобы получить бензоксазолы 22 и 23.
Удаление защитных групп простого силилового эфира с соединения 22 (R3=Ме3С(СН3)2Si) с помощью фтористоводородной кислоты (48 мас.% в воде) или фторида тетрабутиламмония дает бензоксазол 24. Омыление соединения 22 (R3=СН3СО) с использованием карбоната калия в диоксане дает бензоксазол 24. Бензоксазол 23 (R=СН3) подвергают деметилированию с использованием трибромида бора в дихлорметане или гидрохлорида пиридина при высокой температуре (200°С), чтобы получить бензоксазол 24.
Схема VI
На схеме VI, бензоксазол 24 обрабатывают н-бутиллитием при низких температурах (-78°С) с последующим добавлением электрофила (напр., CNCO2Et, Ph(CH3)NCHO, EtI и т.п.), чтобы получить соединение 25. Удаление защитных групп соединения 25 трибромидом бора (R=СН3) или фторидом тетрабутиламмония (R=Ме3С(СН3)2Si) дает бензоксазол 26 [R=CHO, CO2Et, CH2CH3, C(CH3)2OH].
Третичный спирт 25 (R=С(СН3)ОН) обрабатывают гидрохлоридом пиридина при высокой температуре (200°С), чтобы получить 1-метил-винил-бензоксазол 27. Восстановление соединения 27 Н2/Pd-C дает аналог изопропила 28.
Схема VII
На схеме VII, восстановление бензоксазола 29 боргидридом натрия в метаноле дает спирт 30. Обработка спирта 30 трибромидом бора в CH2Cl2 в течение 1 часа дает бензоксазол 31, тогда как продолжительная (18 часов) обработка дает бромид 32. Бромид 32 превращают в ацетонитрил 33 при обработке цианидом калия и 18-краун-6-простым эфиром в N,N-диметилформамиде.
Схема VIII
На схеме VIII, бромбензоксазол 35 (R=СН3) вначале обрабатывают цианидом меди(I) в ДМФ, чтобы получить соответствующий арил-нитрил, который при обработке трибромидом бора дает бензоксазол 36. Бензоксазол 36 также получают по второму пути синтеза, где бромбензоксазол 35 обрабатывают цианидом цинка в присутствии палладиевого катализатора [например, тетракис(трифенилфосфин)палладия(0)], чтобы получить соответствующий арил-нитрил, который при деметилировании трибромидом бора дает бензоксазол 36. Бензоксазол 35 (R=H) обрабатывают бромидом меди(I) и свежеприготовленным метоксидом натрия в ДМФ, чтобы получить метоксибензоксазол 37. Бромирование бензоксазола 37 N-бромсукцинимидом в ацетонитриле дает монобром-бензоксазол 38 (главный продукт) и дибромбензоксазол 39 (малый продукт).
Стандартные фармакологические тест-процедуры легко доступны для определения профиля активности данного испытуемого соединения. Следующее кратко суммирует некоторые примеры тест-процедур и может включать данные для примеров соединений по изобретению. Все анализы, за исключением анализа связывания радиоактивного лиганда, могут быть использованы для определения активности соединений как агонистов или антагонистов эстрогенного рецептора. Как правило, активность агониста эстрогенного рецептора измеряют, сравнивая активность соединения с эстрогеном, выбранным для сравнения (например, таким как 17β-эстрадиол, 17α-этинил, 17β-эстрадиол, эстрон, диэтилстилбестерол и т.п.). Активность антагониста эстрогенного рецептора обычно измеряют путем совместной обработки испытуемым соединением с эстрогеном сравнения и сравнения результата с результатом, полученным только с эстрогеном сравнения. Стандартные фармакологические тест-процедуры для SERMs также приведены в патентах США 4418068 и 5998402, которые таким образом приобщены к сему ссылкой.
Оценка величин сродства связывания с ERα и ERβ
Примеры образцов по изобретению оценивают по их способности конкурировать с 17β-эстрадиолом за ERα и ERβ в обычном анализе связывания радиоактивного лиганда. Эта тест-процедура обеспечивает методологию определения относительных величин сродства связывания для рецепторов ERα и ERβ. Используемая процедура кратко описана ниже.
Получение экстрактов рецептора для характеристики селективности связывания. Домены связывания лиганда, обычно определяемые здесь как вся последовательность ниже по потоку от домена связывания DNA, получают PCR, используя cDNA полной длины в качестве матриц и праймеров, которые содержат подходящие сайты рестрикции для субклонирования, обеспечивая в то же время подходящую рамку считывания для экспрессии. Указанные матрицы содержат аминокислоты M250-V595 ERα человека [Green, et al., Nature 320: 134-9 (1986)] и M214-О530 ERβ человека [Ogawa, et al., Biochemical & Biophysical Research Communications 243: 122-6 (1998)]. ERβ человека клонируют в pET15b (Novagen, Madison WI) как фрагмент Nco1-BamH1, несущий С-концевой Flag tag. ERα человека клонируют как ERβ, за исключением того, что добавляют N-концевой His tag. Последовательности всех используемых конструктов проверяют установлением полной последовательности обеих нитей.
Клетки BL21(DE3) используют для экспрессии протеинов человека. Обычно 10 мл культуры, выдерженной в течение ночи, используют для инокуляции 1 л культуры среды LB, содержащей 100 мкг/мл ампициллина. После инкубации в течение ночи при 37°С добавляют IPTG до конечной концентрации 1 мМ и продолжают инкубацию при 25°С в течение 2 часов. Клетки собирают центрифугированием (1500 х g) и осадки промывают и повторно суспендируют в 100 мл 50мМ Tris-Cl (pH 7,4), 150 мМ NaCl. Клетки подвергают лизису пропускания дважды через French пресс при 12000 фунтах на кв. дюйм. Лизат осветляют центрифугированием при 12000 х g в течение 30 минут при 4°С и хранят при -70°С.
Оценка экстрактов в отношении специфического связывания [3H]-эстрадиола. Физиологический раствор с фосфатным буфером Dulbecco (Gibco, 1 х конечная концентрация), обогащенный 1 мМ EDTA, используют в качестве буфера для анализа. Чтобы оптимизировать количество рецептора для использования в анализе, [3H]-17β-эстрадиол (New England Nuclear; конечная концентрация = 2 нМ) ± 0,6 мкМ диэтилстилбестрола и 100 мкл различных разбавлений лизата E. coli добавляют в каждую лунку высокосвязывающего маскированного титрационного микропланшета (EG&G Wallac). Конечный объем для анализа равен 120 мкл, и концентрация DMSO ≤1%. После инкубации при комнатной температуре в течение 5-18 часов несвязанный материал отсасывают и планшет промывают три раза приблизительно 300 мкл буфера для анализа. После промывания в лунки добавляют 135 мкл смеси для сцинтилляции (Optiphase Supermix, EG&G Wallac) и планшет герметизируют и встряхивают по меньшей мере 5 минут, чтобы смешать сцинтиллянт с остаточным промывочным буфером. Связанную радиоактивность оценивают путем сцинтилляционного отсчета жидкости (EG&G Wallac Microbeta Plus).
После определения разбавления каждого препарата рецептора, которое обеспечивает максимальное специфическое связывание, анализ далее оптимизируют определением IC50 немеченого 17β-эстрадиола, используя различные разбавления препарата рецептора. Конечное рабочее разбавление для каждого препарата рецептора выбирают такое, где IC50 немеченого 17β-эстрадиола равно 2-4 нМ.
Процедура испытания конкуренции при связывании лиганда. Испытуемые соединения вначале солюбилизируют в DMSO, и конечная концентрация DMSO в анализе связывания равна ≤1%. Восемь разбавлений каждого испытуемого соединения используют в качестве немеченого конкурента для [3H]-17β-эстрадиола. Обычно набор разбавлений соединения испытывают одновременно на ERα и ERβ человека. Результаты наносят на график как измеренный DPM против концентрации испытуемого соединения. Для подбора кривой для реакции на дозу подбирают четырехпараметрическую логистическую модель на преобразованных весовых данных и определяют IC50 как концентрацию соединения, снижающую максимальное связывание [3H]-эстрадиола на 50%.
Величины сродства связывания для ERα и ERβ (которые измеряют по IC50) для типичных примеров по изобретению показаны в таблице (1).
| Таблица 1:Величины сродства связывания ER для типичных соединений по изобретению | ||
| Пример | ER-b IC50 (нМ) | ER-a IC50 (нМ) |
| 1 | 140 | 720 |
| 2 | 963 | 5110 |
| 3 | 66 | 1570 |
| 4 | 239 | 5280 |
| 5 | 59 | 139 |
| 6 | 39 | 843 |
| 7 | 1600 | 5000 |
| 8 | 181 | 2353 |
| 9 | 440 | 1500 |
| 10 | 105 | 2040 |
| 11 | 703 | >5000 |
| 12 | 49 | 1227 |
| 13 | 25 | 190 |
| 14 | 50 | 902 |
| 15 | 3 | 82 |
| 16 | 64 | 1813 |
| 17 | 42 | 1210 |
| 18 | 16 | 464 |
| 19 | 157 | 2765 |
| 20 | 2 | 155 |
| 21 | 3 | 260 |
| 22 | 1 | 47 |
| 23 | 3 | 113 |
| 24 | 6 | 1217 |
| 25 | 2 | 227 |
| 26 | 4 | 474 |
| 27 | 4 | 409 |
| 28 | 25 | 1036 |
| 29 | 155 | 803 |
| 30 | 134 | 3080 |
| 31 | 31 | 352 |
| 32 | 16 | 196 |
| 33 | 31 | 352 |
| 34 | 14 | 1101 |
| 35 | 15 | 481 |
| 36 | 11 | 390 |
| 37 | 79 | 498 |
| 38 | 102 | 1010 |
| 39 | 190 | 7827 |
| 40 | 235 | 1300 |
| 41 | 6 | 411 |
| 42 | 95 | 9620 |
| 43 | 59 | 2557 |
| 44 | 13 | 537 |
| 45 | 84 | 655 |
| 46 | 59 | 2638 |
| 47 | 1340 | Не определено |
| 48 | 40 | 2975 |
| 49 | 1042 | 5230 |
| 50 | 399 | >5000 |
| 51 | 142 | 775 |
| 52 | 82 | 1200 |
| 53 | 166 | 1870 |
| 54 | 135 | 809 |
| 55 | 313 | 1980 |
| 56 | 97 | 1030 |
| 57 | 366 | 1340 |
| 58 | 26 | 1435 |
| 59 | 52 | 2668 |
| 60 | 64 | 559 |
| 61 | 93 | 1180 |
| 62 | 201 | >10000 |
| 63 | 1 | 44 |
| 64 | 3 | 376 |
Результаты, полученные в стандартной фармакологической тест-процедуре, описанной выше, показывают, что соединения по данному изобретению связывают оба подтипа эстрогенного рецептора. Величины IC50 обычно ниже для ERβ, что указывает на то, что эти соединения являются лигандами селективными преимущественно в отношении ERβ, но все еще считаются активными по отношению к ERα. Соединения по данному изобретению будут проявлять диапазон активности на основе, по меньшей мере частично, их профилей селективности сродства к рецептору. Так как соединения по изобретению связывают ERβ с более высоким сродством, чем ERα, они могут быть полезны при лечении или подавлении болезней, которые могут быть регулируемыми посредством ERβ. Дополнительно, так как каждый комплекс рецептора с лигандом является уникальным и, следовательно, его взаимодействие с различными корегуляторными протеинами является уникальным, соединения по данному изобретению будут проявлять различные и непредсказуемые активности в зависимости от клеточного контекста. Например, в некоторых типах клеток возможно, что соединение будет вести себя как агонист эстрогенного рецептора, тогда как в других тканях как антагонист эстрогенного рецептора. Соединения с такой активностью иногда можно отнести к SERM (селективным модуляторам эстрогенного рецептора). В отличие от многих эстрогенов, однако, многие SERM не вызывают увеличений массы влажной матки. Эти соединения являются антиэстрогенными в матке и могут полностью антагонизировать трофические эффекты агонистов эстрогенного рецептора в ткани матки. Эти соединения, однако, действуют как агонисты эстрогенного рецептора в костной, сердечно-сосудистой и центральной нервной системах. Благодаря селективному характеру этих соединений в отношении тканей они применимы для лечения или подавления болезненных состояний или синдромов у млекопитающих, которые вызываются или ассоциируются с недостаточностью эстрогена (в конкретных тканях, таких как костная или сердечно-сосудистая) или с избытком эстрогена (в матке или молочных железах). В дополнение, соединения по данному изобретению также имеют возможность вести себя как агонисты эстрогенного рецептора на одном типе рецептора, в то же время проявляя себя в качестве антагонистов эстрогенного рецептора на другом. Например, продемонстрировано, что соединения могут антагонизировать действие 17β-эстрадиола через ERβ, проявляя в то же время активность агониста эстрогенного рецептора с ERα [Sun, et al., Endocrinology 140: 800-804 (1999)]. Такая активность ERSAA (селективного агониста-антагониста эстрогенного рецептора) обеспечивает различную эстрогенную активность в этих сериях соединений.
Регуляция mRNA металлотионеина II
Эстрогены, действуя через ERβ, но не ERα, могут ап-регулировать уровни mRNA металлотионеина II в клетках Saos-2, как описано Harris [Endocrinology 142: 645-652 (2001)]. Результаты этой тест-процедуры могут быть объединены с результатами тест-процедуры, описанной ниже (ERE-репортерная тест-процедура), чтобы создать профиль селективности для соединений по данному изобретению (смотри также WO 00/37681). Данные для типичных соединений по изобретению показаны в таблице (2).
| Таблица 2:Регуляция mRNAметаллотионеина-II в клетках Saos-2 | |
| Соединение | Кратная регуляция |
| Пример 12 | 9,6 |
| Пример 14 | 12,4 |
| Пример 13 | 9,7 |
Оценка испытуемого соединения в раковых клетках молочной железы MCF-7 с использованием ERE-репортерной тест-процедуры
Исходные растворы испытуемых соединений (обычно 0,1 М) готовят в DMSO и затем разбавляют DMSO в 10-100 раз, чтобы получить рабочие растворы 1 или 10 мМ. Исходные растворы в DMSO хранят либо при 4°С (0,1 М), либо при -20оС (<0,1 М). Клетки MCF-7 пассируют дважды в неделю с ростовой средой [D-MEM/F-12 среда, содержащая 10% (об./об.) инактивированной теплом фетальной телячьей сыворотки, 1% (об./об.) пенициллина-стрептомицина и 2 мМ glutaMax-1]. Клетки поддерживают в вентилируемых склянках при 37°С внутри инкубатора, где 5% СО2/95% влажного воздуха. За сутки до обработки клетки помещают с ростовой средой в 96-луночные планшеты при 25000 клеток/лунка и инкубируют при 37°С в течение ночи.
Клетки инфицируют в течение 2 часов при 37°С 50 мкл/лунка разбавленного 1:10 раствора аденовирусной 5-ERE-tk-люциферазы в экспериментальной среде [среда D-MEM/F без фенольного красного, содержащая 10% (об./об.) инактивированной теплом, десорбированной углем фетальной телячьей сыворотки, 1% (об./об.) пенициллина-стрептомицина, 2 мМ glutaMax-1, 1 мМ пирувата натрия]. Лунки затем промывают один раз 150 мкл экспериментальной среды. И наконец, клетки обрабатывают в течение 24 часов при 37°С в репликатах из 8 лунок/обработка 150 мкл/лунка носителя (≤0,1% об./об. DMSO) или соединением, которое разбавляют в ≥1000 раз в экспериментальной среде.
Начальный скрининг испытуемых соединен