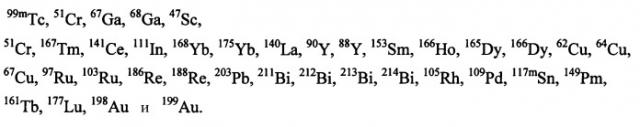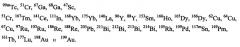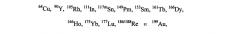Усовершенствованные пептидные соединения, высвобождающие гастрин
Иллюстрации
Показать всеПредложены новые усовершенствованные соединения для применения при диагностической визуализации или терапии, имеющие формулу M-N-O-P-G, где М представляет собой агент, хелатирующий металл (в форме комплекса с металлическим радионуклидом или нет), N-O-P представляет собой линкер, и G представляет собой пептид для целенаправленной доставки к рецептору GRP. Также представлены способы визуализации у пациента с использованием соединений изобретения, способы получения диагностического визуализирующего средства и радиотерапевтического средства. 33 н. и 16 з.п. ф-лы, 51 ил., 8 табл.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет по дате подачи предварительной заявки на патент США № 10/341577 от 13 января 2003 г.
Область изобретения
Настоящее изобретение относится к новым пептидным соединениям, высвобождающим гастрин (GRP), которые можно применять в качестве средств диагностической визуализации или радиотерапевтических средств. Эти соединения GRP метят радионуклидами или метками, выявляемыми световой визуализацией in vivo, и включают применение новых линкеров между меткой и пептидом, обеспечивающим целенаправленную доставку, что обеспечивает улучшенную фармакокинетику.
Предпосылки изобретения
Применение радиофармацевтических препаратов (например, диагностических визуализирующих средств, радиотерапевтических средств) для диагностики и лечения рака хорошо известно. В последние годы открытие направленных на участок поражения радиофармацевтических препаратов для диагностики и/или лечения рака приобрело популярность и продолжает нарастать, по мере того, как специалисты в области медицины лучше понимают специфичность, эффективность и возможность применения таких соединений.
Эти более новые радиофармацевтические средства обычно состоят из агента, обеспечивающего целенаправленную доставку, соединенного с хелатирующим металл агентом, который может образовывать хелатный цикл (например, образовывать комплексы) с диагностическим металлическим радионуклидом, таким как, например, технеций или индий, или терапевтическим металлическим радионуклидом, таким как, например, лютетий, иттрий или рений. Роль агента, хелатирующего металл, состоит в захвате (т.е. хелатировании) металлического радионуклида, по мере того как радиофармацевтическое средство доставляется в желаемый участок. Агент, хелатирующий металл, который непрочно связывается с металлическим радионуклидом, сделал бы радиофармацевтическое средство неэффективным для его желаемого применения, поскольку металлический радионуклид не достиг бы желаемого участка. Таким образом, дальнейшие исследования и разработки привели к открытию агентов, хелатирующих металлы, таких как представлено в патенте США № 5662885, выданном Pollak et al., включенном в настоящее описание в качестве ссылки, которые обладают высоким сродством связывания к металлическим радионуклидам и способностью к конъюгации с агентом, обеспечивающим целенаправленную доставку. В последующем была введена концепция применения "спейсера" для создания физического разделения между агентом, хелатирующим металл, и средством, обеспечивающим целенаправленную доставку, например в патенте США № 5976495, выданном Pollak et al., включенном в настоящее описание в качестве ссылки.
Роль средства, обеспечивающего целенаправленную доставку, ввиду его сродства к определенным участкам связывания является направление диагностического средства, такого как радиофармацевтическое средство, содержащее металлический радионуклид, к желаемому участку для диагностики или лечения. Обычно, средство, обеспечивающее целенаправленную доставку, может включать белок или другую макромолекулу, которая проявляет специфическое сродство к данному рецептору. Другие известные средства, обеспечивающие целенаправленную доставку, включают моноклональные антитела (Mab), фрагменты антител (Fab и (Fab)2) и рецепторно-авидные пептиды Donald J. Buchsbaum, "Cancer Therapy with Radiolabeled Antibodies; Pharmacokinetics of Antibodies and Their Radiolabels; Experimental Radioimmunotherapy and Methods to Increase Therapeutic Efficacy," CRC Press, Boca Raton, Chapter 10, pp. 115-140, (1995); Fischman, et al. "A Ticket to Ride: Peptide Radiopharmaceuticals," The Journal of Nuclear Medicine, vol. 34, No. 12, (Dec. 1993).
В последние годы было установлено, что некоторые раковые клетки содержат рецепторы пептида, высвобождающего гастрин (GRP) (GRP-R), у которых имеется ряд подтипов. В частности, было показано, что несколько типов раковых клеток имеют избыточно экспрессированные или необычно экспрессированные рецепторы GRP. По этой причине было проведено много научных исследований GRP и аналогов GRP, которые связываются с семейством рецепторов GRP. Одним таким аналогом является бомбезин (BBN), пептид из 14 аминокислот (т.е. тетрадекапептид), выделенный из кожи лягушки, который представляет собой аналог человеческого GRP и который связывается с рецепторами GRP с высокой специфичностью и сродством, аналогичным GRP.
Бомбезин и аналоги GRP могут принимать форму агонистов или антагонистов. Связывание агонистов GRP или BBN с рецептором GRP увеличивает скорость клеточного деления этих раковых клеток, и такие агонисты интернализуются клетками, хотя связывание антагонистов GRP или BBN в целом не приводит ни к интернализации клеткой, ни увеличенным скоростям клеточного деления. Такие антагонисты предназначены для полного ингибирования связывания эндогенного GRP с рецепторами GRP и снижения скорости пролиферации раковых клеток (см., например, Hoffken, K.; Peptides in Oncology II, Somatostatin Analogues and Bombesin Antagonists (1993), pp. 87-112). По этой причине проводилась и проводится большая работа, направленная на создание аналогов BBN и GRP, которые являются антагонистами (например, Davis et al., Metabolic Stability and Tumor Inhibition of Bombesin/GRP Receptor Antagonists, Peptides, vol. 13, pp. 401-407, 1992).
При создании эффективного соединения для применения в качестве диагностического или терапевтического средства против рака важно, чтобы препарат имел соответствующие свойства целенаправленной доставки и фармакокинетики in vivo. Например, предпочтительно, чтобы для радиофармацевтического средства меченный радиоактивной меткой пептид имел высокий специфический захват раковыми клетками (например, через рецепторы GRP). Кроме того, также предпочтительно, чтобы после того, как радионуклид локализовался в участке рака, он оставался в нем в течение желаемого количества времени для доставки высоколокализованной дозы облучения к участку.
Более того, создание меченных радиоактивной меткой пептидов, которые эффективно выводятся из нормальных тканей, также является важным фактором для радиофармацевтических средств. Когда биологические молекулы (например, Mab, Fab или пептиды) метятся металлическими радионуклидами (конъюгированным хелатированием) и вводятся животному, такому как человек, то большая процентная доля металлического радионуклида (в любой химической форме) может стать "захваченной" в паренхиме почек или печени (т.е. не выделяется в мочу или желчь). Duncan et al.; Indium-111-Diethylenetriaminepentaacetic Acid-Octreotide Is Delivered in Vivo to Pancreatic, TumorCell, Renal, and Hepatocyte Lysosomes, Cancer Research 57, pp. 659-671, (Feb. 15, 1997). Для малых биологических молекул, меченных радиоактивной меткой (т.е. пептидов или Fab), основным путем выведения активности является выведение через почки, которые также могут удерживать высокие уровни радиоактивного металла (т.е. обычно >10-15% инъецированной дозы). Ясно, что удерживание металлических радионуклидов в почках или печени нежелательно. Напротив, слишком быстрое удаление радиофармацевтического средства из потока крови почками также нежелательно, если требуется более длительная диагностическая визуализация или высокий захват опухолью для лучевой терапии.
В последующей работе, такой как в патенте США № 6200546 и заявке на патент США № 2002/0054855, выданном Hoffman et al., включенном в настоящее описание в качестве ссылки, была предпринята попытка преодолеть эту проблему получением соединения, имеющего формулу X-Y-B, где Х представляет собой группу, способную образовывать комплекс с металлом, Y представляет собой ковалентную связь в спейсерной группе и В представляет собой связывающую часть агониста бомбезина. Сообщалось, что такие соединения имеют высокое сродство связывания с рецепторами GRP, и радиоактивность удерживалась внутри клеток в течение продолжительных периодов времени. Кроме того, исследования in vivo на здоровых мышах показали, что удерживание радиоактивного металла в почках было ниже, чем известно в данной области, причем большая часть радиоактивности выделялась в мочу.
В настоящее время были созданы новые улучшенные радиофармацевтические и другие диагностические соединения с улучшенным выделением почками (т.е. с более низким удерживанием радиоактивного металла в почках) для диагностической визуализации и терапевтических применений. Для диагностической визуализации быстрое выделение почками и низкие удерживаемые уровни радиоактивности имеют решающее значение для улучшенных изображений. Для радиотерапевтического применения решающее значение имеет более медленное выведение из крови для обеспечения возможности более высокого накопления в опухолевой ткани и улучшенной целенаправленной доставки к опухоли при низком удерживании в почках.
Краткое описание изобретения
В одном варианте осуществления настоящего изобретения предоставляются новые улучшенные соединения для применения при диагностической визуализации или лучевой терапии. Соединения включают химическую часть, способную образовывать комплекс с применяемым в медицине ионом металла или радионуклидом (хелатирующим металл), присоединенным к пептиду для целенаправленной доставки к рецептору GPR линкерной или спейсерной группой. В другом варианте осуществления эти соединения включают оптическую метку (например, фотометку или другую метку, выявляемую световой визуализацией, оптико-акустической визуализацией или фотолюминесценцией), присоединенную к пептиду для целенаправленной доставки к рецептору GPR линкерной или спейсерной группой.
В целом, соединения настоящего изобретения могут иметь формулу:
M-N-O-P-G,
где М представляет собой агент, хелатирующий металл (в форме комплекса с радионуклидом или в форме, не образующей комплекс с радионуклидом), или оптическую метку, N-O-P представляет собой линкер, а G представляет собой пептид для целенаправленной доставки к рецептору GPR.
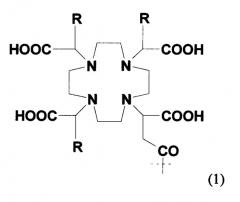
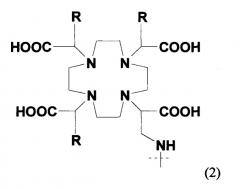
Агент, хелатирующий металл М, может представлять собой любое из агентов, хелатирующих металлы, известных в данной области, для образования комплекса с применяемым в медицине металлом или радионуклидом. Предпочтительные агенты, хелатирующие металлы, включают DTPA, DOTA, DO3A, HP-DO3A, EDTA, TETA, EHPG, HBED, NOTA, DOTMA, TETMA, PDTA, TTHA, LICAM, MECAM или пептиды, образующие хелаты, такие как, например, пептиды, раскрытые в настоящем описании. Агент, хелатирующий металл, может находиться или не находиться в форме комплекса с металлическим радионуклидом и может включать необязательный спейсер, такой как одиночная аминокислота. Предпочтительные металлические радионуклиды для сцинтиграфии или лучевой терапии включают
Выбор металла должен определяться на основании желаемого терапевтического или диагностического применения. Например, для диагностических целей предпочтительные радионуклиды включают 64Cu, 67Ga, 68Ga, 99mTc и 111In, где особенно предпочтительны 99mTc и 111In. Для терапевтических целей предпочтительные радионуклиды включают
где 177Lu и 90Y особенно предпочтительны. Наиболее предпочтительным хелатообразующим агентом, используемым в соединениях изобретения, является 1-замещенная 4,7,10-трикарбоксиметил-1,4,7,10-тетраазациклодекантриуксусная кислота (DO3A).
Оптическая метка М может представлять собой любую из различных оптических меток, известных в данной области. Предпочтительные метки включают без ограничения оптические красители, включая органические хромофоры или флуорофоры, такие как цианиновые красители, поглощающие свет соединения, отражающие и рассеивающие свет соединения и биолюминесцентные молекулы.
В одном варианте осуществления линкер N-O-P содержит, по меньшей мере, одну не альфа-аминокислоту.
В другом варианте осуществления линкер N-O-P содержит, по меньшей мере, одну замещенную желчную кислоту.
В еще одном варианте осуществления линкер N-O-P содержит, по меньшей мере, одну не альфа-аминокислоту с циклической группой.
Пептид для целенаправленной доставки к рецептору GRP может представлять собой GRP, бомбезин или его любые производные или аналоги. В предпочтительном варианте осуществления пептид для целенаправленной доставки к рецептору GRP представляет собой GRP или аналог бомбезина, который действует в качестве агониста. В особенно предпочтительном варианте осуществления пептид для целенаправленной доставки к рецептору GRP представляет собой связывающую часть агониста бомбезина, раскрытую в патенте США № 6200546 и заявке на патент США 2002/0054855, включенных в настоящее описание в качестве ссылки.
Предоставляется также новый способ визуализации с использованием соединений настоящего изобретения.
Набор с одной или несколькими емкостями, который содержит все компоненты, необходимые для получения диагностических или терапевтических средств изобретения, предоставлен в иллюстративном варианте осуществления настоящего изобретения.
Кроме того, предоставляется новый способ получения диагностического визуализирующего средства, включающий стадию добавления к инъецируемой визуализирующей среде вещества, содержащего соединения настоящего изобретения.
Предоставляется также новый способ лучевой терапии с использованием соединений изобретения, как и новый способ получения средства лучевой терапии, включающий стадию добавления к инъецируемой терапевтической среде вещества, включающего соединение изобретения.
Краткое описание чертежей
Фиг.1А представляет собой графическое изображение серии химических реакций для синтеза промежуточного соединения С ((3β,5β)-3-(9Н-флуорен-9-илметокси)аминохолан-24-овой кислоты) из А (метил-(3β,5β)-3-аминохолан-24-ата) и В ((3β,5β)-3-аминохолан-24-овой кислоты), как описано в примере I.
Фиг.1В представляет собой графическое изображение последовательности реакций для синтеза N-[(3β,5β)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]холан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L62), как описано в примере I.
Фиг.2А представляет собой графическое изображение последовательности реакций для синтеза N-[(4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L70), как описано в примере II.
Фиг.2B представляет собой общее графическое изображение последовательности реакций для синтеза N-[4-[2-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]этокси]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L73), N-[3-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L115) и N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]фенилацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L116), как описано в примере II.
Фиг.2С представляет собой химическую структуру линкера, используемого в реакции, показанной на фиг.2В для синтеза N-[4-[2-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]этокси]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L73), как описано в примере II.
Фиг.2D представляет собой химическую структуру линкера, используемого в реакции, показанной на фиг.2В для синтеза N-[3-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L115), как описано в примере II.
Фиг.2Е представляет собой химическую структуру линкера, используемого в реакции, показанной на фиг.2В для синтеза N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]фенилацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L116), как описано в примере II.
Фиг.2F представляет собой графическое изображение последовательности реакций для синтеза N-[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]глицил-4-пиперидинкарбонил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L74), как описано в примере II.
Фиг.3А представляет собой графическое изображение серии химических реакций для синтеза промежуточного соединения (3β,5β)-3-[[(9Н-флуорен-9-илметокси)амино]ацетил]амино-12-оксохолан-24-овой кислоты (С), как описано в примере III.
Фиг.3В представляет собой графическое изображение последовательности реакций для синтеза N-[(3β,5β)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-12,24-диоксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L67), как описано в примере III.
Фиг.3C представляет собой химическую структуру (3β,5β)-3-амино-12-оксохолан-24-овой кислоты (В), как описано в примере III.
Фиг.3D представляет собой химическую структуру (3β,5β)-3-[[(9H-флуорен-9-илметокси)амино]ацетил]амино-12-оксохолан-24-овой кислоты (С), как описано в примере III.
Фиг.3Е представляет собой химическую структуру N-[(3β,5β)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-12,24-диоксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L67), как описано в примере III.
Фиг.4А представляет собой графическое изображение последовательности реакций для получения промежуточных соединений (3β,5β,12α)-3-[[(9Н-флуорен-9-илметокси)амино]ацетил]амино-12-гидроксохолан-24-овой кислоты (3а) и (3β,5β,7α,12α)-3-[[(9Н-флуорен-9-илметокси)амино]ацетил]амино-7,12-дигидроксохолан-24-овой кислоты (3b), как описано в примере IV.
Фиг.4В представляет собой графическое изображение последовательности реакций для синтеза N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-12-гидрокси-24-оксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L63), как описано в примере IV.
Фиг.4C представляет собой графическое изображение последовательности реакций для синтеза N-[(3β,5β,7α,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-7,12-дигидрокси-24-оксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L64), как описано в примере IV.
Фиг.4D представляет собой химическую структуру (3β,5β,7α,12α)-3-амино-7,12-дигидроксихолан-24-овой кислоты (2b), как описано в примере IV.
Фиг.4Е представляет собой химическую структуру (3β,5β,12α)-3-[[(9Н-флуорен-9-илметокси)амино]ацетил]амино-12-гидроксохолан-24-овой кислоты (3а), как описано в примере IV.
Фиг.4F представляет собой химическую структуру (3β,5β,7α,12α)-3-[[(9Н-флуорен-9-илметокси)амино]ацетил]амино-7,12-дигидроксохолан-24-овой кислоты (3b), как описано в примере IV.
Фиг.4G представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-12-гидрокси-24-оксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L63), как описано в примере IV.
Фиг.4H представляет собой химическую структуру N-[(3β,5β,7α,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-7,12-дигидрокси-24-оксохолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L64), как описано в примере IV.
Фиг.5А представляет собой общее графическое изображение последовательности реакций для синтеза 4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]бензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L71) и транс-4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]циклогексилкарбонил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L72), как описано в примере V, где линкер представлен на фиг.5В и 5С, соответственно.
Фиг.5В представляет собой химическую структуру линкера, используемого в соединении L71, как показано на фиг.5А и как описано в примере V.
Фиг.5С представляет собой химическую структуру линкера, используемого в соединении L72, как показано на фиг.5А и как описано в примере V.
Фиг.5D представляет собой химическую структуру амидной смолы Ринка, функционализированной бомбезином [7-14] (B), как описано в примере V.
Фиг.5Е представляет собой химическую структуру транс-4-[[[(9H-флуорен-9-илметокси)карбонил]амино]метил]циклогексанкарбоновой кислоты (D), как описано в примере V.
Фиг.6А представляет собой графическое изображение последовательности реакций для синтеза промежуточного линкера 2-[[[9H-флуорен-9-илметокси)карбонил]амино]метил]бензойной кислоты (Е), как описано в примере VI.
Фиг.6В представляет собой графическое изображение последовательности реакций для синтеза промежуточного линкера 4-[[[9H-флуорен-9-илметокси)карбонил]амино]метил]-3-нитробензойной кислоты (Н), как описано в примере VI.
Фиг.6С представляет собой общее графическое изображение синтеза N-[2-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L75), как описано в примере VI.
Фиг.6D представляет собой общее графическое изображение синтеза N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]-3-нитробензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L76), как описано в примере VI.
Фиг.7А представляет собой графическое изображение последовательности реакций для синтеза промежуточного линкера [4-[[[9H-флуорен-9-илметокси)карбонил]амино]метил]фенокси]уксусной кислоты (Е), как описано в примере VII.
Фиг.7В представляет собой графическое изображение синтеза N-[[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]фенокси]ацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L124), как описано в примере VII.
Фиг.7C представляет собой химическую структуру N-[[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]фенокси]ацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L124), как описано в примере VII.
Фиг.8А представляет собой графическое изображение последовательности реакций для синтеза промежуточного соединения [4-[[[9H-флуорен-9-илметокси)карбонил]амино]метил]-3-метоксибензойной кислоты (Е), как описано в примере VIII.
Фиг.8В представляет собой графическое изображение синтеза N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]-3-метоксибензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L125), как описано в примере VIII.
Фиг.8C представляет собой химическую структуру N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]метил]-3-метоксибензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L125), как описано в примере VIII.
Фиг.9А представляет собой графическое изображение реакций для синтеза 3-[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]аминобензойной кислоты, (В), как описано в примере IX.
Фиг.9В представляет собой графическое изображение реакций для синтеза 6-[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]аминобензойной кислоты, (С), как описано в примере IX.
Фиг.9С представляет собой графическое изображение реакций для синтеза 4-[[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]метиламино]бензойной кислоты, (D), как описано в примере IX.
Фиг.9D представляет собой графическое изображение реакций для синтеза N-[4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]фенилацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L146); N-[3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L233); N-[6-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]нафтоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L234) и N-[4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]метиламино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L235), как описано в примере IX.
Фиг.10А представляет собой графическое изображение реакций для синтеза 4,10-бис(1,1-диметилэтилового) эфира 7-[[бис(1,1-диметилэтокси)фосфинил]метил]-1,4,7,10-тетраазациклододекан-1,4,10-триуксусной кислоты Н, как описано в примере X.
Фиг.10В представляет собой графическое изображение реакций для синтеза N-[4-[[[[[4,10-бис(карбоксиметил)-7-(дигидроксифосфинил)метил-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]ацетил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L237), как описано в примере X.
Фиг.11А представляет собой графическое изображение реакций для синтеза N,N-диметилглицил-L-серинил-[S-[(ацетиламино)метил]]-L-цистениилглицил-4-аминобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L238), как описано в примере XI.
Фиг.11В представляет собой графическое изображение реакций для синтеза N,N-диметилглицил-L-серинил-[S-[(ацетиламино)метил]]-L-цистениилглицил-(3β,5β,7α,12α)-3-амино-7,12-дигидрокси-24-оксохолан-24-ил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L239), как описано в примере XI.
Фиг.12А представляет собой графическое изображение реакции для синтеза 4-[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]амино-3-метоксибензойной кислоты (А), как описано в примере XII.
Фиг.12B представляет собой графическое изображение реакции для синтеза 4-[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]амино-3-хлорбензойной кислоты (D), как описано в примере XII.
Фиг.12C представляет собой графическое изображение реакции для синтеза 4-[[[(9H-флуорен-9-илметокси)карбонил]амино]ацетил]амино-3-метилбензойной кислоты (Е), как описано в примере XII.
Фиг.12D представляет собой химическую структуру N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]глицил]амино]-3-метоксибензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L240), как описано в примере XII.
Фиг.12E представляет собой химическую структуру N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]глицил]амино]-3-хлорбензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L241), как описано в примере XII.
Фиг.12F представляет собой химическую структуру N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]глицил]амино]-3-метилбензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L240), как описано в примере XII.
Фиг.13А представляет собой графическое изображение реакции для синтеза 4-[N,N'-бис[2-[(9H-флуорен-9-илметокси)карбонил]аминоэтил]амино]-4-оксобутановой кислоты (D), как описано в примере XIII.
Фиг.13В представляет собой графическое изображение реакции для синтеза N-[4-[[4-[бис[2-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]этил]амино-1,4-диоксибутил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L244), как описано в примере XIII.
Фиг.13C представляет собой химическую структуру соединения L244, как описано в примере XIII.
Фиг.14А и Фиг.14В представляют собой графическое изображение кривых связывания и конкуренции, как описано в примере XLIII.
Фиг.15А представляет собой графическое изображение результатов экспериментов лучевой терапии, описанных в примере LV.
Фиг.15В представляет собой графическое изображение результатов других экспериментов лучевой терапии, описанных в примере LV.
Фиг.16 представляет собой химическую структуру N-[4-[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]глицил]амино]-L-лизинил-(3,6,9)-триоксаундекан-1,11-дикарбоновая кислота-3,7-дидеокси-3-аминохолевая кислота)-L-аргинил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L65).
Фиг.17 представляет собой химическую структуру N-[2-S-[[[[[12α-гидрокси-17α-(1-метил-3-карбоксипропил)этиохолан-3β-карбамоилметоксиэтоксиэтоксиацетил]амино-6-[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]гексаноил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L66).
Фиг.18А представляет собой химическую структуру N-[4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L70).
Фиг.18В представляет собой химическую структуру N-[4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]-3-карбоксипропионил]амино]ацетил]амино]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L114).
Фиг.18С представляет собой химическую структуру N-[4-[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]-2-гидрокси-3-пропокси]бензоил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L144).
Фиг.18D представляет собой химическую структуру N-[(3β,5β,7α,12α)-3-[[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]этоксиэтокси]ацетил]амино]-7,12-дигидроксихолан-24-ил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L69).
Фиг.18Е представляет собой химическую структуру N-[4-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]фенилацетил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L146).
На фиг.19 раскрыты химические структуры промежуточных соединений, которые можно использовать для получения соединений L64 и L70, как описано в примере LVI.
Фиг.20 представляет собой графическое изображение получения L64 с использованием сегментного связывания, как описано в примере LVI.
Фиг.21 представляет собой графическое изображение получения (1R)-1-(бис{2-[бис(карбоксиметил)амино]этил}амино)пропан-3-карбоновая кислота-1-карбоксилглицил-4-аминобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L201).
Фиг.22А представляет собой графическое изображение химической структуры промежуточных соединений, используемых для получения L202.
Фиг.22В представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-4-гидразинобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L202).
Фиг.23А представляет собой графическое изображение химической структуры промежуточных соединений, используемых для получения L203.
Фиг.23В представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]-4-аминобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L203).
Фиг.24 представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]-4-аминобензоилглицил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L204).
Фиг.25 представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]-4-аминобензоилглицил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L205).
Фиг.26А представляет собой графическое изображение химических структур промежуточных соединений, используемых для получения L206.
Фиг.26В представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-[4'-амино-2'-метилбифенил-4-карбоксил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L206).
Фиг.27А представляет собой графическое изображение химических структур промежуточных соединений, используемых для получения L207.
Фиг.27В представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-[3'-аминобифенил-3-карбоксил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L207).
Фиг.27В представляет собой графическое изображение получения N-[(3β,5β,12α)-3-[[[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]ацетил]амино]-[1,2-диаминоэтилтерефталил]-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L208).
Фиг.29А представляет собой графическое изображение химических структур промежуточных соединений, используемых для получения L209.
Фиг.29В представляет собой графическое изображение получения L209.
Фиг.30А представляет собой графическое изображение химических структур промежуточных соединений, используемых для получения L210.
Фиг.30В представляет собой химическую структуру L210.
Фиг.31 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицилглицил-4-аминобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L211).
Фиг.32 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутамил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида (L212).
Фиг.33 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинкарбоксилата L213.
Фиг.34 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-D-фенилаланил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида L214.
Фиг.35 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутаминил-L-аргинил-L-лейцилглицил-L-аспаргинил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида L215.
Фиг.36 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутаминиларгинил-L-тирозинилглицил-L-аспаргинил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида L216.
Фиг.37 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутаминил-L-лизил-L-тирозинилглицил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейцил-L-метионинамида L217.
Фиг.38 представляет собой химическую структуру L218.
Фиг.39 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-D-фенилаланил-L-глутаминил-L-триптофил-L-аланил-L-валилглицил-L-гистидил-L-лейциламинопентинила, L219.
Фиг.40 представляет собой химическую структуру N-[(3β,5β,12α)-3-[[[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододец-1-ил]ацетил]амино]глицил-4-аминобензоил-L-глутаминил-L-триптофил-L-серенил-L-валил-D-аланил-L-гистидил-L-лейцил-L-метионинамида, L220.
Фиг.41 представляет собой химическую структуру N-[(3β,5β,12α)