Селективные обратные агонисты серотонин 2а/2с рецептора, применяемые в качестве лекарственных средств при нейродегенеративных заболеваниях
Иллюстрации
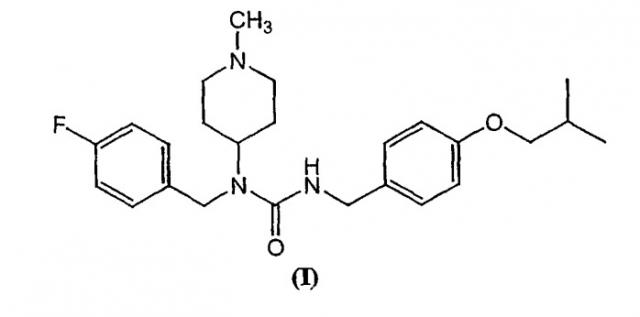
Показать всеИзобретение относится к соединению, имеющему структуру формулы (I)
или к его тартратной соли. Изобретение также относится к применению и композиции, а также к способу ингибирования активации моноаминового рецептора, обратному агонисту, и к анти-дискинезийному агенту в комбинации с обратным агонистом. Технический результат - получение нового биологически активного соединения, обладающего активностью обратного агониста серотониновых рецепторов. 24 н. и 30 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Данное изобретение относится к терапевтическому применению N-(1-метилпиперидин-4-ил)-N-(4-фторфенилметил)-N'-(4-(2-метилпропилокси)фенилметил)карбамида и родственных обратных агонистов 2А/2С рецептора для лечения различных нейродегенеративных заболеваний у человека, включая болезнь Паркинсона, болезнь Хантингтона, деменция Леви и болезнь Альцгеймера. Конкретно, данные агенты улучшают двигательную функцию при болезни Паркинсона и болезни Хантингтона. Конкретно, N-(1-метилпиперидин-4-ил)-N-(4-фторфенилметил)-N'-(4-(2-метилпропилокси)фенилметил)карбамид и родственные соединения могут применяться для контроля поведенческих и нейропсихиатрических проявлений, присутствующих при всех указанных заболеваниях. Также описаны фармацевтические композиции, содержащие сочетание N-(1-метилпиперидин-4-ил)-N-(4-фторфенилметил)-N'-(4-(2-метилпропилокси)фенилметил)карбамида и существующих терапевтических агентов.
Уровень техники
Нейродегенеративные нарушения (НН) представляют собой группу заболеваний человека, которые имеют общий патофизиологический признак, прогрессивное разрушение отдельных популяций нейронов с течением времени. Эти нейродегенеративные заболевания включают без ограничения болезнь Альцгеймера и родственные деменции, болезнь Паркинсона, болезнь Хантингтона, болезнь Леви и родственные нарушения движения, и атаксию Фридриха и родственные спинально-церебеллярные атаксии. Каждое из этих заболеваний имеет уникальные клинические аспекты, включая возраст наступления, время развития, неврологические признаки и симптомы, нейропсихиатрические симптомы и чувствительность к известным терапевтическим агентам. Кроме того, патофизиологическая основа каждого из этих заболеваний вызывается генетическими механизмами, уникальными для каждого заболевания.
Несмотря на значительный прогресс в разъяснении генетических причин, лежащих в основе указанных различных заболеваний, относительно мало известно о биохимических механизмах, которые вызывают селективную дегенерацию нейронов, общую для всех них. Кроме того, в большинстве этих заболеваний, включая болезнь Паркинсона и болезнь Альцгеймера, были определены генетические факторы, которые вызывают редкие семейные формы этих заболеваний, но патофизиологический базис большинства спорадических причин еще неизвестен. По этой причине в настоящее время не существует никаких специфических терапевтических агентов, которые могут непосредственно модифицировать развитие заболевания. Вместо этого клиницисты применяют множество существующих агентов для получения симптоматического облегчения двигательных, познавательных и нейропсихиатрических проявлений, которые характеризуют эти заболевания. Ни один из существующих агентов не был создан и разработан специально для лечения пациентов с НН.
Среди различных неврологических симптомов, которые характеризуют НН, такие как аномалии двигательных функций, включая брадикинезии, дискинезии и хорею, и появление нейропсихиатрических симптомов, включая психоз, и аффективных симптомов, таких как тревога и депрессия, часто и тяжело нарушают функциональный статус пациента и качество жизни. К сожалению, большинство из существующих терапевтических агентов, включая нейролептики и антидепрессанты, часто обладают действием, плохо переносимым пациентами. Кроме того, доступные терапевтические агенты для болезни Паркинсона, включая L-допа и агонисты допамина, хотя и обычно эффективные, вызывают появление тяжелых, ограничивающих лечение побочных эффектов, которые в настоящее время трудноизлечимы фармакотерапевтически.
Множество факторов, связанные как с болезнью, так и с лекарствами, в первую очередь ответственны за ограниченную восприимчивость к этим агентам. Во-первых, пациенты с нейродегенеративными заболеваниями особенно чувствительны к большинству терапевтических агентов, которые преодолевают гематоэнцефалический барьер и взаимодействуют с нейронными мишенями, что и создает воздействие на побочные моторные или нейропсихиатрические симптомы. Например, атипичные нейролептики обычно хорошо переносятся здоровыми добровольцами, или пациентами с первичными психиатрическими заболеваниями, такими как шизофрения; где состояние мозга не характеризуется дегенерацией нейронов. Наоборот, если эти агенты вводить пациентам с болезнью Паркинсона или Хантингтона, они вызывают тяжелые, ограничивающие лечение побочные эффекты в двигательной функции, вызывают тяжелую седацию и могут ухудшить познавательную функцию. Прямое влияние характеристик потери нейронов при НН и адаптивные изменения, которые возникают вторично к первым, стоят в основе возникновения нейрохимического и/или нейрофизиологического состояния у пациентов с НН, которое вызывает такую чрезмерную чувствительность.
Во-вторых, известные механизмы действия указанных лекарственных средств, включая антагонизм к допаминовым рецепторам, не переносятся некоторыми пациентами, вторичными к определенным изменениям в определенной нейронной системе. Например, у пациентов, страдающих болезнью Паркинсона, наблюдается относительно селективная дегенерация восходящей допаминергической нейронной системы, и, как следствие, у них наблюдается дефицит центральной допаминовой нейротрансмиссии. Поэтому неудивительно, что лекарства, которые еще больше ослабляют допаминергическую нейротрансмиссию путем блокирования допаминовых рецепторов, плохо переносятся.
Наконец, практически все современные известные терапевтические агенты не имеют специфичности в механизмах действия. Нейролептики и антидепрессанты обладают множеством фармакологически родственных взаимодействий с критическими белками нейронов, включая главные рецепторы поверхности клеток, ионные каналы и транспортеры обратного захвата. Отсутствие специфичности мишени лекарственного средства вызывает множество побочных эффектов у пациентов, не страдающих НН, которые количественно и качественно хуже у пациентов, страдающих НН.
Данные наблюдения показали необходимость в разработке новых терапевтических агентов, которые специально разработаны не только для эффективного воздействия на эти определенные инвалидизирующие симптомы, но также переносятся конкретными пациентами, страдающими такими заболеваниями. Это может быть достигнуто улучшением селективности взаимодействия новых терапевтических агентов с мишенями лечения.
Конкретно, развитие агентов с новыми механизмами действия, которые позволяют при желании избежать известные "подводные камни" существующих агентов. Кроме того, улучшенная селективность позволяет избежать известных побочных эффектов, связанных с взаимодействием с не эффективными имеющимися лекарственными мишенями.
Краткое описание фигур.
На фиг.1 показаны графики активности агонистов D2 и 5-НТ2А рецепторов терапевтических средств для лечения болезни Паркинсона, определенной с помощью физиологически предсказуемого клеточного in vivo исследования R-SAT. На фиг.1А показан график воздействия лекарства на D2 рецепторы человека. На фиг. 1В показан график воздействия лекарства на серотониновые 2А рецепторы человека.
На фиг 2А показан график эффективности соединении формулы (I) в снижении локомоторных проявлений, вызванных МК-801, у крыс по сравнению с контрольной группой после подкожного введения в течение десяти (10) минут. На фиг.2В представлен график эффективности соединения формулы (I) в снижении локомоторных проявлений, вызванных МК-801, у крыс по сравнению с контрольной группой после перорального введения в течение тридцати (30) минут.
На фиг.3 показана столбиковая диаграмма, которая показывает три уровня дозирования соединения формулы (I) и действие каждой дозы на снижение дискинезии у приматов (модель).
На фиг.4 показано воздействие соединения формулы (I) на вызванную амфетамином гиперактивность у мышей, при применении в сочетании с различными дозами галоперидола.
Сущность изобретения
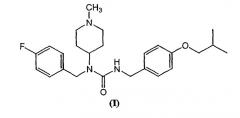
Описана композиция, содержащая соединение формулы (I):
и фармацевтически приемлемый носитель. В некоторых вариантах композиция также содержит дополнительный терапевтический агент. В некоторых вариантах дополнительный терапевтический агент выбирают из леводопы (SINEMET™, SINEMET-CR™), бромокриптина (PARLODEL™), перголида (PERMAX™), сульфата эфенедрина (EPHEDRINE™), пемолина (CYLERT™), мазиндола (SANOREX™), d,l--метилфенетиламина (ADDERALL™), метилфенидата (RITALIN™), прамипексола (MIRAPEX™), модафинила (PROVIGIL™) и ропинирола (REQUIP™). В других вариантах, дополнительный терапевтический агент представляет собой анти-дискинезийный агент, выбранный из баклофена (Lioresal™), токсина ботулина (Botox™), клоназепама (Klonopin™) и диазепама (Valium™). В других вариантах, дополнительный терапевтический агент представляет собой антидистонийный, антимиоклонический или антитреморный агент, выбранный из баклофена (LIORESAL™), токсина ботулина (BOTOX™), клоназепама (KLONOPIN™) и диазепама (VALIUM™). В других вариантах дополнительный терапевтический агент представляет собой нейролептик с антагонизмом к допаминергическому рецептору. В другом варианте дополнительный терапевтический агент представляет собой нейролептик, выбранный из хлорпромазина (THORAZINE™), галоперидола (HALDOL™), молиндона (MOBAN™), тиоридазина (MELLARIL™), фенотиазина, бутирофенона, дифенилбутилпиперинда (пимозид), тиоксантинов (флуфентиксол), замещенных бензамидов (сульпирид), сертиндола, амисульприда, рисперидона, клозапина, оланзапина, зипразидона, арипипразола и их активных метаболитов (N-десметилклозапин, N-десметилоланзапин, 9-ОН-рисперидон).
Также описан способ лечения нейродегенеративных заболеваний, предусматривающий идентификацию пациента, страдающего нейродегенеративным заболеванием, и введение пациенту эффективного количества обратного агониста, селективного к рецептору серотонину; где снижается дискинезия, связанная с допаминергической терапией. В некоторых вариантах нейродегенеративным заболеванием является болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, спинально-церебеллярная атрофия, синдром Туретта, атаксия Фридриха, болезнь Мачадо-Джозефа, деменция Леви, дистония, прогрессирующий супрануклеарный паралич или лобно-височная деменция. В одном варианте рецептором серотонина является 5НТ2А рецептор. В другом варианте рецептором серотонина является 5НТ2С рецептор. В некоторых вариантах обратный агонист связывается с 5НТ2А рецептором или 5НТ2С рецептором. В некоторых вариантах обратным агонистом является соединение формулы (I). Один из вариантов также включает введение допаминергического агента в сочетании с соединением формулы (I). В некоторых вариантах реагент повышает допаминергическое действие и его выбирают из группы, включающей леводопу, SINAMET™, SINAMETCR™, бромокриптин (RARLODEL™), перголид (PERMAX™), сульфат эфенедрина (EPHEDRINE™), пемолин (CYLERT™), мазиндол (SANOREX™), d,l--метилфенетиламин (ADDERALL™), метилфенидат (RITALIN™), прамипексол (MIRAPEX™), модафинил (PROVIGIL™) и ропинирол (REQUIP™).
Также описан способ лечения дискинезии, вызванной допаминергической терапией, предусматривающий идентификацию пациента, страдающего дискинезией, вызванной допаминергической терапией, и введение пациенту эффективного количества обратного агониста, селективного к рецептору серотонину; где снижается дискинезия, вызванная допаминергической терапией. В одном варианте рецептором серотонина является 5НТ2А рецептор. В другом варианте рецептором серотонина является 5НТ2С рецептор. В некоторых вариантах обратный агонист связывается с 5НТ2А рецептором или 5НТ2С рецептором. В некоторых вариантах, обратным агонистом является соединение формулы (I). Один из вариантов также включает введение антидискинезийного агента в сочетании с соединением формулы (I). В некоторых вариантах антидискинезийный агент выбирают из группы, включающей баклофен (LIORESAL™), токсин ботулина (BOTOX™), клоназепам (KLONOPIN™) и диазепам (VALIUM™). В некоторых вариантах пациент страдает нейродегенеративным заболеванием, которое выбирают из группы, включающей болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, спинально-церебеллярную атрофию, синдром Туретта, атаксию Фридриха, болезнь Мачадо-Джозефа, деменцию Леви, дистонию, прогрессирующий супрануклеарный паралич или лобно-височную деменцию.
Также описан способ лечения дистонии, миоклонуса или дрожания, вызванных допаминергической терапией, предусматривающий идентификацию пациента, страдающего дистонией, миоклонусом или дрожанием, вызванными допаминергической терапией, и введение пациенту эффективного количества обратного агониста, селективного к рецептору серотонину; где уменьшается дистония, миоклонус или дрожание, вызванные допаминергической терапией. В одном варианте рецептором серотонина является 5НТ2А рецептор. В другом варианте, рецептором серотонина является 5НТ2С рецептор. В некоторых вариантах обратный агонист связывается с 5НТ2А рецептором или 5НТ2С рецептором. В некоторых вариантах обратным агонистом является соединение формулы (I). Один из вариантов также включает введение антидистонического, антимиоклонального или антитреморного агента в сочетании с соединением формулы (I). В некоторых вариантах антидистонический, антимиоклональный или антитреморный агент выбирают из группы, включающей баклофен (LIORESAL™), токсин ботулина (BOTOX™), клоназепам (KLONOPIN™) и диазепам (VALIUM™).
Также описан способ лечения психоза, вызванного допаминергической терапией, предусматривающий идентификацию пациента, страдающего психозом, вызванным допаминергической терапией, и введение пациенту эффективного количества обратного агониста, селективного к рецептору серотонину; где снижается психоз, вызванный допаминергической терапией. В одном варианте рецептором серотонина является 5НТ2А рецептор. В другом варианте рецептором серотонина является 5НТ2С рецептор. В некоторых вариантах обратный агонист связывается с 5НТ2А рецептором или 5НТ2С рецептором. В некоторых вариантах, обратным агонистом является соединение формулы (I). Один из вариантов также включает введение нейролептического агента в сочетании с соединением формулы (I). В некоторых вариантах нейролептический агент выбирают из группы, включающей хлорпромазин (THORAZINE™), галоперидол (HALDOL™), молиндон (MOBAN™), тиоридазин (MELLARIL™), фенотиазин, бутирофенон, дифенилбутилпиперинд (пимозид), тиоксантины (флуфентиксол), замещенные бензамиды (сульпирид), сертиндол, амисульприд, рисперидон, клозапин, оланзапин, зипразидон, арипипразол и их активные метаболиты (N-десметилклозапин, N-десметилоланзапин, 9-ОН-рисперидон). В некоторых вариантах пациент страдает нейродегенеративным заболеванием, которое выбирают из группы, включающей болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, спинально-церебеллярную атрофию, синдром Туретта, атаксию Фридриха, болезнь Мачадо-Джозефа, деменцию Леви, дистонию, прогрессирующий супрануклеарный паралич или лобно-височную деменцию.
Также описан способ лечения нейропсихиатрических заболеваний, предусматривающий идентификацию пациента, страдающего нейропсихиатрическим заболеванием; и введение пациенту эффективного количества обратного агониста, селективного к рецептору серотонину. В некоторых вариантах нейропсихиатрическое заболевание выбирают из группы, включающей шизофрению, шизоаффективные нарушения, манию, нарушения поведения, связанные со слабоумием и психотической депрессией. В одном варианте рецептором серотонина является 5НТ2А рецептор. В другом варианте рецептором серотонина является 5НТ2С рецептор. В некоторых вариантах обратный агонист связывается с 5НТ2А рецептором или 5НТ2С рецептором. В некоторых вариантах обратным агонистом является соединение формулы (I). Один из вариантов также включает введение нейролептического агента в сочетании с обратным агонистом, где нейролептический агент выбирают из группы, включающей хлорпромазин (THORAZINE™), галоперидол (HALDOL™), молиндон (MOBAN™), тиоридазин (MELLARIL™), фенотиазин, бутирофенон, дифенилбутилпиперинд (пимозид), тиоксантины (флуфентиксол), замещенные бензамиды (сульпирид), сертиндол, амисульприд, рисперидон, клозапин, оланзапин, зипразидон, арипипразол и их активные метаболиты (N-десметилклозапин, N-десметилоланзапин, 9-ОН-рисперидон).
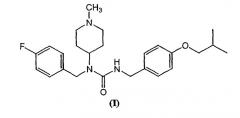
Также описано соединение, имеющее структуру формулы (I)
Также описан способ ингибирования активности моноаминового рецептора, предусматривающий взаимодействие моноаминового рецептора или системы, содержащей моноаминовый рецептор, с количеством соединения формулы (I), которое является эффективным для ингибирования активности моноаминового рецептора. В некоторых вариантах моноаминовым рецептором является рецептор серотонина. В одном из вариантов рецептором серотонина является 5-НТ2А подкласс. В некоторых вариантах рецептор серотонина находится в центральной нервной системе. В некоторых вариантах рецептор серотонина находится в периферической нервной системе. В некоторых вариантах рецептор серотонина находится в клетках крови или тромбоцитах. В некоторых вариантах рецептор серотонина мутирован или модифицирован. В некоторых вариантах активность представляет собой сигнальную активность. В некоторых вариантах активность является конститутивной. В некоторых вариантах активность связана с активацией рецептора серотонина.
Также описан способ ингибирования активации моноаминового рецептора, предусматривающий взаимодействие моноаминового рецептора или системы, содержащей моноаминовый рецептор, с таким количеством соединения формулы (I), которое является эффективным для ингибирования активации моноаминового рецептора. В некоторых вариантах активация происходит с помощью агонистического агента. В некоторых вариантах агонистический агент является экзогенным. В некоторых вариантах агонистический агент является эндогенным. В некоторых вариантах активация является конститутивной. В некоторых вариантах моноаминовым рецептором является рецептор серотонина. В одном из вариантов рецептором серотонина является 5-НТ2А подкласс. В некоторых вариантах рецептор серотонина находится в центральной нервной системе. В некоторых вариантах рецептор серотонина находится в периферической нервной системе. В некоторых вариантах рецептор серотонина находится в клетках крови или тромбоцитах. В некоторых вариантах рецептор серотонина мутирован или модифицирован.
Также описан способ лечения болезненного состояния, связанного с моноаминовым рецептором, предусматривающий введение пациенту, при необходимости такого лечения, терапевтически эффективного количества соединения формулы (I). В некоторых вариантах болезненное состояние выбирают из группы, включающей шизофрению, психоз, мигрень, гипертензию, тромбоз, спазм сосудов, ишемию, депрессию, тревогу, нарушения сна и нарушения аппетита. В некоторых вариантах болезненное состояние связано с дисфункцией моноаминового рецептора. В некоторых вариантах болезненное состояние связано с активацией моноаминового рецептора. В некоторых вариантах болезненное состояние связано с повышенной активностью моноаминового рецептора. В некоторых вариантах моноаминовым рецептором является рецептор серотонина. В одном из вариантов рецептором серотонина является 5-НТ2А подкласс. В некоторых вариантах рецептор серотонина находится в центральной нервной системе. В некоторых вариантах рецептор серотонина находится в периферической нервной системе. В некоторых вариантах рецептор серотонина находится в клетках крови или тромбоцитах. В некоторых вариантах рецептор серотонина мутирован или модифицирован.
Также описан способ лечения шизофрении, предусматривающий введение пациенту, при необходимости такого лечения, терапевтически эффективного количества соединения формулы (I).
Также описан способ лечения мигрени, предусматривающий введение пациенту, при необходимости такого лечения, терапевтически эффективного количества соединения формулы (I).
Также описан способ лечения психоза, предусматривающий введение пациенту, при необходимости такого лечения, терапевтически эффективного количества соединения формулы (I).
Также описан способ идентификации генетического полиморфизма, предрасполагающего пациента к реакции на соединение формулы (I), предусматривающий введение пациенту терапевтически эффективного количества указанного соединения; определение реакции указанного пациента на указанное соединение, тем самым, идентифицируя чувствительных пациентов, имеющих улучшенное болезненное состояние, связанное с моноаминовым рецептором; и идентифицируя генетический полиморфизм у чувствительного пациента, где генетический полиморфизм предрасполагает пациента к чувствительности к указанному соединению. В некоторых вариантах улучшенное болезненное состояние связано с 5-НТ классом или 5-НТ2А подклассом моноаминергических рецепторов.
Также описан способ идентификации пациента, подходящего для лечения соединением по п.48, предусматривающий определение присутствия полиморфизма у пациента, где полиморфизм предрасполагает пациента к чувствительности к соединению и где присутствие полиморфизма указывает на то, что пациент подходит для лечения соединением формулы (I).
Подробное описание предпочтительных вариантов
Определения
В целях данного изобретения следующие определения в их полном смысле применяются для определения технических терминов, а также, в их полном смысле, применяются для определения объема данного изобретения, для которого испрашивается защита в формуле изобретения.
"Конститутивная активность" определяется как повышенная основная активность рецептора, которая не зависит от присутствия агониста. Конститутивная активность рецептора может быть определена с применением множества различных методов, включая клеточные (например, мембранные) препараты (см., например, Barr & Manning, J. Biol. Chem. 272:32979-87 (1997)), очищенные восстановленные рецепторы с или без связанного G-белка в фосфолипидных везикулах (Cerion et al., Biochemistry 23:4519-25 (1984)) и функциональные клеточные исследования (заявка на патент США № 60/103317) или любой другой метод, известный в данной области техники.
"Агонист" определяется как соединение, которое повышает основную активность рецептора при контакте с рецептором.
"Антагонист" определяется как соединение, которое конкурирует с агонистом или обратным агонистом в связывании с рецептором, тем самым блокируя действие агониста или обратного агониста на рецептор. Однако антагонист (также известный как "нейтральный" антагонист) не оказывает воздействия на конститутивную активность рецептора.
"Обратный агонист" определяется как соединение, которое снижает основную активность рецептора (т.е. сигнал, опосредованный рецептором). Такие соединения также известны как отрицательные антагонисты. Обратный агонист представляет собой лиганд для рецептора, который заставляет рецептор принимать неактивное состояние относительно основного состояния, имеющего место при отсутствии какого-либо лиганда. Таким образом, в то время как антагонист может ингибировать активность агониста, обратный агонист представляет собой лиганд, который может изменять конформацию рецептора в отсутствие агониста. Концепция обратного агониста изложена в Bond et al., Nature 374:272 (1995). Более конкретно, в Bond et al. выдвинуто предположение, что не содержащий лигандов 2-адренорецептор существует в равновесии между неактивной конформацией и спонтанно активной конформацией. Агонисты предложены для стабилизации рецептора в активной конформации. Наоборот, полагают, что обратные агонисты стабилизируют неактивную конформацию рецептора. Таким образом, в то время как антагонист проявляет свою активность посредством ингибирования агониста, обратный агонист может дополнительно проявлять активность в отсутствие агониста путем ингибирования спонтанного превращения, не содержащего лиганд рецептора в активную конформацию.
"5-НТ2А рецептор" определяется как рецептор, имеющий активность, соответствующую активности подтипа рецептора серотонина человека, который характеризуется через молекулярное клонирование и фармакологию, как описано у Saltzman et al., Biochem. Biophys. Res. Comm. 181:1469-78; и Julius et al., Proc. Natl. Acad. Sci. USA 87:928-932.
Термин "пациент" относится к животному, предпочтительно млекопитающему, наиболее предпочтительно к человеку, который является объектом лечения, наблюдения или эксперимента.
"Селективное" определено как свойство соединения, где количество соединения является достаточным для получения желаемой реакции от определенного типа, подтипа, класса или подкласса рецептора, при этом незначительно или вообще не влияя на активность других типов рецептора. Например, селективное соединение может оказывать, по крайней мере, 10-кратное действие на активность желаемого рецептора по сравнению с рецепторами других типов. В некоторых случаях селективное соединение может оказывать, по крайней мере, 20-кратное действие на активность желаемого рецептора по сравнению с другими типами рецептора, или, по крайней мере, 50-кратное действие, или, по крайней мере, 100-кратное действие, или, по крайней мере, 1000-кратное действие или, по крайней мере, 10000-кратное действие, или, по крайней мере, 100000-кратное действие или более чем 100000-кратное действие. "Селективность" или "селективный" применительно к обратному агонисту означает свойство соединения в соответствии с данным изобретением, где количество соединения, которое эффективно, обратно агонизирует 5-НТ2А рецептор, тем самым снижая его активность, оказывает незначительное или вообще не оказывает агонистического или антагонистического действия на другие, родственные или не родственные рецепторы. В частности, в одном варианте, было неожиданно обнаружено, что соединение не вступает в значительное взаимодействие с другими рецепторами серотонина (5-НТ 1А, 1В, 1D, 1Е, 1F, 2В, 2С, 4А, 6 и 7) в концентрациях, при которых передача сигналов 5-НТ2А рецепторов сильно или полностью ингибируется. В одном варианте, соединение также является селективным к другим моноаминсвязывающим рецепторам, таким как допаминергические, гистаминергические, адренергические и мускариновые рецепторы. Соединения, которые являются высоко селективными к 5-НТ2А рецепторам, могут оказывать благоприятное действие при лечении психоза, шизофрении или подобных нейропсихиатрических заболеваний, при этом не оказывая неблагоприятного действия, присущего лекарственным средствам, в настоящее время применяемым для этих целей.
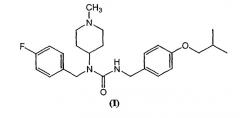
Некоторые из описанных здесь вариантов относятся к обратным агонистам 2А или 2С рецепторов сеторонина, включая композиции и методы лечения определенных побочных эффектов, вызываемых или обостренных терапией с применением допаминергических агентов, которая обычно применяется для лечения нейродегенеративных заболеваний. Например, описанные здесь соединения могут применяться для снижения дискинезии и психоза, связанных с допаминергической терапией, применяемой при лечении болезни Паркинсона, нейродегенеративного заболевания. Согласно одному из вариантов, представлено соединение N-(1-метилпиперидин-4-ил)-N-(4-фторфенилметил)-N'-(4-(2-метилпропилокси)фенилметил)карбамид, имеющее структуру формулы (I):
Один из вариантов относится к композиции, включающей соединение формулы (I) и фармацевтически приемлемый носитель. Композиция также может содержать другие соединения, такие как соединения для лечения дискинезии, дистонии или психоза.
Согласно одному из вариантов тартрат N-(1-метилпиперидин-4-ил)-N-(4-фторфенилметил)-N'-(4-(2-метилпропилокси)фенилметил)карбамида является мощным, селективным, перорально биодоступным обратным агонистом 5-НТ2А рецептора. Соединение формулы (I) также оказывает меньшее действие как обратный агонист 5-НТ2С рецептора и не оказывает существенного действия на остальные подтипы моноаминергических рецепторов. Что наиболее заметно, соединение формулы (I) не оказывает действия на подтипы рецептора допамина. (См. заявку на патент США № 09/800096). Экстенсивные поведенческие фармакологические профили соединения формулы (I), включая предклинические модели нейролептического и антидискинезийного действия лекарственного средства, поддерживают терапевтическое применение при болезни Паркинсона и родственных нейродегенеративных заболеваний человека.
Болезнь Паркинсона (PD) является общеизвестным и прогрессирующим нейродегенеративным заболеванием. Современные оценки показывают, что почти 900000 человек в США имеют PD и что распространенность заболевания увеличивается при старении населения США. Агонисты рецептора допамина применяют для облегчения симптомов PD, таких как двигательная дисфункция. К сожалению, длительное применение таких допаминергических агентов вызывает, с течением времени, нейропсихиатрические (психоз) и проблемные двигательные (дискинезия) побочные эффекты у 30-80% пациентов, соответственно.
Нейролептики и антагонисты рецептора допамина могут быть эффективными для ослабления таких побочных эффектов. К сожалению, большинство этих соединений значительно ухудшают двигательную функцию у пациентов с PD, вторичную к их гипо-допаминергическому состоянию. Биохимические и фармакологические данные подтверждают гипотезу, что потенцирование серотонинергической нейротрансмиссии может быть патофизиологически связано с развитием дискинезии и психоза у таких пациентов. Не претендуя на теорию, описанные здесь соединения выбирают для использования взаимодействия серотонинергической активности и отрицательных побочных эффектов, связанных с допаминергической терапией.
L-допа представляет собой типовое допаминергическое соединение, применяемое для лечения PD. Было показано, что L-допа повышает центральное выделение серотонина, оборот и концентрацию метаболитов в мозге грызунов. Агонисты рецептора допамина прямого действия, такие как перголид, обладают, в дополнение к их свойству агониста рецептора допамина, мощным агонистическим действием на рецепторы серотонина 2А (5-НТ2А) и 2С (5-НТ2С), как показано в различных in vitro фармакологических исследованиях.
В одном из вариантов соединения в соответствии с данным изобретением могут применяться для лечения многих побочных эффектов, которые вызываются допаминергической терапией. Например, соединения в соответствии с данным изобретением также применяют для лечения дискинезии или психоза, вызванных или ухудшенных, в качестве побочного эффекта, другими терапевтическими агентами, такими как L-допа. В одном из вариантов соединение предпочтительно применяют для лечения дискинезии или психоза, связанного с лечением L-допа.
Соединения могут применяться для лечения существующей дискинезии или психоза, или могут применяться в профилактических целях, когда, например, считается необходимым начать лечение L-допа, и существуют опасения развития дискинезии или психоза.
Соединения могут применяться для лечения дискинезии или психоза в виде монотерапии, или в сочетании с лекарственными средствами для профилактики, или лечения побочных эффектов в виде дискинезии или психоза, вызываемых лекарственными средствами, или, альтернативно, соединения могут даваться в сочетании с другими соединениями, которые также снижают дискинезию.
В некоторых вариантах соединения в соответствии с данным изобретением могут быть оставлены в композиции для введения пациентам при необходимости такового. Соответствующие соединения могут иметь множество форм в зависимости от метода применения композиции. Например, композиция может быть в виде порошка, таблеток, капсул, жидкости, мази, крема, геля, гидрогеля, аэрозоля, спрея, мицеллы, липосомы или любой другой фармацевтически приемлемой формы. Специалист в данной области техники легко поймет, что подходящий носитель для применения с соединениями в соответствии с данным изобретением, должен быть выбран из тех, которые хорошо переносятся пациентом, которому вводят композицию. Носитель также должен обладать способностью легко доставлять соединения к соответствующим целевым рецепторам. Например, специалист в данной области техники может проконсультироваться в Pharmaceutical Dosage Forms and Drug Delivery Systems, by Ansel, et al., Lippincott Williams & Wilkins Publishers; 7-е издание (1999) или в подобных источниках с руководством по таким композициям.
Соединения в соответствии с данным изобретением могут применяться множеством способов. Например, при системном введении соединения в соответствии с данным изобретением могут иметь композицию, которая может вводиться перорально в виде таблеток, капсул или жидкости. Альтернативно, композиция может вводиться инъекцией в кровь. Инъекции могут быть внутривенными (болюс или инфузия) или подкожными (болюс или инфузия). Соединения в соответствии с данным изобретением также могут вводиться центрально интрацеребральным, интрацеребровентрикулярным или интратекальным способом.
Соединения также могут применяться в устройстве с замедленным выделением. Такие устройства могут, например, вводиться под кожу, и соединение может выделяться в течение недель или месяцев. Такие устройства могут быть особенно полезными для пациентов с долговременной дискинезией, таких как пациенты, получающие длительную терапию L-допа для лечения PD. Устройства особенно предпочтительны, если применяют соединение, которое обычно требует частого введения (например, частые инъекции).
Понятно, что требуемое количество соединения определяется биологической активностью и биодоступностью, которые, в свою очередь, зависят от способа введения, физико-химических свойств применяемого соединения и того, применяется ли соединение в виде монотерапии или сочетанной терапии. На частоту введения также влияют указанные выше факторы и, особенно, период полувыведения соединения в лечимом пациенте.
Специалист в данной области техники поймет, что определенные формулировки композиций и точные терапевтические режимы (такие как ежедневная доза соединения и частота введения) могут быть определены известными методами. Такие методы обычно применяют в фармацевтической промышленности, включая in vivo эксперименты и клинические исследования.
В общем, ежедневная доза составляет от 0,01 мкг/кг массы тела до 1,0 г/кг массы тела обратного агониста рецептора серотонина 2А/2С при применении методов, представленных в данном описании. В одном варианте ежедневная доза составляет от 0,01 мг/кг массы тела до 100 мг/кг массы тела, или любого количества, кратного миллиграмму или половине миллиграмма в пределах этого интервала, например, 1,5, 2, 2,5, и т.д.
Ежедневные дозы могут даваться единожды (например, ежедневная таблетка для перорального введения или одна инъекция в день). Альтернативно, применяемое соединение может обуславливать введение два или более раз в день, в зависимости от кинетики лекарственного средства, связанной с конкретным пациентом. Альтернативно, может применяться устройство для медленного выделения для получения оптимального дозирования без необходимости многократного введения дозы Biochemical Evidence.
Краеугольным камнем современного фармакологического вмешательства в PD остается терапия на основе L-допа. L-допа легко преодолевает гематоэнцефалический барьер, поглощается нейронами и претерпевает быстрое ферментное превращение в допамин благодаря активности L-ароматической кислоты декарбоксилазы (LAAD) в допаминергических нейронах. Увеличенная доступность и выделение допамина из таких нейронов ведет непосредственно к повышенной допаминергической нейротрансмиссии и клинической эффективности при реверсировании двигательных эффектов гипо-допаминергического состояния, имеющегося при PD. Однако L-допа не имеет специфичности к допаминергическим системам, и LAAD в значительной степени экспрессируется в мозге. Ранние биохимические исследования мозга крыс показали, что L-допа значительно снижает центральные серо