Способ дифференциации чумного и псевдотуберкулезного микробов с одновременной внутривидовой дифференциацией штаммов чумного микроба
Иллюстрации
Показать всеИзобретение относится к медицинской микробиологии. Способ предусматривает выделение ДНК исследуемого штамма, проведение полимеразной цепной реакции (ПЦР) с использованием синтезированных праймеров TAN1 и TAN2, комплементарных hutG-YP01967 области следующей нуклеотидной последовательности:
TAN1-5'-TGGGCTTGAATACGGATGATG-3',
TAN2-5'-ACAACCATGCTGACGTGGG-3'. Видовую и подвидовую принадлежность исследуемых штаммов микроорганизмов определяют путем сравнения размера образовавшегося ампликона исследуемых штаммов с маркерами, в частности смесь ампликонов, образованных с праймерами TAN1 и TAN2 и ДНК референтных штаммов чумного и псевдотуберкулезного микробов. Использование изобретения позволяет быстро и точно проводить дифференциацию штаммов чумного и псевдотуберкулезного микробов и одновременно внутривидовую дифференциацию штаммов чумного микроба. 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области медицинской микробиологии, в частности к дифференциации возбудителей чумы и псевдотуберкулеза и молекулярно-генетическому типированию штаммов чумного микроба разного происхождения.
Дифференциация двух близкородственных и высокогомологичных видов рода иерсиний - чумного микроба (I группа патогенности) и значительно менее опасного возбудителя псевдотуберкулеза (III группа патогенности) важна при мониторинге природных очагов чумы. Своевременное выявление активизации природного очага позволяет с помощью противоэпидемических мероприятий предотвратить возникновение заболеваний среди людей, проживающих или работающих в зоне активного природного очага чумы. В то же время выяснение происхождения штамма чумного микроба имеет большое значение для определения его потенциальной опасности. Штаммы основного подвида относят к наиболее вирулентным и эпидемически значимым, штаммы неосновных подвидов (алтайский, гиссарский, кавказский, удэгейский) и группу таласских штаммов относят к эпидемически мало значимым с избирательной вирулентностью. Особое значение приобретает возможность быстрой идентификации и определения происхождения штамма при террористических актах с применением патогенных биологических агентов и выявлении завозных случаев этой особо опасной инфекции.
Для дифференциации штаммов чумного микроба используются различные методы молекулярно-генетического типирования, такие как IS-типирование, риботипирование, пульс-электрофорез, мультилокусное секвенирование, VNTR-типирование. Однако методы молекулярного типирования, основанные на ДНК- или РНК- зондировании, макрорестрикционном анализе с электрофорезом в импульсном поле, секвенировании трудоемки, требуют применения радиоактивной или нерадиоактивной метки и использования дорогостоящего оборудования (вакуумный аппарат для переноса-фрагментов ДНК из геля на мембраны, аппарат для гибридизации, аппарат для электрофореза в импульсном поле, секвенатор).
Широкое распространение получили методы индикации, идентификации и дифференциации возбудителей инфекционных заболеваний, основанные на ПЦР-технологии. Преимуществами этих методов являются простота исполнения, быстрое получение результатов, относительно недорогое оборудование и расходные материалы.
Для индикации возбудителя чумы в методах, основанных на полимеразной цепной реакции, в качестве ДНК-мишени используют отдельные хромосомные или плазмидные гены, чаще всего pla, caf. lcrV или сочетание двух-трех генов (Hinnebusch B.J., 1998; Leal N.C., Almedia A.M., 1999; Neubauer H. et al., 2000; Rahalison L. et al., 2000; Hongwei Z.J.L., 2000; Балахонов С.В. с соавт. 1999, 2000; Гаранина С.Б., 2001, Сучков И.Ю. с соавт., 2001). Данные методы позволяют выявлять чумной микроб в любом биологическом материале без выделения чистой культуры и в ряде случаев дают представление о потенциальной вирулентности штамма. Однако для типирования, определения подвидовой принадлежности они не пригодны.
Наиболее близким к предлагаемому изобретению по совокупности существенных признаков является способ дифференциации авирулентных вследствие потери области пигментации и вирулентных штаммов чумного микроба (RU 2288275 С1, 27.11.2006), включающий выделение тотальной ДНК, проведение ПЦР с праймерами IH 1-5'ТТТ-ACC-GCA-ACA-ACA-TCA-TCC-3', IY 4-5'GGG-CTG-AAA-CCA-CTG-AGA-TG-3', выявление и последующий анализ специфичных ампликонов. Однако в этом случае решается узкая задача - дифференциация вирулентных и авирулентных штаммов чумного микроба. Способ не позволяет проводить подвидовую дифференциацию и дифференциацию с близкородственными штаммами псевдотуберкулезного микроба.
Техническим результатом изобретения является обеспечение возможности быстрой, простой в исполнении и интерпретации результатов дифференциации штаммов чумного и псевдотуберкулезного микробов и одновременной внутривидовой дифференциации штаммов чумного микроба.
Сущность изобретения заключается в том, что из исследуемого материала выделяют тотальную ДНК, проводят при определенных условиях и режиме амплификации ПЦР с праймерами TAN1 и TAN2, комплементарными hutG - YP01967 области, выявляют методом электрофореза в агарозном или полиакриламидном геле ампликоны определенного размера, специфичные для псевдотуберкулезного микроба и каждого из подвидов чумного микроба, при этом праймеры имеют следующие нуклеотидные последовательности:
TAN1-5'-TGGGCTTGAATACGGATGATG-3'
TAN2-5'-ACAACCATGCTGACGTGGG-3',
дифференциацию (видовую и внутривидовую) осуществляют путем сравнения ампликонов исследуемых штаммов с маркерами. В качестве маркеров возможно использование стандартных маркеров или смесь ампликонов, образованных с праймерами TAN1-TAN2 и ДНК референтных штаммов чумного и псевдотуберкулезного микробов. В качестве стандартного маркера возможно использование ДНК pUC 19, обработанной рестриктазой MspI.
В качестве референтных штаммов чумного микроба используют следующие штаммы:
- для основного подвида - штаммы 231 из Аксайского высокогорного очага, А 1822 из Кызылкумского пустынного очага, А 1270 из Забайкальского степного очага, 805 из Приараксинского низкогорного очага;
- для удэгейского подвида - штаммы из Монголии: И3069 из аймака Убурхангай и И2422 из Баян-Улэгейского аймака.
- для алтайского подвида - штаммы Алтайского высокогорного очага: И2183 из Уландрика и И2359 из Кош-Агачского района;
- для гиссарского подвида - штамм А 1249 из Гиссарского высокогорного очага;
- для таласской группы штамм А1802 из Таласского высокогорного очага;
- для кавказского подвида - штамм 1146 из Зангезуро-Карабахского горного очага.
В качестве референтных штаммов псевдотуберкулезного микроба используют штаммы I серотипа А2526 (Алма-Атинская область) и MollaretI.
Дифференциацию чумного и псевдотуберкулезного микробов, а также определение подвидовой принадлежности осуществляют по размерам образовавшихся ампликонов. Для точного определения размера ампликонов, образованных с ДНК референтных штаммов, и используемых в качестве маркера, проведено их секвенирование.
При секвенировании установлено, что штаммы псевдотуберкулезного микроба I серотипа, выделенные в Алма-Атинской области и во Франции, образуют ампликоны размером 692 п.н. и 711 п.н. соответственно. Штаммы чумного микроба основного подвида по размеру образованных ампликонов разделяются на три группы: первая группа представлена штаммом из Аксайского высокогорногой очага - размер ампликона 364 п.н., вторая группа представлена штаммами из Забайкальского степного. Тувинского горного очагов и Монголии - размер ампликона 356 п.н., третья группа представлена штаммами из Кызылкумского пустынного, Приараксинского низкогорного очагов - размер ампликона 348 п.н.. Штаммы улэгейского подвида по размеру ампликонов разделяются на две группы: первая группа представлена штаммами из Монголии, аймака Убурхангай - размер ампликона 416 п.н, вторая группа - штаммами из Монголии, Баян-Улэгейского аймака - размер ампликона 348 п.н. Третья группа основного подвида и вторая группа улэгейского подвида имеют ампликоны одинакового размера, но различаются по нуклеотидному составу. При обнаружении ампликонов размером 348 п.н. рекомендуется проведение секвенирования ампликонов для дифференциации штаммов из указанных очагов основного и удэгейского подвидов. Штаммы алтайского подвида делятся на две группы: первая группа представлена штаммом из Алтайского горного очага, Кош-Агачского района - размер ампликона 396 п.н, вторая группа представлена штаммами из Алтайского горного очага, из Уландрика - размер ампликона 405 п.н. Штаммы гиссарского подвида циркулируют только в Гиссарском высокогорном очаге и образуют ампликоны размером 456 п.н. Штаммы таласской группы циркулируют только в Таласском высокогорном очаге и образуют ампликоны размером 380 п.н. Штаммы кавказского подвида из Зангезуро-Карабахского горного очага образуют ампликоны размером 1819 п.н., из Присеванского горного очага 1807 п.н., из Приараксинского низкогорного очага 1831 п.н., из Ленинаканского горного и Терско-Сунженского низкогорного очагов - 1803 п.н. Различия на 10-30 п.н у фрагментов такой величины при разделении методом гель-электрофореза не улавливаются. В связи с этим в качестве референтного штамма кавказского подвида используется только один штамм из Зангезуро-Карабахского горного очага. Данные, позволяющие соотнести размер ампликонов исследуемых штаммов с определенным видом, подвидом микроорганизмов и местом его персистенции, представлены в таблице (см. фиг. 3).
Способ осуществляют следующим образом.
Выделение тотальной ДНК из исследуемого материала, подозрительного на зараженность чумным или псевдотуберкулезным микробом, осуществляют по стандартной методике для Y.pestis. (Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности (МУ 1.3.1794-03). Полимеразную цепную реакцию проводят по стандартной методике с использованием пары праймеров TAN1 - 5'-TGGGCTTGAATACGGATGATG-3' и TAN2-5'-ACAACCATGCTGACGTGGG-3', комплементарных hutG - YP01967 области. Отжиг праймеров осуществляют при температуре 63°С в течение 30 с при числе циклов амплификации, равных 35.
Продукты ПЦР анализируют в 3,5% агарозном или 5% полиакриламидном геле с использованием буфера ТВЕ по общепринятой методике. Видовую, подвидовую и очаговую принадлежность микроорганизма определяют путем сравнения размера образовавшегося ампликона исследуемых штаммов с маркерами.
Отличительной особенностью заявляемого способа является использование одной пары праймеров TAN1 и TAN2, позволяющей одновременно определять видовую и подвидовую принадлежности исследуемых штаммов патогенных иерсиний.
Заявленный способ успешно апробирован на семидесяти двух штаммах разных подвидов, в том числе на типовых штаммах Y.pestis 231 (708), А 1822 - основного, Y.pestis 1146 - кавказского, Y.pestis A-1249 - гиссарского, Y.pestis КМ683 (И2359) - алтайского, Y.pestis И-3069, И2422 улегейского подвидов, Y.pestis A-1802 (21/10) - таласской группы и шестидесяти восьми штаммах псевдотуберкулезного микроба.
Изобретение иллюстрируется электрофореграммами ампликонов исследуемых штаммов со стандартными маркерами и маркерами, созданными на основе ампликонов референтных штаммов.
Результаты анализа представлены на фиг. 1 и 2.
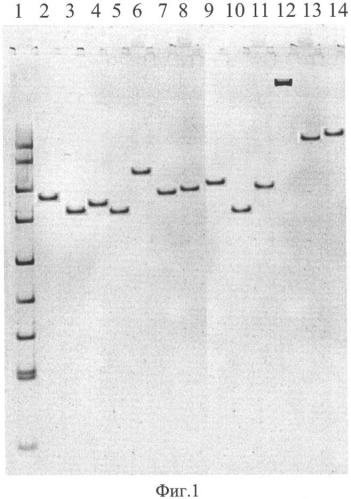
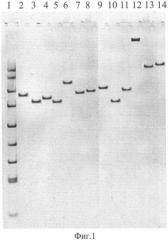
На фиг. 1 приведена электрофореграмма ампликонов, полученных при ПЦР-анализе референтных штаммов чумного и псевдотуберкулезного микробов с помощью праймеров TAN1 и TAN2, где показано положение ампликонов относительно стандартного маркера в 5% полиакриламидном геле, характеризующее видовую, подвидовую и очаговую принадлежности.
1. Стандартный маркер ДНК pUC 19, обработанная рестриктазой MspI
2. Y.pestis 231 - основной подвид (Аксайский высокогорный очаг)
3. Y.pestis A 1822 - основной подвид (Кызылкумский пустынный очаг)
4. Y.pestis A1270 основной подвид (Забайкальский степной очаг)
5. Y.pestis 805 основной подвид (Приараксинский низкогорный очаг)
6. Y.pestis A1249 - гиссарский подвид (Гиссарский высокогорный очаг)
7. Y.pestis A1802 - таласская группа (Таласский высокогорный очаг)
8. Y.pestis И2359 - алтайский подвид (Алтайский высокогорный очаг)
9. Y.pestis И3069 - удэгейский подвид (Монголия, аймак Убурхангай)
10. Y.pestis И2422, удэгейский подвид (Монголия, Баян-Улэгейский аймак)
11. Y.pestis И2183 - алтайский подвид (Алтайский высокогорный очаг)
12. Y.pestis 1146 - кавказский подвид (Зангезуро-Карабахский очаг)
13. Y.pseudotuberculosis A2526 (Алма-Ата) (I серотип)
14. Y.pseudotuberculosis Mollaret I (I серотип)
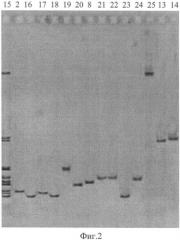
На фиг. 2 приведена электрофореграмма ампликонов, полученных при ПЦР-анализе штаммов чумного и псевдотуберкулезного микробов разного происхождения с помощью праймеров TAN1 и TAN2, где показано положение ампликонов относительно маркера из ампликонов референтных штаммов чумного и псевдотуберкулезного микроба в 3,5% агарозном геле, характеризующее видовую, подвидовую и очаговую принадлежности.
16. Маркер из ампликонов референтных штаммов чумного и псевдотуберкулезного микроба
2. Y.pestis 231 - основной подвид (Аксайский высокогорный очаг)
17. Y.pestis A1824 - основной подвид (Кызылкумский пустынный очаг)
18 Y.pestis A1252 - основной подвид (Забайкальский степной очаг)
19. Y.pestis 813 - основной подвид (Приараксинский низкогорный очаг)
20. Y.pestis A 1723 - гиссарский подвид (Гиссарский высокогорный очаг)
21. Y.pestis A1814 - таласская группа (Таласский высокогорный очаг)
8. Y.pestis И2359 - алтайский подвид (Алтайский высокогорный очаг)
22. Y.pestis И3086 - удэгейский подвид (Монголия, аймак Убурхангай)
23. Y.pestis И3068 - улэгейский подвид (Монголия, аймак Убурхангай)
24. Y.pestis И3071 - улэгейский подвид (Монголия, аймак Хурмен Сом)
25. Y.pestis И2817 - алтайский подвид (Алтайский высокогорный очаг)
26. Y.pestis 542 Аз. - кавказский подвид (Зангезуро-Карабахский очаг)
13. Y.pseudotuberculosis A2526 (Алма-Ата) (I серотип)
14. Y.pseudotuberculosis Mollaret I (I серотип)
Маркер 16 содержит ампликоны, полученные в результате амплификации ДНК референтных штаммов чумного и псевдотуберкулезного микробов с предложенными праймерами TAN1 и TAN2.
Для получения маркера проводят ПЦР с референтными штаммами по схеме, описанной в примере 1. Среди референтных штаммов, образующих ампликоны одинаковых размеров, выбирают один из штаммов. Затем реакционные смеси, содержащие ампликоны, объединяют и осаждают ДНК путем добавления этилового спирта и центрифугирования. Осадок подсушивают и растворяют в деионизованной воде. Полученный раствор содержит набор ампликонов, характерных для всех референтных штаммов, и используется в качестве маркера при дифференциации штаммов. В высушенном виде маркерные ампликоны могут храниться при комнатной температуре в течение длительного времени.
Наличие фрагмента ДНК определенного размера на электрофореграмме позволяет отнести исследуемый штамм к конкретному виду и для чумного микроба определить подвидовую принадлежность.
Изобретение иллюстрируется следующими примерами.
Пример 1. Идентификация штамма Y.pestis 231 (708) основного подвида из Аксайского высокогорного очага. (Модельный эксперимент).
Подготовка препарата ДНК
В модельном эксперименте штамм Y.pestis 231 (708) высевают на агар LB и выращивают в течение ночи при температуре 28°С. Осуществляют выделение тотальной ДНК из исследуемого материала, содержащего штамм Y.pestis 231 (708) основного подвида.
По стандарту мутности готовят взвесь микроорганизмов в дистиллированной воде в концентрации 1,0×107-1,0×109 м.к./мл (микробных клеток в 1 мл).
Обеззараживание осуществляют добавлением мертиолята натрия до концентрации 1:10000 с последующим прогреванием при температуре 56°С в течение 30 мин. После обработки мертиолятом натрия 100 мкл образца переносят в микроцентрифужные пробирки 1,5 мл и добавляют лизирующий раствор на основе 6 М гуанидинизотиоцианата в объеме 300 мкл и инкубируют при температуре 65°С в течение 15 минут. После проведения данного этапа материал считается обеззараженным (п.1.1. МУ 1.3.1794-03).
По окончании инкубирования и снижения температуры пробы до комнатной в пробирку вносят 30 мкл нуклеосорбента, встряхивают и выдерживают 10 минут, периодически перемешивая сорбент до гомогенного состояния 3-4 раза.
Пробирку центрифугируют 30 с на микроцентрифуге, супернатант удаляют.
К осадку добавляют 300 мкл раствора на основе 4 М гуанидинизотиоцианата и встряхивают пробирку на вортексе, после чего пробу центрифугируют в течение 30 с, супернатант удаляют.
К осадку добавляют 1 мл отмывочного буфера, пробирку встряхивают до гомогенного состояния суспензии, центрифугируют в течение 40 с и, как можно более аккуратно, удаляют надосадок, используя наконечник дозатора.
Пробирки помещают в твердотельный термостат при температуре 55-65°С на 15-20 минут, оставляя их открытыми для выпаривания остатков спирта, содержащегося в отмывочном буфере. Следует стремиться как можно тщательнее высушивать нуклеосорбент, поскольку с этим связана более полноценная десорбция ДНК и, кроме того, присутствие спирта может вызвать ингибирование ПЦР.
В пробирки с высушенным сорбентом добавляют 25-50 мкл бидистиллированной воды, закрывают их, перемешивают на вортексе до гомогенного состояния сорбента и инкубируют в течение 8-10 минут при температуре 55-65°С, встряхивая 2-3 раза.
Пробы центрифугируют в течение 1 минуты. Надосадок используют в качестве исследуемого материала для постановки ПЦР. Подготовленные образцы можно хранить при температуре 4°С в течение недели или при температуре минус 20°С до 6 месяцев.
Проведение ПЦР.
Полимеразная цепная реакция проводится в 0,5 мл пробирках.
Реакционная смесь в объеме 25 мкл содержит 1·ПЦР-буфер (10·ПЦР-буфер - 2,5 мкл), MgCl2 - 2,0 mM, dNTPmix - 0,3 mM, праймер TAN1-2 pmol, праймер TAN2 - 2 pmol, Taq DNA полимераза - 0,1 ед., исследуемой ДНК - 10 мкл.
Режим амплификации: начальная денатурация 94°С - 2 мин, далее проводят 35 циклов: денатурации при 94°С - 30 с, отжиг при 63°С - 30 с, элонгации при 72°С - 40 с.
Продукты амплификации анализируются в 3,5% агарозном геле. На гель наносится 3 мкл реакционной смеси, в качестве маркера используется ДНК фага λ, обработанного рестриктазой PstI, ДНК pUC 19, обработанной рестриктазой MspI.
Агарозный гель прокрашивается бромистым этидием и просматривается под ультрафиолетовым излучением путем сравнения полученного ампликона с маркером определяют размер фрагмента. Наличие фрагмента размером 364 п.н. свидетельствует о принадлежности данного штамма к основному подвиду из Аксайского высокогорного очага.
Пример 2. Идентификацию штамма Y.pestis KM683 (И2359) - алтайского подвида из Алтайского горного очага осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 396 п.н., что говорит о принадлежности данного штамма к алтайскому подвиду из Алтайского горного очага.
Пример 3. Идентификацию штамма Y.pestis А-1249 - гиссарского подвида осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 456 п.н., что говорит о принадлежности данного штамма к гиссарскому подвиду из Гиссарского высокогорного очага.
Пример 4. Идентификацию штамма Y.pestis И-3069 - удэгейского подвида осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 416 п.н., что говорит о принадлежности данного штамма к улэгейскому подвиду из Монголии аймака Убурхангай.
Пример 5. Идентификацию штамма Y.pestis A-1802(21/10) - таласской группы осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 380 п.н., что говорит о принадлежности данного штамма к таласской группе из Таласского высокогорного очага.
Пример 6. Идентификацию штамма Y.pestis 1146 - кавказского подвида осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 1819 п.н., что говорит о принадлежности данного штамма к кавказскому подвиду из Зангезуро-Карабахского очага.
Пример 7. Идентификацию штамма Y.pseudotuberculosis A-2526 осуществляют аналогично примеру 1.
При анализе продуктов амплификации длина синтезированного ампликона составила 692 п.н., что говорит о принадлежности данного штамма к виду Y.pseudotuberculosis (I серотип), выделенного в Алма-Атинской области.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах предлагаемого изобретения, позволил установить, что не обнаружены источники, характеризующиеся признаками, тождественными всем существенным признакам предлагаемого изобретения.
Таким образом, заявленный способ, основанный на полимеразной цепной реакции с использованием подобранной пары праймеров, позволяет в короткие сроки с соблюдением правил работы с особо опасными инфекциями выявлять штаммы чумного и псевдотуберкулезного микроба с одновременной подвидовой дифференциацией штаммов чумного микроба, что делает возможным использование данного способа в научно-исследовательских учреждениях, противочумных станциях и в работе Специализированных противоэпидемических бригад.
1. Способ дифференциации чумного и псевдотуберкулезного микробов с одновременной внутривидовой дифференциацией штаммов чумного микроба, включающий выделение тотальной ДНК исследуемого штамма, проведение полимеразной цепной реакции с использованием синтезированных праймеров с последующим анализом специфичных ампликонов, отличающийся тем, что при постановке полимеразной цепной реакции используют праймеры TAN1 и TAN2, комплементарные hutG-YP01967 области следующей нуклеотидной последовательности:
TAN1-5'-TGGGCTTGAATACGGATGATG-3'
TAN2-5'-ACAACCATGCTGACGTGGG-3',
дифференциацию штаммов проводят путем сравнения размера ампликона исследуемого штамма с маркером.
2. Способ по п.1, отличающийся тем, что в качестве маркера используют стандартные маркеры.
3. Способ по п.1, отличающийся тем, что в качестве маркера используют смесь ампликонов, образованных с праймерами TAN1-TAN2 и ДНК референтных штаммов чумного и псевдотуберкулезного микробов.