Антимикробные консерванты для достижения мультидозовых рецептур с использованием -циклодекстринов для жидких лекарственных форм
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к фармацевтической композиции для лечения заболевания, состояния или нарушения, для которого требуется применение антагониста нейрокининового рецептора, содержащей терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли, где композиция содержит сульфобутиловый эфир β-циклодекстрина, консервант мета-крезол и фармацевтически приемлемый носитель. Кроме того, изобретение относится к применению указанной композиции и способу лечения заболеваний, для которого требуется применение антагониста нейрокининового рецептора. Технический результат заключается в обеспечении стабильности рецептуры и приемлемой толерантности в месте инъекции продукта при использовании консерванта, обеспечивающего предотвращение бактериального и грибкового роста в рецептуре. 4 н. и 7 з.п. ф-лы, 4 ил., 9 табл.
Реферат
Область техники, к которой относится изобретение
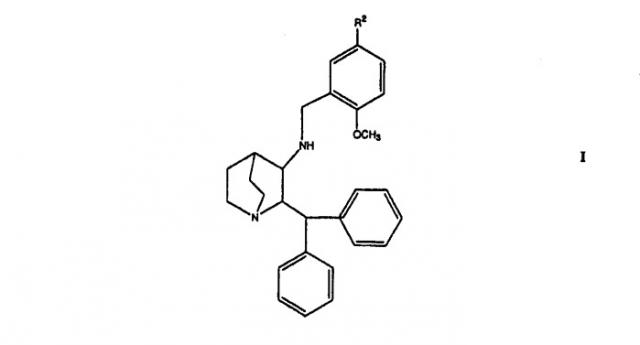
Настоящее изобретение направлено на фармацевтические композиции, содержащие терапевтически эффективное количество активного фармацевтического агента («API»), фармацевтически приемлемый циклодекстрин и фармацевтически приемлемый консервант. Изобретение также направлено на фармацевтические композиции соединений формулы I, в которой R2 выбирают из группы, состоящей из метила, этила, изопропила, втор-бутила и трет-бутила и фармацевтически приемлемого циклодекстрина и консерванта.
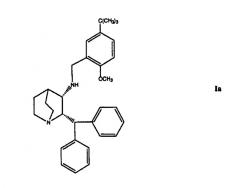
В частности, изобретение направлено на фармацевтические композиции соединения формулы Ia и фармацевтически приемлемый циклодекстрин и консервант.
Кроме того, изобретение направлено на улучшение толерантности в месте инъекции к инъектируемым водным растворам, содержащим соединение формулы I или его фармацевтически приемлемые соли, β-циклодекстрин и консервант.
Изобретение также направлено на способ получения консервированной композиции API.
Уровень техники
Введение антагониста нейрокининового рецептора, включая соединения формулы I и Ia, создает различные проблемы в отношении толерантности в месте инъекции (например, чувствительность субъекта, раздражение, воспаление, опухание и/или покраснение места). Хотя были проведены многочисленные исследования в отношении улучшения толерантности в месте инъекции путем использования различных веществ, ни одно из этих исследований, однако, не фокусировалось на введении антагониста нейрокининового рецептора.
Соединения формулы I или Ia являются объектом патентов США 5807867, 6222038 и 6255320. В них описано получение соединений формулы I и Ia. Соединение Ia может быть также получено, как описано в находящейся на рассмотрении предварительной заявке США № 60/541323, соответственно принадлежащей и разработанной Pfizer, Inc. Патент США 5393762 также описывает фармацевтические композиции и лечение рвоты с использованием антагониста рецептора NK-1. Находящаяся на рассмотрении предварительная заявка США № 60/540697, соответственно принадлежащая и разработанная Pfizer, Inc., описывает метод улучшения восстановления пациентов после анестезии путем введения соединений формулы I или Ia. Текст вышеупомянутых заявок, патентов и всех других ссылок, цитируемых в данном подробном описании, введен в данное описание посредством ссылки во всей полноте документов.
Соединение формулы Ia является основным лекарственным средством с двумя функциональными аминогруппами, вторичным амином с pKa 4,43 и третичным амином с pKa 9,31. Цитратная соль соединения формулы Ia имеет растворимость 2,7 мг/мл при рН 4,2 в 0,02 М фосфатном/0,02 М ацетатном буферном растворе. Желаемая растворимость 10 мгА/мл может быть получена при добавлении солей (например, NaCl, CaCl2 или ацетата натрия), при использовании частично водных, масляных или мицеллярных разбавителей или при добавлении модифицированного парентерально приемлемого циклодекстрина. Вообще, однако, наблюдали, что рецептуры, содержащие циклодекстрины, обеспечивали улучшенную толерантность в месте инъекции, чем другие приемы для увеличения растворимости.
Обеспечение адекватной растворимости фармацевтического лекарственного средства в парентеральных рецептурах является решающим фактором, особенно когда лекарственное средство имеет низкую водную растворимость. Изменение рН раствора, выбор солевой формы лекарственного средства и использование сорастворителей представляют собой обычные приемы, используемые для достижения адекватной растворимости. Нетипичные приемы включают применение эксципиентов, таких как комплексообразующие агенты.
Циклодекстрин может увеличивать растворимость, образуя соединение включения с молекулой лекарственного средства, посредством чего нерастворимое/гидрофобное лекарственное средство погружается в гидрофобную полость циклодекстрина. Внешняя гидрофильная оболочка молекулы циклодекстрина затем увеличивает растворимость всего комплекса. Стандартная терминология для комплексообразования с циклодекстрином определяет циклодекстрин как молекулу «хозяин» и лекарственное средство как молекулу «гость». К сожалению, циклодекстрин, используемый для образования комплекса включения, может также связывать консерванты, инактивируя многие консерванты с плохой растворимостью в воде.
Было обнаружено, что сульфобутиловый эфир β-циклодекстрина (здесь и далее «SBE-CD») является эффективным как для увеличения растворимости соединения формулы Ia, так и для улучшения реакции в месте инъекции. К сожалению, исследование установило, что SBE-CD образует комплексы как с антимикробным консервантом (например, метакрезолом), так и с соединением формулы Ia, приводя к конкурентно-связывающему взаимодействию и, вообще, к антимикробной неэффективности.
Следовательно, было необходимо достичь оптимального баланса между достаточной концентрацией циклодекстрина (например, SBE-CD) и антимикробного консерванта (например, метакрезола). В то время как более низкая концентрация SBE-CD могла бы увеличить антимикробную защитную эффективность, это преимущество будет компенсироваться понижением приемлемой толерантности в месте инъекции («IST»). Эти конкурирующие характеристики вынуждали сохранять равновесие между антимикробной эффективностью консерванта (критерий А) и приемлемой толерантностью в месте инъекции продукта.
Находящаяся на рассмотрении предварительная заявка США № 60/540644, поданная одновременно с настоящей заявкой, разработанная и принадлежащая Pfizer Inc., описывает метод улучшения толерантности в месте инъекции во время парентерального введения композиции, содержащей соединение формулы I и циклодекстрин. Был также установлен циклодекстринсовместимый консервант, обеспечивающий желаемые возможности дозирования при многоразовом использовании. Предпочтительно метакрезол используется в рецептуре для предотвращения бактериального и грибкового роста в рецептуре в течение предполагаемого длительного периода эксплуатации.
Сущность изобретения
В одном аспекте изобретение направлено на фармацевтическую композицию, содержащую терапевтически эффективное количество активного фармацевтического ингредиента (API), β-циклодекстрин, фармацевтически приемлемый консервант, фармацевтически приемлемый носитель и необязательный фармацевтически приемлемый эксципиент, в которой консервант демонстрирует фармацевтически приемлемую антимикробную консервирующую эффективность.
В предпочтительном варианте осуществления β-циклодекстрин является 2-гидроксипропил-β-циклодекстрином или сульфобутиловым эфиром β-циклодекстрина, предпочтительно сульфобутиловым эфиром β-циклодекстрина.
В другом варианте осуществления фармацевтически приемлемый консервант выбирают из тимерозала, пропиленгликоля, фенола или метакрезола или их комбинации. Предпочтительно консервантом является метакрезол. Предпочтительно концентрация консерванта равна от примерно 0,1 мг/мл до примерно 600 мг/мл. Предпочтительно консервантом является метакрезол, и он находится в концентрации от примерно 0,1 мг/мл до примерно 20 мг/мл.
В предпочтительном варианте осуществления фармацевтическая композиция имеет рН в интервале от примерно 3 до примерно 6.
В предпочтительном варианте осуществления консервант имеет величину связывания с циклодекстрином, меньшую, чем величина связывания API с циклодекстрином. Предпочтительно величина связывания API с циклодекстрином находится между 500 М-1 и 10000 М-1. Предпочтительно величина связывания API с циклодекстрином находится между 800 М-1 и 3000 М-1.
В другом варианте осуществления активный фармацевтический ингредиент имеет константу связывания с циклодекстрином, которая более чем или равна удвоенной константе связывания для консерванта. В предпочтительном варианте осуществления константа связывания более чем или равна пятикратной константе. В наиболее предпочтительном варианте осуществления константа связывания более чем или равна десятикратной константе.
В предпочтительном варианте осуществления от примерно 1 мг/мл до примерно 5 мг/мл консерванта, предпочтительно метакрезола, не связано с циклодекстрином. Предпочтительно примерно 2,5 мг/мл консерванта, предпочтительно метакрезола, не связано с циклодекстрином.
В предпочтительном варианте осуществления фармацевтическая композиция имеет антимикробную эффективность против бактерий, такую, что концентрация бактерий уменьшается на 2 или более порядков после 6 часов, на 3 или более порядков после 24 часов и отсутствие роста бактерий после 28 дней. Предпочтительно бактерии выбирают из Escherichia coli (грамотрицательная бактерия) (АТСС8739), Pseudomonas aeruginosa (грамотрицательная бактерия) (АТСС9027) или Staphylococcus aureus (грамположительная бактерия) (АТСС6538).
В предпочтительном варианте осуществления фармацевтическая композиция имеет антимикробную эффективность против грибка и плесени, такую, что концентрация грибка или плесени уменьшается на 2 или более порядков после 7 дней, на 1 порядок после 14 дней и отсутствие увеличения грибка или плесени после от 14 дней до примерно 28 дней. Предпочтительно грибком является Candida albicans (грибок) (АТСС10231) и плесенью является Aspergillus niger (плесень) (АТСС16404).
В предпочтительном варианте осуществления фармацевтическая композиция имеет антимикробную эффективность, которая удовлетворяет критериям А и В Pharmaceopia Europa и критериям USP AET.
В другом аспекте изобретение направлено на фармацевтическую композицию, содержащую соединение формулы I в качестве активного фармацевтического ингредиента,
или его фармацевтически приемлемые соли, в которой R2 выбирают из группы, состоящей из метила, этила, изопропила, втор-бутила и трет-бутила, предпочтительно трет-бутила, фармацевтически приемлемый β-циклодекстрин, фармацевтически приемлемый консервант, фармацевтически приемлемый носитель и необязательного фармацевтически приемлемый эксципиент.
Предпочтительно β-циклодекстрин является 2-гидроксипропил-β-циклодекстрином или сульфобутиловым эфиром β-циклодекстрина, предпочтительно сульфобутиловым эфиром β-циклодекстрина.
Предпочтительно фармацевтически приемлемый консервант выбирают из тимерозала, пропиленгликоля, фенола или метакрезола или их комбинации. Предпочтительно консервантом является метакрезол.
Предпочтительно фармацевтическая композиция имеет рН в интервале от примерно 4 до примерно 5.
В предпочтительном варианте осуществления от примерно 1 мг/мл до примерно 5 мг/мл консерванта, то есть метакрезола, не связано с циклодекстрином.
В предпочтительном варианте осуществления соединение формулы I или его фармацевтически приемлемая соль находятся в количестве от примерно 0,1 мг/мл до примерно 100 мг/мл и β-циклодекстрин находится в количестве от примерно 20 мг/мл до примерно 200 мг/мл и консервантом является метакрезол.
Предпочтительно β-циклодекстрин находится в количестве от примерно 55 мг/мл до 100 мг/мл и метакрезол в количестве от примерно 2,5 мг/мл до 3,5 мг/мл.
В предпочтительном варианте осуществления соединением формулы I является соединение формулы Ia
или его фармацевтически приемлемые соли.
Предпочтительно соединение формулы Ia или его фармацевтически приемлемая соль находится в количестве от примерно 0,1 мг/мл до примерно 100 мг/мл и β-циклодекстрин в количестве от примерно 20 мг/мл до примерно 200 мг/мл и консервантом является метакрезол, и он находится в количестве от примерно 1 мг/мл до примерно 5 мг/мл. Предпочтительно β- циклодекстрин находится в количестве от примерно 55 мг/мл до примерно 100 мг/мл и консервантом является метакрезол, и он находится в количестве от примерно 2,5 мг/мл до примерно 3,5 мг/мл. Предпочтительно β-циклодекстрин является сульфобутиловым эфиром β-циклодекстрина.
В третьем аспекте изобретение направлено на фармацевтическую композицию, содержащую соединение формулы Ia
или его фармацевтически приемлемые соли, в которой соединение формулы Ia находится в количестве 10 мгА/мл, сульфобутиловый эфир β-циклодекстрина в количестве примерно 63 мг/мл и метакрезол в количестве примерно 3,3 мг/мл, фармацевтически приемлемый носитель и необязательный фармацевтически приемлемый эксципиент. Предпочтительно фармацевтически приемлемая соль соединения формулы Ia является цитратом.
В четвертом аспекте изобретение направлено на метод лечения рвоты или улучшения восстановления после анестезии у млекопитающих, предусматривающий парентеральную инъекцию млекопитающему водной фармацевтической композиции, содержащей вышеописанные фармацевтические композиции соединений формулы I или Ia, β-циклодекстрин, присутствующий в количестве, которое достаточно для улучшенной толерантности к инъекции в месте инъекции. Предпочтительно фармацевтически приемлемой солью является цитрат. Предпочтительно композиция вводится подкожно.
В пятом аспекте изобретение направлено на метод улучшения толерантности в месте инъекции во время лечения рвоты или улучшения восстановления после анестезии у млекопитающих, предусматривающий парентеральную инъекцию млекопитающему фармацевтически приемлемого раствора вышеописанных фармацевтических композиций соединений формулы I или Ia. Предпочтительно фармацевтически приемлемой солью является цитрат. Предпочтительно композиция вводится подкожно.
В шестом аспекте изобретение направлено на метод разработки консервированной API композиции, содержащей терапевтически эффективное количество API, β-циклодекстрин и фармацевтически приемлемый консервант.
В предпочтительном варианте осуществления консервант имеет величину связывания с циклодекстрином, меньшую, чем величина связывания API с циклодекстрином. Предпочтительно консервант выбирают из тимерозала, пропиленгликоля, фенола или метакрезола или их комбинации.
В предпочтительном варианте осуществления величина связывания API с циклодекстрином более 50 М-1. Предпочтительно величина связывания API с циклодекстрином находится между 500 М-1 и 10000 М-1. Предпочтительно величина связывания API с циклодекстрином находится между 800 М-1 и 3000 М-1.
В предпочтительном варианте осуществления требования к тесту на антимикробную эффективность (AET) удовлетворяют критериям А и В Pharmaceopia Europa и критериям USP AET.
В дальнейшем аспекте изобретение направлено на фармацевтическую композицию, как определено здесь, для использования в качестве лекарства, особенно когда композиция содержит соединение формулы I или Ia, при лечении заболевания, для которого требуется применение антагониста нейрокининового рецептора, такого как антагонист рецептора NK-1.
В дальнейшем аспекте изобретение направлено на использование фармацевтической композиции, как определено здесь, содержащей соединение формулы I или Ia, для производства лекарства для лечения заболевания, для которого требуется применение антагониста нейрокининового рецептора, такого как антагонист рецептора NK-1.
В дальнейшем аспекте изобретение направлено на способ лечения заболевания, для которого требуется применение антагониста нейрокининового рецептора, такого как антагонист рецептора NK-1 у млекопитающих, предусматривающий введение указанному млекопитающему терапевтически эффективного количества фармацевтической композиции, как определено здесь, содержащей соединение формулы I или Ia.
Определения
Термин(ы) «соединение(я) формулы I» и «соединение(я) формулы Ia», как использовано здесь, означают соединение или соединения формулы I или Ia, их пролекарства и фармацевтически приемлемые соли соединений или пролекарств. Соединения, используемые в настоящем изобретении, могут быть выделены и использованы сами по себе или в форме их фармацевтически приемлемой соли, сольвата и/или гидрата.
Термин «фармацевтически приемлемая соль» относится к неорганическим или органическим солям соединения настоящего изобретения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединения или отдельным реагированием соединения или пролекарства с подходящей органической или неорганической кислотой и выделением образующейся таким образом соли. Репрезентативные соли включают гидробромид, гидрохлорид, гидройодид, сульфат, бисульфат, нитрат, ацетат, трифторацетат, оксалат, бесилат, пальмитат, памоат, малонат, стеарат, лаурат, малат, малеат, борат, бензоат, лактат, фосфат, гексафторфосфат, бензолсульфонат, тозилат, формат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат и тому подобное. См., например, Berge et al. J. Pharm. Sci., 66, 1-19 (1977).
Предпочтительно фармацевтически приемлемой солью является цитрат. Термин «цитратная соль», как использовано здесь, относится к моногидрату соли лимонной кислоты соединения формулы Ia, имеющего молекулярную массу 660,82 и теоретическую эффективность, основанную на активном ингредиенте, равную 709 мг/г.
Термин «активный фармацевтический ингредиент», или «API», как использовано здесь, относится к фармацевтическому лекарственному веществу, имеющему терапевтические свойства и обладающему способностью связываться или быть «изолированным» в циклодекстрине. Предпочтительно API имеет величину связывания с циклодекстрином более 50 М-1. Более предпочтительно API имеет величину связывания с циклодекстрином между примерно 800 М-1 и примерно 3000 М-1. Даже более предпочтительно API имеет величину связывания с циклодекстрином между примерно 500 М-1 и примерно 10000 М-1. Более того, предпочтительно API имеет более чем удвоенную константу связывания с циклодекстрином, чем консервант. Более предпочтительно API имеет более чем пятикратную константу связывания с циклодекстрином. Даже более предпочтительно API имеет более чем десятикратную константу связывания с циклодекстрином.
Термин «активный ингредиент» или «мгА/мл», как использовано здесь, относится к свободному основанию соединения формулы Ia, имеющему молекулярную массу 468,69.
Термин «циклодекстрин» относится к соединению, содержащему циклическую альфа(1→4) связанную D-глюкопиранозную часть. α-циклодекстрин относится к циклодекстрину с 6 циклическими связанными D-глюкопиранозными частями, β-циклодекстрин имеет 7 циклических связанных D-глюкопиранозных частей и γ-циклодекстрин имеет 8 циклических связанных D-глюкопиранозных частей. Эти циклические связанные D-глюкопиранозные части определяют гидрофобную полость и циклодекстрины, как известно, образуют соединения включения с другими органическими молекулами, с солями и с галогенами как в твердом состоянии, так и в водных растворах.
Циклодекстрины различаются по структуре и свойствам. Например, размер (то есть диаметр и глубина) и функциональность (то есть гидрофобность, заряд, реактивность и способность к водородным связям) гидрофобной полости различаются среди замещенных и незамещенных α-, β- и γ-циклодекстринов. Обычно циклодекстрин, выбираемый для рецептуры, имеет размер и функциональность, который связывает с целевым компонентом другие компоненты рецептуры. Для настоящих рецептур и методов полагают, что замещенные циклодекстрины, такие как гидроксиалкилциклодекстрины и сульфоалкиловые эфиры циклодекстринов имеют размер и функциональность, которые совместимы с другими компонентами рецептуры. Предпочтительные циклодекстрины включают гидроксипропил-β-циклодекстрин и сульфобутиловый эфир β-циклодекстрина. Более предпочтительно циклодекстрином является сульфобутиловый эфир β-циклодекстрина («SBE-CD»).
Фраза «терапевтически эффективное количество» означает количество соединения настоящего изобретения, которое (i) лечит или предотвращает отдельную болезнь, состояние или нарушение, (ii) ослабляет, улучшает или устраняет один или несколько симптомов отдельной болезни, состояния или нарушения или (iii) предотвращает или замедляет приступ одного или нескольких симптомов отдельной болезни, состояния или нарушения, описываемых здесь.
Термин «млекопитающие» или «животные», как использовано здесь, относится к человеку, домашним животным, таким как, но без ограничения, собаки, кошки и лошади, животным как источнику пищи (то есть коровы, свиньи и овцы), животным в зоопарке и другим аналогичным видам животных.
Термин «фармацевтически приемлемый» означает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, содержащимися в рецептуре, и/или с животным, которое этим лечат.
Термины «проводить курс лечения», «лечить» или «лечение» охватывают как превентивное, то есть профилактическое, так и паллиативное лечение.
Термин «улучшенная толерантность в месте инъекции», как использовано здесь, означает величину два или меньше, как определено здесь в таблице IV.
Термин «фармацевтически приемлемый консервант», как использовано здесь, означает консервант. В частности, рецептура, содержащая консервант, сохраняет эффективность, согласно стандартам, изложенным в Ph. Eur. 4th Ed. 2003 (5.1.3) для парентеральных рецептур и в USP26NF21S2, <51> для категории 1 фармацевтических продуктов. Предпочтительно консервант имеет пониженную величину связывания с циклодекстрином по сравнению с API, такую, что достаточное количество консерванта не изолировано в циклодекстрине, обеспечивая действенную антимикробную эффективность.
Краткое описание рисунков
Фиг.1 изображает насыщенные метакрезоловые растворы SBE-CD и соединение формулы Ia. Концентрация метакрезола показывает линейный рост, когда увеличивается SBE-CD. Концентрация лекарственного средства существенно не изменяет растворимости м-крезола в SBE-CD.
Фиг.2 изображает концентрацию соединения формулы Ia от времени при 1, 0,5 и 0,25 мМ соединения формулы Ia, построенную по уравнению 11.
Фиг.3 изображает сравнение между бактериальной эффективностью как функцией общего количества метакрезола и как функцией расчетного связанного метакрезола для S.aureus в 6-часовой и 24-часовой временных точках.
Фиг.4 изображает окно рецептур, гарантирующее эффективность консерванта в соответствии с Ph. Eur. критерий A, при отсутствии боли при инъекции, с менее чем 3,5 мг/мл метакрезола и менее чем 80 мг/мл SBE-CD.
Описание изобретения
Разработка парентеральных рецептур, использующих циклодекстрин для солюбилизации или для других целей, требует понимания взаимодействия между лекарственным средством и циклодекстрином. Фармацевтические лекарственные средства, которые солюбилизируются циклодекстрином, связываются в стехиометрическом соотношении, связанном с присущей им константой связывания. Это соотношение изменяется на основе некоторых факторов, таких как структура лекарственного средства, циклодекстрина и свойства раствора (например, рН, ионная сила, сорастворимость).
Рецептуры, имеющие многочисленные эксципиенты, дополнительно осложняют взаимодействие. Например, в парентеральных рецептурах многократного применения, содержащих консервант, консервант может конкурировать с лекарственным средством за связывание с циклодекстрином. Ранее сообщалось, что 2-гидроксипропил-β-циклодекстрин взаимодействует не только с молекулами лекарственного средства, но может также образовывать комплексы с антимикробными консервантами. Loftsson, T. et al., Drug Development and Industrial Pharmacy 1992, 18(13), 1477-1484.
Связывание консерванта с циклодекстрином, однако, понижает антимикробную эффективность консерванта, так как консерванту требуется быть несвязанным в растворе. Минимальнное требование к эффективности консервации парентеральных продуктов описано в European Pharmacopoeia в применении к критерию А и в U.S. Pharmacopoeia. Антимикробные консерванты для предложенных рецептур были признаны соответствующими критериям тестирования антимикробной эффективности («AET»).
Мультидозовая рецептура соединения формулы Ia, содержащая 10 мгА/мл соединения формулы Ia и 10% (мас./об.) циклодекстрина при рН 4,4 была использована для установления эффективного антимикробного консерванта, который существенно не взаимодействует с циклодекстрином. По предварительным экспериментам растворимость соединения формулы Ia в присутствии 2-гидроксипропил-β-циклодекстрина была аналогична растворимости в присутствии SBE-CD. Более того, оба давали рецептуры с приемлемой толерантностью в месте инъекции («IST»). В дополнение к совместимости с циклодекстрином, например SBE-CD, существуют дополнительные критерии, которые ограничивают антимикробные консерванты, приемлемые для рецептуры. Этими критериями являются физическая и химическая совместимость с соединением формулы Ia, эффективность защиты от бактерий, плесени и дрожжей при рН примерно 4,4 и приемлемая толерантность в месте инъекции.
Как обсуждается более полно в экспериментальном разделе, предварительный скрининг антимикробных консервантов для мультидозовой рецептуры соединения формулы Ia проводили с хлоркрезолом, фенилэтанолом, бензиловым спиртом, этанолом, бронополом, сахарозой, циклодекстринглюконатом, тимерозалом, бензетониумхлоридом, бензалкониумхлоридом, хлорбутанолом, бензойной кислотой, метакрезолом, фенолом и 25% пропиленгликолем. Первоначальные результаты показали, что тимерозал, хлорбутанол/фенилэтанол, этанол и пропиленгликоль (50%) удовлетворяют требованиям USP/Ph. Eur. (таблица VII).
При рассмотрении результатов толерантности в месте инъекции хлорбутанол/фенилэтанол, этанол и пропиленгликоль демонстрировали плохую толерантность в месте инъекции (таблица VIII). Наоборот, тимерозал и метакрезол обеспечивали хорошую толерантность в месте инъекции.
Бензетониумхлорид и бензойная кислота, оба, были неэффективными в сокращении микроорганизмов после 7 дней. Пропиленгликоль (25%) был активен против бактерий только в присутствии SBE-CD, но неэффективен против грибков. С другой стороны, фенольные соединения, фенол и мета-крезол, были эффективными в сокращении микроорганизмов, но их активность против бактерий сильно снижалась, когда в рецептуре присутствовал SBE-CD.
Изобретателями было предположено и определено, что трудности, с которыми сталкиваются при консервировании желаемых рецептур были обусловлены взаимодействием между антимикробным консервантом (например, метакрезолом) и SBE-CD. В частности, консервант, например, метакрезол, был, вероятно, изолирован SBE-CD, что делало метакрезол неактивным против бактерий и грибков. Для того чтобы продемонстрировать эту теорию, были определены константы связывания соединения формулы Ia с SBE-CD и метакрезола с SBE-CD (КР). Эти константы были использованы для вычисления концентрации несвязанного метакрезола в рецептуре, тестируемой на антимикробную эффективность. Используемые в вычислениях средние величины констант связывания составили для лекарственного средства (КD = 1000) и для консерванта (КР = 28).
В случаях, когда желательно предпочтительное связывание одного из компонентов, желательно определить количество связанной доли каждого компонента в равновесии. Связывание одного компонента в сравнении с другим в растворе может быть измерено с использованием методик, таких как спектроскопия или калориметрия. Garde, A., and Connors, K.A. "Binding of Substituted Acetic Acids to α-cyclodextrin in Aqueous Solution" J. Pharm. Sci. 1997 86(11): 1210-1214. Для того чтобы различить связывание включения от других возможных эффектов солюбилизации агентов трехкомпонентных рецептур, таких как наложение или гидротропия, требуются методы для определения константы связывания одного из связанных с циклодекстрином компонентов в присутствии других конкурирующих связывающихся агентов. Способность находить различия между связыванием и другими формами взаимодействия существенна для понимания и создания оптимальных рецептур.
В настоящем изобретении метод определения констант связывания использует равновесный диализ при разработке парентеральных рецептур многократного применения, содержащих SBE-CD и консервант. В частности, метод был применен в разработке парентеральных рецептур, содержащих соединение формулы Ia, циклодекстрин (SBE-CD) и консервант (метакрезол). Этот подход применим к соединениям, иным, чем соединение формулы Ia в разработке парентеральных рецептур, и находится в границах настоящего изобретения. Разработка рецептур с использованием этого подхода привела к оптимизации связывания циклодекстрина с лекарственным средством и не связывания с консервантом. Значимость этой методики заключается в ее способности измерять константу связывания многочисленных соединений, конкурирующих за связывание с циклодекстрином. Экспериментальные данные по диализу также обеспечивают легко интерпретируемое представление связывания в рецептуре путем визуализации степени взаимодействия по равновесию, устанавливающемуся после диализа.
Равновесный диализ позволяет рассчитывать константы связывания путем моделирования результирующей скорости диффузии через полупроницаемую мембрану с равновесной конечной точкой. Равновесный диализ выполняется путем предоставления возможности субстрату в растворе, содержащем связанный субстрат и лиганд, в донорном отсеке прибора для равновесного диализа (в ячейке), прийти со временем в равновесие с акцепторным отсеком. Ono, N., Hirayama, F., Arima, H., Uekama, K. "Determination oh Stability Constant of β-Cyclodextrin Complexes Using the Membrane Premeation Technique and the Permeation Behavior of Drug Competing Agent-β-Cyclodextrin Ternary Systems" Eur. J. Pharm. Sci. 1999 9: 133-139. Акцепторная ячейка не содержит лиганд. Мембрана является полупроницаемой, обычно позволяя веществам с низкой молекулярной массой свободно диффундировать, в то время как циклодекстрин (MW = 2163) остается в донорном отсеке. Отбор проб из обоих отсеков с течением времени дает профиль время-концентрация субстрата как в донорном, так и в акцепторном отсеках диализной ячейки.
Математическая модель, описывающая скорость диффузии лекарственного средства через мембрану, может быть выведена для систем, содержащих два или более компонентов в растворе. Скорость диализа и константа связывания для субстратов получены путем решения уравнения, используя программу нелинейной аппроксимации кривой. В зависимости от взаимодействий между компонентами возможно описать конкурирующее связывание, которое имеет место в растворе. Равновесная константа связывания является мерой относительной концентрации метакрезола, связанного с SBE-CD в соответствии с уравнением химического равновесия ниже: S = мета-крезол, L = SBE-CD. S:L означает комплекс, сформировавшийся между метакрезолом и SBE-CD.
Анализ растворимости
Цитратная соль соединения формулы Ia имеет растворимость 2,7 мг/мл при рН 4,2 в 0,02 М фосфатном/0,02 М ацетатном буферном растворе. Обычные методы растворимости выполняли первоначально, чтобы определить растворимость и константу связывания соединения формулы Ia и консерванта с SBE-CD. Эти исследования делают возможным определение стехиометрии связывания между SBE-CD и соединением формулы Ia, как видно из линейного наклона соотношения молярной растворимости соединения формулы Ia и SBE-CD (фиг.1).
Связывание с метакрезолом вычисляли с использованием анализа растворимости. Эксперимент выполняли при различных концентрациях соединения формулы Ia для определения, существует ли какое-либо влияние присутствия в растворе лекарственного средства на константу связывания метакрезола. Растворимость метакрезола измеряли в избытке (насыщении) метакрезола, и равновесная константа связывания была вычислена с использованием следующего уравнения:
Где St представляет собой общую растворимость метакрезола, s0 является истинной растворимостью метакрезола, Lt представляет собой концентрацию SBE-CD (лиганда) и K11 является равновесной константой связывания метакрезола в предположении стехиометрии связывания 1:1.
Полученная с использованием метода растворимости равновесная константа связывания метакрезола в среднем по исследованию равнялась 27,6 М-1. Влияние на связывание присутствия соединения формулы Ia было минимальным, как показано в таблице 1. Эти данные были использованы для сравнения результатов с исследуемым в настоящее время методом равновесного диализа. Соединение формулы Ia имело константу связывания 1040 М-1 при рН 4,4.
| Таблица I | ||||
| Соединение формулы Ia [мМ] | Наклон | y-пересечение [мМ] | R2 | K11 (равновесие) |
| 0,00 | 0,46 | 34,06 | 0,88 | 24,53 |
| 10,67 | 0,46 | 33,15 | 0,95 | 25,78 |
| 21,34 | 0,53 | 32,15 | 0,92 | 35,46 |
| 42,67 | 0,43 | 31,15 | 0,97 | 24,59 |
| Средняя константа связывания, М-1 | 27,59 | |||
| Таблица I: Вычисленные константы связывания для метакрезола в экспериментах по насыщенной растворимости при варьировании SBE-CD и лекарственного средства (соединения формулы Ia). Наклон растворимости метакрезола от концентрации SBE-CD был использован для оценки связывания. Добавление соединения формулы Ia не изменяет существенно концентрацию метакрезола. |
Метод равновесного диализа
В первоначальных экспериментах была установлена скорость потока равновесного диализа для соединения формулы Ia и для метакрезола через 500 MWCO диализную мембрану. Три различные концентрации соединения формулы Ia были первоначально загружены в донорную сторону диализного отсека. Образцы отбирали в различные интервалы времени и концентрацию свободных компонентов измеряли с использованием ВЭЖХ. Равновесия достигали для каждой тестированной системы примерно за 4 дня. Гладкая линия являлась построением данных с использованием модели для единой системы, представленной в обсуждении. Точка равновесия для всех этих контрольных экспериментов достигалась после того, как 50% общего количества лекарственного средства равномерно распределялось в донорной и акцепторной сторонах отсека. Это асимптотическое приближение к равновесию было смоделировано, и была вычислена скорость диализа, таблица II.
| Таблица II | |||||
| Аппроксимированное соотношение | Соединение формулы Ia | Метакрезол[мМ] | SBE-CD [мМ] | k(час-1) | Keq[М-1] |
| 1:1 | 1,0 | 1,0 | 0,015 | 740 | |
| 1:2 | 0,5 | 1,0 | 0,013 | 1092 | |
| 1:4 | 0,25 | 1,0 | 0,012 | 1444 | |
| 1:1 | 1,1 | 1,0 | 1,984 | 88 | |
| 1:2 | 0,6 | 1,0 | 2,182 | 75 | |
| 1:4 | 0,3 | 1,0 | 2,761 | 85 | |
| 1:1 | 1,0 | 1,0 | 1,0 | 0,018 | 690 |
| 1:2 | 0,5 | 0,5 | 1,0 | 0,013 | 720 |
| 1:4 | 0,25 | 0,25 | 1,0 | 0,011 | 520 |
| Таблица II. Вычисленные по методу равновесного диализа константы связывания. Асимптотическая скорость диффузии была построена по уравнению 11 с использованием программы численной линейной аппроксимации для получения констант связывания. |
Первичный метод анализа данных был проведен для выполнения вычислений из данных равновесного диализа, как описано ниже. В частности, скорость диффузии через мембрану была рассчитана с использованием следующих уравнений:
Скорость диффузии из донорной фазы определяли по следующему соотношению:
| [D]t-[D]eq=([D]0-[D]eq)e(-2kt) | (1) |
Скорость диффузии в акцепторную фазу:
| [D]eq-[D]t=[D]eqe(-2kt) | (2) |
где
k = константа скорости проницания, мин-1
[D]0 = концентрация в донорной или акцепторной фазе в нулевой момент времени 0
[D]t = концентрация в донорной или акцепторной фазе в момент времени t
[D]eq = концентрация в донорной или акцепторной фазе в равновесии
t = время (мин)
Основанием для расчета в присутствии SBE-CD явилось предположение, что комплексообразование происходит только в донорной фазе в соответствии со стандартной реакцией