Бета-цепочечные миметики и относящиеся к ним способы
Иллюстрации
Показать всеОписываются новые гетероциклические соединения общей формулы I
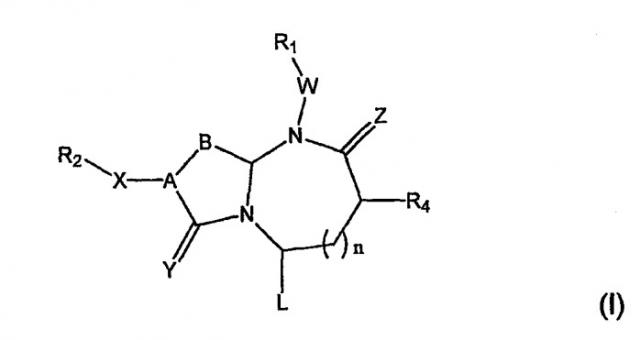
где А представляет собой -(СН)-, -N- или -CH2-N-; В представляет собой -(СН2)-, -(СН2-СН2)-; D представляет собой -(СН2)- или -(С=О)-; W представляет собой -(С=О)- или отсутствует; X представляет собой -NH(C=O)- или отсутствует; Y представляет собой кислород или серу; L представляет собой водород, -C(O)NHR3 или -C(=O)OR4; R1 - С1-12алкил; С6-10арил; С1-6алкокси; С6-10аралкил; С6-10аралкилокси; R2 - насыщенный или ненасыщенный С1-10алкил, возможно замещенный; С1-10алкенил; С6-10аралкилокси; С1-10алкандиенил; С6-10арил, возможно замещенный; С6-10аралкил, возможно замещенный; бензодиоксолил; пиперонил; хроменонил; алкил-С(=О)-; 5-6-членный гетероарил, содержащий один или два атома азота, или атом кислорода, или атом серы и возможно замещенный; R3 - радикал формулы
где Ra - С1-10алкил, возможно замещенный; С1-10алкенил; С3-10циклоалкил; амино; С6-10аралкил:, возможно замещенный; Rd - водород; С6-10аралкил, возможно замещенный; R4 - С6-10аралкил; при условии, что если А означает -(СН)-, тогда В - -(СН2)-, D - -(СН2)-, X - -NH(C=O)- и L - -C(=O)NHR3; если А означает N, тогда В - -(СН2-СН2)- и X отсутствует; если А означает -CH2-N-, тогда В - -(СН2)-, D - -(СН2)-, W - -(С=О)-, X отсутствует и L - водород, и содержащая их фармацевтическая композиция. Новые соединения обладают ингибирующим действием в отношении транскрипции NF-kB и могут быть использованы в медицине. 2 н. и 5 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Уровень техники
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к бета-цепочечным миметикам, химической библиотеке, относящейся к ним, и их применению.
Описание предшествующего уровня техники
Рандомизированный скрининг молекул на возможную активность в качестве терапевтических агентов проводился в течение многих лет и привел к открытию ряда важных лекарственных средств. Хотя успехи в молекулярной биологии и компьютеризованной химии привели к повышенному интересу в том, что было названо «рациональным конструированием лекарственных средств», такие способы не оказались такими быстрыми или надежными, как первоначально предполагалось. Поэтому в последние годы возобновился интерес и возврат к рандомизированному скринингу лекарственных средств. С этой целью определенные шаги были сделаны в новых технологиях, основанных на разработке комбинаторных библиотек химических соединений и скрининге таких библиотек в поисках на биологически активные члены.
В целом, комбинаторные библиотеки химических соединений являются просто коллекцией молекул. Такие библиотеки различаются химическими разновидностями в библиотеке, а также способами, применяемыми как для образования членов библиотек, так и идентификации того, какие члены взаимодействуют с представляющими интерес биологическими мишенями. Хотя эта область является все еще молодой, способы получения и скрининга библиотек стали уже совсем иными и усовершенствованными. Например, в недавнем обзоре различных комбинаторных химических библиотек соединений идентифицирован ряд таких способов (Dolle, J. Com. Chem., 2(3): 383-433, 2000), включающих применение как «меченых», так и «немеченых» членов библиотек (Janda, Proc. Natl. Acad. Sci. USA 91:10779-10785, 1994).
Первоначально комбинаторные химические библиотеки были, в основном, ограничены членами пептидного или нуклеотидного происхождения. С этой целью способы Houghten et al. иллюстрируют пример метода, названного «двойственно иттерационным» методом, для составления библиотек растворимых комбинаторных пептидов с помощью метода синтеза расщеплением (Nature (London) 354:84-86, 1991; Biotechniques 13:412-421, 1992; Bioorg. Med. Chem. Lett. 3:405-412, 1993). Таким способом получали библиотеки растворимых пептидов, содержащие десятки миллионов членов. Обнаружено, что такие библиотеки являются эффективными в идентификации опиоидных пептидов, таких как метионин- и лейцинэнкефалин (Dooley and Houghten, Life Sci. 52, 1509-1517, 1993), и библиотеку N-ацилированных пептидов применяли для идентификации ацеталинов, которые являются сильнодействующими антагонистами опиоидов (Dooley et al., Proc. Natl. Acad. Sci. USA 90:10811-10815, 1933). Совсем недавно была создана библиотека всех D-аминокислотных опиоидных пептидов и подвергнута скринингу на аналгезирующую активность против мю("μ")-опиоидного рецептора (Dooley et al., Science, 266:2019-2022, 1944).
Хотя комбинаторные библиотеки, содержащие члены пептидного и нуклеотидного происхождения, имеют большую ценность, в данной области все же существует потребность в библиотеках, содержащих члены другого происхождения. Например, традиционные библиотеки пептидов в значительной степени различаются только аминокислотной последовательностью для генерирования членов библиотеки. Хотя общепризнанно, что вторичные структуры пептидов являются важными для биологической активности, такие библиотеки пептидов не придают ограниченную вторичную структуру членам этой библиотеки.
С этой целью некоторые исследователи циклизовали пептиды с дисульфидными мостиками при попытке обеспечить более ограниченную вторичную структуру (Timelty et al., J. Chem. Soc. 1067-68, 1994; Eichler et al., Peptide Res. 7:300-306, 1994). Однако такие циклизованные пептиды обычно являются все еще вполне гибкими и недостаточно биологически доступными, и поэтому были достигнуты только ограниченные успехи.
Совсем недавно были разработаны непептидные соединения, которые более близко имитируют вторичную структуру обращенных витков, обнаруживаемых в биологически активных белках или пептидах. Например, в патенте США № 5440013, выданном Kahn, и опубликованной Международной заявке на патент РСТ WO94/034494 на имя Rahn описаны конформационно затрудненные непептидные соединения, которые имитируют трехмерную структуру обращенных витков.
Хотя значительные успехи были достигнуты в синтезе и идентификации конформационно затрудненных пептидных миметиков, сохраняется потребность в данной области в маленьких молекулах, которые имитируют вторичную структуру пептидов. Имеется также потребность в данной области в библиотеках, содержащих такие члены, а также способах для синтеза и скрининга членов библиотек против представляющих интерес мишеней, в частности биологических мишеней для идентификации биоактивных членов библиотек. Например, в патенте США № 5929237 и являющемся его частичным продолжением патенте США № 6013458, на имя Kahn, описаны также конформационно затрудненные соединения, которые имитируют вторичную структуру областей обращенных витков биологически активных пептидов и белков.
Настоящее соединение также удовлетворяет этим потребностям и обеспечивает дополнительные родственные преимущества предоставлением конформационно затрудненных соединений, которые имитируют вторичную β-цепочечную структуру биологически активных пептидов и белков.
Краткая сущность изобретения
В сущности, настоящее изобретение относится к конформационно затрудненным соединениям, которые имитируют вторичную структуру β-цепочечных структур биологически активных пептидов и белков. Данное изобретение описывает также библиотеки, содержащие такие соединения, а также их синтез и скрининг.
Соединения по настоящему изобретению имеют следующую общую структуру (I):
где А представляет собой -(СН)-, -N- или -СН2-N-, В представляет собой -(С=О) или -(СН2)m-, W представляет собой -(С=О)-, -Y(C=O)-, -NH(C=O)- или отсутствует, Х представляет собой -NH-, -NH(C=O)- или отсутствует, Y представляет собой кислород или серу, Z представляет собой кислород или водород, L представляет собой водород, R5, -C(O)NHR3 или его эквиваленты, n равно 0 или 1 и m равно 1 или 2; R1, R2, R3, R4 и R5 являются одинаковыми или различными и независимо выбраны из водорода, остатка боковой цепи аминокислоты или ее производного, остатка молекулы, линкера и твердого носителя, и структуру стереоизомеров указанных соединений.
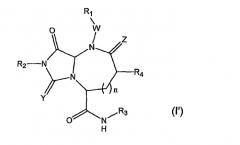
В одном варианте осуществления Х отсутствует, А представляет собой -N-, B представляет собой -(С=О)-, L представляет собой -С(О)NHR3 и другие группы имеют значения, указанные выше для структуры (I), так что соединения изобретения имеют следующую структуру (I'):
Необязательно, W отсутствует и Z представляет собой кислород.
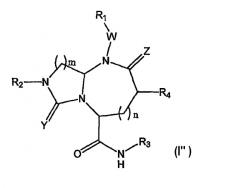
В одном варианте осуществления Х отсутствует, A представляет собой -N-, B представляет собой -(СН2)m-, L представляет собой -С(О)NHR3- и другие группы имеют значения, указанные выше в связи со структурой (I), так что соединения изобретения имеют следующую структуру (I"):
Необязательно, W отсутствует и Z представляет собой кислород.
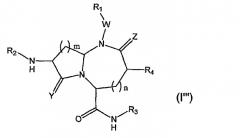
В одном варианте осуществления Х представляет собой -NH-, A представляет собой -(СН)-, B представляет собой -(СН2)m-, L представляет собой -С(О)NHR3 и другие группы имеют значения, указанные выше в связи со структурой (I), так что соединения изобретения имеют следующую структуру (I"'):
Необязательно, когда Z представляет собой кислород, то W отсутствует.
В одном варианте осуществления А представляет собой -СН2-N-, B представляет собой -(СН2)m-, L представляет собой -С(О)NHR3 и другие группы имеют значения, указанные выше в связи со структурой (I), так что соединения изобретения имеют следующую структуру (I""):
Необязательно, Y представляет собой кислород и/или W отсутствует, и/или Z представляет собой кислород.
Настоящее изобретение относится также к библиотекам, содержащим указанные выше структуры (I), (I'), (I"), (I"') и (I""), а также способам синтеза таких библиотек и способам скрининга их для идентификации биологически активных соединений. Описаны также композиции, содержащие соединение по данному изобретению в комбинации с фармацевтически приемлемым носителем или разбавителем.
Эти и другие аспекты по данному изобретению будут очевидными на основании ссылки на нижеследующее подробное описание и чертежи.
Краткое описание нескольких изображений чертежей
На фиг.1 и 2 показана синтетическая методика получения библиотек по настоящему изобретению и соединений по настоящему изобретению.
На фиг.3 показана синтетическая методика получения библиотеки по настоящему изобретению и соединений по настоящему изобретению, которые более полно описаны в примере 9.
На фиг.4 показана синтетическая методика получения библиотеки по настоящему изобретению и соединений по настоящему изобретению, которые более полно описаны в примере 10.
Подробное описание изобретения
Описаны конформационно затрудненные соединения, которые имитируют вторичную структуру β-цепочечных областей биологически активных пептидов и белков. Такие миметики β-цепочечных структур имеют применение в широком диапазоне областей, включая применение диагностических и терапевтических агентов. Описаны также библиотеки, содержащие миметики β-цепочечных структур по данному изобретению, а также способы скрининга их для идентификации биологически активных членов.
В одном аспекте настоящее изобретение относится к миметикам β-цепочечных структур и химическим библиотекам, содержащим миметики β-цепочечных структур. Миметики β-цепочечной структуры по настоящему изобретению являются применимыми в качестве биоактивных агентов, включающих (но не ограничивающихся перечисленным), применение в качестве диагностических, профилактических и/или терапевтических агентов. Библиотеки миметиков β-цепочечных структур по данному изобретению применяют при идентификации таких биоактивных агентов. На практике по настоящему изобретению библиотеки могут содержать от десятков до сотен тысяч (или больше) индивидуальных миметиков β-цепочечных структур (называемые также здесь «членами»).
В одном аспекте по настоящему изобретению описан миметик β-цепочечной структуры, имеющий следующую структуру (I):
где А представляет собой -(СН)-, -N- или -СН2-N-, В представляет собой -(С=О) или -(СН2)m-, W представляет собой -(С=О)-, -Y(C=O)-, -NH(C=O)- или отсутствует, Х представляет собой -NH-, -NH(C=O)- или отсутствует, Y представляет собой кислород или серу, Z представляет собой кислород или водород (когда Z представляет собой водород, то C=Z представляет собой СН2), L представляет собой водород, R5, -C(O)NHR3 или его эквиваленты, n равно 0 или 1 и m равно 1 или 2; R1, R2, R3, R4 и R5 являются одинаковыми или различными и независимо выбраны из водорода, остатка боковой цепи аминокислоты или ее производного, остатка молекулы, линкера и твердого носителя, и его стереоизомеры.
В одном аспекте изобретения R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из амино-С2-5-алкила, гуанидино-С2-5-алкила, С1-4-алкилгуанидино-С2-5-алкила, ди-С1-4-алкилгуанидино-С2-5-алкила, амидино-С2-5-алкила, С1-4-алкиламидино-С2-5-алкила, ди-С1-4-алкиламидино-С2-5-алкила, С1-3-алкокси, фенила, замещенного фенила, (где заместители независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидина, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензиле независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидино, гидразино, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидино, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бисфенилметила, замещенного бисфенилметила (где заместители независимо выбраны из одного или нескольких из заместителей из амино, амидино, гуанидина, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидино, гидразино, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидрокси), пиридил-С1-4-алкила, замещенного пиридил-С1-4-алкила (где заместители пиридина независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидино, гидразино, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидил-С1-4-алкила, замещенного пиримидил-С1-4-алкила (где заместители пиримидина независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидина, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси или нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4-алкила, замещенного триазин-2-ил-С1-4-алкила (где заместители триазина независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидина, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазол-С1-4-алкила, замещенного имидазол-С1-4-алкила (где заместители имидазола независимо выбраны из одного или нескольких заместителей из амино, амидино, гуанидина, гидразина, амидразонила, С1-4-алкиламино, С1-4-диалкиламино, галогена, перфтор-С1-4-алкила, С1-4-алкила, С1-3-алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинил-С1-4-алкила, N-амидинопиперазинил-N-С0-4-алкила, гидрокси-С2-5-алкила, С1-5-алкиламино-С2-5-алкила, С1-5-диалкиламино-С2-5алкила, N-амидинопиперидинил-С1-4-алкила и 4-аминоциклогексил-С0-2-алкила.
В одном варианте осуществления R1, R2 и R3 являются одинаковыми или различными и представляет собой остаток соединения и R4 выбран из остатка боковой цепи аминокислоты или его производного. В другом варианте осуществления L представляет собой -С(=О)NHR3 и R1, R2 и R3 являются одинаковыми или различными и представляет собой остаток соединения или остаток боковой цепи аминокислоты или его производного и R4 представляет собой водород.
Применяемый здесь термин «остаток боковой цепи аминокислоты» представляет собой любой остаток боковой цепи аминокислоты, присутствующий в существующих в природе белках, включающих в себя (но не ограничивающихся указанным) остатки боковых цепей существующих в природе аминокислот, указанные в таблице 1. Другие остатки боковых цепей существующих в природе аминокислот по данному изобретению включают в себя (но не ограничиваются указанным) остатки боковой цепи 3,5-дибромтирозина, 3,5-дииодтирозина, гидроксилизина, γ-карбоксиглутамата, фосфотирозина и фосфосерина. Кроме того, на практике по данному изобретению можно также применять боковые цепи гликозилированных аминокислот, включающих в себя (но не ограничивающихся перечисленным) гликозилированный треонин, серин и аспарагин.
Кроме остатков боковых цепей существующих в природе аминокислот, остатки боковых цепей аминокислот по настоящему изобретению включают в себя различные их производные. Применяемый здесь термин «производное» остатка боковой цепи аминокислоты включает в себя модификации и/или варианты остатков боковых цепей существующих в природе аминокислот. Например, остатки боковых цепей аминокислот аланина, валина, лейцина, изолейцина и фенилаланина могут быть обычно классифицированы как низшие алкильные, арильные или аралкильные остатки. Производные остатков боковых цепей аминокислот включают в себя другие, имеющие неразветвленную или разветвленную цепь, циклические или нециклические, замещенные или незамещенные, насыщенные или ненасыщенные алкильные остатки с низшей цепью, арильные или арилалкильные остатки.
Применяемые здесь термины «остаток соединения» и «остаток молекулы» используют для обозначения любого остатка, агента, соединения, носителя, молекулы, линкера, аминокислоты, пептида или белка, ковалентно присоединенного к миметику β-цепочечной структуры. Присоединение предпочтительно находится в любом из R1-, и/или R2-, и/или R3-положений. Этот термин включают в себя также остатки боковых цепей аминокислот и их производные.
Применяемый здесь термин «алкильные остатки с низшей цепью» содержат 1-12 атомов углерода, «низшие арильные части» содержат 6-12 атомов углерода и «аралкильные части с низшей цепью» содержат 7-12 атомов углерода. Таким образом, в одном варианте осуществления производное боковой цепи аминокислоты выбрано из С1-12-алкила, С6-12-арила и С7-12-арилалкила и в более предпочтительном варианте из С1-7-алкила, С6-10-арила и С7-11-арилалкил.
Производные боковой цепи аминокислоты по данному изобретению дополнительно включает в себя замещенные производные имеющих низшую цепь алкильных остатков, арильных и арилалкильных остатков, где заместитель выбран из (но не ограничивается ими) одного или нескольких химических остатков:
-ОН, -OR, -COOH, -COOR, -CONH2, -NH2, -NHR, -NRR, -SH, -SR, -CO2R, -SO2H, -SOR и галогена (включая F, Cl, Br и I), где в каждом случае R независимо выбран из имеющих неразветвленную или разветвленную цепь, циклических или нециклических, замещенных или незамещенных, насыщенных или ненасыщенных низших алкильных, арильных или аралкильных остатков. В одном аспекте заместитель имеет меньше, чем 18 атомов углерода. Кроме того, циклические, имеющие низшую цепь алкильные, арильные и арилалкильные остатки по данному изобретению включают в себя нафталин, а также гетероциклические соединения, такие как тиофен, пиррол, фуран, имидазол, оксазол, тиазол, пиразол, 3-пирролин, пирролидин, пиридин, пиримидин, пурин, хинолин, изохинолин и карбазол. Производные боковых цепей аминокислот дополнительно включают в себя гетероалкилпроизводные алкильной части имеющих низшую алкильную цепь алкильных и аралкильных остатков, включающих в себя (но не ограничивающихся перечисленным) алкил- и аралкилфосфонаты и силаны.
В одном аспекте изобретения остатки R1, R2 и R3 выбраны из -ОН, -OR, -COR, -COOR, -CONH2, -CONR, -CONRR, -NH2, -NHR, -NRR, -SO2R и -COSR, где в каждом случае R имеет указанные выше значения.
В следующем варианте осуществления и в дополнении к остатку боковой цепи аминокислоты или ее производному (или остатку соединения в случае R1, R2 и R3) R1, R2 или R3 может быть линкером, облегчающим связывание соединения с другим остатком или соединением. Например, соединения по данному изобретению могут быть связаны с одним или несколькими известными соединениями, такими как биотин, для применения в диагностическом анализе или анализе для скрининга. Кроме того, R1, R2 или R3 может быть линкером, связывающим соединение с твердым носителем (таким как носитель, применяемым в синтезе пептида в твердой фазе), или, в альтернативном случае, может быть самим носителем. В этом варианте осуществления связь с другим остатком, или соединением, или твердым носителем находится предпочтительно у R1-, R2- или R3-положения и более предпочтительно у R3-положения.
В варианте осуществления, когда Х отсутствует, А представляет собой N, B представляет собой -С(=О)- и L представляет собой -С(О)NHR3, β-цепочечные соединения по данному изобретению имеют следующую структуру (I'):
где R1, R2, R3, R4, W, Y, Z и n имеют значения, указанные выше. В предпочтительно варианте осуществления R2 и R3 представляют собой остаток соединения, R1 и R4 выбраны из остатков боковых цепей аминокислот.
В варианте осуществления, когда Х отсутствует, А представляет собой N, В представляет собой -(СН2)m- и L представляет собой -С(О)NHR3, миметики β-цепочечных структур по данному изобретению включают в себя следующую структуру (I"):
где R1, R2, R3, R4, W, Y, Z и n имеют значения, указанные выше. В предпочтительно варианте осуществления R2 и R3 представляют собой остаток соединения и R1 и R4 выбраны из остатков боковых цепей аминокислот.
В более конкретном варианте осуществления, когда Х представляет собой -NH-, А представляет собой -(CH)- и В представляет собой -(СН2)m- и L представляет собой -С(О)NHR3, миметики с β-цепочечной структурой имеют следующую структуру (I"'):
где R1, R2, R3, R4, W, Y, Z, m и n имеют значения, указанные выше.
В более конкретном варианте осуществления, когда А представляет собой -CH2-N-, B представляет собой -(СН2)m- и L представляет собой -С(О)NHR3, соединения по данному изобретению имеют следующую структуру (I""):
В формуле необязательно R1, R2, R3, R4, W, Х, Y, Z, m и n имеют значения, указанные выше, W отсутствует, Z представляет собой кислород и Y представляет собой кислород.
Миметики β-цепочечных структур по данному изобретению могут быть получены с применением подходящих молекул исходных компонентов (далее называемых «компонентными частями»). Коротко говоря, в синтезе миметиков β-цепочечных структур, имеющих структуру (I'), первую и вторую компонентные части сочетают с образованием комбинированного первого-второго промежуточного соединения и, если необходимо, сочетают третью и/или четвертую компонентные части с образованием третьего-четвертого промежуточного соединения (или, если он является коммерчески доступным, можно применять одно третье промежуточное соединение), комбинированное первое-второе промежуточное соединение и третье-четвертое промежуточное соединение (или третье промежуточное соединение) затем сочетают, получая при этом первое-второе-третье-четвертое промежуточное соединение (или первое-второе-третье промежуточное соединение), которое циклизуют с образованием миметиков β-цепочечных структур по данному изобретению. В альтернативном варианте миметики β-цепочечных структур структуры (I') могут быть получены последовательным сочетанием индивидуальных компонентных частей либо постадийно в растворе, либо твердофазным синтезом, как обычно практикуется в твердофазном синтезе пептидов.
В контексте по настоящему изобретению «первая компонентная часть» имеет следующую структуру 1:
где R2, A и В имеют значения, указанные выше, и R представляет собой защитную группу, подходящую для применения в синтезе пептидов. Подходящие группы R включают в себя алкильные группы и в предпочтительном варианте осуществления R представляет собой метильную группу. Такие первые компонентные части могут быть легко синтезированы восстановительным аминированием посредством сочетания СН(OR)2-(CH2)m-CHO с H2N-R2 или замещением в СН(OR)2-(CH2)m-Br.
Вторая компонентная часть по данному изобретению имеет следующую структуру 2:
где L и R4 имеют значения, указанные выше, Р представляет собой аминозащитную группу, пригодную для применения в пептидном синтезе, и Х представляет собой уходящую группу активированной группы карбоновой кислоты. Предпочтительные защитные группы включают в себя трет-бутилдиметилсилил (TBDMS), BOC, FMOC и алло(аллилоксикарбонил). Когда L представляет собой -С(О)NHR3, -NHR3 может быть карбоксилзащитной группой. N-защищенные аминокислоты являются коммерчески доступными, например FMOC-аминокислоты являются доступными из различных источников. Превращение указанных N-защищенных аминокислот во вторые компонентные части по данному изобретению может быть легко достигнуто активацией группы карбоновой кислоты N-защищенной аминокислоты. Подходящие активированные группы карбоновых кислот включают в себя галогенангидриды кислот, где Х представляет собой галогенид, такой как хлорид или бромид, ангидриды кислот, где Х представляет собой ацильную группу, такую как ацетил, реакционноспособные эфиры, такие как эфиры N-гидроксисукцинимида и пентафторфениловые эфиры, и другие активированные промежуточные соединения, такие как активное промежуточное соединение, образованное реакцией сочетания с применением карбодиимида, такого как дициклогексилкарбодиимид (DCC).
В случае азидопроизводного аминокислоты, служащего в качестве второй компонентной части, такие соединения могут быть получены из соответствующей аминокислоты реакцией, описанной Zaloom et al. (J. Org. Chem. 46:5173-76, 1981).
«Третья компонентная часть» по данному изобретению имеет следующую структуру 3:
R1-NH2 или R3-NH2
где R1 и R3 имеют значения, указанные выше. Подходящие третьи компонентные части являются коммерчески доступными из различных источников или могут быть легко получены стандартными органическими синтетическими способами, обычно применяемыми для синтеза первичных аминов.
Более конкретно, имеющие структуру (I') миметики β-цепочечных структур по данному изобретению синтезируют взаимодействием первой компонентной части со второй компонентной частью с получением комбинированного первого-второго промежуточного соединения с последующим либо последовательным взаимодействием комбинированного первого-второго промежуточного соединения с третьей компонентной частью, либо с третьей и четвертой компонентными частями с получением комбинированного первого-второго-третьего-четвертого промежуточного соединения и затем циклизацией промежуточного соединения с получением миметика β-цепочечной структуры.
Общий синтез миметика β-цепочечной структуры, имеющего структуру I', можно выполнить следующим способом. Первую компонентную часть 1 сочетают со второй компонентной частью 2 с применением реагента сочетания, такого как фосген, получая при этом, после удаления N-защитной группы, комбинированное первое-второе промежуточное соединение 1-2, как показано ниже:
где А, В, L, R, R2, R4, P, X и n имеют значения, указанные выше. Х2С(=S) является примером агента сочетания, можно применять другой тип агентов сочетания. Синтезы репрезентативных компонентных частей по данному изобретению описаны в примерах. Соединения-миметики β-цепочной структуры от (I") до (I"') могут быть получены способами, аналогичными синтезу модульного компонента, описанного выше, но с подходящими модификациями для компонентных частей.
В другом аспекте по данному изобретению описаны библиотеки, содержащие миметики β-цепочечных структур по настоящему изобретению. После составления комплекта библиотеки по настоящему изобретению могут быть подвергнуты скринингу для идентификации индивидуальных членов, обладающих биоактивностью. Такой скрининг библиотек на биоактивные члены может включать в себя, например, оценку связывающей активности членов библиотек или оценку действия членов библиотек в функциональном анализе. Скрининг обычно выполняют контактированием членов библиотеки (или субпопуляции членов библиотеки) с представляющей интерес мишенью, такой как, например, антитело, фермент, рецептор или клеточная линия. Члены библиотек, которые способны взаимодействовать с представляющей интерес мишенью, называют здесь «биоактивными членами библиотек» или «биоактивными миметиками». Например, биоактивным миметиком может быть член библиотеки, который способен связываться с антителом или рецептором, который способен ингибировать фермент или который способен вызывать или антагонизировать функциональную реакцию, ассоциированную, например, с линией клеток. Другими словами, скрининг библиотек по настоящему изобретению определяет, какие члены библиотеки способны взаимодействовать с одной или несколькими специфическими биологическими, представляющими интерес мишенями. Когда взаимодействие имеет место, взаимодействие биоактивного миметика (или миметиков) может быть идентифицировано из числа членов библиотеки. Идентификация одного или (ограниченного числа) биоактивного миметика(ов) из библиотеки дает миметики β-цепочечной структуры, которые сами являются биологически активными и, таким образом, являются применимыми в качестве диагностических, профилактических или терапевтических агентов и могут дополнительно применяться для достижения значительного успеха в идентификации главных соединений в этих областях.
Синтез пептидных миметиков библиотеки по настоящему изобретению можно выполнять с применением известных способов синтеза пептидов в комбинации с первой, второй, третьей и, необязательно, четвертой компонентной частью по данному изобретению. Более конкретно, любая аминокислотная последовательность может быть присоединена к N-концевой и/или С-концевой части конформационно затрудненного соединения. С этой целью миметики могут быть синтезированы на твердом носителе (таком как смола РАМ) известными способами (см., например, John M. Stewart and Janis D. Young, Solid Phase Peptide Synthesis, 1984, Pierce Chemical Comp., Rockford, III) или силилсвязанной смоле присоединением спирта (см. Randolph et al., J. Am. Chem. Soc. 117:5712-14, 1995).
Кроме того, комбинацию способов синтеза как в растворе, так и твердой фазе можно применять для синтеза пептидных миметиков по данному изобретению. Например, твердый носитель можно применять для синтеза линейной пептидной последовательности до точки, в которой конформационно затрудненную β-цепь присоединяют к последовательности. Подходящую структуру миметика конформационно затрудненной β-цепи, которую предварительно синтезировали способами синтеза в растворе, можно затем присоединить в качестве следующей «аминокислоты» для синтеза в твердой фазе (т.е. миметик конформационно затрудненной β-цепи, который имеет как N-концевую часть, так и С-концевую часть, можно применять в качестве следующей аминокислоты, которую нужно присоединить к линейному пептиду). При введении структуры миметика конформационно затрудненной β-цепи в последовательность могут быть затем присоединены дополнительные аминокислоты для завершения образования пептида, связанного с твердым носителем. В альтернативном варианте линейные пептидные последовательности с защищенной N-концевой и С-концевой частями могут быть синтезированы на твердом носителе, отделены от носителя и затем подвергнуты сочетанию с миметиками структур с конформационно ограниченной β-цепью в растворе с применением известных способов сочетания в растворе.
В другом аспекте по данному изобретению описаны способы конструирования библиотек. Традиционные комбинаторные химические способы (см., например, Gallop et al., J. Med. Chem. 37:1233-1251, 1994) делают возможным быстрое получение огромного числа соединений последовательным присоединением реагентов к основному молекулярному каркасу. Комбинаторные способы применяли для конструкции библиотек пептидов, полученных из существующих в природе аминокислот. Например, посредством применения 20 смесей 20 подходящим образом защищенных и разных аминокислот и сочетания каждого с одним из 20 аминокислот создают библиотеку 400 (т.е. 202) дипептидов. Повторение процедуры несколько раз приводит к получению библиотеки дипептидов, содержащей приблизительно 20 биллионов (т.е. 208) октапептидов.
В следующем аспекте по данному изобретению описаны способы скрининга библиотек на биоактивность и выделения биоактивных членов библиотеки. Библиотеки по настоящему изобретению можно подвергнуть скринингу на биоактивность различными способами и методами. Обычно анализ для скрининга проводят (1) контактированием библиотеки с представляющей интерес биологической мишенью, такой как рецептор, и предоставлением возможности достижения связывания между миметиками библиотеки и мишенью и (2) детектированием случая связывания подходящим анализом, таким как калориметрический анализ, описанный Lam et al. (Nature 354: 82-84, 1991) или Griminski et al. (Biotechnology 12:1008-1011, 1994) (обе публикации включены здесь в качестве ссылки). В предпочтительном варианте осуществления члены библиотеки находятся в растворе и мишень иммобилизуют на твердой фазе. В альтернативном варианте библиотека может быть иммобилизована на твердой фазе и может быть зондирована контактированием ее с мишенью в растворе.
Синтез пептидных миметиков библиотеки по настоящему изобретению можно выполнить с применением общей схемы для получения библиотеки β-цепочечных миметиков, как показано на фиг.1. Синтез выбранных пептидных мишеней библиотеки бициклических шаблонов по настоящему изобретению выполняли с применением реакторного блока PlexChem, который имеет 96-луночный планшет. В указанной выше схеме "Pol" представляет собой смолу 2-хлортритилхлорида (Novabiochem), подробная процедура представлена ниже.
Стадия 1. Смолу 2-хлортритилхлорида (1 ммоль/г) и раствор Fmoc-R1-аминокислоты (1,5 экв.) и DIEA (2 экв.) в DCE помещают в 96-луночный блок Robinson (Flexchem). Реакционную смесь встряхивают в течение 12 часов при комнатной температуре. Смолу промывают ДМФА, МеОН и DCM.
Стадия 2. К смоле, набухшей в ДМФА перед реакцией, добавляют 25% пиперидин в ДМФА. После этого реакционную смесь встряхивают в течение 30 мин при комнатной температуре. Повторяют стадию удаления защиты и смесь продуктов промывают ДМФА, МеОН и затем DCM. К смоле добавляют раствор 4-R2-амино-2-Fmoc-аминомасляной кислоты (1,5 экв.), DIC (1,5 экв.) и НОВТ (1,5 экв.) в NMP. После того как реакционную смесь встряхивают в течение 12 часов при комнатной температуре, смолу промывают ДМФА, МеОН и затем DCM.
Стадия 3. К смоле, набухшей в ДМФА перед реакцией, добавляют 25% пиперидин в ДМФА. После этого реакционную смесь встряхивают в течение 30 мин при комнатной температуре. Повторяют стадию удаления защиты и смесь продуктов промывают ДМФА, МеОН и затем DCM. К смоле добавляют раствор 2-(9Н-флуорен-9-илметоксикарбониламино)-5,5-диметоксипентановую кислоту (1,5 экв.), DIC (1,5 экв.) и НОВТ (1,5 экв.) в NMP. Реакционную смесь встряхивают в течение 12 часов при комнатной температуре и затем смолу промывают ДМФА, МеОН и затем DCM.
Стадия 4. К смоле, набухшей в ДМФА перед реакцией, добавляют 25% пиперидин в ДМФА. После этого реакционную смесь встряхивают в течение 30 мин при комнатной температуре. Повторяют стадию удаления защиты и смесь продуктов промывают ДМФА, МеОН и затем DCM. К смоле добавляют раствор коммерчески доступной R3-кислоты (1,5 экв.), DIC (1,5 экв.) и НОВТ (1,5 экв.) в NMP. Реакционную смесь встряхивают в течение 12 часов при комнатной температуре и затем смолу промывают ДМФА, МеОН и затем DCM.
Стадия 5. Смолу обрабатывают муравьиной кислотой (1,2 мл на ка