Способ конструирования рекомбинантного штамма staphylococcus carnosus
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к генной инженерии, и представляет собой способ конструирования рекомбинантного штамма Staphylococcus carnosus - продуцента фермента нитритредуктазы. Данный способ предусматривает получение промежуточного штамма Staphylococcus carnosus thyA- с помощью триметоприма и замещение в нем промоторной части оперона, отвечающего за восстановление нитритов при дыхании. Изобретение позволяет получить новый штамм, пригодный для снижения концентрации остаточного нитрита в пищевых продуктах. 4 ил.
Реферат
Изобретение относится к области молекулярной биологии, генной инженерии, биохимии и представляет собой рекомбинантный штамм - продуцент фермента нитритредуктазы для снижения концентрации остаточного нитрита в пищевых продуктах.
Наиболее распространенный способ повышения уровня транскрипции генов в бактериях рода Staphylococcus заключается в замещении промоторной части гена на более сильный промотор. Такая замена приводит к увеличению синтеза соответствующего белкового продукта [US 6436694].
Нитрит натрия вводят в рецептуру мясных продуктов для придания им розово-красного цвета, ингибирования спорообразования и роста нежелательной микрофлоры, также он оказывает антиокислительное действие на липиды и участвует в образовании вкуса и аромата соленого мяса. В производстве мясных продуктов предусмотрено восстановление нитрита с помощью химических веществ и бактериальных заквасок. При допускаемых уровнях вводимого нитрита и микроорганизмов, бактериальные закваски не способны полностью восстановить нитрит, что приводит к образованию остаточного нитрита. Наряду с "положительным" действием, существует проблема остаточного нитрита, который при повышенной концентрации, является мутагеном и токсичным веществом, приводит к образованию нитрозаминов и способен вызывать метгемоглобинию [Archer D.L., 2002]. Разрешенный уровень остаточного нитрита в нашей стране составляет от 30 до 50 мг на 1 кг продукта, он не является опасным, но вносит вклад в общий пул нитрита [Жукова Г.Ф. и др., 1999]. Многочисленные работы, направленные на поиск альтернатив нитриту, не привели к желаемому результату [Adams J.B., 1997].
В литературе отсутствуют данные о применении генетически модифицированных штаммов для снижения уровня остаточного нитрита. Таким образом, предлагаемое техническое решение соответствует критериям: "новизна", "изобретательский уровень", "промышленно применимо".
Задача изобретения состоит в получении штамма Staphylococcus carnosus - продуцента фермента нитритредуктазы для снижения концентрации остаточного нитрита в пищевых продуктах.
Решение поставленной задачи достигается в способе конструирования штамма Staphylococcus carnosus продуцента фермента нитритредуктазы, предусматривающем получение промежуточного штамма thyA- с помощью триметоприма и замещение в нем промоторной части оперона, отвечающего за восстановление нитритов при дыхании.
Сущность изобретения заключается в том, что в штамме Staphylococcus carnosus проводят замену исходной промоторной области нитритредуктазного оперона на более сильный промотор гена, кодирующего фермент глицеральдегид-3-фосфат дегидрогеназу. На основе штамма Staphylococcus carnosus B-8953 (ВКПМ, 117545, г.Москва, 1-й Дорожный проезд, д.1), с помощью триметоприма, получен мутант Staphylococcus carnosus LIA-25 (thyA-), неспособный расти на среде GS без тимидина. Такой тип мутации возникает спонтанно в гене thyA и является допустимым при генетической модификации штаммов применяемых в пищевом производстве [Sasaki Y., 2004].
Между генами nirC и nirR нитритредуктазного оперона Staphylococcus carnosus LIA-25 (thyA-) [Neubauer H. и др., 1999], вводят конструкцию, состоящую из двух элементов: гена тимидилат синтетазы(thyA) и промотора гомологичного гена глицеральдегид-3-фосфат дегидрогеназы (gap), оба элемента получают из хромосомы исходного штамма В-8953.
Введение дополнительных элементов в хромосому осуществляют с помощью термочувствительной плазмиды рВТ2 [Bruckner R. и др., 1993], несущей конструкцию для интеграции с использованием ПЦР. Плазмида была удалена после интеграции с помощью нагревания до пермессивной температуры. Таким образом, мутантный штамм был комплементирован геном thyA и приобрел способность расти на среде GS без тимидина, а нитритредуктазный оперон оказался под контролем промотора гена gap.
Полученный с помощью генетической инженерии штамм был назван Staphylococcus carnosus LIA-96 и заложен в коллекцию ВКПМ под номером В-9518. Он показал в 1,5 раза большую скорость восстановления ионов нитрита в L-среде по сравнению с исходным штаммом.
Таким образом, уровень остаточного нитрита в сырокопченых колбасах и деликатесных мясных изделиях может быть значительно снижен при использовании штамма Staphylococcus carnosus GM, что в свою очередь приведет к уменьшению уровня риска для здоровья потребителя.
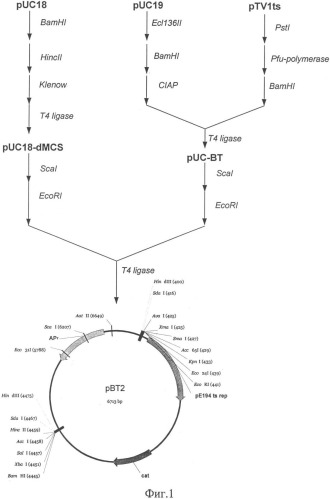
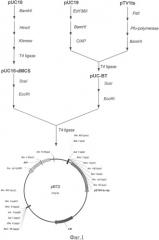
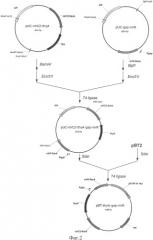
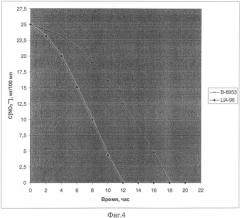
Описание примеров поясняется чертежами. На фиг.1 представлена схема получения термочувствительного вектора рВТ2; на фиг.2 - схема получения плазмиды pBT-thyA-gap-nirR; на фиг.3 - схема замещения промотора оперона nir промотором гена gap в Staphylococcus carnosus LIA-25; на фиг.4 - график изменения концентрации нитрита в L-среде при культивировании штамма Staphylococcus carnosus LIA-96.
Пример 1: Получение термочувствительного вектора рВТ2.
Для репликации, интеграции в геном S.carnosus и дальнейшего удаления под действием температуры была сконструирована термочувствительная плазмида рВТ2.
500 мкг плазмиды pTV1ts [К.Харди, 1990] обрабатывают последовательно эндонуклеазой рестрикции PstI, Pfu полимеразой и далее эндонуклеазой рестрикции BamHI. Фрагмент размером ˜4 т.п.н. лигируют с плазмидой pUC19 обработанной эндонуклеазами рестрикции Есl136II, BamHI, а также щелочной фосфатазой желудка теленка. После переосаждения лигазную смесь трансформируют в штамм E.coli XL-1 (Blue). Клоны, содержащие необходимую вставку ДНК размером ˜4 т.п.н., отбирают на чашках по устойчивости к ампициллину и стандартному тесту на отсутствие активность β-галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Полученная плазмида названа pUC-ВТ.
500 мкг плазмиды pUC18 последовательно обрабатывают эндонуклеазами рестрикции BamHI и HincII, фрагментом Кленова и лигазой фага Т4. После переосаждения лигазную смесь трансформируют в штамм E.coli XL-1 (Blue). Полученная плазмида названа pUC18-dMCS.
По 200 мкг наибольших по молекулярной массе фрагментов, полученных при обработке плазмид pUC-BT и pUC18-dMCS эндонуклеазами рестрикции Seal и EcoRI, лигируют между собой. После переосаждения лигазную смесь трансформируют в штамм Е. coli C600. Полученная плазмида названа рВТ2 (фиг.1).
Пример 2: Получение конструкции для замещения промотора оперона nir и ее введение в состав рВТ2.
500 мкг плазмиды pUC-nirC2-thyA последовательно обрабатывают эндонуклеазами рестрикции BamHI и Есо31I, параллельно 500 мкг плазмиды pUC-gap-nirR последовательно обрабатывают эндонуклеазами рестрикции BglII и Есо31I. Получившиеся наибольшие по размеру фрагменты лигируют между собой. После переосаждения лигазную смесь трансформируют в штамм E.coli XL-1 (Blue). Полученная плазмида названа pUC-nirC2-thyA-gap-nirR.
По 500 мкг векторов pUC-nirC2-thyA-gap-nirR и рВТ2 обрабатывают эндонуклеазой рестрикции SdaI и получившиеся наибольшие по размеру фрагменты лигируют между собой. После переосаждения лигазную смесь трансформируют в штамм E.coli XL-1 (Blue). Полученная плазмида названа pBT-thyA-gap-nirR (фиг.2).
Пример 3: Получение штамма Staphylococcus carnosus - ауксотрофа по тимидину.
Для того чтобы иметь возможность использовать в качестве селективного маркера ген, кодирующий тимидилат синтетазу, необходимо получить соответствующую ауксотрофность в штамме.
Культуру клеток наращивают в 5 мл среды GS((NH4)2HPO4 - 2,5 г/л, КН2PO4 - 1,5 г/л, NaCl - 5 г/л, MgSO4·7H2O (20% раствор) - 0,5 мл, глутамат натрия - 3 г/л, глюкоза - 3 г/л, рН 7) при t=37°C в течение 12 часов. Из полученной культуры отбирают 50 мкл и добавляют к 5 мл среды GS, содержащей 20 мкг/мл тимидина и 1,2 мг/мл триметоприма, и культивируют в течение 16 часов при t=37°C. Далее 500 мкл полученной культуры центрифугируют (n=6000 об/мин, 90 секунд), ресуспендируют в 1 мл физраствора и снова центрифугируют. Осадок ресуспендируют в 100 мкл физраствора и высевают на агаризированную GS-среду, содержащую тимидин в концентрации 20 мкг/мл, и выдерживают при 30°С до появления колоний. Отбирают наибольшие по размеру колонии и делают посев репликой на среду GS с тимидином и без тимидина. Колонии выросшие за 24 часа, но не показавшие рост в течение недели на среде с тимидином, были классифицированы как мутанты thyA-. Один из таких мутантов S.carnosus LIA-25 (thyA-25) был взят для дальнейших исследований.
Пример 4: Замещение промотора оперона nir промотором гена gap в Staphylococcus carnosus LIA-25.
Плазмиду pBT-thyA-gap-nirR трансформируют в компетентные клетки штамма S.carnosus LIA-25. Трансформанты растят в течение 48 часов при 30°С на агаризованой среде GS с добавлением хлорамфеникола (10 мкг/мл). После подтверждения фенотипа, одну колонию наращивают при 38°С в течение 12 часов в 5 мл L-среды (10 г/л пептона, 5 г/л дрожжевого экстракта, 5 г/л NaCl) с эритромицином (2 мкг/мл). Далее 100 мкл культуры высевают на прогретую до 38°С чашку со средой LA, содержащую эритримицин в концентрации 10 мкг/мл и растят при 38°С в течение 12 часов. Появившиеся колонии высевают путем реплики на среду LA с эритромицином (10 мкг/мл) и с эритромицином (10 мкг/мл) и хлорамфениколом (10 мкг/мл). Колонии, не выросшие на среде с хлорамфениколом и эритромицином, были проверены путем ПЦР на наличие замены промоторов гена nirR с использованием праймеров TTTTGACGTCCCTGCAGGATGGTTATGCAAAATCATAAAAC (nirC2-F) и CGTGTCGCACTGATAGGC (nirRconf-R).
Схема процесса интеграции плазмиды pBT-thyA-gap-nirR изображена на фиг.3.
Штамм, полученный с помощью вектора pBT-thyA-gap-nirR, был назван S.carnosus LIA-96.
Пример 5: Изучение изменения содержания нитрита в L-среде при культивировании штамма Staphylococcus carnosus LIA-96.
Для оценки нитритредуктазной активности полученным продуцентом проведено культивирование штамма Staphylococcus carnosus LIA-96 в L-среде с добавлением нитрита. В L-среду, с добавлением нитрита до конечной концентрации 25 мг на 100 мл вносят штаммы S.carnosus LIA-96 или S.carnosus В-8953 до 108 клеток на 100 мл среды. Проводят культивирование в анаэробных условиях при 37°С и отбирают пробы через равные промежутки в течение 14 часов. Далее измеряют концентрацию нитрита по методике [Xu J. и др., 2000]. На фиг.4 показана динамика изменения концентрации нитрита при использовании для засева штамма-продуцента или исходного штамма.
В образце со штаммом-продуцентом концентрации нитрита снизилась до нулевого уровня за 12 часов, в то время как в образце с исходным штаммом это произошло при культивировании в течение 18 часов. Таким образом, штамм-продуцент снижает концентрацию нитрита быстрее в 1,5 в сравнении с традиционно используемым штаммом.
Рекомбинантный штамм бактерии Staphylococcus carnosus B-8953 - депонированный в коллекции ВКПМ под номером В-9518 - продуцент фермента нитритредуктазы.
Список литературы
1. D.L.Archer, Evidence that ingested nitrate and nitrite are beneficial to health, Journal of Food Protection, 2002, Vol.65(5), p.872-875.
2. Г.Ф.Жукова, М.С.Торская, В.И.Родин, С.А.Хотимченко, N-нитрозамины и нитриты в мясе и мясных продуктах. Вопрос питания, 1999, 68, стр.32-34.
3. J.B.Adams, Food additive-additive interactions involving sulphur dioxide and ascorbic and nitrous acids: a review. Food Chemistry, 1997, Vol.59(3), p.401-409.
4. Sasaki Y., Ito Y. and Sasaki Т., "thyA as a Selection Marker in Construction of Food-Grade Host-Vector and Integration Systems for Streptococcus thermophilus", Applied And Environmental Microbiology, March. 2004, Vol.70(3) p.1858-64.
5. H.Neubauer, I.Pantel, F.Gotz, "Molecular Characterization of the Nitrite-Reducing System of Staphylococcus carnosus", Journal of Bacteriology, March 1999, Vol.181(5), p.1481-1488.
6. R. Bruckner, E. Wagner and F. Gotz, Characterization of a sucrase gene from Staphylococcus xylosus. Journal Of Bacteriology. 1993, Vol.175, p.851-857.
7. Xu J., Xu X., Verstraete W. Adaptation of E.coli cell method for micro-scale nitrate measurement with the Griess reaction in culture media. J Microbiol Methods. 2000 Jun; 41(l):23-33.
8. К.Харди. Плазмиды. Методы. М.: Мир, 1990.
Способ конструирования рекомбинантного штамма Staphylococcus carnosus - продуцента фермента нитритредуктазы, предусматривающий получение промежуточного штамма Staphylococcus carnosus (thyA-) с помощью триметоприма и замещение в нем промоторной части оперона, отвечающего за восстановление нитритов при дыхании, введением между генами nirC и nirR нитритредуктазного оперона Staphylococcus crnosus LIA-25 (thyA-), конструкции, состоящей из двух элементов: гена тимидилат синтетазы (thyA) и промотора гомологичного гена глицеральдегид-3-фосфат дегидрогеназы (gap), причем оба элемента получают из хромосомы исходного штамма Staphylococcus carnosus B-8953.