Фармацевтические композиции, включающие валсартан и ингибиторы нейтральной эндопептидазы (nep)
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к фармацевтической комбинации, включающей: i) антагонист АТ-1 валсартан или его фармацевтически приемлемую соль в единичной суточной дозе от приблизительно 20 мг до приблизительно 320 мг, и (ii) ингибитор NEP, представляющий собой этиловый эфир N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты или N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановую кислоту или их фармацевтически приемлемую соль в единичной суточной дозе от приблизительно 20 мг до приблизительно 800 мг. Кроме того, изобретение относится к набору для лечения, включающему указанную комбинацию. Технический результат заключается в синергетическом эффекте в отношении лечения гипертензии при применении указазнной комбинации. 3 н. и 2 з.п. ф-лы, 6 табл.
Реферат
Ангиотензин II взаимодействует со специфическими рецепторами поверхности клетки-мишени. Было возможно определить подтипы рецепторов, которые называются, например, рецепторы AT 1 и AT 2. В последнее время были сделаны огромные усилия, чтобы идентифицировать вещества, которые связываются с рецептором AT 1. Такие активные ингредиенты часто называют антагонистами ангиотензина II. Вследствие ингибирования рецептора AT 1 такие антагонисты могут применяться, например, как антигипертензивные средства или, среди других показаний, для лечения застойной сердечной недостаточности. Поэтому подразумевается, что антагонистами ангиотензина II являются те активные ингредиенты, которые связываются с подтипом рецептора AT 1.
Ингибиторы системы ренин-ангиотензин являются хорошо известными препаратами, которые снижают кровяное давление и проявляют благотворные воздействия при гипертонии и застойной сердечной недостаточности, как описано, например, N.Eng. J.Med. 316, 23 (1987), 1429-1435. Известно большое количество пептидных и непептидных ингибиторов системы ренин-ангиотензин, наиболее широко изученными являются ингибиторы ангиотензин-превращающего фермента (АСЕ), которые включают препараты каптоприл, эналаприл, лизиноприл, беназеприл и спираприл. Хотя основной тип действия ингибиторов АСЕ включает предупреждение образования сосудосуживающего пептида Ang II, в Hypertension, 16, 4 (1990), 363-370 сообщено, что АСЕ расщепляет различные пептидные субстраты, включая влияющие на сосуды пептиды брадикинин и вещество Р. Было продемонстрировано предотвращение деградации брадикинина ингибиторами АСЕ и сообщено в Circ. Res., 66, 1 (1990), 242-248, что активность ингибиторов АСЕ в некоторых условиях опосредована скорее снижением уровней брадикинина, чем ингибированием образования Ang II. Следовательно, нельзя предположить, что воздействие ингибитора АСЕ объясняется только предотвращением образования ангиотензина и последующим ингибированием системы ренин-ангиотензин.
Нейтральная эндопептидаза (ЕС 3.4.24.11; энкефалиназа; атриопептидаза; NEP) является содержащей цинк металлопротеазой, которая расщепляет различные пептидные субстраты на аминоконцевой стороне ароматических аминокислот. Смотри Biochem. J., 241, (1987), 237-247. Субстраты этого фермента включают, но без ограничения, атриальные натриуретические факторы (ANF, известные также как ANP), мозговой натриуретический пептид (BNP), метионин - и лейцин-энкефалин, брадикинин, нейрокинин А и вещество Р.
ANPs представляет собой семейство сосудорасширяющих, диуретических и антигипертензивных пептидов, которые были предметом многих недавних сообщений в литературе, например, Annu. Rev.Pharm. Tox., 29, (1989), 23-54. Одна форма, ANF 99-126, является циркулирующим в кровеносной системе пептидным гормоном, который высвобождается из сердца в условиях кардиального расширения. Функция ANF состоит в поддержании солевого и водного гомеостаза, а также регуляции кровяного давления. ANF быстро дезактивируется в системе кровообращения по меньшей мере двумя способами: опосредованным рецептором клиренсом, сообщенным в Am. J. Physiol., 256 (1989), R469-R475, и энзиматической дезактивацией через NEP, сообщенной в Biochem. J., 243 (1987), 183-187. Ранее было продемонстрировано, что ингибиторы NEP потенцируют гипотензивный, диуретический, натриуретический и содержащегося в плазме ANF ответы у экспериментальных животных на фармакологическую инъекцию ANF. Потенцирование ANF с помощью двух специфических ингибиторов NEP сообщается Sybertz и др., в J. Pharmacol. Exp. Ther. 250, 2 (1989), 624-631 и в Hypertension, 15, 2 (1990), 152-161, тогда как потенцирование ANF вообще раскрыто в патенте US 4749688. В патенте US 4740499 Olins раскрывает применение тиорфана и келаторфана для потенцирования атриальных пептидов. Более того, ингибиторы NEP снижают кровяное давление и проявляют ANF-подобные эффекты, такие как диурез, и повышенное выделение циклического гуанозин-3',5'-монофосфата (cGMP) при некоторых формах экспериментальной гипертонии. Антигипертензивное действие ингибиторов NEP опосредуется через ANF, потому что антитела к ANF будут нейтрализовать снижение кровяного давления.
Продолжительное и неконтролируемое гипертензивное сосудистое заболевание в конце концов приводит к различным патологическим изменениям в органах-мишенях, таких как сердце и почки. Стабильная гипертензия может привести также к увеличению случаев паралича. Следовательно, существует большая необходимость в оценке эффективности антигипертензивной терапии, в исследовании сердечно-сосудистых конечных точек поражения после снижения кровяного давления, чтобы получить дополнительное представление о преимуществах комбинированной терапии.
Природа гипертензивных сосудистых заболеваний является многофакторной. При определенных обстоятельствах комбинируют препараты с различными механизмами действия. Однако только теоретическое рассмотрение какой-либо комбинации препаратов, имеющих различный способ действия, необязательно приводит к комбинациям с преимущественными эффектами. Соответственно, существует необходимость в более эффективной комбинированной терапии, которая дает менее вредные побочные эффекты.
В одном аспекте настоящее изобретение относится к фармацевтическим комбинациям, включающим валсартан или его фармацевтически приемлемую соль и ингибитор нейтральной эндопептидазы (NEP) или его фармацевтически эффективную соль, необязательно в присутствии фармацевтически приемлемого носителя, и фармацевтические композиции, включающие их.
В другом варианте воплощения настоящее изобретение относится к способам терапии сердечных и родственных почечных состояний путем введения фармацевтической композиции, включающей валсартан плюс ингибитор NEP, или относится к фармацевтической композиции, включающей валсартан или его фармацевтически приемлемые соли и ингибитор нейтральной эндопептидазы (NEP) или его фармацевтически эффективные соли.
В другом варианте воплощения по изобретению настоящее изобретение относится к фармацевтической композиции, включающей валсартан или его фармацевтически приемлемые соли и ингибитор нейтральной эндопептидазы (NEP) или его фармацевтически эффективные соли и диуретик, особенно гидрохлортиазид.
Валсартан является антагонистом рецептора AT 1, (S)-N-(1-карбокси-2-метилпроп-1-ил)-N-пентаноил-N-[2-(1H-тетразол-5-ил)бифенил-4-илметил] амином формулы (I)
и раскрыт в патенте ЕР 0443983 А и патенте US 5399578, раскрытия которых включены в контекст во всей их полноте, как если бы были помещены далее в контексте.
Ингибитор NEP, применимый в упомянутой комбинации, означает соединение формулы (II)
и его фармацевтически приемлемые соли,
где
R2 означает алкил из 1-7 атомов углерода, трифторметил, фенил, замещенный фенил, -(СН2)1-4-фенил или -(СН2)1-4-замещенный фенил;
R3 означает водород, алкил из 1-7 атомов углерода, фенил, замещенный фенил,
-(СН2)1-4-фенил или -(СН2)1-4-замещенный фенил;
R1 означает гидрокси, алкокси из 1-7 атомов углерода или амино;
n означает число 1-15; и
термин «замещенный» фенил относится к заместителю, выбранному из (низш.)алкила из 1-4 атомов углерода, (низш.)алкокси из 1-4 атомов углерода, (низш.)алкилтио из 1-4 атомов углерода, гидрокси, хлора, брома или фтора.
Предпочтительные селективные ингибиторы нейтральной эндопептидазы формулы II включают соединения,
где
R2 означает бензил;
R3 означает водород;
n означает число от 1 до 9; и
R1 означает гидрокси.
Еще более предпочтительный селективный ингибитор нейтральной эндопептидазы формулы II описывается в литературе как SQ 28603, который означает соединение формулы II,
где
R2 означает бензил;
R3 означает водород;
n означает 1; и
R1 означает гидрокси.
Получение селективных ингибиторов нейтральной эндопептидазы формулы II, где R2 иной, чем трифторметил, раскрывается Delaney и др. в патенте US 4722810. Получение селективных ингибиторов нейтральной эндопептидазы формулы II, где R2 означает трифторметил, раскрывается Delaney и др. в патенте US 5223516.
Ингибиторы NEP в объеме по настоящему изобретению включают соединения, раскрытые в патенте US 4610816, вставленные в контекст, путем цитирования, включая в особенности N-[N-[1(S)-карбоксил-3-фенилпропил]-(S)-фенилаланил]-(S)-изосерин и N-N-[((1S)-карбокси-2-фенил)этил]-(S)-фенилаланил]-β-аланин; соединения, раскрытые в патенте US 4929641, в особенности N-[2(S)-меркаптометил-3-(2-метилфенил)-пропионил]метионин; SQ 28603, (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]-β-аланин), раскрытый в заявке 84/0670; UK 69578 раскрывает цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]карбонил]амино]циклогексанкарбоновую кислоту и ее активный энантиомер(ы); тиорфан и его энантиомеры; ретротиорфан; фосфорамидон; и SQ 29072, (7-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]-гептановая кислота). Также полезными для применения являются любые депо-формы перечисленных выше ингибиторов NEP, например соединения, в которых одна или несколько карбоксильных групп этерифицированы.
Ингибиторы NEP в объеме по настоящему изобретению включают также соединения, раскрытые в патенте US 5217996, в особенности этиловый эфир N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты и N-(3-карбокси-1-оксопропил)-(4S)-n-фенгилфенилметил-4-амино-2R-метилбутановую кислоту или в каждом случае его или ее фармацевтически приемлемую соль; соединения, раскрытые в патенте ЕР 00342850, в особенности (S)-цис-4-[1-[2-(5-инданилоксикарбонил)-3-(2-метоксиэтокси)пропил]-1-циклопентанкарбоксамидо]-1-циклогексанкарбоновая кислота; соединения, раскрытые в патенте GB 02218983, в особенности 3-(1-[6-эндогидроксиметилбицикло[2,2,1]гептан-2-экзокарбамоил]циклопентил)-2-(2-метоксиэтокси)пропановая кислота; соединения, раскрытые в заявке WO 92/14706, в особенности метиловый эфир N-(1-(3-(N-трет-бутоксикарбонил-(S)-пролиламино)-2(S)-трет-бутоксикарбонилпропил)циклопентанкарбонил)-O-бензил-(S)-серина; соединения, раскрытые в патенте ЕР 00343911; соединения, раскрытые в патенте JP 06234754; соединения, раскрытые в патенте ЕР 00361365, в особенности 4-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]бензойная кислота; соединения, раскрытые в заявке WO 90/09374, в особенности 3-[1-(цис-4-карбоксикарбонил-цис-3-бутилциклогексил-1-карбамоил)циклопентил]-2S-(2-метоксиэтоксиметил)пропановая кислота; соединения, раскрытые в патенте JP 07157459, в особенности N-((2S)-2-(4-бифенилметил)-4-карбокси-5-феноксивалерил)глицин; соединения, раскрытые в заявке WO 94/15908, в особенности N-(1-(N-гидроксикарбамоилметил)-1-циклопентанкарбонил)-L-фенилаланин; соединения, раскрытые в патенте US 5273990, в особенности (S)-(2-бифенил-4-ил)-1-(1H-тетразол-5-ил)этиламино)метилфосфоновая кислота; соединения, раскрытые в патенте US 5294632, в особенности (S)-5-(N-(2-(фосфонометиламино)-3-(4-бифенил)пропионил)-2-аминоэтил)тетразол; соединения, раскрытые в патенте US 5250522, в особенности β-аланин, 3-[1,1'-бифенил]-4-ил-N-[дифеноксифосфинил)метил]-L-аланин; соединения, раскрытые в патенте ЕР 00636621, в особенности N-(2-карбокси-4-тиенил)-3-меркапто-2-бензилпропанамид; соединения, раскрытые в заявке WO 93/09101, в особенности 2-(2-меркаптометил-3-фенилпропионамидо)тиазол-4-илкарбоновая кислота; соединения, раскрытые в патенте ЕР 00590442, в особенности ((L)-(1-((2,2-диметил-1,3-диоксолан-4-ил)-метокси)карбонил)-2-фенилэтил)-L-фенилаланил)-β-аланин, N-[N-[(L)-[1-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил] -2-фенилэтил]-L-фенилаланил]-(R)-аланин, N-[N-[(L)-1-карбокси-2-фенилэтил]-L-фенилаланил]-(R)- аланин, этиловый эфир N-[2-ацетилтиометил-3-(2-метилфенил)пропионил]метионина, N-[2-меркаптометил-3-(2-метилфенил)пропионил]метионин, N-[2(S)-меркаптометил-3-(2-метилфенил)пропаноил]-(S)-изосерин, N-(S)-[3-меркапто-2-(2-метилфенил)пропионил]-(S)-2-метокси-(R)-аланин, N-[1-[[1(S)-бензилоксикарбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, N-[1-[[1(S)-карбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)-метионин, N-(3-фенил-2-(меркаптометил)пропионил)-(S)-4-(метилмеркапто)метионин, N-[2-ацетилтиометил-3-фенилпропионил]-3-аминобензойная кислота, N-[2-меркаптометил-3-фенилпропионил]-3-аминобензойная кислота, N-[1-(2-карбокси-4-фенилбутил)циклопентанкарбонил]-(S)-изосерин, этиловый эфир N-[1-(ацетилтиометил)циклопентанкарбонил]-(S)-метионина, 3(S)-[2-(ацетилтиометил)-3-фенилпропионил]амино-c-капролактам; и соединения, раскрытые в заявке WO 93/10773, в особенности этиловый эфир N-(2-ацетилтиометил-3-(2-метилфенил)пропионил)метионина.
Диуретик означает, например, производное тиазида, выбранное из группы, состоящей из хлортиазида, гидрохлортиазида, метилклотиазида и хлорталидона. Наиболее предпочтительным является гидрохлортиазид. Соединения, которые должны быть скомбинированы, могут присутствовать в виде фармацевтически приемлемых солей. Если эти соединения содержат, например, по меньшей мере один основный центр, они могут образовать кислотно-аддитивные соли. Соответствующие кислотно-аддитивные соли могут также образоваться, имея при необходимости дополнительно присутствующий основный центр. Соединения, содержащие по меньшей мере одну кислотную группу (например, СООН), могут также образовать соли с основаниями. Кроме того, могут быть образованы соответствующие внутренние соли, если соединение содержит, например, как карбоксигруппу, так и аминогруппу.
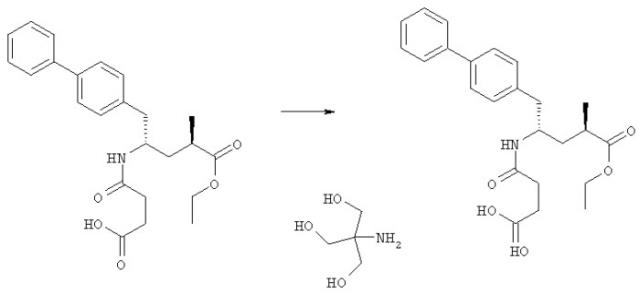
Что касается этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты, то предпочтительные соли включают натриевую соль, раскрытую в патенте US 5217996, соль с триэтаноламином и соль с трис(гидроксиметил)аминометаном. Получение соли с триэтаноламином и соли с трис(гидроксиметил)аминометаном может быть осуществлено следующим образом.
Триэтаноламин: к этиловому эфиру N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты (349 мг, 0,848 ммолей) прибавляли 5 мл этилового эфира и 0,113 мл (0,848 ммолей) триэтаноламина в 1 мл этилацетата. Твердое вещество собирали и сушили, плавя при 69-71°С.
Трис(гидроксиметил)аминометан: к этиловому эфиру N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты (3,2 г, 7,78 ммоля) прибавляли 32 мл этилацетата и 940 мг (7,78 ммоля) трис(гидроксиметил)аминометана. Суспензию разбавляли 45 мл этилацетата и нагревали при кипении в течение ночи (примерно 20 ч). Реакционную смесь охлаждали до 0°С, фильтровали, твердое вещество промывали этилацетатом и сушили, плавя при 114-115°С.
Соли этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты с триэтаноламином и трис(гидроксиметил)аминометаном являются новыми и могут быть использованы в качестве ингибиторов NEP. Другим вариантом воплощения по настоящему изобретению являются упомянутые новые соли, их применение в качестве ингибиторов NEP, особенно для предупреждения и терапии состояний и заболеваний, ассоциированных с ингибированием NEP, фармацевтическая композиция, включающая эти соли и их комбинации с валсартаном, в особенности для лечения состояний и заболеваний, как раскрывается для комбинаций по настоящему изобретению выше и далее.
Неожиданно было найдено, что комбинация валсартана и ингибитора NEP дает больший терапевтический эффект, чем введение валсартана, ингибиторов АСЕ или ингибиторов NEP по отдельности, и способствует образованию ангионевротического отека меньше, чем наблюдается при введении одного ингибитора вазопептидазы. Более высокая эффективность может быть также обоснована как увеличенная продолжительность действия. Продолжительность действия можно контролировать или как время возвращения к базисной линии перед следующей дозой, или как площадь под кривой (AUC) и выражать как результат изменения кровяного давления в мм ртутного столба (изменение в мм рт.ст.) и продолжительность эффекта (минуты, часы или дни).
Дальнейшие преимущества состоят в том, что могут использоваться более низкие дозы индивидуальных препаратов, подлежащих комбинированию по настоящему изобретению, чтобы снизить дозирование, например, необходимо, чтобы в большинстве случаев дозы не только были меньше, но также и применялись реже, или могли использоваться, чтобы понизить частоту побочных эффектов. Комбинированное введение валсартана или его фармацевтически приемлемой соли и ингибитора NEP или его фармацевтически приемлемой соли приводит к значительному отклику у большего процента подвергшихся терапии пациентов, т.е. приводит к большей скорости отклика отвечающего организма, безотносительно от лежащей в основе этиологии состояния. Это соответствует желаниям и потребностям пациентов, которые должны быть подвергнуты терапии.
Можно показать, что комбинированная терапия с валсартаном и ингибитором NEP приводит к более эффективной антигипертензивной терапии (для злокачественной, первичной артериальной, вазоренальной, диабетической, изолированной систолической или другого симптоматического типа гипертензии) посредством улучшенной эффективности, а также большей скорости отклика отвечающего организма. Комбинация также полезна при лечении или предупреждении сердечной недостаточности, такой как (острая или хроническая) застойная сердечная недостаточность, левожелудочковая дисфункция и гипертрофическая кардиомиопатия, диабетическая кардиальная миопатия, наджелудочковая и желудочковая аритмии, фибрилляция предсердий, трепетание предсердий или вредная для здоровья реконструкция сосудов. Кроме того, было показано, что терапия валсартаном и ингибитором NEP доказала, что является полезной при лечении и предупреждении инфаркта миокарда и его последствий. Комбинация валсартан плюс ингибитор NEP полезна также в терапии атеросклероза, стенокардии (устойчивой или неустойчивой) и почечной недостаточности (диабетической и недиабетической). Более того, комбинированная терапия, использующая валсартан и ингибитор NEP, может улучшить эндотелиальную дисфункцию, обеспечивая тем самым преимущество при заболеваниях, при которых нормальная функция эндотелия нарушена, таких как сердечная недостаточность, стенокардия и диабет. Кроме того, комбинация по настоящему изобретению может быть использована для лечения и предупреждения вторичных альдостером, первичной и вторичной легочной гипертензии, состояний почечной недостаточности, таких как диабетическая нефропатия, гломерулонефрит, склеродермы, гломерулярного склероза, протеинурии при первичном почечном заболевании и также почечной васкулярной гипертензии, диабетической ретинопатии, ведения других сосудистых нарушений, таких как мигрень, болезнь периферических сосудов, болезни Рейно, просветной гиперплазии, дисфункции сознания (такой, как болезнь Альцгеймера), глаукомы и паралича.
Структура активных агентов, идентифицированных непатентованными или торговыми названиями, или кодовые номера можно получить из действующего издания стандартного руководства "The Merck Index" или из баз данных, например Life Cycle Patents International (например, IMS World Publications). Соответствующее их содержание этим включено путем цитирования. Любой специалист в этой области полностью способен идентифицировать активные агенты и, основываясь на этих ссылках, способен таким образом получить и исследовать фармацевтические показания и свойства на стандартных экспериментальных моделях как in vitro, так и in vivo.
Предмет ингибиторов NEP, отнесенный, например, к патентам US, EP, GB, JP или заявкам WO, настоящим включен путем цитирования, особенно соответствующие ингибиторы NEP и их фармацевтически приемлемые соли и фармацевтические композиции, которые приведены в формуле изобретения или раскрыты в рабочих примерах.
Специалист в данной области полностью способен выбрать относящуюся к делу экспериментальную модель, чтобы доказать эффективность комбинации по настоящему изобретению при терапевтических показаниях, указанных выше и далее.
Репрезентативные исследования осуществляли с комбинацией валсартана и этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты, например, применяя следующую методологию.
Эффективность препарата оценивали на различных животных моделях, включая крысу, обработанную ацетатом дезоксикортикостерона и солью (DOGA-соль), и крысу со спонтанной гипертензией (SHR) или поддерживаемую на нормальном солевом рационе, или с солевой нагрузкой (4-8% соли в корме крысы или 1% хлористый натрий в качестве питьевой воды).
Экспериментальная модель DOCA-соль использует протокол или острого, или хронического исследования. Методика острого исследования включает оценку эффектов различных исследуемых веществ в течение шестичасового экспериментального периода, используя крыс с постоянно находящимися бедренным артериальным и венозным катетерами. Методика острого исследования оценивает исследуемые вещества по их способности снижать кровяное давление в ходе установленной фазы DOCA-солевой гипертензии. В противоположность этому методика хронического исследования оценивает способность исследуемых веществ предотвращать или задерживать повышение кровяного давления в ходе эволюционной фазы DOCA-солевой гипертензии. Поэтому кровяное давление при методике хронического исследования будет контролироваться посредством радиодатчика. Радиодатчик имплантируется хирургически в абдоминальную аорту крысы перед началом обработки DOCA-солью и, таким образом, перед индукцией гипертензии. Кровяное давление постоянно контролируется в течение периодов до 6 недель (приблизительно одну неделю перед введением DOCA-соли и в течение 5 недель после).
Крысам давали наркоз с 2-3% изофлураном в ингаляционном кислороде, затем с помощью амитала натрия (амобарбитала) в дозе 100 мг/кг внутрибрюшинно. Уровень наркоза оценивали с помощью характеристики спокойного ритмичного дыхания.
Методика острого исследования
Крыс подвергали односторонней нефрэктомии во время имплантации DOCA. Шерсть скрепляли зажимами на левом боку и тыльной стороне шеи и обрабатывали стерильными тампонами со спиртом и повидоном/йодом. В ходе хирургического вмешательства крыс помещали на согревающую подушечку, чтобы поддерживать температуру при 37°С.
Делали надрез 20 мм через кожу и находящуюся под ней мышцу, чтобы выделить левую почку. Почку освобождали от окружающей ткани, выводили временно на поверхность тела, и две лигатуры (шелк 3-0) надежно закрепляли вокруг почечной артерии и вены, расположенных проксимально к их соединению с аортой. Затем почечную артерию и вену перерезали и почку удаляли. Мышечную и кожную раны закрывали хирургическим швом (шелк 4-0) и скрепками для ран из нержавеющей стали соответственно. В то же самое время делали надрез 15 мм на тыльной стороне шеи и имплантировали подкожно гранулу с высвобождением активного ингредиента в течение 3 недель (Innovative Research of America, Florida), содержащую ацетат дезоксикортикостерона (100 мг/кг). Рану затем закрывали зажимами из нержавеющей стали, и обе раны обрабатывали повидоном/йодом; крысам проводили постхирургическую внутримышечную инъекцию пенициллина G (100000 ЕД) на фоне прокаина и подкожно водили бупренорфин (0,05-0,1 мг/кг). Крысам незамедлительно ставили питьевую воду, содержащую 1% хлористого натрия и 0,2% хлористого калия; данная обработка продолжалась по крайней мере 3 недели, за это время животные становились гипертензивными и доступными для экспериментирования.
За сорок восемь часов до проведения опытов животным давали наркоз с изофлураном и имплантировали катетеры в бедренную артерию и вену для измерения давления, сбора крови и введения исследуемых соединений. Крысам давали восстановиться в течение 48 ч, когда держали их привязанными в клетке для обитания из органического стекла, которая служила также экспериментальной камерой.
Методика хронического исследования
Данная методика такая, как описана выше, кроме того, что крысам имплантировали радиодатчик за 7-10 дней до односторонней нефрэктомии и начала обработки DOCA и солью. Кроме того, крысы не подвергались хирургическому вмешательству для установки бедренного артериального и венозного катетеров. Радиодатчики имплантировали, как описано М.К.Bazil, С.Krulan и R.L.Webb. Telemetric monitoring of cardiovascular parameters in conscious spontaneously hypertensive rats. J.Cardiovasc.Pharmacol. 22:897-905, 1993.
Затем протоколы вводили в компьютер для измерения кровяного давления, скорости сердечных сокращений и т.д. в заранее определенных временных точках. Данные базисной линии собирали в различные временные точки и в течение различных интервалов времени. Например, базисная линия значений предварительной дозы обычно состоит из совокупности данных и усреднения в течение 3 последующих 24-часовых периодов времени перед введением препарата.
Кровяное давление, скорость сердечных сокращений и активность определяли в различных заранее выбранных временных точках до, в ходе и после введения препарата. Все измерения проводили на неограниченных и неповрежденных животных. Самое большое время исследования, определенное по комбинации нескольких критериев жизни, могло быть длиной в девять месяцев. Для исследований с данной продолжительностью крысам давали перорально (1-3 мл/кг наполнителя) не более чем дважды в день ежедневно или вводили препарат в воде для питья или перемешанным с кормом. Для исследований с более короткой продолжительностью, т.е. до 8 недель, препараты вводили с помощью подкожно имплантированных осмотических мини-насосов. Осмотические мини-насосы выбирали, основываясь на скорости и времени доставки препарата. Дозы валсартана колебались в пределах от 1 до 10 мг/кг/день, и дозы этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты изменялись в пределах от 10 до 50 мг/кг/день.
Кроме того, крыс со спонтанной гипертензией (SHR) использовали для изучения эффектов валсартана в комбинации с этиловым эфиром N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты. Гипертензивный фон SHR модифицировали или с помощью хронической солевой нагрузки в попытке подавить систему ренин-ангиотензин (RAS), или хроническим солевым истощением, чтобы активировать RAS у крыс со спонтанной гипертензией. Эти манипуляции будут осуществляться, чтобы более широко оценить эффективность различных исследуемых веществ. Эксперименты проводили на крысах со спонтанной гипертензией (SHR), поставляемых Taconic Farms, Germantown, New York (Tac:N(SHR)fBR). Радиотелеметрическое устройство (Data Sciences International, Inc., St. Paul, Minnesota) имплантировали в нижнюю абдоминальную аорту у всех исследуемых животных в возрасте между 14 и 16 неделями. Всем SHR давали восстановиться от процедуры хирургической имплантации в течение по меньшей мере 2 недель перед началом экспериментов. Сердечно-сосудистые параметры непрерывно контролировались с помощью радиодатчика и передавались на радиоприемное устройство, где превращенный в цифровую форму сигнал затем улавливался и хранился с использованием компьютеризованной системы накопления данных. Кровяное давление (среднее артериальное, систолическое и диастолическое давление) и скорость сердечных сокращений контролировали у находящихся в сознании, свободно передвигающихся и неповрежденных SHR, находящихся в клетках для обитания. Артериальное кровяное давление и скорость сердечных сокращений измеряли каждые 10 мин в течение 10 с и регистрировали. Данные, сообщенные для каждой крысы, представляют средние значения, усредненные в течение 24-часового периода и составленные из 144 десятиминутных замеров, собираемых каждый день. Значения базисной линии для кровяного давления и скорости сердечных сокращений состоит из среднего значения трех последовательных 24-часовых замеров, полученных перед началом обработок препаратом. Все крысы отдельно размещались в помещении с контролируемыми температурой и влажностью и содержались при 12-часовом цикле свет-темнота.
Помимо сердечно-сосудистых параметров, у всех крыс регистрировали также данные измерений массы тела. Препараты вводили в воде для питья перорально через желудочный зонд или с помощью осмотических мини-насосов, как указано выше. В случае введения в воде для питья потребление воды измеряли пять раз в неделю. Дозы валсартана и этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты затем рассчитывали, основываясь на потреблении воды для каждой крысы, концентрации лекарственного вещества в питьевой воде и индивидуальных массах тела. Все растворы препаратов приготавливали свежими каждые 3-4 дня. В комбинации используются более низкие дозы каждого препарата, и соответственно валсартан вводится в диапазоне 1-30 мг/кг/день и этиловый эфир N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты в дозах ниже 50 мг/кг/день. Однако в случаях, когда при терапии комбинацией повышается скорость ответа организма, дозы идентичны тем, которые применяются в монотерапии.
Когда препараты вводятся перорально с помощью желудочного зонда, доза валсартана изменяется в пределах от 1 до 50 мг/кг/день, а этилового эфира N-(3-карбокси-1-оксопропил)-(4S)-n-фенилфенилметил)-4-амино-2R-метилбутановой кислоты не превышает 100 мг/кг/день.
По завершении хронических исследований SHR и обработанным DOCA-солью крысам давали наркоз и быстро удаляли сердце. После отделения и удаления ушек предсердия левый желудочек и левый плюс правый желудочек (в сумме) взвешивали и регистрировали. Левожелудочковую и суммарную желудочковую массу затем приводили к массе тела и описывали. Все величины, сообщенные для кровяного давления и массы сердца, представляют групповое среднее значение ± стандартное отклонение.
Сосудистую функцию и структуру оценивали после обработки, чтобы определить благоприятные воздействия комбинации. SHR исследовали в соответствии с методиками, описанными Intengan H.D., Thibault G., Li J.S., Schiffrin E.L., Circulation 1999, 100 (22): 2267-2275. Подобным образом методология оценки сосудистой функции у крыс, обработанных DOCA-солью, описана Intengan H.D., Park J.B., Schiffrin, E.L., Hypertension, 1999, 34(4, часть 2): 907-913.
Имеющиеся результаты указывают на неожиданный терапевтический эффект комбинации по изобретению.
В одном аспекте объектом данного изобретения является обеспечение фармацевтической комбинированной композиции, например, для лечения или предупреждения состояния или заболевания, выбранного из группы, состоящей из гипертензии, сердечной недостаточности, такой как (острая и хроническая) застойная сердечная недостаточность, левожелудочковой дисфункции и гипертрофической кардиомиопатии, диабетической кардиальной миопатии, наджелудочковой и желудочковой аритмий, фибрилляции предсердий, трепетания предсердий, вредной для здоровья реконструкции сосудов, инфаркта миокарда и его последствий, атеросклероза, стенокардии (неустойчивой или устойчивой), почечной недостаточности (диабетической и недиабетической), сердечной недостаточности, грудной жабы, диабета, вторичных альдостером, первичной и вторичной легочной гипертензии, состояний почечной недостаточности, таких как диабетическая нефропатия, гломерулонефрит, склеродермы, гломерулярного склероза, протеинурии при первичном почечном заболевании и также почечной васкулярной гипертензии, диабетической ретинопатии, ведения других сосудистых нарушений, таких как мигрень, болезнь периферических сосудов, болезни Рейно, просветной гиперплазии, дисфункции сознания (такой, как болезнь Альцгеймера), глаукомы и паралича, композиции, которая включает (i) антагонист рецептора АТ-1 валсартан или его фармацевтически приемлемую соль и (ii) ингибитор NEP или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Дополнительным активным ингредиентом может быть диуретик, особенно гидрохлортиазид.
В данной композиции компоненты (i) и (ii) могут быть получены и введены вместе, один после другого или раздельно в одной комбинированной стандартной лекарственной форме или в двух отдельных стандартных лекарственных формах. Стандартная лекарственная форма также может быть заданной комбинацией.
Дополнительным аспектом по настоящему изобретению является способ лечения или предупреждения состояния или заболевания, выбранного из группы, состоящей из гипертензии, сердечной недостаточности, такой как (острая и хроническая) застойная сердечная недостаточность, левожелудочковой дисфункции и гипертрофической кардиомиопатии, диабетической кардиальной миопатии, наджелудочковой и желудочковой аритмий, фибрилляции предсердий, трепетания предсердий, вредной для здоровья реконструкции сосудов, инфаркта миокарда и его последствий, атеросклероза, стенокардии (неустойчивой или устойчивой), почечной недостаточности (диабетической и недиабетической), сердечной недостаточности, грудной жабы, диабета, вторичных альдостером, первичной и вторичной легочной гипертензии, состояний почечной недостаточности, таких как диабетическая нефропатия, гломерулонефрит, склеродермы, гломерулярного склероза, протеинурии при первичном почечном заболевании и также почечной васкулярной гипертензии, диабетической ретинопатии, ведения других сосудистых нарушений, таких как мигрень, болезнь периферических сосудов, болезни Рейно, просветной гиперплазии, дисфункции сознания (такой, как болезнь Альцгеймера), глаукомы и паралича, включающий введение терапевтически эффективного количества комбинации (i) антагониста рецептора АТ-1 валсартана или его фармацевтически приемлемой соли и (ii) ингибитора NEP или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя млекопитающему, нуждающемуся в такой обработке.
Терапевтически эффективное количество каждого компонента комбинации по настоящему изобретению может быть введено одновременно или последовательно и в любом порядке.
Соответствующий активный ингредиент или его фармацевтически приемлемая соль могут быть использованы также в виде гидрата или включать другие растворители, использованные для кристаллизации.
Фармацевтические композиции по изобретению могут быть получены известным, по сути, способом и способами, подходящими для энтерального, такого как пероральное или ректальное, и парентерального введения млекопитающим (теплокровным млекопитающим), охватывая человека, включающими терапевтически эффективное количество фармакологически активного соединения, одного или в комбинации с одним или несколькими фармацевтически приемлемыми носителями, особенно подходящими для энтерального или парентерального применения. Обычные пероральные формы включают таблетки, капсулы, сиропы, эликсиры и суспензии. Обычные инъекционные формы включают растворы и суспензии.
Примерами типичных фармацевтически приемлемых носителей для использования в комбинациях, описанных выше, являются: сахара, такие как лактоза, сахароза, маннит и сорбит; крахмалы, такие как кукурузный крахмал, крахмал из тапиоки и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза в натриевой форме, этилцеллюлоза и метилцеллюлоза, фосфаты кальция, такие как дикальцийфосфат и трикальцийфосфат; сульфат натрия; сульфат кальция; поливинилпирролидон; поливиниловый спирт; стеариновая кислота; стеараты щелочно-земельных металлов, такие как стеарат магния и стеарат кальция; стеариновая кислота; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло и кукурузное масло; неионные, катионные и анионные поверхностно-активные вещества; полимеры этиленгликоля; β-циклодекстрин; жирные спирты; и гидролизованные твердые вещества злаков, а также другие нетоксичные совместимые наполнители, связующие вещества, дезинтеграторы, буферы, консерванты, антиоксиданты, смазывающие агенты, ароматизирующие агенты и тому подобные, обычно применяемые в фармацевтических композициях.
Изобретение относится также к объединению отдельных фармацевтических композиций в виде набора. То есть набора, объединяющего две отдельных единицы: фармацевтическую композицию валсартана и фармацевтическую композицию ингибитора NEP. Набор особенно полезен, когда два отдельных компонента должны быть введены в различных дозированных формах (например, парентеральная форма валсартана и пероральная форма ингибитора NEP) или введены с различными дозовыми