Производные бензоксазола и фармацевтическая композиция, обладающая свойствами лигандов рецептора аденозина
Иллюстрации
Показать всеИзобретение относится к производным бензотиазола общей формулы I и их фармацевтически приемлемым кислотно-аддитивным солям в качестве лигандов рецептора аденозина и к лекарственное средству на их основе. Соединения могут найти применение для лечения и профилактики заболеваний, опосредованных рецепторами аденозина, например эпилепсии, депрессий, наркомании, болезни Паркинсона. В общей формуле I
R обозначает фенил, незамещенный или замещенный галогеном или -СН2N(СН3)(СН2)nОСН3, или обозначает бензил, низший алкил, низшую алкокси-группу, -(СН2)nОСН3, или обозначает пиридин-3- или -4-ил, незамещенный или замещенный низшим алкилом, галогеном, морфолинилом, -(СН2)n-галогеном, -(СН2)nОСН3, -(СН2)n-морфолин-4-ил, или -(СН2)n-пирролидин-1-ил; R1 обозначает фенил, незамещенный или замещенный галогеном тетрагидропиран-4-ил, 3,6-дигидро-2Н-пиран-4-ил или морфолин-4-ил; n обозначает независимо друг от друга 1 или 2. 2 н. и 7 з.п.ф-лы.
Реферат
Настоящее изобретение относится к соединениям общей формулы
где
R обозначает фенил, незамещенный или замещенный галогеном или -СН2Н(СН3)(СН3)nОСН3, или обозначает бензил, низший алкил, низшую алкокси-группу, -(СН2)nОСН3, или обозначает пиридин-3- или -4-ил, незамещенный или замещенный низшим алкилом, галогеном, морфолинилом, -(СН2)n-галогеном, -(СН2)nОСН3, -(СН2)n-морфолин-4-ил, или -(СН2)n-пирролидин-1-ил;
R1 обозначает фенил, незамещенный или замещенный галогеном тетрагидропиран-4-ил, 3,6-дигидро-2H-пиран-4-ил или морфолин-4-ил;
n обозначает независимо друг от друга 1 или 2;
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Неожиданно было найдено, что соединения общей формулы I являются лигандами рецептора аденозина. В частности, соединения согласно настоящему изобретению обладают хорошим сродством к А2A-рецептору и высокой селективностью по отношению к A1- и А3-рецепторам.
Аденозин моделирует широкую область физиологических функций посредством взаимодействия со специфическими поверхностными рецепторами клеток. Обзор потенциальных возможностей рецепторов аденозина в качестве лекарственных мишеней впервые был опубликован в 1982 г. Аденозин как структурно, так и метаболически относится к биоактивным нуклеотидам: аденозинтрифосфату (АТФ), аденозиндифосфату (АДФ), аденозинмонофосфату (АМФ) и циклическому аденозинмонофосфату (ц-АМФ); к биохимическому метилирующему агенту S-аденозил-L-метионину (SAM); и структурно к коэнзимам НАД, ФАД и коэнзиму А; и к РНК. Совместно аденозин и эти родственные соединения играют важную роль в регулировании многих аспектов клеточного метаболизма и в модуляции различной активности центральной нервной системы.
Кроме того, известно, что связывание агониста рецептора аденозина с тучными клетками, экспрессирующими А3 рецептор крысы, приводит к увеличению инозитолтрифосфата и внутриклеточным концентрациям кальция, которые потенциируют индуцируемую антигеном секрецию медиаторов воспаления. Поэтому A3 рецептор играет посредническую роль при астматических приступах и других аллергических реакциях.
Аденозин является нейромодулятором, способным модулировать многие аспекты физиологической функции мозга. Эндогенный аденозин, центральное звено между метаболизмом энергии и нейрональной активностью, изменяется в соответствии с поведенческим состоянием и (пато)физиологическими условиями. В условиях увеличенной потребности и уменьшенной доступности энергии (таких, как гипоксия, гипоглицемия и/или чрезмерная нейрональная активность) аденозин обеспечивает мощный защитный механизм обратной связи. Взаимодействие с рецепторами аденозина представляет перспективную мишень для терапевтического вмешательства в ряд неврологических и психиатрических болезней, таких как эпилепсия, нарушение сна, двигательные расстройства (болезни Паркинсона или Хантингтона), депрессия, шизофрения или наркомания. Увеличенное высвобождение нейромедиатора следует за травмами, такими как гипоксия, ишемия и припадок. Эти нейромедиаторы, в конце концов, ответственны за невральную дегенерацию и невральную смерть, которые вызывают повреждение мозга или смерть индивидуума. Агонисты аденозина A1, которые имитируют центральные ингибиторные воздействия аденозина, могут поэтому быть использованы в качестве нейропротекторных агентов. Аденозин был предложен в качестве эндогенного антиконвульсивного агента, ингибирующего выделение глутамата из возбужденных нейронов и ингибирующего нейрональное воспаление. Агонисты аденозина могут быть использованы поэтому в качестве антиэпилептических агентов. Антагонисты аденозина стимулируют активность ЦНС и, как оказалось, являются эффективными в качестве агентов повышения когнитивности. Селективные А2а антагонисты имеют терапевтический потенциал в лечении различных форм деменции, например болезни Альцгеймера, и нейродегенеративных расстройств, например инсульта. Антагонист аденозин А2а рецептора моделирует активность стриарных ГАМК-эргических нейронов и регулирует плавные и хорошо скоординированные движения, предоставляя, таким образом, возможность для терапии паркинсонических синдромов. Аденозин вовлечен также в ряд физиологических процессов, включенных в седативный эффект, гипноз, шизофрению, состояние страха, боли, дефицит дыхания, депрессию, лекарственную наркоманию (амфетамин, кокаин, опиоиды, этанол, никотин, органические вещества, получаемые из конопли). Поэтому лекарства, воздействующие на аденозиновые рецепторы, имеют терапевтический потенциал в качестве седативных средств, мышечных релаксантов, антипсихотических средств, снимающих тревогу средств, анальгетиков, респираторных стимулирующих средств, антидепрессантов, и в лечении злоупотреблением лекарственными средствами. Они могут быть также использованы в лечении ADHD (дефицит внимание, вызванный гиперактивностью).
Важную роль для сердечно-сосудистой системы аденозин выполняет в качестве кардиопротекторного агента. Уровни эндогенного аденозина увеличиваются в ответ на ишемию и гипоксию и защищают ткань сердечной мышцы во время и после травмы (прекондиционирование). Действием на A1 рецептор агонисты А1 аденозина способны защитить от повреждения, вызванного миокардиальной ишемией и реперфузией. Моделирующее влияние А2а рецепторов на адренергическую функцию может иметь значение для различных болезней, таких как коронарная артериальная болезнь и сердечная недостаточность. А2а антагонисты могут оказывать плодотворное терапевтическое воздействие в ситуациях, в которых желательна усиленная антиадренергическая реакция, такая как во время острой миокардиальной ишемии. Селективные антагонисты А2а рецепторов могут также усиливать эффективность аденозина в конечной стадии наджелудочковой аритмии.
Аденозин моделирует многие аспекты почечной функции, включая выделение ренина, скорость гломерулярной фильтрации и поток почечной крови. Соединения, которые противодействуют почечному воздействию аденозина, имеют потенциал в качестве почечных защитных агентов. Кроме того, аденозин А3 и/или А2а антагонисты могут быть использованы при лечении астмы и других аллергических реакций и в лечении сахарного диабета и ожирения.
Многочисленные документы описывают современные исследования по аденозиновым рецепторам, например, следующие публикации:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J. Med. Chem., (1998), 41, 2835-2845,
J. Med. Chem., (1998), 41, 3186-3201,
J. Med. Chem., (1998), 41, 2126-2133,
J. Med. Chem., (1999), 42, 706-721,
J. Med. Chem., (1996), 39, 1164-1171,
Arch. Pharm. Med. Chem., 332, 39-41, (1999),
Am. J. Physiol., 276, H1113-1116, (1999) or
Naunyn Schmied, Arch. Pharmacol. 362, 375-381, (2000).
Объектами настоящего изобретения являются соединения формулы I, как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для производства медикаментов для лечения болезней, связанных с А2 рецептором, их производство, медикаменты на основе соединения в соответствии с изобретением и их получение, а также применение соединений формулы I для контроля или профилактики болезней, основанных на модулировании аденазиновой системы, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротекция, шизофрения, состояние страха, боли, дефицита дыхания, депрессия, лекарственная наркомания (амфетамин, кокаин, опиоиды, этанол, никотин, органические вещества, получаемые из конопли), или против астмы, аллергических реакций, гипоксии, ишемии, припадков и токсикомании. Кроме того, соединения по настоящему изобретению могут быть использованы в качестве седативных средств, мышечных релаксантов, антипсихотических средств, антиэпилептических средств, антиконвульсантов и кардиопротекторных агентов при таких расстройствах, как коронарная артериальная болезнь и сердечная недостаточность. Наиболее предпочтительные показания в связи с настоящим изобретением относятся к таким, которые основаны на антагонистической активности относительно А2а рецептора, и которые включают расстройства центральной нервной системы, например, лечение или профилактику болезни Альцгеймера, центральные депрессивные расстройства, наркоманию, нейропротекцию и болезнь Паркинсона, а также ADHD.
Используемый в данном описании термин "низший алкил" обозначает алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, трет.-бутил и подобные им. Предпочтительными низшими алкильными группами являются группы, содержащие от 1 до 4 атомов углерода.
Термин "галоген" обозначает хлор, йод, фтор или бром.
Термин "низшая алкокси-группа" обозначает группу, в которой алкильный остаток определен выше и присоединен через атом кислорода.
Термин "фармацевтически приемлемая кислотно-аддитивная соль" включает соли неорганических или органических кислот, таких как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, п-толуолсульфоновая кислота и им подобные.
Предпочтительными соединениями по настоящему изобретению являются соединения формулы I, в которой R1 обозначает 4-фторфенил. Такими соединениями являются:
2-Хлорметил-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]изоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метилизоникотинамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-6-метилникотинамид,
4-Фтор-N-[7-(4-фторфенил)-4-метоксибензооксазол-2-ил]бензамид,
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-морфолин-4-ил-изоникотинамид или
N-[7-(4-Фторфенил)-4-метоксибензооксазол-2-ил]-2-метоксиметил-изоникотинамид.
Далее предпочтительными являются соединения формулы I, в которой R обозначает незамещенный фенил, например следующие соединения:
4-Фтор-N-(4-метокси-7-фенилбензооксазол-2-ил)бензамид или
4-{[(2-Метоксиэтил)метиламино]метил}-N-(4-метокси-7-фенилбензооксазол-2-ил)-бензамид.
Далее предпочтительными являются соединения, где R1 обозначает тетрагидропиран-4-ил, например следующие соединения:
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-6-метилникотинамид или
N-[4-Метокси-7-(тетрагидропиран-4-ил)бензооксазол-2-ил]-2-метилизоникотинамид.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены известными из уровня техники методами, например методом, описанным ниже, который включает процессы:
а) реакцию соединения формулы
с соединением формулы
или
с соединением формулы
с образованием соединения формулы
в которой R1 обозначает фенил, незамещенный или замещенный галогеном, или
б) реакцию соединения формулы
с соединением формулы
или с соединением формулы
с образованием соединения формулы
в которой R1 обозначает незамещенный или замещенный галогеном фенил,
или
в) гидрирование соединения формулы
посредством H2/Pd/C
с образованием соединения
или
г) реакцию соединения формулы
с NaOH и затем с соединением формулы
или с соединением формулы
с образованием соединения формулы
или
д) реакцию соединения формулы
с NaOH и затем с соединением формулы
или с соединением формулы
с образованием соединения формулы
или
е) реакцию соединения формулы
с соединением формулы
или с соединением формулы
с образованием соединения
или
ж) модификацию одного или более заместителей R1 или R в пределах данных выше определений
и,
если желательно, превращение полученных выше соединении в фармацевтически приемлемые кислотно-аддитивные соли.
Соединения формулы I могут быть получены в соответствии со следующей схемой:
Получение соединений формулы I, в которой R1 обозначает фенил или фенил, замещенный галогеном
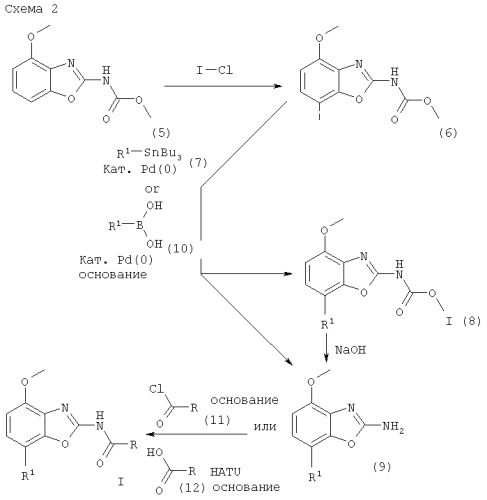
Один из методов получения соединений формулы I, в которой R1 обозначает фенил или фенил, замещенный галогеном, исходит из интермедиата формулы (5), как представлено ниже на схеме 2. Получение интермедиата формулы (5) представлено ниже в реакционной схеме 1.
где R1 обозначает фенил или замещенный галогеном фенил и R обозначен выше.
Получение интермедиата формулы (2)
Исходный 2-нитрорезорцинол формулы (1) доступен коммерчески (от фирмы Aldrich) или может быть получен согласно методам, хорошо известным из уровня техники.
2-Нитрорезорцинол формулы (1) гидрируют в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на угле. Эта реакция может протекать в различных растворителях, таких как метанол, этанол, диоксан или тетрагидрофуран, предпочтительно в метаноле, при комнатной температуре и давлении от 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 часов, предпочтительно в течение около 18 ч. Продукт формулы (2), 2-аминорезорцинол, предпочтительно используется на следующей стадии без очистки.
Получение интермедиата формулы (3)
Интермедиат формулы (2) реагирует с небольшим избытком цианидбромида в смеси водного растворителя, предпочтительно в смеси низшего спирта и воды, предпочтительно в смеси метанола и воды. Реакция предпочтительно протекает при комнатной температуре в течение приблизительно 2 ч. Продукт, бензоксазольное соединение формулы (3), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (4)
Метод получения интермедиата формулы (4) заключается в обработке интермедиата формулы (3) небольшим избытком сильного основания, предпочтительно гидрида натрия в апротонном растворителе, предпочтительно тетрагидрофуране, при повышенной температуре, предпочтительно около 50°С, в течение около 1 ч; промежуточное соединение последовательно обрабатывается метилйодидом, предпочтительно с использованием около 1 эквивалента метилйодида, при повышенной температуре, предпочтительно около 50°С, в течение 1-5 ч, предпочтительно около 3 ч. Продукт формулы (4) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (5)
Интермедиат формулы (4) реагирует с небольшим избытком метилхлорформиата в органическом растворителе, предпочтительно дихлорметане. Реакция протекает в присутствии аминного основания, такого как пиридин, триэтиламин или N-этилдиизопропиламин, предпочтительно пиридина, при температуре ниже комнатной температуры, предпочтительно при 0°С, в течение 0,25-4 ч. Продукт формулы (5) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (6)
Интермедиат формулы (5) реагирует с небольшим избытком йодирующего реагента, предпочтительно йодмонохлорида, в органическом растворителе, предпочтительно уксусной кислоте, при комнатной температуре, в течение приблизительно 2-30 ч, предпочтительно около 16 ч. Продукт формулы (6) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I (8) и/или формулы (9)
Исходные трибутилстаннановые соединения формулы (7) коммерчески доступны, например, от фирмы Fluka или могут быть получены методами, хорошо известными из уровня техники.
Интермедиат формулы (6) реагирует с избытком трибутилстаннана формулы (7) в органическом растворителе, предпочтительно в N,N-диметилформамиде, содержащем палладиевый катализатор, предпочтительно трис(дибензилиденацетон)дипалладий(0), каталитическое количество фосфинового или арсинового лиганда, предпочтительно трифениларсина, и избыток Cu(I) соли, предпочтительно CuI. Реакция протекает при повышенной температуре, предпочтительно около 80°С, в течение 2-24 ч, предпочтительно около 16 ч. Продукт(ы) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации. В зависимости от реакционных параметров, таких как температура и время реакции, основной продукт реакции может представлять собой соединение формулы I (8), в других случаях основной продукт реакции может быть соединением формулы (9), или в результате реакции может быть получена смесь продуктов формулы I (8) и (9).
Альтернативное получение соединений формулы I (8) и/или формулы (9)
Исходные соединения бороновой кислоты формулы (10) доступны коммерчески, например, от фирмы Fluka или могут быть получены методами, хорошо известными из уровня техники.
Соединения формулы I (8) или формулы (9) альтернативно могут быть получены обработкой интермедиата формулы (6) избытком соединения бороновой кислоты формулы (10). Реакция протекает в водном растворителе, предпочтительно в смеси воды, диоксана и 1,2-диэтоксиэтана, содержащем палладиевый катализатор, предпочтительно тетракис(трифенилфосфин)палладий(0), избыток соли лития, предпочтительно хлорида лития, и неорганическое основание, предпочтительно карбонат натрия. Реакция протекает предпочтительно при температуре кипения растворителя, предпочтительно около 100°С, в течение 2-24 ч, предпочтительно около 16 ч. Продукт(ы) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации. В зависимости от реакционных параметров, таких как температура и время реакции, основной продукт реакции может представлять собой соединение формулы I (8), в других случаях основной продукт реакции может быть соединением формулы (9), или в результате реакции может быть получена смесь продуктов формулы I (8) и (9).
Получение интермедиатов формулы (9) из соединений формулы I (8)
Соединения формулы I (8) могут быть превращены в соответствующие интермедиаты формулы (9) реакцией с избытком водного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, предпочтительно гидроксид натрия. Реакция протекает в водном растворителе, предпочтительно в смеси воды и смешивающегося с ней органического растворителя, такого как диоксан, тетрагидрофуран или этиленгликоль, предпочтительно этиленгликоля, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение 2-16 ч, предпочтительно около 16 ч. Продукт формулы (9) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил
Один из методов получения соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил, заключается в обработке интермедиата формулы (9) небольшим избытком соответствующего ацилхлорида формулы (11), который коммерчески доступен или может быть получен методами, хорошо известными из уровня техники. Может также быть использован такой катализатор, как N,N-диметил-4-аминопиридин. Реакция протекает в апротонном органическом растворителе, предпочтительно смеси дихлорметана и тетрагидрофурана, содержащем основание, предпочтительно N-этилдиизопропиламин или триэтиламин, при температуре между комнатной температурой и температурой кипения растворителя в течение 2-24 ч, предпочтительно 16 ч. Продукт формулы I, где R1 обозначает фенил или галогензамещенный фенил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Альтернативное получение соединений формулы I, где R1 обозначает фенил или галогензамещенный фенил
Альтернативный способ получения соединений формулы I где R1 обозначает фенил или галогензамещенный фенил, включает обработку соответствующей карбоновой кислоты формулы (12) стехиометрическим эквивалентом реагента для конденсации с пептидом, предпочтительно O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурониум гексафторфосфат (HATU), в эфирном растворителе, предпочтительно тетрагидрофуране, содержащем основание, предпочтительно N-этилдиизопропиламин, при комнатной температуре в течение 30-90 мин, предпочтительно 1 ч. Смесь обрабатывается затем интермедиатом формулы (9) в смеси растворителей, предпочтительно в смеси тетрагидрофурана, диоксана и N,N-диметилформамида, при комнатной температуре в течение 16-24 ч, предпочтительно 16 ч. Продукт формулы I, где R1 обозначает фенил или галогензамещенный фенил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
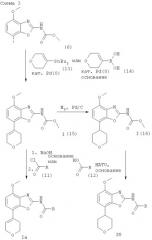
Получение соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил или тетрагидропиран-4-ил
Один из методов получения соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил или тетрагидропиран-4-ил, исходит из интермедиата формулы (6), как показано ниже на схеме 3.
где R обозначен выше.
Получение соединений формулы I (15)
Исходные трибутилстаннановые соединения формулы (13) могут быть получены методами, хорошо известными из уровня техники.
Интермедиат формулы (6) реагирует с избытком трибутилстаннана формулы (7) в органическом растворителе, предпочтительно в диоксане, содержащем палладиевый катализатор, предпочтительно трис(дибензилиденацетон)дипалладий(0), каталитическое количество фосфинового или арсинового лиганда, предпочтительно три(2-фурил)фосфина. Реакция протекает при повышенной температуре, предпочтительно около 100°С, в течение около 2-24 ч, предпочтительно около 16 ч. Продукт формулы I (15) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Альтернативное получение соединений формулы I (15)
Исходные соединения бороновой кислоты формулы (14) могут быть получены методами, хорошо известными из уровня техники.
Соединения формулы I (15) альтернативно могут быть получены обработкой интермедиата формулы (6) избытком соединения бороновой кислоты формулы (14). Реакция протекает в водном растворителе, предпочтительно в смеси воды, диоксана и 1,2-диэтоксиэтана, содержащей палладиевый катализатор, предпочтительно тетракис-(трифенилфосфин)палладий(0), и неорганическое основание, предпочтительно карбонат натрия. Реакция протекает предпочтительно при температуре кипения растворителя, предпочтительно около 100°С, в течение около 2-24 ч, предпочтительно около 16 ч. Продукт формулы I (15) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I (16)
Соединения формулы I (15) могут быть превращены в соединения формулы I (16) гидрированием в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на активированном угле. Эта реакция протекает в различных органических растворителях, таких как метанол, этанол, диоксан, тетрагидрофуран или дихлорметан, предпочтительно в смеси метанола и дихлорметана, при комнатной температуре, при давлении 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 ч, предпочтительно около 18 ч. Продукт формулы I (16) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил (Ia)
Соединения формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил, могут быть получены из соединений формулы I (15) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (8). Продукт формулы I, где R1 обозначает 3,6-дигидро-2Н-пиран-4-ил (Ia), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы I, где R1 обозначает тетрагидропиран-4-ил (Iб)
Соединения формулы I, где R1 обозначает тетрагидропиран-4-ил, могут быть получены из соединений формулы I (16) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (8). Продукт формулы I, где R1 обозначает тетрагидропиран-4-ил (Ia), выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
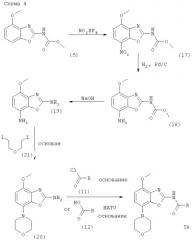
Получение соединений формулы I, где R1 обозначает морфолин-4-ил
Один из методов получения соединений формулы I, где R1 обозначает морфолин-4-ил, исходит из интермедиата формулы (5), как представлено ниже на схеме 4.
где R обозначен выше.
Получение интермедиата формулы (17)
Интермедиат формулы (5) вводят в реакцию с нитрующим агентом, предпочтительно с нитрониум тетрафторборатом, в полярном органическом растворителе, предпочтительно нитрометане. Реакция протекает в температурном интервале от 0°С до комнатной в течение приблизительно 2-24 ч, предпочтительно около 18 ч. Продукт формулы (17) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (18)
Интермедиат формулы (17) может быть превращен в интермедиат формулы (18) гидрированием в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на активированном угле. Эта реакция протекает в различных органических растворителях, таких как метанол, этанол, диоксан, тетрагидрофуран или дихлорметан, предпочтительно в смеси метанола и дихлорметана, при комнатной температуре, при давлении 1 атм и выше, предпочтительно при 1 атм, в течение 2-24 ч, предпочтительно около 18 ч. Продукт формулы (18) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (19)
Интермедиат формулы (18) может быть превращен в соответствующий интермедиат формулы (19) реакцией с избытком водного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, предпочтительно гидроксид натрия. Реакция протекает в водном растворителе, предпочтительно в смеси воды и смешивающегося с ней органического растворителя, такого как диоксан, тетрагидрофуран или этиленгликоль, предпочтительно в смеси воды, диоксана и этиленгликоля, при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение приблизительно 2-16 ч, предпочтительно около 4 ч. Продукт формулы (19) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение интермедиата формулы (20)
Интермедиат формулы (19) вводят в реакцию с дийодидалкиловым соединением формулы (21), которое может быть получено методами, хорошо известными из уровня техники, в органическом растворителе, предпочтительно в N,N-диметилформамиде, содержащем основание, предпочтительно карбонат калия. Реакция протекает в интервале между комнатной температурой и температурой кипения растворителя, предпочтительно около 60°С, в течение около 1-48 ч, предпочтительно около 48 ч. Продукт формулы (20) выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы Iв (R1 обозначает морфолин-4-ил)
Соединения формулы I, где R1 обозначает морфолин-4-ил, могут быть получены из интермедиата формулы (20) методами, полностью аналогичными методам, описанным выше для получения соединений формулы I из интермедиатов формулы (9). Продукт формулы I, где R1 обозначает морфолин-4-ил, выделяют стандартными методами и предпочтительно очищают посредством хроматографии или перекристаллизации.
Конверсия соединений формулы I в другие соединения формулы I, имеющие модифицированный R заместитель
В случае если соединение формулы I содержит R заместитель, имеющий химически реакционную функциональную группу, например, когда R содержит галоидбензильную функциональную группу или 2-галопиридильную функциональную группу, соединение формулы I может быть превращено в другое соединение формулы I, имеющее модифицированный R заместитель, посредством реакций, включающих реакционную функциональную группу, содержащуюся в первоначальном R заместителе. Такие превращения могут быть проведены согласно методам, хорошо известным из уровня техники, и специфические примеры могут быть найдены в ряду примеров, приведенных ниже. Например, соединения формулы I, имеющие R заместители, несущие галоидбензильную или 2-галопиридильную функциональные группы, могут реагировать с нуклеофильными спиртовыми или аминными реагентами, образуя соединения формулы I, содержащие R заместители, имеющие соответственно бензильную эфирную или бензильную аминную функциональные группы, или пиридил-2-ил-эфирную или пиридил-2-ил-аминную функциональные группы.
Выделение и очистка соединений
Выделение и очистка соединений и интермедиатов, приведенная в данном описании, может быть осуществлена, если нужно, посредством любого подходящего метода выделения и очистки, как, например фильтрование, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная хроматография низкого или высокого давления, или комбинацией этих методов. Подходящие методы разделения и выделения в чистом виде могут быть проиллюстрированы посредством ссылок на методы получения и примеры, приведенные ниже. Однако другие эквивалентные методы разделения и выделения в чистом виде могут, конечно, также быть использованы.
Соли соединений формулы I
Соединения формулы I могут быть основными, например, в случаях, когда остаток R содержит основную группу, такую как алифатический или ароматический аминный фрагмент. В таких случаях соединения формулы I могут быть превращены в соответствующую кислотно-аддитивную соль.
Превращение осуществляется обработкой, по меньшей мере, стехиометрическим количеством соответствующей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобными, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и им подобными. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и им подобном, после чего добавляют кислоту в аналогичном растворителе. Температура поддерживается в пределах от 0 до 50°С. Образующаяся соль самопроизвольно выпадает в осадок или может быть извлечена из раствора менее полярным растворителем.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой, по крайней мере, стехиометрическим эквивалентом подходящего основания типа гидроксидов натрия или калия, карбонатом калия, бикарбонатом натрия, аммиаком и им подобных.
Соединения формулы I и их фармацевтически приемлемые соли обладают различными фармакологическими свойствами. В частности, было найдено, что соединения по настоящему изобретению являются лигандами рецептора аденозина (А2A). Кроме того, было показано, что предпочтительные соединения формулы I обладают хорошей селективностью по отношению к A1 рецептору в области от 26 до 650.
Соединения были исследованы в соответствии с тестами, приведенными ниже.
А2A рецептор аденозина человека
A2A рецептор аденозина человека рекомбинантно экспрессируют в клетках яичника китайского хомячка (СНО), используя вирусную экспрессионную систему "леса семлики" (semliki forest). Клетки харвестируют, дважды отмывают центрифугированием, гомогенизируют и снова отмывают центрифугированием. Окончательно отмытый мембранный осадок суспендируют в Трис (50 мл) буфере, содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). [3H]-SCH-58261 (Dionisotti и др., 1997, Br. J. Pharmacol. 121, 353; 1 nM) анализ связывания проводят в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг Ysi-поли-1-лизин SPA гранул и 0,1 U аденозин деаминазы в общем объеме 200 мкл буфера. Неспецифическое связывание определяют, используя ксантинамин морского угря (ХАС; 2 мкМ). Соединения тестируют при 10 концентрациях от 10 мкМ до 0,3 нМ. Все анализы были дублированы и повторены, по крайней мере, дважды. Перед центрифугированием аналитические планшеты были инкубированы в течение 1 ч при комнатной температуре и затем связанные лиганды определяли с использованием сцинтиляционного счетчика Packard Topcount. IC50 величины вычисляли, используя подходящую программу нелинейной кривой, и Ki значения вычисляли, применяя уравнение Cheng-Prussoff.
Предпочтительные соединения имели значения р Ki>7,5. В следующей таблице представлены сродство к А2а рецептору и селективность к A1 рецептору для этих соединений.
| Пример | hA2a pKi | Селективность к hA1 |
| 1 | 7,92 | 26 |
| 2 | 7,65 | 137 |
| 5 | 7,66 | 140 |
| 9 | 7,66 | 351 |
| 13 | 7,64 | 227 |
| Пример | hA2a pKi | Селективность к hA1 |
| 14 | 7,80 | 134 |
| 17 | 7,89 | 242 |
| 18 | 8,19 | 120 |
| 20 | 8,07 | 650 |
| 21 | 7,52 | 96 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве медикаментов, например в форме фармацевтических препаратов. Фармацевтические препараты могут быть введены орально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Введение может осуществляться также ректально, например в форме суппозиториев, или парентерально, например в форме инъекционных растворов.
Соединения формулы I могут быть соединены с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Могут использоваться лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и подобные им, например, в качестве носителей для таблеток, таблеток, покрытых оболочкой, драже, и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им. Однако в зависимости от природы активной субстанции может не потребоваться никаких носителей, обычно применяемых в случае мягких желатиновых капсул. Подходящими носителями для производства растворов и сиропов