Производные разветвленного полиаминостероида
Иллюстрации
Показать всеОписываются производные разветвленного полиаминостероида общей формулы I, где R1 - насыщенный или ненасыщенный С2-С10алкил (прямой или разветвленный) или метил, R2 - СООН или фрагменты разветвленных полиаминов, R3 - Н, OR19, где R19 - Н или С1-6ацил, R4 - Н, R5 - Н, СН3, R6 - Н, СН3, R7=R8=R9=H, R10 - Н, СН3, R11 - ОН, -OSO3, -O-ацил, -(Z)n-(NR-Z)p-N(R)2, Z - линейный углеводородный дирадикал, n=0, 1, p=1, R-H, С1-6алкил, C1-6аминоалкил, возможно замещенный С1-6алкилом, R12=R13=R15=H, R16 - Н, ОН, R17 - Н, R18 - Н, СН3, возможная двойная связь. Соединения обладают бактерицидной активностью и могут использоваться для профилактики бактериальных инфекций. 4 н. и 23 з.п. ф-лы, 1 табл., 2 ил.
Реферат
Изобретение относится к новым соединениям, обладающим широким спектром антибактериальной активности, конкретно к стероидам, содержащим разветвленные полиаминовые боковые цепи, а также к применению таких соединений в качестве бактерицидных средств для лечения различных инфекций.
Устойчивость к действию лекарственных средств при использовании антибиотиков становится все большей проблемой, связанной с угрозой для здоровья. Существующее в течение многих лет убеждение в том, что инфекционные заболевания можно контролировать современным арсеналом антибактериальных лекарственных средств, обусловило разработку немногочисленных новых и более эффективных лекарств. Однако последние данные о полирезистентности патогенных бактерий возродили интерес к разработке новых антибиотиков. Хотя устойчивость к действию многих антибиотиков, например бета-лактамов, макролидов, тетрациклинов и аминогликозидов, и быстрый рост такой устойчивости известен в течение многих лет, предполагалось, что такие резервные лекарственные средства, как гликопептиды и фторхинолоны, способны эффективно противодействовать большинству инфекций. Однако, в связи с большим числом тревожных сообщений об устойчивости к действию ванкомицина, множественной лекарственной устойчивости и примерами переноса резистентных генов между различными видами, появившимися в конце восьмидесятых и в начале девяностых годов, проблема лекарственной резистентности становится предметом внимания здравоохранительных учреждений и фармацевтической промышленности. В связи с этим важной задачей остается выявление новых соединений, обладающих антибактериальной активностью.
Стероиды представляют собой группу соединений, обнаруженных в живых организмах, основным примером которых являются гормоны. Все стероиды имеют общую основу или ядра, включающие три шестичленных кольца и одно пятичленное кольцо, и в связи с этим могут считаться производными циклопентанонпергидрофенантрена. Стероиды обладают важнейшими биологическими свойствами. Они оказывают решающее влияние на катаболизм и анаболизм всех основных биохимических веществ, таких как протеины, карбогидраты и липиды, и их действие заключается в индуцировании синтеза ферментов, регулирующих уровень содержания указанных биохимических соединений. Гормоны могут быть классифицированы на эстрогены, андрогены, прогестины, минералокортикоиды и глюкокортикоиды. Они регулируют важнейшие аспекты биологической деятельности, например рост и функционирование костной и мышечной ткани, давление крови, уровень содержания глюкозы в крови и развитие половых признаков. Выполняя множество биологических функций, стероиды в виде гормонов, или в виде их близких по химическим свойствам производных, сами по себе являются мощными лекарственными средствами в отношении различных заболеваний. Стероиды используют в заместительной терапии при лечении пациентов с недостаточной выработкой стероидов; глюкокортикоиды в больших концентрациях применяются системно и локально в качестве противовоспалительных и иммуносупрессорных агентов; эстрогенные и прогестиновые стероиды используются для лечения дисфункций репродуктивной системы и, чаще, в качестве контрацептивов.
Антибиотическим действием обладает ограниченное число стероидов, например фусидовая кислота. Фусидовая кислота, являющаяся продуктом ферментации Fusidium coccineum, известна с начала 1960 гг. (патент США 3072531). Фусидовая кислота (например, Fucidin®, LEO Pharmaceutical Products Ltd, Denmark) используется в клинических условиях для лечения инфекционных заболеваний, например стафилококковых инфекций, и этот препарат применяют как местно, так и системно (Kuchers et al., 1997 и цитированные в документе ссылки; Duvold et al., 2001 и цитированные в документе ссылки; Christiansen, 1999, и цитированные в документе ссылки). Обычно этот препарат применяют совместно с традиционными антибиотиками, такими как пенициллины, эритромицины или клиндамицин.
Недавно стероидный антибиотик был выделен из желудка акулы-dogfish, Squalus acanthias (Moore et al., 1993; Rao et al., 2000). Такое соединение со стероидной основой, содержащей линейный полиамин и сульфатную функциональную группу, было названо скваламином (squalamine) и было установлено, что это вещество обладает широким спектром бактерицидных свойств в отношении грамположительных и грамотрицательных бактерий, грибков и простейших организмов. Использование природного скваламина в качестве противомикробного средства раскрыто в US 5192756. Был осуществлен химический синтез скваламина, хотя для этого использовали достаточно сложную методику. Ряд скваламиновых аналогов и их использование в качестве антибиотиков раскрыты в WO 00/09137.
Другие скваламиновые аналоги, содержащие полиаминовые боковые цепи, раскрыты в WO 02/14342, а также в работе B. Ding et al., J. Med. Chem. 45, 2002, pp. 663-669.
Об антибиотических свойствах самих разветвленных полиаминов не сообщается.
Авторы настоящего изобретения неожиданно обнаружили, что стероидные производные, содержащие стероидную основу, соединенную с разветвленным полиамином, представляют собой соединения с широким спектром антимикробной и, особенно, бактерицидной активности. Разветвленный полиаминовый фрагмент придает антибактериальную активность стероидам, не обладающим такой активностью, и усиливает бактерицидную активность стероидов, обладающих ею изначально.
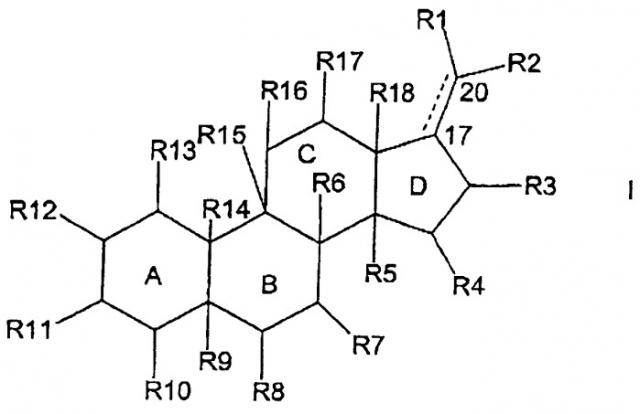
Таким образом, настоящее изобретение относится к соединению формулы I
в которой конденсированные кольца А, В, С и D, независимо друг от друга, являются насыщенными или частично или полностью ненасыщенными кольцами;
связь между С-17 и С-20 изображена сплошной и пунктирной линией для обозначения того, что указанная связь может быть одинарной или двойной;
R1 представляет водород, галоген, липофильную группу, -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2, где n равно 0 или 1, а р представляет целое число от 1 до 5;
каждый Z, независимо друг от друга, представляет углеводородный бирадикал с прямой или разветвленной цепью, необязательно замещенный С1-6алкилом, С1-6алкенилом, С1-6алкинилом, гидрокси, алкокси, амино, С1-6аминоалкокси, С1-6аминоалкилом, С1-6аминоалкиламинокарбонилом, С1-6алкилС3-8циклоалкилом или С1-6алкилгетероарилом;
каждый R, независимо друг от друга, представляет водород или С1-6алкил, С1-6аминоалкил, С1-6аминоалкокоси или С1-6аминоалкиламинокарбонил, причем все перечисленные группы необязательно замещены алкилом или С1-6аминоалкилом;
при условии, что, по меньшей мере, один Z замещен С1-6алкилом, С1-6алкенилом, С1-6алкинилом, гидрокси, алкокси, С1-6аминоалкокси, С1-6аминоалкилом, С1-6аминоалкиламинокарбонилом, С1-6алкилС3-8циклоалкилом или С1-6алкилгетероарилом, или, по меньшей мере, один R отличается от водорода;
R2 представляет галоген, С1-4алкил, необязательно замещенный СООН; С1-4алкокси, -СООН, -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2;
R3 представляет водород, галоген или О-R19, где R19 представляет водород, -SO3, C1-6 алкил, С1-6ацил или -(Z)n-(NR-Z)p-N(R)2;
каждый из R4, R7, R8, R10, R11, R12, R13, R16 и R17, независимо друг от друга, представляет водород, галоген, гидрокси, -OSO3, -O-ацил, -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2;
каждый из R5, R6, R9, R14, R15 и R18, независимо друг от друга, представляет водород или метил, или каждый независимо отсутствует в том случае, когда одно из конденсированных колец А, В, С и D является ненасыщенным, для того чтобы все валентности соответствующего углеродного атома были заняты;
при условии, что, по меньшей мере, один, но не более трех из заместителей R1, R2, R4, R7, R8, R10, R11, R12, R13, R16 и R17 представляют -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2;
а также к его фармацевтически приемлемым солям или сложным эфирам.
Точный механизм действия соединений настоящего изобретения в настоящее время неизвестен. Не ограничиваясь конкретной гипотезой, предполагается, что эти соединения способны перфорировать клеточные мембраны, и в результате образования пор может осуществляться лизис мембран. Предполагается, что соединения настоящего изобретения способны влиять на два основных механизма резистентности к лекарственным средствам, оказывающим воздействие на некоторые другие антибиотики, которые касаются деградации клеток под действием ферментов и маршрутов экспорта (Sadownik et al., 1995; Savage and Li, 2000 и ссылки в этой работе).
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение формулы I вместе с фармацевтически приемлемым эксципиентом или разбавителем.
Еще один аспект настоящего изобретения относится к применению соединения формулы I в производстве лекарственного средства для профилактики или лечения инфекций.
В соответствии с другим аспектом настоящее изобретение относится к способу профилактики или лечения инфекций, включающему введение пациенту, нуждающемуся в лечении, эффективного количества соединения формулы I.
На Фиг.1 представлена кинетика изменения минимальной бактерицидной концентрации (MBC) соединения 102 в отношении S.aureus.
На Фиг.2 представлена кинетика изменения минимальной бактерицидной концентрации (MBC) соединения 102 в отношении S.pyogenes.
В контексте настоящего описания термин «углеводород» относится к соединению, содержащему только углерод и водород, в котором углеродные атомы образуют линейную или разветвленную цепь.
Термин «алкил» используется для обозначения одновалентного радикала, образующегося из алкана с прямой или разветвленной цепью в результате удаления атома водорода от любого углеродного атома. Такой термин включает подклассы первичных, вторичных и третичных алкилов, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил и изогексил.
Термин «алкенил» относится к одновалентному радикалу, полученному из алкена с прямой или разветвленной цепью в результате удаления атома водорода от любого углеродного атома. Этот термин включает подклассы первичных, вторичных и третичных алкенилов, таких как винил, 1-пропенил, изопропенил, бутенил, трет-бутенил, пентенил и гексенил.
Термин «алкинил» относится к одновалентному радикалу, полученному из алкина с прямой или разветвленной цепью в результате удаления атома водорода от любого углеродного атома. Этот термин включает этинил, пропинил, изопропинил, трет-бутинил, пентинил и гексинил.
Термин «алкокси» используется для обозначения радикала формулы OR', в которой R' представляет указанный выше углеводородный радикал, например метокси, этокси, пропокси, бутокси и т.п.
Термин «алкоксикарбонил» используется для обозначения радикала формулы -COOR', в которой R' представляет указанный выше углеводородный радикал, например метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил и т.п.
Термин «циклоалкил» используется для обозначения насыщенного циклоалканового радикала, например циклопропила, циклобутила, циклопентила или циклогексила. Аналогичным образом, термин «циклоалкенил» используется для обозначения циклоалкенового радикала, например циклопропенила, циклобутенила, циклопентенила или циклогексенила.
Термин «арил» используется для обозначения радикалов карбоциклических ароматических колец, необязательно конденсированных бициклических колец, например фенила или нафтила. Термин «гетероарил» используется для обозначения радикалов гетероциклических ароматических колец, в частности 5- или 6-членных колец с 1-3 гетероатомами, выбранными из O, S и N, или необязательно конденсированных бициклических колец с 1-4 гетероатомами, примерами которых являются пиридил, тетразолил, тиазолил, имидазолил, пиразолил, оксазолил, изоксазолил, тиенил, пиразинил, изотиазолил, бензимидазолил и бензофуранил.
Термин «ацил» относится к радикалу формулы -СО-R', в которой R' представляет определенный выше углеводородный радикал.
Термин «аралкил» используется для обозначения ароматического кольца с алкильной боковой цепью, например бензила.
Термин «галоген» используется для обозначения фтора, хлора, брома или йода.
Термин «амино» используется для обозначения радикала формулы -NR"2, в которой каждый R", независимо друг от друга, представляет водород или углеводородный радикал.
Термин «аминоалкокси» относится к радикалу формулы -OR'-NR"2, в которой R' представляет углеводородный бирадикал, а каждый R", независимо друг от друга, представляет водород или углеводородный радикал.
Термин «аминоалкил» относится к радикалу формулы -R'-NR"2, в которой R' представляет углеводородный бирадикал, а каждый R", независимо друг от друга, представляет водород или углеводородный радикал.
Термин «аминоалкиламинокарбонил» относится к радикалу формулы -С(О)-NR"-R'-NR"2, в которой R' представляет углеводородный бирадикал, а каждый R", независимо друг от друга, представляет водород или углеводородный радикал.
Термин «разветвленный полиамин» используется для обозначения соединения общей формулы NHR-(Z)n-(NR-Z)p-N(R)2, в которой n и р, и каждый R и Z, независимо друг от друга, определены выше, причем, по меньшей мере, один R имеет значение, отличное от водорода и, по меньшей мере, один Z замещен С1-6алкилом, С1-6алкенилом, С1-6алкинилом, гидрокси, алкокси, С1-6аминоалкилом, С1-6аминоалкокоси, С1-6аминоалкиламинокарбонилом, С1-6алкилС3-8циклоалкилом или С1-6алкилгетероарилом.
Термин «фармацевтически приемлемая соль» используется для обозначения солей щелочных и щелочно-земельных металлов, например солей натрия, калия, магния или кальция, а также солей серебра и солей с такими основаниями, как аммоний или подходящие нетоксичные амины, например низшие алкиламины, например триэтиламин, гидроксисодержащие низшие алкиламины, например 2-гидроксиэтиламин или бис-(2-гидроксиэтил)амин, циклоалкиламины, например дициклогексиламин, или бензиламины, такие как N,N-дибензилэтилендиамин и дибензиламин, а также солей присоединения подходящих органических или неорганических кислот, таких как хлористоводородная, бромистоводородная, йодистоводородная, серная, азотная, фосфорная, уксусная, молочная, малеиновая, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, метансульфоновая, салициловая, янтарная, винная, толуолсульфоновая, сульфаминовая или фумаровая кислоты.
Термин «фармацевтически приемлемые эфиры» используется для обозначения таких легко гидролизуемых сложных эфиров, как алканоилоксиалкиловые, аралканоилоксиалкиловые, ароилоксиалкиловые эфиры, например ацетоксиметиловый, пивалоилоксиметиловый, бензоилоксиметиловый эфиры и соответствующие 1'-оксиэтиловые производные, или алкоксикарбонилоксиалкиловые эфиры, например метоксикарбонилоксиметиловые и этоксикарбонилоксиметиловые эфиры и соответствующие 1'-оксиэтиловые производные, или лактониловые эфиры, например фталидиловые эфиры, или диалкиламиноалкиловые эфиры, например диметиламиноэтиловые эфиры. Легко гидролизуемые сложные эфиры включают in vivo гидролизуемые сложные эфиры соединений формулы I. Такие сложные эфиры могут быть получены общепринятыми способами, известными специалистам в данной области, например способом, раскрытым в GB Patent № 1490852, включенном в настоящее описание в виде ссылки.
Термины «антибиотический» и «антибактериальный (антимикробный)» взаимозаменяемы и имеют одинаковое значение.
Согласно предпочтительному варианту осуществления изобретения R2, R7, R11 и/или R16 представляют-(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2.
Конкретными примерами R19 являются С1-6алкил и С1-6ацил.
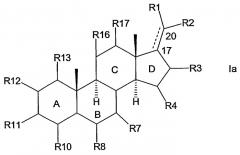
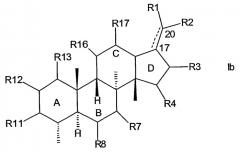
Конкретным примером R7, R11 и R16 является -ОН. Соединения формулы I, в которой R11 представляет O-SO3 или О-ацил, также считаются особенно подходящими. Предпочтительный вариант осуществления настоящего изобретения относится к соединению общей формулы Ia или Ib
в которых R1, R2, R3, R4, R7, R8, R10, R11, R12, R13, R16 и R17 имеют указанные выше значения.
Конкретными примерами соединений настоящего изобретения являются соединения формулы Ia или Ib, в которых R2 представляет -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2, особенно те, в которых R7 и R11 оба представляют гидрокси; R11 и R16 оба представляют гидрокси; или R3 представляет -OR19, где R19 представляет С1-6алкил или С1-6ацил.
Еще более характерными примерами соединений настоящего изобретения являются соединения формулы Ia или Ib, в которой R11 представляет -(Z)n-(NR-Z)p-N(R)2 или C(O)-(Z)n-(NR-Z)p-N(R)2, особенно в том случае, когда R2 представляет С1-4алкил, необязательно замещенный СООН; С1-4алкокси или -СООН; или когда R3 представляет -OR19, где R19 представляет С1-6алкил или С1-6ацил.
В соединениях формулы I и, более конкретно, формулы Ia или Ib, R1 предпочтительно представляет липофильную группу, т.е. преимущественно неполярную группу. Предполагается, что неполярный характер заместителей R1 ответственен за способность соединений настоящего изобретения к размещению в клеточной мембране, которая также имеет липофильную природу. Примерами таких липофильных групп являются C1-10алкил, арил, С3-8циклоалкил, аралкил с 1-10 углеродными атомами в алкильном фрагменте, С1-10алкиларил, С1-10алкилС3-8циклоалкил, С1-10алкокси и гетероарил. Предпочтительно, R1 представляет насыщенный или ненасыщенный С1-10углеводородный радикал с прямой или разветвленной цепью, например фрагмент формулы II
в которой углерод-углеродная связь, обозначенная символом "*", является одинарной или двойной связью.
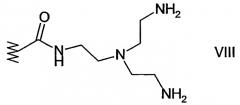
Согласно предпочтительному варианту осуществления изобретения R2 и/или R11 представляют фрагмент формул VIII, IX, X, XI, XII или XIII, приведенных ниже:
В соответствии с предпочтительным вариантом осуществления изобретения соединения формулы I выбирают из группы, включающей
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 101),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-11-дезокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 102),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-16-дезацетокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 103),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-13(17)-ен-17,20,24,25-тетрагидрофусидан-21-карбоксамид (соединение 104),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-3β-дезацетокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 105),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-9(11)-ен-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 106),
24-N-{2'-[бис(2'-аминоэтил)амино]этил}-3α-гидрокси-5β-холан-24-амид (соединение 107),
22-N-{2'-[бис(2'-аминоэтил)амино]этил}-23,24-биснор-5-холеник-22-амид (соединение 108),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}фусид-21-амид (соединение 109),
21-N-{3'-[бис(3'-аминопропил)амино]пропил}фусид-21-амид (соединение 110),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-3-OSO3-11-дезокси-17,20,24,25-тетрагидрофусид-21-амид (соединение 111),
21-N-{2'-[бис(2'-аминоэтил)амино]этил}-11-дезокси-16-дезацетокси-17S,20,24,25-тетрагидрофусид-21-амид (соединение 112),
21-N-{3'-[бис(3'-аминопропил)амино]пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 113),
22-N-{3'-[бис(3'-аминопропил)амино]пропил}-23,24-биснор-5-холеник-22-амид (соединение 114),
21-N-{3'-[бис(3'-аминопропил)амино]пропил}-}-3-ОАс-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 115),
21-N-{3'-[бис(3'-аминопропил)амино]пропил}-}-3-OSO3-11-дезокси-17,20,24,25-тетрагидрофусид-21-амид (соединение 116),
21-N-{3'-[бис(3'-аминопропил)амино]пропил}-}-11-дезокси-16-дезацетокси-17S,20,24,25-тетрагидрофусид-21-амид (соединение 117),
3-N-{2'-[бис(2'-аминоэтил)амино]этил}фусидовая кислота (соединение 118),
21-N-{3'-[(3'-аминопропил)(метил)амино]пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 119),
21-N-{3'-[(3'-аминопропил)(метил)амино]пропил}-11-дезокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 120),
21-N-{3'-[(3'-аминопропил)(метил)амино]пропил}-16-дезацетокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 121),
24-N-{3'-[(3'-аминопропил)(метил)амино]пропил}-3α-гидрокси-5β-холан-24-амид (соединение 122),
21-N-{3'-[(3'-аминопропил)(метил)амино]пропил}-11-дезокси-16-дезацетокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 123),
3-N-{3'-[бис(3'-аминопропил)амино]пропил}фусидовая кислота (соединение 124),
3-N-{3'-[(3'-аминопропил)(метил)амино]пропил}фусидовая кислота (соединение 125),
21-N-{3-({4'-[(3'-аминопропил)метиламино]бутил}метиламино)пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 126),
21-N-{3'-({3'-[(3'-аминопропил)этиламино]пропил}этиламино)пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 127),
21-N-{3'-({4'-[(3'-аминопропил)этиламино]бутил}этиламино)пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 128),
21-N-{3-({3'-[(3'-аминопропил)этиламино]пропил}этиламино)пропил}-11-дезокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 129),
21-N-{3'-({4'-[(3'-аминопропил)циклопропилметиламино]бутил}циклопропилметиламино)-пропил}-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 130),
21-N-{3'-[(3'-аминопропил)-(3'-диметиламинопропил)амино]пропил}-11-дезокси-17R,20S,24,25-тетрагидрофусид-21-амид (соединение 131),
и их фармацевтически приемлемые соли и сложные эфиры.
Наименования перечисленных выше соединений даны в соответствии с номенклатурой IUPAC для разветвленной полиаминовой боковой цепи и конвенциями по названию фусидана и стероида для стероидных фрагментов. Для обозначений использовалась программа, доступная на http://www2.acdlabs.com/ilab/.
Соединения формулы I содержат хиральные центры и углерод-углеродные двойные связи, что предусматривает существование стерео- и геометрических изомеров. Следует иметь в виду, что настоящее изобретение относится ко всем изомерным и таутомерным формам соединений, охватываемым формулой I, как в виде чистых соединений, так и в виде их смесей.
Фармацевтические композиции
Композиции настоящего изобретения содержат в качестве активного компонента, по меньшей мере, одно соединение формулы I (на которое далее ссылаются как на активный ингредиент), включая его фармацевтически приемлемые соли и сложные эфиры, вместе, по меньшей мере, с одним фармацевтически приемлемым носителем и/или разбавителем.
Отношение активного ингредиента к носителю в указанной композиции может изменяться от 0,5% до 100% масс, главным образом, от 0,1 до приблизительно 50% масс. Композиции могут быть приготовлены в форме различных фармацевтических рецептур, таких как грануляты, таблетки, пилюли, драже, суппозитории, капсулы, таблетки с замедленным высвобождением, суспензии, препараты для инъекций, и могут быть помещены в пузырьки, тубы или аналогичные контейнеры в соответствии с общепринятыми принципами составления фармацевтических рецептур, например, описанных в Remington: The Science and Practice of Pharmacy, 20th Ed., Mack Publishing Company, 2000. Для составления композиций, содержащих соединения настоящего изобретения, можно использовать следующие фармацевтически приемлемые органические или неорганические, твердые или жидкие носители и/или разбавители, подходящие для перорального, энтерального, парентерального или местного применения: вода, желатин, лактоза, крахмал, стеарат магния, тальк, растительные и животные масла и жиры, бензиловый спирт, камедь, полиалкиленгликоль, вазелин, масло какао, ланолин и другие эмульгирующие агенты, в качестве дополнительных агентов можно использовать соли для регулирования осмотического давления или буферы, обеспечивающие соответствующее значение рН.
Кроме того, композиция может содержать другие терапевтически активные компоненты, которые можно применять вместе с соединениями изобретения для лечения инфекционных заболеваний, например другие подходящие антибиотики, в частности такие антибиотики, которые способны повышать активность композиции и/или препятствовать развитию резистентности. Такие антибиотики включают пенициллины, цефалоспорины, тетрациклины, рифамицины, эритромицины, линкомицин, клиндамицин и фторхинолоны. Другие соединения, которые можно успешно комбинировать с соединениями изобретения, особенно в препаратах для местного применения, включают, например, кортикостероиды, такие как гидрокортизон или триамцинолон. Альтернативно, другие такие терапевтически активные компоненты можно вводить (либо одновременно, либо последовательно) в качестве средств, сопутствующих применению композиции настоящего изобретения.
В случае гранулятов, таблеток, капсул или драже фармацевтическая композиция настоящего изобретения содержит от 25 до 98% активного ингредиента изобретения, а в случае пероральных суспензий соответствующее количество активного ингредиента составляет от 2 до 20%.
Когда активный ингредиент вводят в виде солей фармацевтически приемлемых нетоксичных кислот или оснований, желательно, чтобы предпочтительные соли легко или умеренно растворялись в воде с целью обеспечения соответствующей скорости поглощения.
Как отмечалось выше, соединения формулы I и их соли могут содержаться в фармацевтических препаратах, включая суспензии, мази и кремы. Фармацевтический препарат для перорального применения также может быть в виде суспензии активного ингредиента, как такового или в виде фармацевтически приемлемой соли с умеренной растворимостью в воде, причем такой препарат содержит носитель в количестве от 20 до 100 мг/мл. Фармацевтический препарат для местного применения может быть в виде мази или крема, с содержанием активного ингредиента в количестве от 0,5 до 50% от количества препарата. Препараты для местного применения являются особенно подходящими благодаря устойчивости к действию солнечного света и соответствующей липофильной природе соединений настоящего изобретения.
Дозировка соединений настоящего изобретения может быть выбрана таким образом, чтобы достигалась желаемая активность без серьезных побочных эффектов. При системной терапии человека соединения настоящего изобретения и их соли обычно вводят (для взрослых) в дозированных единицах, содержащих не менее 50 мг и до 1000 мг, предпочтительно от 200 до 750 мг, в расчете на соединение формулы I.
Термин «дозированная единица» обозначает единичную дозу, которая может быть введена пациенту и которая может быть легкой в обращении и при упаковке, оставаясь физически и химически стабильной единичной дозой, содержащей либо только активный ингредиент, либо его смесь с одним или несколькими твердыми или жидкими фармацевтическими разбавителями или наполнителями.
Соединение в виде дозированной единицы можно вводить один или несколько раз в день, через определенные интервалы времени, однако всегда в зависимости от состояния пациента и в соответствии с предписанием врача.
При системном лечении дневная дозированная единица предпочтительно составляет 0,5-3 г активного ингредиента.
Термин «используемая единица» применительно к местному применению обозначает используемую, т.е. единичную, дозу, которая может быть введена локально пациенту в количестве от 0,1 до 10 мг, предпочтительно, от 0,2 до 1 мг активного ингредиента в расчете на квадратный сантиметр инфицированной площади.
Для применения рассматриваемой композиции путем инъекции предусматриваются закрытая ампула, пробирка или аналогичный контейнер, содержащий парентерально применимый стерильный водный или масляный раствор для инъекций или дисперсию активного ингредиента в виде единичной дозы.
Парентеральные препараты особенно полезны для лечения таких состояний, при которых желательна быстрая реакция на лечение. При непрерывной терапии пациентов, страдающих инфекционными заболеваниями, подходящей формой фармацевтического препарата могут быть таблетки или капсулы, что связано с продолжительным действием лекарства при пероральном применении, особенно в виде таблеток пролонгированного действия.
При лечении инфекционных заболеваний предпочтительны таблетки, содержащие другие активные компоненты, как указано выше.
Согласно способу лечения пациентов, страдающих инфекционными заболеваниями, соединение формулы I или эквивалентное количество его соли или эфира можно вводить пациентам в дозе по 0,03-0,7 г/кг массы тела 1-3 раза в день, предпочтительно 0,5-3 г в день. Активный ингредиент предпочтительно вводить в указанных выше дозированных единицах.
Пациентами, которых могут лечить или лечат согласно изобретению, могут быть животные, включая млекопитающих, и особенно люди. Животные могут также включать таких домашних животных, как лошади, коровы, свиньи, овцы, домашняя птица, рыбы, кошки, собаки и другие зоологические животные.
Лечение инфекционных заболеваний часто включает установление резистентности указанного заболевания к предполагаемому лечению, которое часто проводят до фактического начала лечения. Так, например, у пациента могут брать образцы, содержащие инфицирующие микробы, например образцы крови или мочи, после чего образец подвергают культивации и воздействию лечения с целью выяснения реакции организма на лечение указанной инфекции. Соответственно, настоящее изобретение также обеспечивает способ идентификации соединений с бактерицидным действием, включающий контактирование микроорганизма с соединением формулы I, необязательно вместе с другими терапевтически активными агентами, и установление токсического или статического действия указанного соединения или смеси соединений на изучаемый микроорганизм.
Композиции настоящего изобретения не ограничиваются фармацевтическими препаратами, но также могут применяться в не терапевтическом контексте для контроля микробного роста. Так, например, селективность бактерицидных агентов делает их полезными веществами, усиливающими рост конкретных микроорганизмов (таких как непатогенные микроорганизмы) за счет роста других микроорганизмов в многовидовой культуре.
Далее настоящее изобретение иллюстрируется следующими примерами получения соединений изобретения и примерами их применения, не ограничивающими заявленную область изобретения.
Примеры получения и применения соединений изобретения
Способы получения соединений изобретения
Исходные стероидные соединения
Исходные карбоксозамещенные стероидные аналоги могут быть приобретены коммерческим путем или получены способами, описанными в литературе. Стероиды, родственные фусидовой кислоте, могут быть получены по различным литературным методикам из природных фусиданов, таких как фусидовая кислота, фумигацин, виридоминовые кислоты, и соединений семейства цефалоспорина Р (см., например, Godtfredsen and Vangedal, 1962; Arigoni et al., 1964; Godtfredsen et al., 1965a и 1965b; Godtfredsen et al., 1966; Diassi et al., 1979; von Daehne и цитированные в этих документах ссылки, содержание которых включено в настоящее описание в виде ссылки), или хорошо известной для специалиста простой химической модификацией перечисленных выше фусиданов, включающей гидрирование двойных связей, реакции дегидратации, сульфирования и окисления.
Сульфирование гидроксильных групп:
Согласно имеющимся литературным данным (Kinney et al., 2000) все соединения настоящего изобретения, содержащие одну или несколько свободных гидроксильных групп, могут быть подвергнуты селективному сульфированию либо по одной гидроксильной группе, либо по нескольким гидроксильным группам, с использованием стехиометрического количества или избытка комплекса триоксид серы-пиридин. Сульфирование проводят перед реакциями сочетания А, В и С.
Ацилирование гидроксильных групп
Ацилирование свободных гидроксильных групп стероидных производных проводят, используя избыток уксусного ангидрида в пиридине, при комнатной температуре в безводных условиях.
Восстановление двойных связей
Восстановление двойных связей стероидных производных осуществляют каталитическим гидрированием с использованием палладия на угле в качестве катализатора и уксусной кислоты, МеОН, EtOH или этилацетата в качестве растворителя. Реакции проводят при встряхивании в течение 6-20 часов при комнатной температуре.
Дегидратация гидроксильных групп
Дегидратацию 11-ОН группы производных фусидовой кислоты осуществляют путем их обработки избыточным количеством тионилхлорида в пиридине и дихлорметане при 0°C в безводных условиях.
Удаление 16-ацетоксигруппы
16-Ацетоксигруппа производных фусидовой кислоты может быть удалена в безводных условиях, при нагревании с обратным холодильником соответствующего метилового эфира в безводном метаноле в присутствии избыточного количества магниевой стружки. Метиловый эфир затем удаляют нагреванием с обратным холодильником в течение 1 часа в водном растворе гидроксида натрия.
Окисление гидроксильных групп
Стероиды, содержащие кето- или альдегидные функциональные группы, могут быть получены из соответствующих спиртов различными методами окисления, которые хорошо известны специалисту в данной области.
Исходные вещества на основе разветвленного полиамина
Разветвленные полиамины обычно выбирают из коммерчески доступных веществ, например, имеющихся в базе данных Available Chemicals Directory (ACD), однако такие вещества могут быть также синтезированы известными в литературе методами (избранные ссылки: Goodnow et al., 1990; Bergeron et al., 1994; Stromgaard et al., 1999; Gaell and Blagbrough, 2000; Kuksa et al., 2000 и ссылки, цитированные в указанных работах; Karigiannis and Papaioannou, 2000 и ссылки, цитированные в этой работе, причем все перечисленные работы включены в настоящее описание в виде ссылки).
Синтез стероидов с разветвленным полиаминовым фрагментом, присоединенным посредством амидной связи (Способ А, Схема 1)
Соединения изобретения, в которых разветвленный полиаминовый фрагмент присоединен к стероидным ядрам посредством амидной связи, могут быть получены из различных стероидов, содержащих карбоксильную группу, например из тетрагидрофусидовой кислоты по схеме 1, и разнообразных разветвленных полиаминовых соединений. Карбоксильную группу стероидного производного подвергают этерификации с получением реакционноспособного сложного эфира, например сукцинимидового сложного эфира, путем взаимодействия карбоксильной группы с N-гидроксисукцинимидом в безводном ТГФ в присутствии дициклокарбодиимида (DCC). Сукцинимидовый сложный эфир затем можно подвергнуть взаимодействию с разветвленным полиамином путем растворения избытка разветвленного полиамина в безводном хлороформе в атмосфере аргона и последующего медленного добавления раствора активированного эфира в хлороформе. Реакцию проводят при комнатной температуре и завершают через 6-24 часа. Затем реакционную смесь можно концентрировать без дополнительных стадий промывки и непосредственно очистить методом ВЭЖХ c обращенной фазой, используя в качестве элюента смесь ацетонитрила и воды, забуференную трифторуксусной кислотой, или методом колоночной хроматографии на силикагеле, используя в качестве элюента смесь дихлорметана, метанола и водного аммиака. Такой способ иллюстрируется примером, приведенным на схеме 1, где стероидные ядра представлены тетрагидрофусидовой кислотой. Тетрагидрофусидовую кислоту сначала превращают в соответствующий N-сукцинимидовый эфир взаимодействием с N-гидроксисукцинимидом в безводном ТГФ в присутствии дициклокарбодиимида. Затем сложный эфир тетрагидрофусидовой кислоты взаимодействует с N,N-бис(2-аминоэтил)эта