Полиморфы пирролзамещенных 2-индолиноновых ингибиторов протеинкиназы
Иллюстрации
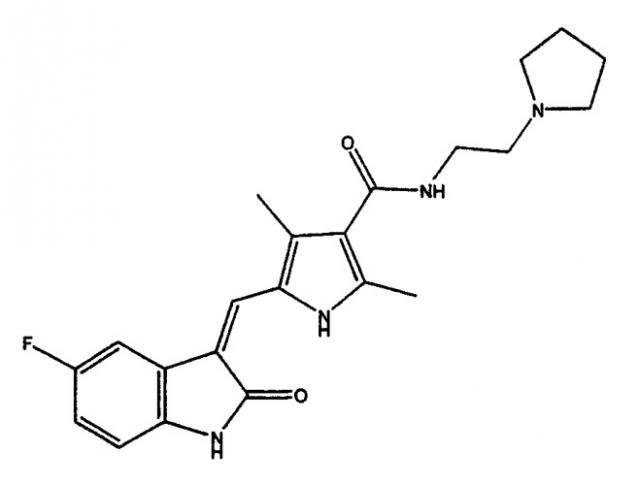
Показать всеНастоящее изобретение относится к полиморфам 1-пирролзамещенного 2-индолинонового соединения (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1Н-пиррол-3-карбоновой кислоты, а именно полиморфной форме соединения формулы I:
в виде полиморфной формы II, по существу свободной от полиморфа формы I, характеризуемой порошковой рентгенограммой PXRD, с характеристическими пиками, выраженными в градусах (±0,1) двойного угла 7.1,13.9,16.0,20.9 и 24.7, полученными с использованием CuKα1 излучения (длина волны = 1.5406 А), и полиморфной форме соединения формулы I в виде полиморфа формы I, по существу свободной от полиморфа формы II, характеризуемой порошковой рентгенограммой PXRD, с характеристическими пиками, выраженными в градусах (±0,1) двойного угла 5.0,16.7,18.9,24.8 и 27.3, полученными с использованием CuKα1 излучения (длина волны = 1.5406 А). Изобретение также относится к фармацевтической композиции, обладающей способностью модулировать каталитическую активность протеинкиназы, на основе этих форм, способу модулирования каталитической активности протеинкиназы и способу лечения расстройств, связанных с протеинкиназой. 11 н. и 15 з.п. ф-лы, 3 ил., 4 табл.
Реферат
По данной заявке испрашивается приоритет согласно 35 USC, 119(e), временной заявке на патент США, серийный № 60/448863, поданной 24 февраля 2003 года, описание которой включено в данное описание в качестве ссылки во всей своей полноте.
Настоящее изобретение относится к полиморфам 3-пирролзамещенного 2-индолинонового соединения (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты.
Описание предшествующего уровня техники
(2-Пирролидин-1-илэтил)амид 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты представляет собой соединение, которое демонстрирует способность к модулированию протеинкиназы (PK). По этой причине данное соединение является полезным для лечения расстройств, связанных с аномальной активностью PK.
Кратко, PK представляют собой ферменты, которые катализируют фосфолирирование гидроксигрупп на тирозиновом, сериновом и треониновом остатках белков. Последствия этой, на первый взгляд, простой активности являются поразительными, поскольку, по существу, все аспекты жизни клеток (например, рост, дифференциация и пролиферация клеток) тем или иным образом зависят от активности PK. Кроме того, аномальная активность PK связана с множеством расстройств, начиная от относительно неопасных для жизни заболеваний, таких как псориаз, до исключительно опасных заболеваний, таких как глиобластома (рак мозга).
(2-Пирролидин-1-илэтил)амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты является ингибитором рецепторной тирозинкиназы (RTK); класса PK. RTK и их лиганды, VEGF, PDGF и FGF опосредуют новообразование сосудов, известное как ангиогенез, в солидных опухолях. Как следствие, посредством ингибирования RTK может ингибироваться рост новых кровеносных сосудов в опухолях. Теоретически, этот новый класс молекул, называемых антиангиогенетическими агентами, имеет гораздо меньшую токсичность для организма по сравнению с обычными противораковыми лекарственными средствами. (2-Пирролидин-1-илэтил)амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты в настоящее время разрабатывается для лечения раковых заболеваний у домашних животных, в основном у собак, и являются также пригодными, среди прочего, для лечения рака у людей. Такие раковые заболевания включают, но, не ограничиваясь этим, лейкемию, рак мозга, немелкоклеточный рак легких, плоскоклеточный рак, астроцитому, саркому Капоши, глиобластому, рак легких, рак мочевого пузыря, рак головы и шеи, меланому, рак яичников, рак простаты, рак груди, мелкоклеточный рак легких, глиому, рак тонкой и прямой кишки, рак мочеполовой системы и стромальный рак желудочно-кишечной системы. Также, сюда включена сверхэкспрессия тучных клеток, включая, но, не ограничиваясь этим, мастоцитоз.
Авторы обнаружили, что соединение (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты существует в двух полиморфных формах, полиморф I и полиморф II, каждая из которых имеет четко различающиеся физические свойства.
По этой причине в первом варианте осуществления настоящее изобретение относится к соединению формулы I:
по существу, свободному от полиморфа формы I.
Во втором варианте осуществления настоящее изобретение относится к соединению формулы
по существу, свободному от полиморфа формы II.
В предпочтительном варианте осуществления соединение первого варианта осуществления характеризуется порошковой рентгенограммой (PXRD), показанной на фиг.1, форма II, и соединение второго варианта осуществления характеризуется порошковой рентгенограммой (PXRD), показанной на фиг.1, форма I.
В третьем варианте осуществления настоящее изобретение относится к композиции, содержащей полиморф I соединения формулы I:
где полиморф I составляет примерно более чем 85% мас. от массы композиции; или примерно более чем 90% мас. от массы композиции; или примерно более чем 95% мас. от композиции; или примерно более чем 99% мас. от массы композиции.
В четвертом варианте осуществления настоящее изобретение относится к композиции, содержащей полиморф II соединения формулы I:
где полиморф II составляет примерно более чем 85% мас. от массы композиции; или примерно более чем 90% мас. от массы композиции; или примерно более чем 95% мас. от массы композиции; или примерно более чем 99% мас. от массы композиции.
В пятом варианте осуществления настоящее изобретение относится к полиморфу соединения формулы I:
где указанный полиморф получают
(a) растворением указанного соединения в кислом водном растворе;
(b) подщелачиванием указанного водного раствора, тем самым, вызывая осаждение указанного соединения, по существу свободного от полиморфа формы II; и
(c) выделением осажденного полиморфа формы I из указанного соединения.
В шестом варианте осуществления настоящее изобретение относится к полиморфу соединения формулы I:
где указанный полиморф получают
(a) растворением указанного соединения в полярном органическом растворителе, который не образует водородных связей;
(b) выпариванием указанного полярного органического растворителя, тем самым вызывая осаждение указанного соединения, по существу свободного от полиморфа формы II; и
(c) выделением осажденного полиморфа формы I из указанного соединения.
В седьмом варианте осуществления настоящее изобретение относится к полиморфу соединения формулы I:
где указанный полиморф получают
(a) растворением указанного соединения в полярном органическом растворителе, который образует водородные связи;
(b) выпариванием указанного полярного органического растворителя, тем самым вызывая осаждение указанного соединения, по существу свободного от полиморфа формы I; и
(c) выделением осажденного полиморфа формы II из указанного соединения.
В предпочтительном варианте осуществления настоящего изобретения полярный органический растворитель шестого варианта осуществления, который не образует водородных связей, представляет собой ТГФ. В другом предпочтительном варианте осуществления полярный органический растворитель седьмого варианта осуществления, который образует водородные связи, представляет собой метанол.
В восьмом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение первого или второго варианта осуществления и фармацевтически приемлемый носитель или эксципиент.
В девятом варианте осуществления настоящее изобретение относится к способу модулирования каталитической активности протеинкиназы, включающему стадию контактирования указанной протеинкиназы с соединением первого или второго вариантов осуществления. В предпочтительном варианте осуществления протеинкиназу выбирают из группы, состоящей из рецепторной тирозинкиназы, не-рецепторной тирозинкиназы и серин-треонинкиназы.
В десятом варианте осуществления настоящее изобретение относится к способу лечения или профилактики расстройств, связанных с протеинкиназой, в организме, включающему введение терапевтически эффективного количества фармацевтической композиции, содержащей соединение первого или второго варианта осуществления и фармацевтически приемлемый носитель или эксципиент, в организм. В предпочтительном варианте осуществления расстройства, связанные с протеинкиназой, выбраны из группы, состоящей из расстройства, связанного с рецепторной тирозинкиназой, расстройства, связанного с не-рецепторной тирозинкиназой, и расстройства, связанного с серин-треонинкиназой. В другом предпочтительном варианте осуществления расстройство, связанное с протеинкиназой, выбрано из группы, состоящей из расстройства, связанного с EGFR, расстройства, связанного с PDGFR, расстройства, связанного с IGFR, расстройства, связанного с c-kit, и расстройства, связанного с flk. В еще одном предпочтительном варианте осуществления расстройства, связанные с протеинкиназой, представляют собой раковое заболевание, выбранное из группы, состоящей из лейкемии, рака мозга, немелкоклеточного рака легких, плоскоклеточного рака, астроцитомы, саркомы Капоши, глиобластомы, рака легких, рака мочевого пузыря, рака головы, рака шеи, меланомы, рака яичников, рака простаты, рака груди, мелкоклеточного рака легких, глиомы, рака тонкой и прямой кишки, рака мочеполовой системы и стромального рака желудочно-кишечной системы. Также, сюда включена сверхэкспрессия тучных клеток, включая, но, не ограничиваясь этим, мастоцитоз. Еще в одном предпочтительном варианте осуществления расстройства, связанные с протеинкиназой, выбраны из группы, состоящей из диабета, аутоиммунного расстройства, расстройства гиперпролиферации, рестеноза, фиброза, псориаза, болезни Гиппеля-Линдау, остеоартрита, ревматоидного артрита, ангиогенеза, воспалительного расстройства, иммунологического расстройства и сердечно-сосудистого расстройства. Еще в одном предпочтительном варианте осуществления организмом является человек.
В одиннадцатом варианте осуществления настоящее изобретение относится к способу лечения рака у домашних животных, включающему введение фармацевтической композиции, содержащей соединение первого или второго варианта осуществления и фармацевтически приемлемый носитель или эксципиент. В предпочтительном варианте осуществления домашними животными являются кошка или собака.
Фиг.1 представляет собой порошковую рентгенограмму (PXRD) для полиморфа I (Форма I) и полиморфа II (Форма II) (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты.
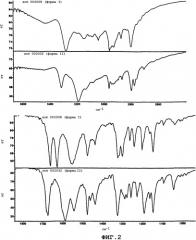
Фиг.2 представляет собой инфракрасные спектры (ИК) пропускания, измеренные для высоко- и среднечастотных областей ИК-спектра, для полиморфа I (верхние спектры) и полиморфа II (нижние спектры) (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты.
Фиг.3 представляет собой рамановские спектры, измеренные в высоко- и среднечастотных областях рамановского спектра, для полиморфа I (верхние спектры) и полиморфа II (нижние спектры) (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты.
Если не утверждается иного, следующие далее термины, используемые в описании и формуле изобретения, имеют значения, обсуждаемые ниже.
"Полиморф" относится к твердой фазе вещества, которая существует в нескольких различных формах, из-за различных конфигураций и/или конформаций молекул в кристаллической решетке.
Полиморф может также определяться как различные несольватированные кристаллические формы соединения.
Полиморфы, как правило, имеют различные химические и физические свойства. Термин "полиморф" в контексте предпочтительных вариантов осуществления настоящего изобретения также включает сольваты (то есть формы, содержащие растворитель или воду), аморфные формы (то есть некристаллические формы) и десольватированные сольваты (то есть формы, которые могут быть получены только посредством удаления растворителя из сольвата).
В предпочтительные варианты осуществления настоящего изобретения включаются чистые, отдельные полиморфы, а также смеси, содержащие два или более различных полиморфов. Чистый, отдельный полиморф может, по существу, не содержать других полиморфов. "По существу свободный" означает, что другой полиморф (полиморфы) присутствуют в количестве, менее чем примерно 15% мас., более предпочтительно, менее чем примерно 10% мас., еще более предпочтительно, менее чем примерно 5% мас., наиболее предпочтительно, менее чем примерно 1% мас. Любому специалисту в данной области будет понятна фраза "в количестве, менее чем примерно 15% мас.", как означающая, что полиморф, представляющий интерес, присутствует в количестве, большем, чем примерно 85% мас. Подобным образом, фраза "менее чем примерно 10% мас." означает, что полиморф, представляющий интерес, присутствует в количестве, большем, чем примерно 90% мас., и так далее и тому подобное.
Полиморфы соединений предпочтительных вариантов осуществления настоящего изобретения являются желательными, поскольку конкретный полиморф соединения может иметь лучшие физические и химические свойства, чем другие полиморфные формы такого же соединения. Например, один из полиморфов может иметь повышенную растворимость в определенных растворителях. Такая дополнительная растворимость может облегчить получение или введение соединений предпочтительных вариантов осуществления настоящего изобретения. Различные полиморфы могут также иметь различные механические свойства (например, различную сжимаемость, совместимость, таблетируемость), которые могут влиять на рабочие характеристики таблетирования лекарственного средства и, таким образом, влиять на изготовление лекарственного средства. Конкретный полиморф может также демонстрировать отличную скорость растворения в том же растворителе по отношению к другому полиморфу. Различные полиморфы могут также иметь различную физическую (твердофазное преобразование метастабильного полиморфа в более стабильный полиморф) и химическую (реакционная способность) стабильность.
Предпочтительные варианты осуществления настоящего изобретения включают фармацевтическую композицию, содержащую полиморф предпочтительных вариантов осуществления настоящего изобретения и фармацевтически приемлемый носитель или эксципиент. Носители и эксципиенты для изготовления фармацевтически приемлемых композиций, содержащих полиморфы предпочтительных вариантов осуществления настоящего изобретения, хорошо известны в данной области и описаны, например, в заявке на патент США № 09/783264, поданной 15 февраля 2001 года, которая включена в данное описание во всей своей полноте. См. WO 01/60814.
Предпочтительные варианты осуществления настоящего изобретения также включают способ модуляции каталитической активности протеинкиназы, включающий приведение в контакт указанной протеинкиназы с полиморфом предпочтительных вариантов осуществления настоящего изобретения, в предпочтительном варианте осуществления настоящего изобретения протеинкиназу выбирают из группы, состоящей из рецепторной тирозинкиназы, не-рецепторной тирозинкиназы и серин-треонинкиназы.
Предпочтительные варианты осуществления настоящего изобретения включают способ лечения или профилактики расстройства, связанного с протеинкиназой, в организме (например, человека), включающий введение терапевтически эффективного количества фармацевтической композиции, содержащей полиморф предпочтительных вариантов осуществления настоящего изобретения и фармацевтически приемлемый носитель или эксципиент, в организм. В предпочтительном варианте осуществления настоящего изобретения расстройство, связанное с протеинкиназой, выбирают из группы, состоящей из расстройства, связанного с тирозинкиназой рецептора, расстройства, связанного с не-рецепторной тирозинкиназой, и расстройства, связанного с серин-треонинкиназой. В другом предпочтительном варианте осуществления настоящего изобретения расстройство, связанное с протеинкиназой, выбирают из группы, состоящей из расстройства, связанного с EGFR, расстройства, связанного с PDGFR, расстройства, связанного с IGFR, и расстройства, связанного с flk. Еще в одном предпочтительном варианте осуществления настоящего изобретения расстройство, связанное с протеинкиназой, представляет собой раковое заболевание, выбранное из группы, состоящей из плоскоклеточного рака, астроцитомы, саркомы Капоши, глиобластомы, рака легких, рака мочевого пузыря, рака головы и шеи, меланомы, рака яичников, рака простаты, рака груди, мелкоклеточного рака легких, глиомы, рака тонкой и прямой кишки, рака мочеполовой системы и рака желудочно-кишечной системы. В предпочтительном варианте осуществления настоящего изобретения расстройство, связанное с протеинкиназой, выбирают из группы, состоящей из диабета, аутоиммунного расстройства, расстройства гиперпролиферации, рестеноза, фиброза, псориаза, болезни Гиппеля-Линдау, остеоартрита, ревматоидного артрита, ангиогенеза, воспалительных расстройств, иммунологических расстройств и сердечно-сосудистых расстройств.
Предпочтительные варианты осуществления настоящего изобретения также включают способ лечения рака у домашних животных, включающий введение фармацевтической композиции, содержащей полиморф предпочтительных вариантов осуществления настоящего изобретения и фармацевтически приемлемый носитель или эксципиент. Как он здесь используется в данном описании, термин "домашнее животное" включает, но, не ограничиваясь этим, кошек и собак.
Следующие примеры приводятся для того, чтобы дать возможность специалисту в данной области более ясно понять и осуществить настоящее изобретение. Примеры не должны рассматриваться в качестве ограничивающих объем настоящего изобретения, а только в качестве иллюстративных и презентативных.
Синтез (2-пирролидин-1-илэтил)амида 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1H-пиррол-3-карбоновой кислоты
5-Фтор-1,3-дигидроиндол-2-он конденсируют с (2-пирролидин-1-илэтил)амидом 5-формил-2,4-диметил-1H-пиррол-3-карбоновой кислоты с получением указанного в заглавии соединения.
MS+ ve APCI 397[M++1].
Методика масштабирования:
5-Формил-2,4-диметил-1H-пиррол-3-карбоновую кислоту (61 г), 5-фтор-l,3-дигидроиндол-2-он (79 г), этанол (300 мл) и пирролидин (32 мл) кипятят с обратным холодильников в течение 4,5 час. К смеси добавляют уксусную кислоту (24 мл) и продолжают кипячение с обратным холодильником в течение 30 минут. Смесь охлаждают до комнатной температуры и твердые вещества собирают вакуумным фильтрованием и дважды промывают этанолом. Твердые вещества перемешивают в течение 130 минут в 40% растворе ацетона в воде (400 мл), содержащем 12 н. хлористоводородной кислоты (6,5 мл). Твердые вещества собирают вакуумным фильтрованием и дважды промывают 40% раствором ацетона в воде. Твердые вещества сушат в вакууме с получением 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты (86 г, 79% выход) в виде оранжевого твердого вещества.
1H-ЯМР (диметилсульфоксид-d6) δ 1,60 (м, 4H, 2×CH2), 2,40, 2,44 (2×с, 6H, 2×CH3), 2,50 (м, 4H, 2×CH2), 2,57, 3,35 (2×м, 4H, 2×CH2), 7,53, 7,70, 7,73, 7,76 (4×м, 4H, ароматика и винил), 10,88 (с, 1H, CONH), 13,67 (с, 1H, пиррол NH).
МС m/z 299 [M-1].
5-[5-Фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновую кислоту (100 г) и диметилформамид (500 мл) перемешивают и добавляют гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (221 г), 1-(2-аминоэтил)пирролидин (45,6 г) и триэтиламин (93 мл). Смесь перемешивают в течение 2 часов при температуре окружающей среды. Твердое вещество собирают вакуумным фильтрованием и промывают этанолом. Твердые вещества промывают в суспензии перемешиванием в этаноле (500 мл) в течение одного часа при 64°C и охлаждают до комнатной температуры. Твердые вещества собирают вакуумным фильтрованием, промывают этанолом и сушат в вакууме с получением (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты (101,5 г, выход 77 %).
1H-ЯМР (диметилсульфоксид-d6) δ 2,48, 2,50 (2×с, 6H, 2×CH3), 6,80, 6,88, 7,68, 7,72 (4×м, 4H, ароматика и винил), 10,88 (с, 1H, CONH), 12,12 (с, 1H, COOH), 13,82 (с, 1H, пиррол NH).
МС m/z396 [M+1].
ОБЩИЕ АНАЛИТИЧЕСКИЕ СПОСОБЫ ДЛЯ ОПРЕДЕЛЕНИЯ ИДЕНТИЧНОСТИ И ФИЗИЧЕСКИХ СВОЙСТВ ПОЛИМОРФОВ
Оценка растворимости полиморфа в различных растворителях
Приблизительно 1,5 мг полиморфа переносят в 10 мл стеклянные флаконы (тарированные) и взвешивают (с точностью до 0,1 мг). Во флаконы порциями добавляют растворители (по одному растворителю в каждый флакон). После каждого добавления флакон закрывают крышкой и встряхивают. Растворение твердого вещества наблюдают визуально. Если очевидного растворения не наблюдается, сразу после этого добавляют еще растворитель. Если растворение является очевидным, флакон оставляют на столе, по меньшей мере, на 30 минут до следующего добавления растворителя. Эту стадию повторяют до тех пор, пока кристаллы не будут видны на черном и белом фонах. Затем оценивают пределы растворимости посредством деления массы на конечный объем и объем перед последним добавлением. Если твердое вещество остается после добавления 10 мл растворителя, растворимость выражается как меньшая, чем масса, деленная на конечный объем. Если твердое вещество полностью растворяется после первого добавления растворителя, растворимость выражается как большая, чем масса, деленная на объем растворителя. Значения растворимости выражают в мг/мл. Все эксперименты осуществляют при комнатной температуре.
Определение зависимости растворимости полиморфов от pH
Примерно 3 мл водных растворов с различными концентрациями либо HCl, либо NaOH, дающими pH 1-13, переносят в 10 мл стеклянный флакон. Добавляют достаточное количество полиморфа. Флаконы обертывают алюминиевой фольгой и встряхивают вручную. Затем ему дают возможность осесть в вытяжном шкафу в течение ночи перед какой-либо дальнейшей обработкой.
Порошковый рентгеноструктурный анализ (PXRD)
Порошковый рентгеноструктурный анализ осуществляют, используя Scintag X2 Advanced Diffraction System, работающую с программным обеспечением Scintag DMS/NT 1.30a и Microsoft Windows NT 4.0. Система использует медный источник рентгеновского излучения (45 кВ и 40 мА) с получением эмиссии CuKaα1 на 1,5406A и твердофазный охлаждаемый детектор Пельтье. Апертуру луча контролируют, используя расхождение трубки и противорассеивательных щелей 2 и 4 мм, и противорассеивательных щелей детектора и приемных щелей шириной 0,5 и 0,2 мм. Данные собирают при значениях два тэта от 2 до 35, используя шаг сканирования 0,03/шаг, при времени отсчета одна секунда на шаг. Для экспериментов используют круглые, загружаемые сверху чашки для образцов из нержавеющей стали со вставками диаметром 9 мм. Порошки набивают в держатель и осторожно прижимают стеклянной пластинкой для обеспечения компланарности между поверхностью образца и поверхностью держателей.
Дифференциальная сканирующая калориметрия (DSC)
Данные дифференциальной сканирующей калориметрии (DSC) получают с использованием калориметра DSC (TA Instruments 2920). 1-10 мг порошка набивают в алюминиевую чашку для DSC. Алюминиевую крышку помещают поверх чашки и наворачивают на нее. Завернутую чашку помещают в ячейку для образца вместе с пустой чашкой в качестве эталона. Температуру увеличивают от 30°C до 300°C со скоростью 10°C/мин.
Микроскопия в поляризованном свете
Микроскопию осуществляют на микроскопе поляризованного света Olympus BHSP. Порошок закрепляют в силиконовом масле и диспергируют между предметным и покровным стеклами микроскопа. Перед наблюдением покровное стекло осторожно притирают по отношению к предметному стеклу для получения хорошего диспергирования образца порошка. Микроскопию используют для оценки размеров части, формы и кристалличности порошковых образцов. Когда на микроскопе закреплен горячий столик, тепловые события, наблюдаемые посредством других методик (например, DSC, термогравиметрический анализ (TGA)), также могут быть визуализированы.
Инфракрасная Фурье-спектроскопия (FTIR)
Образцы полиморфов приготавливают для инфракрасного анализа в виде таблеток с KBr. Данные по инфракрасному пропусканию собирают от 4000 до 400 см-1 на Nicolet 760 FTER, снабженном детектором TGS. Чувствительность, выраженная как усиление инструмента, равна 4. Данные обрабатывают как преобразование Фурье с использованием аподизации Хаппа-Генцеля. Конечные спектры FTIR представляют 200 индивидуальных сканирований.
Рамановская Фурье-спектроскопия
Примерно 2 мг полиморфа набивают в 1,7-мм стеклянную капиллярную пробирку и экспонируют в лазерном свете, 1,00 Вт, 1064 нм. Рамановские спектры получают в области от 3800 до 100 см-1. Данные собирают с использованием рамановского Фурье-спектрометра Nicolet 960, снабженного детектором INGAS. Чувствительность, выраженная как усиление инструмента, равна 8. Данные опять обрабатывают как преобразование Фурье с использованием аподизации Хаппа-Генцеля. Конечные рамановские Фурье-спектры представляли 200 индивидуальных сканирований.
Определение начальной скорости растворения (IDR) с помощью вращающегося диска
IDR измеряют с использованием оптико-волоконной УФ автоматизированной системы растворения. Процесс растворения отслеживается в некоторых случаях непрерывно, при 426,2 нм, с использованием оптико-волоконного датчика, при этом получают по 10 точек данных в минуту. Для получения прессованного диска для эксперимента порошки прессуют в матрице из нержавеющей стали (SS) (диаметр 1¼ дюйма×1 дюйм, внутренний диаметр 3/16 дюйма), используя пуансон из инструментальной стали (HSS) (диаметр 3/16 дюйма и длина 3¾ дюйма). Пуансон из HSS вставляют в матрицу на расстояние примерно 3/4 дюйма, оставляя примерно 1/4 дюйма для размещения примерно 10 мг лекарственного средства в полости матрицы. Опорная пластина из SS (диаметр 1/4 дюйма) помещается для накрывания полости. Затем весь узел закрепляют с помощью держателя на 2 болтах. Пресс Carver используют для прессования порошка при ˜1000 фунтов (˜37000 фунтов/кв.дюйм) в течение 3 минут. Матрицу и держатель удаляют из пресса Carver и пуансон слегка оттягивают назад, чтобы дать возможность таблетке для релаксации/расширения. Затем матрицу плотно фиксируют на пуансоне из HSS с помощью установочного винта. Весь узел из пуансона и матрицы, содержащий таблетку лекарственного средства, при этом одна лицевая сторона таблетки лекарственного средства открыта, вынимают как целое из держателя и присоединяют к электрическому приводу. Матрица вращается со скоростью 300 об/мин и опускается в среду для растворения через 3 минуты после запуска программы сбора данных. Среда для растворения дегазируется и содержится в 500 мл химическом стакане с кожухом для протекания воды (Pyrex, No. 1000). Данные, собранные в течение первых 3 минут, дают фоновое значение для каждого эксперимента по растворению. Среда для растворения состоит из раствора с pH 2 (0,01н. HCl и 0,05M KCl). Матрицу располагают таким образом, чтобы прессованное лекарственное средство находилось примерно в 2,5 дюймах от дна 500 мл емкости для растворения и примерно на таком же расстоянии от поверхности жидкости.
График зависимости начальной скорости растворения строят с использованием Microsoft Excel, и начальную скорость растворения вычисляют автоматически с помощью программы, в соответствии с уравнением (1)
(1)
Объем среды для растворения равен 300 мл. Площадь поверхности таблетки, открытая для среды для растворения, равна 0,177 см2. Период времени для опыта по растворению обычно составляет 15 минут, но может изменяться по необходимости.
Определение физических свойств полиморфов (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты
Идентифицировали две формы полиморфа (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты. Термодинамическое соотношение между двумя формами полиморфа соединения, их поведение при растворении и их свойства в твердом состоянии становятся непосредственно ясны для выбора твердой формы и соответствующего контроля процесса во время производства активного фармацевтического ингредиента (API). По этой причине делали попытку определить соотношение стабильности между двумя формами полиморфа соединения и охарактеризовать их свойства в твердом состоянии с использованием разнообразных методик (например, растворимости, IDR, PXRD, ИК/рамановской спектроскопии, микроскопии поляризованного света и DSC).
Растворимость
Установленные растворимости (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты в различных растворителях представлены в таблице A. Эксперименты осуществляют с использованием полиморфа I при комнатной температуре. Растворимости можно разделить на три группы.
Группа I
Растворимость (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты в изопропиловом спирте, CH2Cl2, этилацетате, ацетонитриле, ацетоне, хлороформе, толуоле, гексане и воде, pH >6: растворимость является очень низкой (<<0,3 мг/мл).
Группа II
Растворимость в метаноле, этаноле, диоксане и ТГФ: растворимость является по-прежнему низкой (0,1-0,4 мг/мл), но выглядит значительно более высокой, чем растворимости в растворителях группы I.
Группа III
Растворимости (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ) и воде при pH ≤2: растворимость является относительно высокой (>1 мг/мл).
| Таблица A.Установленная растворимость полиморфа I (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты в различных растворителях при 23°C. | ||
| Растворитель | Растворимость (мг/мл) | |
| 1 | Вода (pH 2) | 3,11 |
| Вода (pH 6) | 0,005 | |
| 2 | ДМСО | 1,5-3,0 |
| 3 | ДМФ | >1,5 |
| 4 | Метанол | 0,21-0,31 |
| 5 | Этанол | 0,17-0,19 |
| 6 | Диоксан | 0,18-0,20 |
| 7 | ТГФ | 0,32-0,4 |
| 8 | Изопропанол | <0,14 |
| 9 | CH2Cl2 | <0,12 |
| 10 | Этилацетат | <<0,28 |
| 11 | Ацетонитрил | <<0,08 |
| 12 | Ацетон | <<0,16 |
| 13 | хлороформ | <0,11 |
| 14 | толуол | <<0,13 |
| 15 | Гексан | <<<0,13 |
| 16 | PEG 400 | 0,30-0,43 |
pKa (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты равен 8,50. Как ожидается, равновесная растворимость этого соединения является более высокой при более низком pH раствора (таблица A). Однако растворение частиц в среде для растворения зависит от pH в диффузионном слое. Значение pH диффузионного слоя в тесном контакте с твердым телом (pHh=0) может быть получено по равновесному pH раствора, измеренному с помощью pH-метра. Результаты представлены в таблице B. Когда начальное значение pH выше, чем 10, растворимость (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты является очень низкой. По этой причине pH раствора в равновесии почти не изменяется. С другой стороны, если начальный pH<10, в раствор уходит большее количество (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты, и pH равновесного раствора выше, чем начальный pH (таблица B). По этой причине данные указывают на то, что pHh=0 остается относительно высоким (>5), даже когда объем среды для растворения имеет pH, опускающийся до 1,4.
| Таблица B.Влияние (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты на значения pH равновесного раствора водной среды, без буфера, при температуре окружающей среды. | ||
| Начальный pH раствора | Количество (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты, добавленной к 2 мл воды без буфера (мг) | pH равновесного раствора |
| 1,43 | 322,5 | 5,36 |
| 2,19 | 333,2 | 5,20 |
| 3,22 | 280,7 | 6,98 |
| 5,47 | 209,7 | 8,13 |
| 6,73 | 142,0 | 8,31 |
| 7,24 | 141,5 | 8,49 |
| 7,61 | 95,4 | 8,87 |
| 10,07 | 95,1 | 9,86 |
| 11,53 | 96,2 | 11,61 |
| 12,50 | 88,0 | 12,52 |
| 13,20 | 98 | 13,18 |
Попытка измерения зависимости растворимости (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты от pH не была успешной. При растворении исходного лекарственного средства при pH<2,2 образуются очень мелкодисперсные частицы. Эти мелкодисперсные частицы уходят через 0,45 мкм мембрану фильтра и дают мутный фильтрат. Попыток использовать мембрану фильтра с более мелкими порами (0,1 мкм)не предпринималось, поскольку нет очевидного непосредственного использования таких данных.
IDR
Начальную скорость растворения (IDR) полиморфа II сравнивают со скоростью полиморфа I. Обнаружено, что DDR полиморфа II примерно в три раза превышает видимое значение IDR полиморфа I в буфере с pH 2, при 23°C (таблица C). Этот результат противоречит более раннему наблюдению, что полиморф II является менее стабильным и, согласно ожиданиям, должен иметь более низкую растворимость и по этой причине более низкую IDR, при той же температуре и в том же растворителе. Хотя и не желая связываться с теорией, одним из объяснений этого противоречия является то, что лекарственное средство подвергается твердофазному преобразованию в условиях эксперимента. Как следствие, IDR не может быть сравнено с термодинамическим соотношением исходных двух полиморфов. Микроскопическое наблюдение таблетки лекарственного средства из полиморфа I демонстрирует положительное доказательство для гипотезы о твердофазном преобразовании. Цвет таблетки на стороне, открытой для среды для растворения, является оранжево-красным по сравнению с желтым цветом исходной таблетки. Возможно, что полиморф I преобразуется в соль HCl сразу после того, как таблетка вступает в контакт со средой для растворения (буфер 0,05M KCl, pH 2). Благодаря воздействию общего иона растворимость и по этой причине IDR свежеприготовленной соли HCl являются гораздо более низкой, чем можно было ожидать для полиморфа II. После экспонирования таблетки полиморфа II в той же среде для растворения видимого изменения цвета не наблюдается.
Для дополнительного исследования гипотезы образования соли HCl как полиморф I, так и II, суспендируют в указанной выше среде для растворения. Однако никаких изменений цвета частиц не наблюдают, по меньшей мере, в течение 15 минут после приготовления суспензии. Этот результат согласуется с наблюдаемой стабильностью полиморфа II в твердом состоянии в ходе эксперимента по растворению, но не подтверждает быстрого преобразования таблетки полиморфа I в соль HCl. Через день после приготовления суспензии оранжево-красные иглообразные кристаллы, предположительно кристаллы соли HCl, появляются в обоих флаконах. Этот результат подтверждает, что растворимость соли HCl ниже, чем растворимости как полиморфа I, так и II в среде, используемой для исследований по растворению. Возможно также, что прессование перед экспериментом с IDR модифицирует кристаллы полиморфа I и делает их способными к быстрому преобразованию. Картины XRD таблеток полиморфа I, спрессованных при различных давлениях, демонстрируют некоторую степень содержание аморфной формы, которая может быть связана с быстрым образованием соли во время эксперимента по IDR.
Порошковый рентгеноструктурный анализ (PXRD)
Наблюдаются четко различаемые картины дифракции рентгеновского излучения на порошках (PXRD) двух загрузок (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты (Фиг.1). Такое наблюдение говорит о существовании полиморфизма этого лекарственного средства. По этой причине FTIR и Рамановская спектроскопия используются для подтверждения полиморфизма (2-пирролидин-1-илэтил)амида 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1H-пиррол-3-карбоновой кислоты.
ИК и рамановская спектроскопия
ИК и рамановские спектры представлены на фиг.2 и 3 соответственно. Спектральные различия четко наблюдаются для