Замещенные 3-цианотиофенацетамиды в качестве антагонистов рецептора глюкагона
Иллюстрации
Показать всеНастоящее изобретение относится к замещенным 3-цианотиофенацетамидам общей формулы I
в которой R1 и R2 независимо обозначают (низш.)алкил, или R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют 5-6-членный, незамещенный карбоциклический или 6-членный гетероциклический цикл, возможно имеющий заместители, независимо выбранные из группы, включающей (низш.)алкил, алкилсульфонил и алкоксикарбонил, R3 выбирают из группы, включающей (низш.)алкил, незамещенный арил, незамещенный аралкил и незамещенный циклоалкил, R4 - водород, n равно 0, или их фармацевтически приемлемым солям. Соединения могут найти применение для лечения и/или профилактики заболеваний, ассоциированных с антагонистическим действием на рецептор глюкагона, таких как диабет. Описаны также фармацевтическая композиция на основе соединений I и их применение. 4 н. и 18 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к новым замещенным 3-цианотиофенацетамидам, к их получению и применению в качестве лекарственных средств. Кроме того, настоящее изобретение относится к фармацевтически приемлемым солям указанных соединений 3-цианотиофена и фармацевтическим композициям, содержащим указанные соединения.
Рецептор глюкагона (GLUR) представляет собой рецептор (GPCR) семейства секретина, содержащий семь трансмембранных доменов и сопряженный с G-белком. При связывании с GLUR лиганда, природного гормона глюкагона, происходит активация аденилатциклазы и одновременное увеличение продуцирования цАМФ. Увеличение уровня цАМФ вызывает активацию гликогенфосфорилазы, что приводит к увеличению продуцирования глюкозы в печени. Регуляторное действие глюкагона противоположно действию инсулина и, как полагают, играет центральную роль в гомеостазе глюкозы. Глюкагон применяется в клинике для спасения больных диабетом от гипогликемии. Таким образом, предполагается, что низкомолекулярные антагонисты GLUR могут использоваться для лечения диабета.
Установлено, что новые производные 3-цианотиофенацетамидов являются антагонистами рецептора глюкагона, т.е. ингибируют стимулированное глюкагоном продуцирование цАМФ при анализе на стимулированных клетках. Следовательно, соединения по настоящему изобретению могут использоваться для лечения и/или профилактики диабета и/или нарушенной толерантности к глюкозе, а также других состояний, при которых лечебное действие достигается благодаря антагонистическому действию на рецептор глюкагона.
Первым объектом настоящего изобретения является соединение формулы (I)
где R1, R2, R3, R4 и n имеют значения, указанные ниже.
Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель и/или адъювант.
Еще одним объектом настоящего изобретения является способ лечения или профилактики заболеваний, которые ассоциируются с антагонистическим действием на рецептор глюкагона, включающий введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества соединения формулы (I).
Указанные выше и другие признаки, объекты и преимущества настоящего изобретения иллюстрируются на приведенных ниже схемах, в описании заявки и пунктах формулы изобретения.
Если не указано иное, термины, используемые в описании для иллюстрации и понимания сущности и объема изобретения, имеют следующие значения.
Термин "низш." означает группу, содержащую от одного до семи, предпочтительно от одного до четырех атомов углерода.
Термин «галоген» означает фтор, хлор, бром и иод, предпочтительно фтор и хлор.
Термин «алкил», используемый отдельно или в комбинации с другими группами, означает одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до двадцати, предпочтительно от одного до шестнадцати атомов углерода, более предпочтительно от одного до десяти атомов углерода.
Алкильные группы необязательно являются замещенными, например, галогеном, группой гидрокси, (низш.)алкокси, (низш.)алкоксикарбонил, NH2, N(H, (низш.)алкил) и/или N((низш.)алкил)2. Кроме того, используются заместители, указанные в описании заявки. Предпочтительны незамещенные алкильные группы.
Термин «(низш.)алкил», используемый отдельно или в комбинации с другими группами, означает одновалентный алкильный радикал с прямой или разветвленной цепью, содержащий от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Примерами такого радикала являются метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п. Группа (низш.)алкил необязательно замещена аналогично тому, как описано выше, при описании термина "алкил". Предпочтительны незамещенные (низш.)алкильные группы.
Термин "алкокси" означает группу R'-O-, где R' означает алкил. Термин "(низш.)алкокси" означает группу R'-O-, где R' означает (низш.)алкил. Примеры (низш.)алкоксигрупп включают, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и гексилокси. Алкокси- и (низш.)алкоксигруппы необязательно замещены аналогично тому, как описано выше, при описании термина "алкил". Предпочтительны незамещенные алкокси- и (низш.)алкоксигруппы.
Термин "циклоалкил" означает одновалентный карбоциклический радикал, содержащий от 3 до 10 атомов углерода, предпочтительно от 3 до 6 атомов углерода, такой как циклопропил, циклобутил, циклопентенил или циклогексил. Циклоалкильные группы необязательно замещены, например, группой (низш.)алкил, (низш.)алкокси, галоген, циано, трифторметил, гидрокси, нитро, амино, алкиламино, диалкиламино, карбокси, аминокарбонил, фенил, бензил, фенокси и бензилокси. Предпочтительны незамещенные циклоалкильные группы.
Термин "арил" означает группу фенил или нафтил, предпочтительно группу фенил, которая моно- или полизамещена группой (низш.)алкил, (низш.)алкокси, галоген, CN, CF3, гидрокси, NO2, NH2, N(H, (низш.)алкил), N((низш.)алкил)2, карбокси, аминокарбонил, фенил, бензил, фенокси и/или бензилокси. Предпочтительными заместителями являются (низш.)алкил, (низш.)алкокси, галоген, CN и/или CF3. Кроме того, используются заместители, указанные в описании заявки.
Термин "аралкил" означает группу арил(низш.)алкил.
Термин "гетероциклил" означает 4-8-членный цикл, содержащий 1, 2 или 3 атома, выбранных из ряда азот, кислород и/или сера, такой как тетрагидропиридин, дигидрофуран, дигидропиран, фурил, пирролил, пиридил, 1,2-, 1,3- и 1,4-диазинил, тиенил, оксазолил, оксадиазолил, изоксазолил, тиазолил, изотиазолил или имидазолил. Группа гетероциклил необязательно замещена группой арил или группами, указанными выше при описании термина "арил". Гетероциклил может включать двойную связь.
Термин "фармацевтически приемлемые соли" включает соли соединений формулы (I) и неорганических или органических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п., которые нетоксичны для живых организмов. Предпочтительными солями являются формиаты, малеаты, цитраты, гидрохлориды, гидробромиды и метансульфонаты.
Термин "уходящая группа" означает группу, которая удаляется или замещается в условиях проводимой реакции. Примерами уходящих групп являются галоген, мезилат и тозилат.
Более подробно, настоящее изобретение относится к соединениям формулы (I)
где
R1 и R2 независимо выбирают из группы, включающей (низш.)алкил, (низш.)алкокси, аминоалкил, арил, аралкил, замещенный (низш.)алкил, замещенный (низш.)алкокси, замещенный (низш.)аминоалкил, замещенный арил и замещенный аралкил, где заместитель выбирают из группы, включающей один или более галогенов, гидрокси, (низш.)алкокси, амино, алкиламино, диалкиламино, циано и нитро, или
R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют 4-8-членный, замещенный или незамещенный карбоциклический или гетероциклический цикл, где любые заместители независимо выбирают из группы, включающей галоген, гидрокси, (низш.)алкил, арил, аралкил, амино, алкиламино, диалкиламино, алкилсульфонил и алкоксикарбонил,
R3 выбирают из группы, включающей (низш.)алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил и замещенный или незамещенный циклоалкил, где любые заместители выбирают из группы, включающей (низш.)алкил, (низш.)алкокси, галоген, циано, трифторметил, гидрокси, нитро, амино, алкиламино, диалкиламино, карбокси, аминокарбонил, фенил, бензил, фенокси и бензилокси,
R4 выбирают из группы, включающей (низш.)алкил, (низш.)алкокси, галоген, циано, трифторметил, гидрокси, нитро, амино, алкиламино, диалкиламино, алкилсульфонил и алкоксикарбонил, а
n равно 0, 1, 2, 3, 4 или 5,
и к их фармацевтически приемлемым солям 0.
Соединения формулы (I), указанные выше, представляют собой предпочтительный вариант осуществления настоящего изобретения, и фармацевтически приемлемые соли соединений формулы (I) в отдельности также представляют собой предпочтительный вариант осуществления настоящего изобретения. Более предпочтительны соединения, указанные выше, а не их соли.
Предпочтительный вариант осуществления настоящего изобретения относится к соединениям, указанным выше, где R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют 4-8-членный, замещенный или незамещенный карбоциклический или гетероциклический цикл, где любые заместители независимо выбирают из группы, включающей галоген, гидрокси, (низш.)алкил, амино, алкиламино, диалкиламино, алкилсульфонил и алкоксикарбонил.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям, указанным выше, где R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют карбоциклический цикл. Предпочтительно R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют циклопентенил или циклогексенил.
Кроме того, настоящее изобретение относится к соединениям, указанным выше, где R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют замещенный или незамещенный гетероциклический цикл. Предпочтительно R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют шестичленный замещенный или незамещенный гетероциклический цикл, содержащий по меньшей мере один гетероатом. Более предпочтительно R1 и R2 вместе с атомами углерода, к которым они присоединены, включая связь между этими атомами углерода, образуют шестичленный замещенный или незамещенный гетероциклический цикл, содержащий один гетероатом. Предпочтительно указанным гетероатомом является атом азота. Предпочтительны также соединения, в которых указанный гетероатом означает атом кислорода. Предпочтительны также соединения, в которых указанный гетероатом означает атом азота или атом кислорода.
Предпочтительны такие вышеуказанные соединения, в которых гетероциклический цикл замещен заместителем, выбранным из группы, включающей (низш.)алкил, алкилсульфонил, алкоксикарбонил, арил и аралкил. Предпочтительны прежде всего соединения, указанные выше, в которых заместитель присоединен к атому азота. Кроме того, предпочтительны прежде всего соединения, указанные выше, в которых заместитель присоединен к атому азота, причем заместитель означает (низш.)алкил, алкоксикарбонил или алкилсульфонил.
Другими предпочтительными соединениями, указанными выше, являются соединения, в которых R1 и R2 независимо выбирают из группы, включающей (низш.)алкил, (низш.)алкокси, аминоалкил, арил, аралкил, замещенный (низш.)алкил, (низш.)алкокси, замещенный амино(низш.)алкил, замещенный арил и замещенный аралкил. Предпочтительно R1 и R2 независимо означают (низш.)алкил, более предпочтительно метил или этил.
Еще один предпочтительный вариант осуществления настоящего изобретения относится к соединениям, указанным выше, где R3 означает замещенный или незамещенный циклоалкил. Предпочтителен незамещенный циклоалкил. Предпочтительно R3 означает циклопентил.
Другими предпочтительными соединениями, указанными выше, являются соединения, в которых R3 означает замещенный или незамещенный арил. Предпочтителен незамещенный арил, прежде всего фенил. Кроме того, предпочтительны соединения, в которых R3 означает замещенный или незамещенный арил или аралкил. Предпочтителен незамещенный арил или аралкил, прежде всего фенил или бензил.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I), указанным выше, где R3 означает (низш.)алкил. Кроме того, прежде всего предпочтительны соединения, указанные выше, где R3 выбирают из группы, включающей метил, этил, пропил, изопропил и втор-бутил.
В другом предпочтительном варианте осуществления настоящего изобретения n равно 0.
Предпочтительны соединения общей формулы (I), указанные выше, которые выбирают из группы, включающей
N-(3-циано-4,5-диметилтиофен-2-ил)-2,2-дифенилацетамид,
N-(3-циано-4,5-диметилтиофен-2-ил)-2,3-дифенилпропионамид,
N-(3-циано-4-метил-5-этилтиофен-2-ил)-2,3-дифенилпропионамид,
N-(3-циано-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-2,2-дифенилацетамид,
трет-бутиловый эфир 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(2-фенилпропиониламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(3-метил-2-фенилбутириламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(3-метил-2-фенилпентаноиламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
N-(3-циано-6-метансульфонил-4,5,6,7-тетрагидротиено[2,3-с]пиридин-2-ил)-2,2-дифенилацетамид,
N-(3-циано-6-метил-4,5,6,7-тетрагидротиено[2,3-с]пиридин-2-ил)-2,2-дифенилацетамид,
метиловый эфир 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
N-(3-циано-4,7-дигидро-5H-тиено[2,3-c]пиран-2-ил)-2-фенилбутирамид,
(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)амид 3-метил-2-фенилпентановой кислоты,
3-метил-2-(2-фенилпропиониламино)(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)амид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2,2-дифенилацетамид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2-циклопентил-2-фенилацетамид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2,3-дифенилацетамид и
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2-фенилпропионамид и их фармацевтически приемлемые соли.
Другими предпочтительными соединениями общей формулы (I), указанными выше, являются соединения, выбранные из группы, включающей
N-(3-циано-4,5-диметилтиофен-2-ил)-2,2-дифенилацетамид,
N(3-циано-4,5-диметилтиофен-2-ил)2,2-дифенилпропионамид и
N-(3-циано-4-метил-5-этилтиофен-2-ил)-2,3-дифенилпропионамид и их фармацевтически приемлемые соли.
Другими предпочтительными соединениями общей формулы (I), указанными выше, являются соединения, выбранные из группы включающей
N-(3-циано-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-2,2-дифенилацетамид,
трет-бутиловый эфир 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(2-фенилпропиониламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(3-метил-2-фенилбутириламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
трет-бутиловый эфир 3-циано-2-(3-метил-2-фенилпентаноиламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты,
N-(3-циано-6-метансульфонил-4,5,6,7-тетрагидротиено[2,3-с]пиридин-2-ил)-2,2-дифенилацетамид,
N-(3-циано-6-метил-4,5,6,7-тетрагидротиено[2,3-с]пиридин-2-ил)-2,2-дифенилацетамид,
метиловый эфир 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты и
N-(3-циано-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-2-фенилбутирамид и их фармацевтически приемлемые соли.
Другими предпочтительными соединениями общей формулы (I), указанными выше, являются соединения, выбранные из группы, включающей
(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)амид 3-метил-2-фенилпентановой кислоты,
3-метил-2-(2-фенилпропиониламино)-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)амид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2,2-дифенилацетамид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2-циклопентил-2-фенилацетамид,
N-(3-циано-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)-2,2-дифенилацетамид и
N-(3-циано-5,6-дигидро-4H-циклопента[b]тиофен-2-ил)-2-фенилпропионамид и их фармацевтически приемлемые соли.
Соединения формулы (I) могут содержать один или более асимметрических атомов углерода и могут существовать в форме оптически чистых энантиомеров или рацематов. Изобретение включает все указанные формы.
Подразумевается, что соединения общей формулы (I) по настоящему изобретению можно получить в виде производных по функциональным группам с образованием соединений, которые могут снова превращаться в исходное соединение in vivo.
В еще одном варианте настоящее изобретение относится к способу получения соединений общей формулы (I), указанных выше, который включает взаимодействие соединения формулы (II)
с соединением формулы (III)
где R1, R2, R3, R4 и n имеют значения, указанные выше.
Взаимодействие соединений формулы (II) с соединениями формулы (III) можно проводить, например, по известным методикам.
Кроме того, изобретение относится к соединениям формулы (I), указанным выше, полученным по способу, указанному выше.
Как указано выше, соединения формулы (I) по настоящему изобретению можно использовать в качестве лекарственных средств для лечения и/или профилактики заболеваний благодаря антагонистическому действию на рецептор глюкагона. Предпочтительно соединения по настоящему изобретению можно использовать для лечения диабета.
Следовательно, изобретение также относится к фармацевтическим композициям, включающим соединение, указанное выше, и фармацевтически приемлемый носитель и/или адъювант.
Кроме того, настоящее изобретение относится к соединениям, указанным выше, для применения в качестве терапевтически активных веществ, прежде всего для применения в качестве терапевтически активных веществ при лечении и/или профилактике заболеваний, ассоциированных с рецептором глюкагона, предпочтительно при лечении и/или профилактике диабета.
В другом варианте настоящее изобретение относится к способу лечения и/или профилактики заболеваний, ассоциированных с рецептором глюкагона, предпочтительно к способу лечения и/или профилактики диабета, включающему введение человеку или животному вышеуказанного соединения общей формулы (I).
Кроме того, изобретение относится к применению вышеуказанных соединений для лечения и/или профилактики заболеваний, ассоциированных с рецептором глюкагона, предпочтительно к способу лечения и/или профилактики диабета.
Кроме того, изобретение относится к применению вышеуказанных соединений для получения лекарственных средств, предназначенных для лечения и/или профилактики заболеваний, ассоциированных с рецептором глюкагона, предпочтительно для лечения и/или профилактики диабета. Такие лекарственные средства включают соединение, указанное выше.
Соединения формулы (I) можно получать способами, указанными ниже, методами, приведенными в примерах, или аналогичными методами. Соответствующие условия проведения указанных реакций известны специалисту в данной области. Исходные материалы являются коммерческими препаратами или их можно получить аналогично тому, как указано ниже или описано в примерах, или известными методами.
Активность соединений формулы I определяют следующими методами.
В общем случае антагонисты глюкагона можно идентифицировать по их способности ингибировать или снижать стимуляцию продуцирования цАМФ по сравнению с продуцированием цАМФ в присутствии только нативного глюкагона, как описано при определении активности аденилатциклазы. Определение активности аденилатциклазы описано, например, в статье Lin и др., Biochemistry, 14, 1559-1563 (1975), включенной в описание заявки в качестве ссылки. Биологические ответные реакции по инозиттрифосфатному пути можно оценить при определении метаболизма инозитфосфата, как в общем виде описано в статье Subers и Nathanson, J. Mol. Cell. Cardiol., 20, 131-140 (1988), включенной в описание заявки в качестве ссылки, или в статье Pittner и Fain (там же), включенной в описание заявки в качестве ссылки, или измеряя внутриклеточную концентрацию кальция, как в общем виде описано в статье Grynkiewicz и др., J. Biol. Chem., 260, 3440-3450 (1985), включенной в описание заявки в качестве ссылки.
В предпочтительном варианте антагонисты глюкагона, включая 3-цианотиофенацетамиды по настоящему изобретению, можно идентифицировать по их способности специфично ингибировать аденилатциклазную ответную реакцию, индуцированную глюкагоном. Установлено, что глюкагоновые рецепторы присутствуют во многих тканях, например в печени, почках, сердечной мышце и жировой ткани многих видов, включая собаку, свинью, человека и крысу. Кроме того, можно также использовать клетки хозяина, экспрессирующие рекомбинантные рецепторы глюкагона. Определение активности аденилатциклазы можно проводить, например, методом, описанным в статье Lin и др., Biochemistry, 14, 1559-1563 (1975). Эти методы позволяют измерить уровень стимуляции продуцирования цАМФ по сравнению с действием нативного глюкагона и обычно включают инкубацию мембранного препарата из ткани, содержащего рецептор глюкагона, в присутствии смеси глюкагона, антагониста глюкагона и АТФ. При определении аденилатциклазной активности обычно используются препараты из печени крысы, хотя можно использовать и другие ткани, содержащие рецептор глюкагона, или клетки хозяина, экспрессирующие рекомбинантный рецептор глюкагона. Мембраны получают по методу, описанному в статье Neville, Biochim. Biophys. Acta, 154, 540-552 (1968), в модификации Pohl, Methods in Receptor Research, Ed. Blecher, M., New York, c.160-164 (1976).
Определение цАМФ в клетках CHO/GluR12B
Описанные в заявке антагонисты глюкагона характеризовали с использованием клеток СНО-К1, экспрессирующих полноразмерный рецептор глюкагона человека (CHO/GluR 12В). Клетки высеивали в 384-луночный планшет с плотностью 10000 клеток в лунку в среде, содержащей DMEM (фирма Gibco, №21063-029), 10% диализованную ЭТС (фирма Gibco, №26400-044), 1% L-глутамин (фирма Gibco, №25030-081) и 1% пенициллин/стрептомицин (фирма Gibco, №15140-122). Клетки выдерживали при 37°С в течение ночи для прилипания к планшету, среду удаляли и клетки предварительно инкубировали в течение 1 ч с антагонистом, растворенным в ДМСО, разбавленным средой DMEM, содержащей 0,5 мМ IBMX (фирма Calbiochem, №#410957), 1 мг/мл БСА (фирма Sigma, № А-8806), 25 мМ HEPES. Затем в течение 30 мин при 37°С добавляли глюкагон (0,1 нМ), растворенный в той же среде. Образование цАМФ измеряли в клеточных лизатах с использованием методики и реагентов сАМР-Screen™ фирмы Applied Biosystems. Величину IC50 антагониста рецептора глюкагона рассчитывали по графику зависимости ответной реакции от дозы антагониста в процентах от максимума уровня цАМФ, продуцированного 0,1 нМ глюкагоном, причем для расчетов использовали программу Microsoft XLFit, уравнение №205 (сигмоидальная кривая ответная реакция от дозы/переменная крутизна). Для достижения насыщения при высоких и низких концентрациях использовали соответствующие концентрации антагониста и среднюю точку на кривой экстраполировали в виде значения IC50.
Величины IC50 по ингибированию продуцирования цАМФ, стимулированного глюкагоном, измеренные при вышеуказанном анализе с использованием клеток, для каждого из соединений, описанных ниже в примерах, составляют ≤10,0 мкМ.
Ниже в таблице представлены значения IC50 по ингибированию продуцирования цАМФ, стимулированного глюкагоном (анализ с использованием клеток), для некоторых соединений по настоящему изобретению.
| Пример | IC50 (мкМ) | Пример | IC50 (мкМ) |
| 3 | 0,7 | 11 | 2,5 |
| 4 | 1,5 | 13 | 2,5 |
| 5 | 2,3 | 14 | 1,0 |
| 8 | 1,0 | 17 | 5,0 |
Соединения формулы I и/или их фармацевтически приемлемые соли можно использовать в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Препараты можно вводить пероральным способом, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректальным способом, например в форме суппозиториев, парентеральным способом, например в форме инъекционных растворов или растворов для вливания, или местным способом, например в форме мазей, кремов или масел. Предпочтителен пероральный способ введения.
Фармацевтические препараты можно получать способом, известным специалисту в данной области, обычной переработкой описанных соединений формулы I и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными соединениями, в готовую галеновую форму вместе с пригодными, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и при необходимости с обычными фармацевтическими адъювантами.
Пригодные носители включают неорганические и органические материалы. Таким образом, например, при получении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул в качестве таких носителей используются лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые или жидкие полиолы. В зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никаких носителей. Пригодными носителями для растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар и т.п. Пригодными носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Пригодными носителями для местных препаратов являются глицериды, полусинтетические и синтетические глицериды, гидрогенированные масла, жидкие воски, вазелиновое масло, жидкие высшие спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
В качестве фармацевтических адъювантов могут использоваться стабилизирующие агенты, консерванты, смачивающие и эмульгирующие агенты, кондиционеры, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, солюбилизирующие агенты, красители, маскирующие агенты и антиоксиданты.
Доза соединений формулы I может изменяться в широком диапазоне в зависимости от типа заболевания, подлежащего лечению, возраста и индивидуального состояния пациента и способа введения и должна соответствовать индивидуальным требованиям в каждом конкретном случае. Для взрослых пациентов суточная доза составляет приблизительно от 1 до 1000 мг, прежде всего приблизительно от 1 до 100 мг. В зависимости от тяжести заболевания и конкретного фармакокинетического профиля соединения можно вводить одну или несколько суточных стандартных доз, например 1-3 суточных дозы.
Обычно фармацевтические препараты содержат приблизительно 1-500 мг, предпочтительно 1-100 мг соединения формулы I.
Изобретения иллюстрируется следующими примерами, не ограничивающими его объем.
Общие методы
Соединения формулы (I) можно получать нижеописанными способами, способами, приведенными в примерах или аналогичными методами.
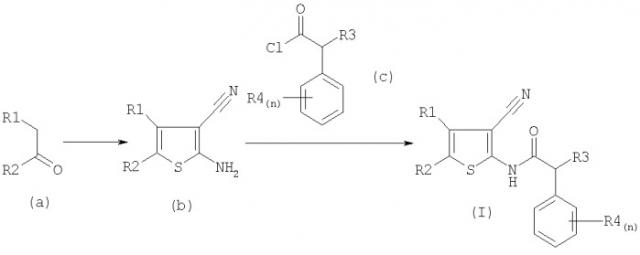
Ниже на схеме 1 показан синтез соединений формулы (I). Тиофен (b) можно получить при взаимодействии кетона (а) с малононитрилом и серой в спиртовом растворителе в присутствии вторичного амина. Затем при взаимодействии тиофена (b) с ацетилхлоридом (с) можно получить соединение формулы (I).
Схема 1
Производные соединений формулы (I) представляют собой дополнительные соединения, включенные в объем настоящего изобретения. На схеме 2 ниже показан пример различных соединений, полученных из трет-ВОС-тетрагидротиенопиридина (d). При удалении трет-ВОС-группы получают амин (е). Амин (е) можно модифицировать известными способами. Например, из амина (е) можно получить алкиламин (f), карбамат (g) или сульфонат (h).
Схема 2
Примеры
Пример 1
N-(3-Циано-4,5-диметилтиофен-2-ил)-2,2-дифенилацетамид
Стадия 1
Получение 2-амино-3-циано-4.5-диметилтиофена
К смеси метилэтилкетона (4,5 мл, 50,0 ммолей), малононитрила (3,34 г, 50,0 ммолей) и серы (1,60 г, 50,0 ммолей) в абсолютном этаноле (20 мл) при перемешивании в атмосфере азота при 0°С добавляли по каплям диэтиламин (5,00 мл), смесь нагревали до 45-50°С и перемешивали в течение 4 ч. Затем смесь охлаждали до комнатной температуры, фильтровали для удаления нерастворимого материала и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле 60 (фирма Мерк, 230-400 меш, элюент: 20% этилацетат/гексан), при этом получали 2,35 г (31%) 2-амино-3-циано-4,5-диметилтиофена в виде пены светло-коричневого цвета.
Стадия 2
Получение N-(3-циано-4,5-диметилтиофен-2-ил)-2,2-дифенилацетамида
К раствору 2-амино-3-циано-4,5-диметилтиофена (152 мг, 1,0 ммоль) и дифенилацетилхлорида (300 мг, 1,3 ммоля) в сухом хлористом метилене (10 мл) при перемешивании в атмосфере азота при комнатной температуре добавляли по каплям триэтиламин (0,42 мл, 3,0 ммоля). Через 1,5 ч смесь промывали 1н. HCl, органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт растирали в охлажденном 30% этилацетате/гексане и фильтровали, при этом получали 162 мг (47%) N-(3-циано-4,5-диметилтиофен-2-ил)-2,2-дифенилацетамида в виде твердого вещества белого цвета. МСВР (ES): m/e рассч. для C21H18N2OS 347,1213 (М+H+), найд. 347,1217.
Пример 2
N-(3-Циано-4,5-диметилтиофен-2-ил)-2,3-дифенилпропионамид
К раствору 2-амино-3-циано-4,5-диметилтиофена (полученного, как описано в примере 1, стадия 1, 24 мг, 0,148 ммоля) и 2,3-дифенилпропионовой кислоты (72 мг, 0,32 ммоля) добавляли EDCI (61 мг, 0,32 ммоля) и смесь перемешивали в течение 19 ч. Затем реакционную смесь разделяли на колонке с силикагелем 60 (фирма Мерк, 230-400 меш, элюент: градиент этилацетат/гексан от 10% до 33%), при этом получали N-(3-циано-4,5-диметилтиофен-2-ил)-2,3-дифенилпропионамид в виде твердого вещества белого цвета (17,0 мг, 39%). МСВР (ES): m/e рассч. для C22H20N2OS 361,1369 (М+Н+), найд. 361,1374.
Пример 3
N-(3-Циано-4-метил-5-этилтиофен-2-ил)-2,3-дифенилпропионамид
Указанное соединение получали аналогично тому, как описано в примере 1, при замене метилэтилкетона на метилпропилкетон.
Пример 4
N-(3-Циано-4,7-дигидро-5Н-тиено[2,3-c]пиран-2-ил)-2,2-дифенилацетамид
Стадия 1
Получение 2-амино-3-циано-4,7-дигидро-5Н-тиено[2,3-с]пирана
К смеси дигидро-4Н-пиран-4-она (5,00 г, 50,0 ммолей), малононитрила (3,34 г, 50,0 ммолей) и серы (1,60 г, 50,0 ммолей) в абсолютном этаноле (20 мл) при перемешивании в атмосфере азота при 0°С добавляли по каплям диэтиламин (5,00 мл), смесь нагревали до 45-50°С и перемешивали в течение 4,5 ч. Затем смесь охлаждали до комнатной температуры, твердое вещество отделяли фильтрованием и несколько раз промывали холодным этанолом, при этом получали 6,09 г (68%) 2-амино-3-циано-4,7-дигидро-5Н-тиено[2,3-с]пирана в виде твердого вещества рыжевато-коричневого цвета.
Стадия 2
Получение N-(3-циано-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-2,2-дифенилацетамида
К раствору 2-амино-3-циано-4,7-дигидро-5Н-тиено[2,3-с]пирана (400 мг, 2,22 ммоля) и триэтиламина (0,93 мл, 6,66 ммоля) в сухом хлористом метилене (10 мл) при перемешивании в атмосфере азота при комнатной температуре добавляли дифенилацетилхлорид (768 мг, 3,33 ммоля). Через 72 ч смесь разбавляли хлористым метиленом и промывали 1н. HCl. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт растирали в охлажденном диэтиловом эфире и фильтровали, при этом получали 310 мг (37%) N-(3-циано-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-2,2-дифенилацетамида в виде твердого вещества белого цвета. МСВР (ES): m/e рассч. для С22Н18N2O2S 375,1162 (М+Н+), найд. 375,1165.
Пример 5
трет-Бутиловый эфир 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
Стадия 1
Получение трет-бутилового эфира 2-амино-3-циано-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
К смеси трет-бутилового эфира 4-оксо-1-пиперидинкарбоновой кислоты (15,96 г, 80,0 ммолей), малононитрила (5,28 г, 80,0 ммолей) и серы (2,56 г, 80,0 ммолей) в абсолютном этаноле (40 мл) при перемешивании в атмосфере азота при 0°С добавляли по каплям диэтиламин (8,00 мл), смесь нагревали до комнатной температуры в течение 1 ч, а затем нагревали при 45-50°С в течение 1 ч. Смесь охлаждали до комнатной температуры и добавляли 10 мл этанола. Полученную суспензию охлаждали до 0°С, продукт отделяли фильтрованием и трижды промывали 10 мл холодного этанола, при этом получали 15,75 г (71%) трет-бутилового эфира 2-амино-3-циано-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты в виде твердого вещества светло-оранжевого цвета.
Стадия 2
Получение трет-бутилового эфира 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
К раствору трет-бутилового эфира 2-амино-3-циано-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты (8,00 г, 28,7 ммоля) и триэтиламина (10,01 мл, 71,8 ммоля) в сухом хлористом метилене (50 мл) при перемешивании в атмосфере азота при комнатной температуре добавляли дифенилацетилхлорид (9,92 г, 43,0 ммоля). Через 18 ч смесь разбавляли хлористым метиленом и промывали 1н. HCl. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией (элюент: 35% этилацетат/гексан), при этом получали 13,60 г (100%) трет-бутилового эфира 3-циано-2-дифенилацетиламино-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты в виде пены. МСВР (ES): m/e рассч. для С27H27N3O3S 474,1846 (М+Н+), найд. 474,1849.
Пример 6
трет-Бутиловый эфир 3-циано-2-(2-фенилпропиониламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
Стадия 1
Получение 2-фенилпропионилхлорида
К раствору 2-фенилпропионовой кислоты (0,36 мл, 2,6 ммоля) и каталитического количества сухого диметилформамида (приблизительно 10 мкл) в 3,0 мл сухого хлористого метилена при перемешивании в атмосфере азота при комнатной температуре добавляли по каплям оксалилхлорид (0,34 мл, 3,9 ммоля). Через 30 мин смесь концентрировали в вакууме и немедленно использовали на стадии 2.
Стадия 2
Получение трет-бутилового эфира 3-циано-2-(2-фенилпропиониламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
К раствору трет-бутилового эфира 2-амино-3-циано-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты (418 мг, 1,5 ммоля, полученного, как описано в примере 5, стадия 1) и карбоната калия (1106 мг, 8,0 ммоля) в 10 мл сухого диэтилового эфира при перемешивании в атмосфере азота при комнатной температуре добавляли раствор 2-фенилпропионилхлорида (полученного, как описано в примере 6, стадия 1) в 3,0 мл сухого хлористого метилена, смесь перемешивали в течение 22 ч и концентрировали в вакууме. Остаток переносили в хлористый метилен и промывали 10% раствором карбоната калия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали 813 мг продукта. Продукт растирали в холодном безводном диэтиловом эфире, при этом получали 353 мг (54%) трет-бутилового эфира 3-циано-2-(2-фенилпропиониламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты в виде твердого вещества грязно-белого цвета. МСВР (ES): m/e рассч. для C22H35N3O3SNa 434,1509 (M+Na+), найд. 434,1509.
Пример 7
трет-Бутиловый эфир 3-циано-2-(3-метил-2-фенилбутириламино)-4,5,6,7-тетрагидро-5Н-тиено[2,3-с]пиридин-6-карбоновой кислоты
Стадия 1
Получение 3-метил-2-фенилбутирилхлорида
К раствору 3-метил-2-фенилмасляной кислоты (891 мг, 5,0 ммолей) и каталитического количества сухого диметилформамида (приблизительно 10 мкл) в 10 мл сухого хлористого метилена при перемешивании в атмосфере азота при комнатной температуре добавляли по каплям оксалилхлорид (0,65 мл, 7,5