Композиция с пролонгированным высвобождением для перорального введения ингибитора hmg-coa редуктазы и способ для ее получения
Иллюстрации
Показать всеГруппа изобретений относится к композиции пролонгированного высвобождения для перорального введения ингибитора HMG-CoA редуктазы. Предложена композиция, которая содержит твердый диспергирующий агент, включающий ингибитор HMG-CoA редуктазы, растворяющий агент и стабилизирующий агент; составной носитель пролонгированного высвобождения; и ускоритель гидратации геля, где составной носитель пролонгированного высвобождения является смесью альгината натрия и ксантановой камеди, а ускорителем гидратации геля является смесь альгината сложного эфира пропиленгликоля и гидроксипропилметилцеллюлозы. Предложен способ получения указанной композиции, включающий стадии: смешивания ингибитора HMG-CoA редуктазы, растворяющего агента и стабилизирующего агента в растворителе с получением твердого диспергирующего агента; однородного перемешивания составного носителя пролонгированного высвобождения и ускорителя гидратации геля с твердым диспергирующим агентом с получением первой смеси; добавления фармацевтически приемлемых добавок к первой смеси с получением второй смеси; и сухого смешивания и составления второй смеси в твердую композицию. Композиция по настоящему изобретению может быть легко и экономично получена и способна поддерживать постоянный уровень лекарственного средства в крови посредством медленного высвобождения ингибитора HMG-CoA редуктазы с однородной скоростью в течение 24 часов. Соответственно композиция пролонгированного высвобождения по настоящему изобретению может быть эффективно использована для снижения уровня холестерина и триглицеридов в крови. 2 н. и 13 з.п. ф-лы, 6 табл., 6 ил.
Реферат
Область изобретения
Настоящее изобретение относится к композиции пролонгированного высвобождения для перорального введения ингибитора 3-гидрокси-3-метилглютарилкоэнзим А (HMG-CoA) редуктазы, которая включает твердое диспергирующее вещество, составной носитель пролонгированного высвобождения и ускоритель гидратации геля, где твердое диспергирующее вещество включает ингибитор HMG-CoA редуктазы, растворяющий агент и стабилизирующий агент; и способ для ее получения.
Предшествующий уровень техники изобретения
Гиперлипидемия или повышенный уровень липидов в крови является главной причиной сердечно-сосудистых заболеваний и атеросклероза. Характерными примерами гиперлипидемии является гиперхолестеринемия, семейная дисбеталипопротеинемия, диабетическая дислипидемия, нефротическая дислипидемия и семейная смешанная гиперлипидемия.
Были разработаны несколько типов агентов для снижения уровня липидов в крови для лечения гиперлипидемии или гиперхолестеринемии. Обычно такие агенты снижают синтез липопротеинов или липидов в сыворотке, или облегчают удаление липопротеинов или липидов из сыворотки или плазмы. Среди таких агентов ингибиторы HMG-CoA редуктазы, фермента, ограничивающего скорость пути биосинтеза холестерина, были разработаны для снижения концентрации липопротеинов или липидов в сыворотке. Примерными ингибиторами HMG-CoA редуктазы являются: мевастатин (патент США № 3983140), ловастатин, также называемый мевинолином (патент США № 4231938), лактон правастатина (патент США № 4448979), велостатин и симвастатин, также называемый как синвинолин (патенты США №№ 4448784 и 4450171), ривастатин, аторвастатин и церивастатин.
Ингибиторы HMG-CoA редуктазы широко используют для лечения гиперлипидемии в течение нескольких десятилетий для снижения общей концентрации холестерина и холестерина ЛПНП in vivo (Grundi S.M., et al., N. Engl. J. Med. 319(1): 24-32, 25-26 и 31, 1998). Синтез мевалоната под действием HMG-CoA является ранней стадией в пути биосинтеза холестерина, и ингибитор HMG-CoA редуктазы снижает общую концентрацию холестерина и холестерина ЛПНП в сыворотке путем ингибирования синтеза мевалоната (Grundi S.M., et al., N. Engl. J. Med. 319(1): 24-32, 25-26 и 31, 1998).
Однако большинство таких ингибиторов HMG-CoA редуктазы вводят в форме композиций быстрого высвобождения, которые вызывают побочные эффекты, такие как гепатотоксичность, мышечные расстройства и рабдомиолиз (Garnet W.R., et al., Am. J. Cardiol. 78: 20-25, 1996; The lovastatin pravastatin study group, Am. J. Cardiol. 71: 810-815, 1993; Duzovne, C.A. et al., Am. J. Med. 91: 25S-30S, 1991; и Mantel G.M. et al., Am. J. Cardiol. 66: 11B-15B, 1990).
Соответственно существует необходимость в разработке композиции с пролонгированным высвобождением ингибитора HMG-CoA редуктазы для предотвращения или облегчения побочных эффектов, индуцированных быстрым высвобождением ингибитора HMG-CoA редуктазы.
Многочисленные исследования композиции с пролонгированным высвобождением ингибитора HMG-CoA редуктазы предположили, что большинство ингибиторов HMG-CoA редуктазы, абсорбирующихся в организме, метаболизируются в печени (85% и более), тогда как только 5% или менее составляют переносимые в систему общей циркуляции. Следовательно, биодоступность ингибитора HMG-CoA редуктазы в систему системной циркуляции является низкой. Также, так как ингибитор HMG-CoA редуктазы проявляет свою ферментативную активность преимущественно в печени, важно понимать фармакокинетику в печени, а также его биодоступность. Композиция с быстрым высвобождением ингибитора HMG-CoA редуктазы проявляет дозо-зависимую нелинейную фармакокинетику, но не может поддерживать его терапевтический эффект в течение длительного времени из-за продолжительного клиренса периода полужизни, вызванного феноменом насыщения (ограниченной емкости), присутствующим во время метаболизма в печени. Однако при введении композиции с пролонгированным высвобождением ингибитора HMG-CoA редуктазы, хотя концентрация в крови ингибитора HMG-CoA редуктазы может быть более низкой, чем таковая композиции быстрого высвобождения из-за метаболизма в печени, нет развития насыщения из-за низкой концентрации в крови. В соответствии с последними исследованиями сообщается, что композиция пролонгированного высвобождения ингибитора HMG-CoA редуктазы проявляет равную или немного меньшую биодоступность, чем композиция быстрого высвобождения и при кислом и при лактоновом типе. Однако показано, что ее эффективность в доставке лекарственного средства к месту мишени является большей, чем таковая композиции быстрого высвобождения (John R., Amer. J. Cardio. 89: 15, 2002). Соответственно композиция с пролонгированным высвобождением способна более эффективно снижать уровень холестерина ЛПНП в крови, чем композиция с быстрым высвобождением (Monique P., Am. J. Drug. Deliv. 1(4): 287-290, 2003).
Авторы настоящего изобретения, следовательно, постарались решить ранее описанные проблемы композиции с быстрым высвобождением ингибитора HMG-CoA редуктазы и разработать новую композицию с пролонгированным высвобождением ингибитора HMG-CoA редуктазы, имеющую улучшенную биодоступность с минимальными побочными эффектами посредством поддержания количества ингибитора HMG-CoA редуктазы на постоянном уровне в крови посредством медленного и однородного механизма его высвобождения.
Сущность изобретения
Соответственно задачей настоящего изобретения является разработка композиции пролонгированного высвобождения для перорального введения ингибитора HMG-CoA редуктазы для лечения гиперлипидемии, которая способна медленно высвобождать ингибитор HMG-CoA редуктазы с однородной скоростью в течение длительного времени.
Другой задачей настоящего изобретения является разработка способа для получения указанной композиции.
В соответствии с одним аспектом настоящее изобретение относится к композиции с пролонгированным высвобождением для перорального введения ингибитора HMG-CoA редуктазы, которая включает твердый диспергирующий агент, содержащий ингибитор HMG-CoA редуктазы, растворяющий агент и стабилизирующий агент; составной носитель пролонгированного высвобождения; и ускоритель гидратации геля.
В соответствии с другим аспектом настоящее изобретение относится к способу получения композиции с пролонгированным высвобождением для перорального введения ингибитора HMG-CoA редуктазы, который включает стадии:
(1) смешивания ингибитора HMG-CoA редуктазы, растворяющего агента и стабилизирующего агента в растворителе для получения твердого диспергирующего агента;
(2) однородного перемешивания составного носителя с пролонгированным высвобождением и ускорителя гидратации геля с твердым диспергирующим агентом для получения первой смеси;
(3) добавления по меньшей мере одной фармацевтически приемлемой добавки к первой смеси для получения второй смеси; и
(4) сухого смешивания и составления второй смеси в твердую композицию.
Краткое описание чертежей
Вышеуказанные и другие задачи и характеристики настоящего изобретения будут очевидны из следующего описания изобретения в сочетании с сопутствующими чертежами, которые соответственно изображают:
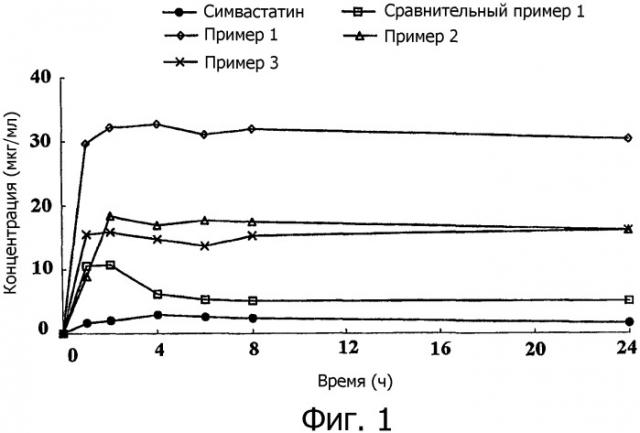
фиг.1 показывает диаграмму, сравнивающую растворимость твердых диспергирующих агентов, полученных в примерах 1-3;
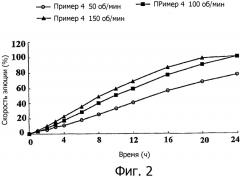
фиг.2 иллюстрирует графики, представляющие собой скорости элюции композиций с пролонгированным высвобождением, полученных в примере 4, графики показаны для каждого числа оборотов;
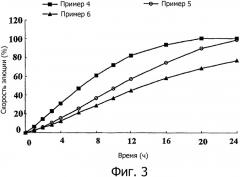
фиг.3 представляет собой диаграмму, сравнивающую скорости элюции композиций с пролонгированным высвобождением, полученных в примерах 4-6, в зависимости от количества ксантановой камеди;
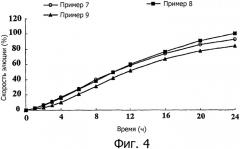
фиг.4 изображает диаграмму сравнения скоростей элюции композиций с пролонгированным высвобождением, полученных в примерах 7-9, в зависимости от количества HPMC 2208;
фиг.5 представляет диаграмму, представляющую собой изменение уровня симвастатина в крови после перорального введения композиции с пролонгированным высвобождением, полученной в примере 5;
фиг.6 иллюстрирует диаграмму, представляющую собой вид распределения и экскреции симвастатина в желчи после перорального введения композиции с пролонгированным высвобождением, полученной в примере 5.
Подробное описание изобретения
Настоящее изобретение относится к композиции с пролонгированным высвобождением для перорального введения ингибитора HMG-CoA редуктазы, которая включает твердый диспергирующий агент, содержащий ингибитор HMG-CoA редуктазы, растворяющий агент и стабилизирующий агент; составной носитель с пролонгированным высвобождением; и ускоритель гидратации геля.
Композиция с пролонгированным высвобождением по настоящему изобретению может быть получена следующими стадиями:
(1) смешивания ингибитора HMG-CoA редуктазы, растворяющего агента и стабилизирующего агента в растворителе для получения твердого диспергирующего агента;
(2) однородного перемешивания составного носителя с пролонгированным высвобождением и ускорителя гидратации геля с твердым диспергирующим агентом для получения первой смеси;
(3) добавления по меньшей мере одной фармацевтически приемлемой добавки к первой смеси для получения второй смеси; и
(4) сухого смешивания и составления второй смеси в твердую композицию.
Так как композиция с пролонгированным высвобождением для перорального введения по настоящему изобретению медленно высвобождает ингибитор HMG-CoA редуктазы в кровь с однородной скоростью, она способна поддерживать постоянный уровень лекарственного средства в крови. Соответственно композиция с пролонгированным высвобождением для перорального введения может быть эффективно использована для профилактики и лечения гиперлипидемии и артериосклероза пероральным введением один раз в день в однократной дозе.
Далее компоненты композиции с пролонгированным высвобождением по настоящему изобретению описаны детально, как указано ниже.
(i) Фармакологически активный ингредиент
Ингибитор HMG-CoA редуктазы является лекарственным средством, используемым для лечения гиперлипидемии и артериосклероза посредством снижения уровня липопротеинов или липидов в крови. Их характерные примеры могут включать мевастатин (патент США № 3983140), ловастатин (патент США № 4231938), правастатин (патенты США №№ 4346227 и 4410629), лактон правастатина (патент США № 4448979), велостатин, симвастатин (патенты США №№ 4448784 и 4450171), ривастатин, флувастатин, аторвастатин, церивастатин и их фармацевтически приемлемые соли. Среди вышеупомянутых ингибиторов HMG-CoA редуктазы симвастатин или его фармацевтически приемлемая соль является предпочтительным.
(ii) Растворяющий агент
Так как биодоступность лекарственных средств, плохо растворимых в воде, снижается пропорционально снижению их растворимости, исследования для растворения лекарственного средства и увеличения его растворимости являются необходимыми для разработки композиции с пролонгированным высвобождением лекарственного средства, плохо растворимого в воде. Так как большинство ингибиторов HMG-CoA редуктазы являются соединениями, плохо растворимыми в воде, растворяющие агенты служат для увеличения растворимости лекарственного средства в настоящем изобретении. Характерные примеры растворяющих агентов могут включать витамин Е TPGS (d-α-токоферилполиэтиленгликоль 1000 сукцинат: Eastman), сложный эфир полиоксиэтилена и стеариновой кислоты (например, Myrj: ICI), полиэтиленгликоль, блоксополимер полиоксипропилен-полиоксипропилена (например, Poloxamer: BASF) и подобные. Композиция с пролонгированным высвобождением по настоящему изобретению включает растворяющий агент в количестве, варьирующем от 0,05 до 20 массовых частей, предпочтительно от 0,1 до 10 массовых частей на основании 1 массовой части фармакологически активного ингредиента.
(iii) Стабилизирующий агент
Стабилизирующий агент для применения в настоящем изобретении может быть любым из обычных стабилизирующих агентов, которые предохраняют лекарственное средство от окисления. Примерами стабилизирующих агентов являются бутилированный гидрокситолуол (ВНТ), бутилированный гидроксианизол (ВНА), эриторбовая кислота, аскорбиновая кислота и подобные. Композиция пролонгированного высвобождения по настоящему изобретению включает стабилизирующий агент в количестве, варьирующем от 0,01 до 0,5 массовых частей, предпочтительно от 0,02 до 0,1 массовых частей на основании 1 массовой части фармакологически активного ингредиента.
В настоящем изобретении получают твердый диспергирующий агент, имеющий улучшенную растворимость, смешиванием фармакологически активного ингредиента, растворяющего агента и стабилизирующего агента в соответствии с обычным способом, таким как метод распылительной сушки, метод выпаривания растворителя, метод мелкой пульверизации-увлажнения, метод расплавления и метод сублимационной сушки.
В случае составления посредством метода распылительной сушки твердый диспергирующий агент по настоящему изобретению может дополнительно содержать фармацевтически приемлемый растворяющий носитель. Фармацевтически приемлемый растворяющий носитель делает твердый диспергирующий агент с небольшим размером частиц однородно распределенным для улучшения его растворимости. Характерные примеры растворяющего носителя могут включать крахмал и его производные (например, декстрин, карбоксиметилкрахмал); целлюлозу и ее производные (метилцеллюлозу, гидроксипропилметилцеллюлозу); сахариды (лактозу, сахар, глюкозу); кремниевую кислоту и силикаты (натуральную алюмокремниевую кислоту, магний-кремниевую кислоту);, карбонат (карбонат кальция, карбонат магния, гидрокарбонат натрия); производные полиоксиэтилена; глицерилмоностеарат и подобные.
(iv) Составной носитель пролонгированного высвобождения
В настоящем изобретении составной носитель пролонгированного высвобождения, служащий для образования гидрогеля, является предпочтительно смесью альгината натрия (Keltone® HVCR, Keltone® LVF, Kelcosol®, Kelset®: ISP, USA) и ксантановой камеди (Keltrol® F; Kelco®, USA), и смесь может кроме того включать смолу плодоворожкового дерева (Cesagum® LN1, LR 200; Cesalpinia, Italy). Обычно эффекты компонентов являются следующими: альгинат натрия подавляет возникновение эффекта исходного выброса; ксантановая камедь вносит вклад в фиксацию конфигурации, что минимизирует различия в скорости элюции из-за физических сил, таких как желудочно-кишечная подвижность; и смола плодоворожкового дерева может сильнее фиксировать конфигурацию в комбинации с ксантановой камедью. Если вышеупомянутые ингредиенты - носители используют в смеси в определенном соотношении смешивания, исходный эффект выброса и различия в скорости элюции из-за физических сил могут быть уменьшены. В композиции с пролонгированным высвобождением по настоящему изобретению составной носитель с продолжительным высвобождением может быть использован в количестве, варьирующем от 3 до 30 массовых частей, предпочтительно от 5 до 25 массовых частей на основании 1 массовой части фармакологически активного ингредиента. В случае применения смеси альгината натрия и ксантановой камеди в качестве составного носителя с пролонгированным высвобождением ксантановую камедь используют в количестве, варьирующем от 0,1 до 10 массовых частей, предпочтительно от 3 до 6 массовых частей на основании 1 массовой части альгината натрия. Далее в случае использования смеси альгината натрия, ксантановой камеди и смолы плодоворожкового дерева в качестве составного носителя с пролонгированным высвобождением ксантановую камедь используют в количестве, варьирующем от 0,2 до 10 массовых частей, предпочтительно от 3 до 6 массовых частей, и смолу плодоворожкового дерева используют в количестве, варьирующем от 0,1 до 5 массовых частей, предпочтительно от 0,5 до 5 массовых частей на основании 1 массовой части альгината натрия.
(v) Ускоритель гидратации геля
Ускоритель гидратации геля, используемый в настоящем изобретении, играет ключевую роль в образовании одиночного гомогенного желатинизированного ядра без образования не-желатинизированного ядра. Когда композиция пролонгированного высвобождения по настоящему изобретению приходит в контакт с водной средой in vivo, ускоритель гидратации геля индуцирует ее быструю гидратацию и пропускает воду во внутреннее ядро композиции равным и быстрым образом. В настоящем изобретении ускорителем гидратации геля является предпочтительно смесь альгината сложного эфира пропиленгликоля и гидроксипропилметилцеллюлозы (HPMC). В вышеуказанной смеси предпочтительно, чтобы HPMC имела вязкость, варьирующую от 4000 до 100000 сП, и альгинат сложного эфира пропиленгликоля использовался в количестве, варьирующем от 0,05 до 20 массовых частей, предпочтительно от 0,1 до 10 массовых частей на основании 1 массовой части НРМС.
В композиции с пролонгированным высвобождением по настоящему изобретению ускоритель гидратации геля используют в количестве, варьирующем от 0,1 до 20 массовых частей, предпочтительно от 0,5 до 15 массовых частей на основании 1 массовой части фармакологически активного ингредиента.
Кроме того, композиция пролонгированного высвобождения по настоящему изобретению может также включать по меньшей мере одну фармацевтически приемлемую добавку для получения твердой композиции для перорального введения. Характерными примерами фармацевтически приемлемой добавки являются вяжущее вещество, смазывающий агент, подсластитель, вспомогательное вещество и подобные. Вяжущим веществом для применения в получении твердой композиции может быть любое из фармацевтически приемлемых вяжущих веществ, таких как поливинилпирролидон (PVP), желатин, гидроксипропилцеллюлоза, кофовидон (Kollidon VA64: BASF, Germany) и подобные.
Смазывающий агент для применения в настоящем изобретении может быть любым из фармацевтически приемлемых смазывающих агентов, которые увеличивают текучесть. Их характерные примеры могут включать легкую безводную кремниевую кислоту, соли стеарата цинка или магния и подобные.
Кроме того, настоящее изобретение относится к способу получения композиции с пролонгированным действием для перорального введения ингибитора HMG-CoA редуктазы.
Способ по настоящему изобретению включает следующие стадии:
(1) смешивание ингибитора HMG-CoA редуктазы, растворяющего агента и стабилизирующего агента в растворителе для получения твердого диспергирующего агента;
(2) однородное смешивание составного носителя с пролонгированным высвобождением и ускорителя гидратации геля с твердым диспергирующим агентом для получения первой смеси;
(3) добавление по меньшей мере одной фармацевтически приемлемой добавки к первой смеси для получения второй смеси; и
(4) сухое смешивание и составление второй смеси в твердую композицию.
Кроме того, способ по настоящему изобретению может также включать стадию покрытия оболочкой поверхности твердой композиции, полученной на стадии (4) любым из фармацевтически приемлемых агентов для покрытия оболочкой. Характерные примеры агента для покрытия оболочкой могут включать гидроксипропилметилцеллюлозу, полиэтиленгликоль, поливиниловый спирт и подобные.
На стадии (1) твердый диспергирующий агент может быть получен обычным способом, таким как способ распылительной сушки, способ выпаривания растворителя, способ мелкой пульверизации-увлажнения, способ расплавления и способ сублимационной сушки, и предпочтительно имеет размер частиц, варьирующий от 5 до 200 мкм в диаметре. Растворителем, используемым для растворения ингибитора HMG-CoA редуктазы, растворяющего агента и стабилизирующего агента, является предпочтительно вода, этанол или метиленхлорид.
Сухая смесь, полученная на стадии (4), может быть рецептирована в мягкие и твердые капсулы в соответствии с обычной методикой. В предпочтительном варианте осуществления настоящего изобретения вторая смесь со стадии (4) может быть прессована в таблетку в соответствии с непосредственным способом получения таблеток или рецептирована в таблетку после прессования и распыления.
Обычная суточная доза композиции с пролонгированным высвобождением для перорального введения ингибитора HMG-CoA редуктазы может быть в форме одной дозы или разделенных доз.
Следующие примеры предназначены для дальнейшей иллюстрации настоящего изобретения без ограничения его объема.
Примеры 1-3. Получение твердых диспергирующих агентов
Симвастатин (Hanmi Fine Chemical Co., Ltd., Korea), витамин Е TPGS (Eastman, USA), BHT (UENO Fine Chemical, USA) и НРМС 2910 (Shin-Etsu, Japan) растворяли в этаноле в соответствии со следующим количеством, как описано в таблице 1 (примеры 1-3; экспериментальные группы), и каждую из полученных смесей подвергали распылительной сушке для получения твердого диспергирующего агента, имеющего средний размер частиц 100 мкм и меньше. В качестве сравнительной группы твердый диспергирующий агент получали смешиванием только симвастатина и НРМС 2910 в этаноле (Сравнительный пример 1).
| Таблица 1 | ||||
| Композиция (мг/диспергирующего агента) | Симвастатин | Витамин Е TPGS | ВНТ | НРМС 2910 |
| Сравнительный пример 1 | 40 | х | х | 100 |
| Пример 1 | 40 | 80 | 2 | 100 |
| Пример 2 | 40 | 40 | 2 | 100 |
| Пример 3 | 40 | 40 | 2 | 50 |
Примеры 4-12. Получение композиции с пролонгированным высвобождением для перорального введения
Симвастатин, витамин Е TPGS, Myrj, BHT и НРМС 2910 смешивали для получения твердых диспергирующих агентов в соответствии с таким же способом, как описано в примере 1. Затем каждый из твердых дипергирующих агентов смешивали с альгинатом натрия (ISP, USA), ксантановой камедью (Kelco, USA), смолой плодоворожкового дерева (Cesalpinia, Italy), альгинатом сложного эфира пропиленгликоля (ISP, USA), НРМС 2208 (Shin-Etsu, Japan) и кофовидоном (BASF, Germany) в течение около 30 мин. Порошки стеарата магния и легкой безводной кремниевой кислоты (мельче, чем сито 40) добавляли к смеси и смешивали в течение 5 мин. Полученную смесь измельчали в массу с использованием сборочного устройства для формования, и массу разрушали на частицы, имеющие размер ячеек, варьирующий от 20 до 80. Затем частицы рецептировали в таблетки обычным прессованием в приборе для составления рецептур. Затем получали композиции с пролонгированным высвобождением для перорального введения по примерам 5-12 в соответствии с таким же способом, как описано выше. Количество каждого ингредиента показано в таблицах 2-4. В таком случае НРМС 2208, используемая во всех примерах, имела вязкость 100000 сП, и в примерах 11 и 12 использовали ловастатин и флувастатин в качестве фармакологически активного ингредиента вместо использования симвастатина соответственно.
| Таблица 2 | |||||||
| Компонент (мг/таблет-ку) | Пример 4 | Пример 5 | Пример 6 | Пример 7 | Пример 8 | Пример 9 | Пример 10 |
| Симвастатин | 40 | 40 | 40 | 40 | 40 | 40 | 40 |
| Витамин Е TPGS | 40 | 40 | 40 | 40 | 40 | 40 | 0 |
| Myrj | 0 | 0 | 0 | 0 | 0 | 0 | 40 |
| ВНТ | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| НРМС 2910 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| Альгинат натрия | 36 | 36 | 36 | 36 | 36 | 36 | 36 |
| Ксантановая камедь | 100 | 120 | 160 | 160 | 160 | 160 | 120 |
| Смола плодоворожкового дерева | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| Альгинат сложного эфира пропиленгликоля | 36 | 36 | 36 | 36 | 36 | 36 | 36 |
| НРМС 2208 | 160 | 160 | 160 | 40 | 80 | 120 | 160 |
| Кофовидон | 35 | 35 | 35 | 35 | 35 | 35 | 35 |
| Легкая безводная кремниевая кислота | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| Стеарат магния | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| Таблица 3 | |
| Компонент (мг/таблетку) | Пример 11 |
| Ловастатин | 60 |
| Витамин Е TPGS | 20 |
| ВНТ | 2 |
| НРМС 2910 | 50 |
| Альгинат натрия | 36 |
| Ксантановая камедь | 150 |
| Смола плодоворожкового дерева | 50 |
| Альгинат сложного эфира пропиленгликоля | 30 |
| НРМС 2208 | 110 |
| Кофовидон | 35 |
| Легкая безводная кремниевая кислота | 10 |
| Стеарат магния | 2 |
| Таблица 4 | |
| Компонент (мг/таблетку) | Пример 12 |
| Флувастатин | 80 |
| Витамин Е TPGS | 60 |
| ВНТ | 2 |
| НРМС 2910 | 60 |
| Альгинат натрия | 40 |
| Ксантановая камедь | 150 |
| Смола плодоворожкового дерева | 80 |
| Альгинат сложного эфира пропиленгликоля | 35 |
| НРМС 2208 | 110 |
| Кофовидон | 35 |
| Легкая безводная кремниевая кислота | 10 |
| Стеарат магния | 2 |
Пример исследования 1. Тест растворимости твердых диспергирующих агентов
Твердые диспергирующие агенты сравнительного примера 1 и примеров 1-3 и неочищенного порошка симвастатина в качестве контрольной группы подвергали исследованию растворимости в дистиллированной воде с использованием системы тестирования растворения в следующих условиях в соответствии с методом 1 Basket, описанным в Корейской Фармакопее.
Система тестирования растворения: Erweka DT 80 (Erweka, Germany)
Отток: 900 мл дистиллированной воды
Температура оттока: 37 ±0,5°С
Количество оборотов: 50, 100 и 150 об/мин
Аналитический метод: жидкостная хроматография
- Колонка: Cosmosil C18 (Nacalai Tesque)
- Подвижная фаза ацетонитрил/буферный раствор рН 4,0*
- Скорость потока: 1,5 мл/мин
- Датчик: ультрафиолетовый спектрофотометр (238 нм)
- Объем введения: 20 мкл.
* Буферный раствор с рН 4,0 получали смешиванием 3 мл ледяной уксусной кислоты с 1 л дистиллированной воды и доведением рН смеси до 4,0 с помощью NaOH.
Как можно видеть из фиг.1, было обнаружено, что твердые диспергирующие агенты по примерам 1-3, полученные распылительной сушкой смеси симвастатина, витамина Е TGPC и НРМС, показали более высокую растворимость, чем твердый диспергирующий агент сравнительного примера 1, полученный смешиванием только симвастатина и НРМС и неочищенным порошком симвастатина, и их растворимость была скорее пропорциональна количеству витамина Е TGPC, чем НРМС.
Пример исследования 2. Исследование растворимости для количества оборотов
Композицию, полученную в примере 5, подвергали исследованию растворимости in vitro в следующих условиях в соответствии с 1 методом Paddle, описанным в Корейской Фармакопее. Количество симвастатина, элюированное из композиции во время исследования, измеряли жидкостной хроматографией через 1, 2, 4, 6, 8, 10, 12, 16, 20 и 24 часа после введения. Каждый образец оставляли с 40 мг заранее промытого MnO2 (под USP Симвастатин Таблетка 1) для реакции с ним в течение 30 мин и центрифугировали при 3000 об/мин в течение 5 мин. Затем поглощение каждого образца измеряли с использованием ультрафиолетового спектрофотометра и их реальное поглощение рассчитывали вычитанием поглощения при 257 нм из таковой при 247 нм.
Система тестирования растворения: Erweka DT 80
Отток: 0,01 М буферного раствора фосфата натрия (рН 7,0), содержащего 5% лаурилсульфат натрия (SLS)
Температура оттока: 37 ±0,5°С
Количество оборотов: 50, 100 и 150 об/мин
Аналитический метод: ультрафиолетовый спектрофотометр (247 нм и 257 нм)
Расчет элюированного количества: Количество общего высвобождения
Как показано на фиг. 2, было обнаружено, что композиция симвастатина по настоящему изобретению не проявляет какого-либо значительного различия в скорости растворения при изменении количества оборотов, показывая, что биодоступность является воспроизводимой.
Пример исследования 3. Исследование растворимости для количества ксантановой камеди
Композиции, полученные в примерах 4-6, подвергали исследованию растворения in vitro при 100 об/мин в соответствии с таким же методом, как описано в примере исследования 2.
Результаты на фиг.3 показывают, что скорость растворения лекарственного средства является обратно пропорциональной количеству ксантановой камеди, что предполагает, что ксантановая камедь действует как носитель пролонгированного высвобождения. Соответственно может быть заключено, что гидрогель, имеющий большую плотность, образуется путем увеличения количества ксантановой камеди.
Пример исследования 4. Исследование растворимости для количества НРМС 2208
Композиции, полученные в примерах 7-9, подвергали исследованию растворения in vitro при 100 об/мин в соответствии с таким же методом, как описано в примере исследования 2.
Как показано на фиг.4, было обнаружено, что скорость растворения лекарственного средства является пропорциональной количеству НРМС, пока количество НРМС не достигнет определенной концентрации, после которой она становится обратно пропорциональной количеству НРМС. Такие результаты показывают, что НРМС действует как ускоритель гидратации геля, она может быть способна действовать как носитель пролонгированного высвобождения при добавлении в высокой концентрации.
Пример исследования 5. Исследования скорости всасывания и распределения/экскреции в желчь при пероральном применении
С целью сравнения биодоступности и эффекта пролонгированного высвобождения вводимой перорально композиции по настоящему изобретению и изучения его терапевтического эффекта на печень, как мишень ингибитора HMG-CoA редуктазы, проводили исследования биодоступности и распределения/экскреции в желчь при пероральном введении крысам, как указано ниже. В этот раз композицию пролонгированного высвобождения, полученную в примере 5, использовали в качестве тестируемого образца и ZOCOR® (Korea MSD Ltd.), известный как композиция быстрого высвобождения симвастатина, использовали в качестве контрольного образца.
Самцов крыс линии Sprague Dawley в возрасте 14-15 недель (средняя масса тела 250 г) делили на две группы, каждая состоящая из 5 крыс. Крысы осваивались в течение более чем 4 дней со свободным доступом к пище и воде. И затем крысы голодали в течение периода 48 часов, тогда как им позволяли свободный доступ к воде. Перед введением каждого образца крысам давали эфир, связывали передние и задние лапы и затем подвергали хирургической операции для вставления трубки в артерию и вену бедренной области и желчный проток для получения крови и желчи в одно и то же время соответственно. Потерю жидкости тела восполняли введением физиологического солевого раствора через трубку, вставленную в вену. После этого каждый из тестируемых и контрольных образцов заполняли в капсулу для перорального введения крысам в количестве, соответствующем 10 мг/кг симвастатина, и вводили перорально крысам с использованием соответствующего устройства для введения соответственно. Образцы крови получали из трубок, вставленных в артерию и вену крыс, до введения и через 0,5, 1, 1,5, 3, 5, 7, 9, 12 и 24 часа после введения. Образцы желчи получали из трубки, вставленной в желчный проток крыс, через 1, 2, 3, 5, 7, 9, 12 и 24 часа после введения.
Концентрацию в крови и тип распределения в желчи симвастатина анализировали следующим.
К каждым 100 мкл образцов желчи и крови добавляли 200 мкл метанола в качестве внутреннего стандарта, и смесь встряхивали для получения экстракта. Экстракт центрифугировали при 3000 об/мин в течение 10 мин для получения надосадочной жидкости, и надосадочную жидкость фильтровали через фильтровальную бумагу, имеющую размер пор 0,22 мкм. Затем фильтрат подвергали анализу ЖХ-МС в следующих условиях. Результаты анализа показаны на фиг. 5 и 6.
Колонка: Waters Oasis HLB (2,1 х 50 мм)
Подвижная фаза: система градиентов концентраций ацетонитрила, воды и 10 мМ NH4OAc (доведение рН до 4,5 муравьиной кислотой)
Объем введения: 50 мкл
Скорость тока: 0,3 мл/мин
Определение: вид SIR m/z: 419,4 (симвастатин), 435,3 (симвастатиновая кислота).
Как показано на фиг.5, композиция пролонгированного высвобождения по настоящему изобретению показала Сmax 79,4 нг/мл и AUC 249,0 нг ч/мл, которые были немного ниже, чем таковые композиции быстрого высвобождения (88,1 нг/мл Сmax и 266,2 нг ч/мл AUC), но проявляла желаемый уровень эффекта пролонгированного высвобождения. Кроме того, результаты на фиг.6 показывают, что обнаружено, что большинство композиций с пролонгированным высвобождением по настоящему изобретению присутствуют и метаболизируются в печени, что указывает на тот факт, что композиция пролонгированного высвобождения была более эффективной для печени, чем композиция быстрого высвобождения. Учитывая, что ингибитор HMG-CoA редуктазы создан для эффекта в печени, где более чем 95% их метаболизируется, композиция пролонгированного высвобождения по настоящему изобретению является наиболее подходящей композицией для перорального введения ингибитора HMG-CoA редуктазы.
Пример исследования 6. Эффект снижения уровня холестерина и триглицеридов
С целью изучения терапевтического эффекта композиции пролонгированного высвобождения ингибитора HMG-CoA редуктазы на гиперлипидемию, вызванную высокохолестериновой диетой, композицию пролонгированного действия по настоящему изобретению вводили крысам с индуцированной гиперлипидемией и измеряли изменения концентрации в крови холестерина и триглицеридов.
В частности, получение высокохолестеринового питания, используемого для индуцирования гиперлипидемии и получения патологической модели, проводили в соответствии со способом, описанным Niiho et al (Ykugaku Zasshi 110: 604-611, 1991). Высокохолестериновое питание получали измельчением обычного питания для животных для нормального питания, пропуская его через сито 40 и смешивая с 5% холестерина, 0,25% фолиевой кислоты и 2,5% оливкового масла.
В следующих исследованиях использовали двадцать четыре самца крыс линии Sprague Dawley в возрасте 4-5 недель. После взвешивания крыс и их равномерного распределения по средней массе тела, их делили на четыре группы, каждая состоящая из 6 крыс, имеющих среднюю массу тела 20-25 г. Крысы акклиматизировались в клетках, установленных при комнатной температуре 23 ±2°С и относительной влажности 55 ±5%.
Первая группа была контрольной группой, которая получала высокохолестериновое питание в течение эксперимента без лечения терапевтическими препаратами; и вторая группа получала высокохолестериновую диету с введением ZOCOR® один раз в сутки в количестве, соответствующем 5 мг/кг симвастатина. 3-я Группа получала высокохолестериновую диету с введением композиции с пролонгированным высвобождением, полученной в примере 5, один раз в сутки в количестве, соответствующем 5 мг/кг симвастатина; и 4-я группа была нормальной, без истории потребления высокохолестериновой диеты и терапевтического лекарственного средства.
Через две недели после введения крыс умерщвляли и в каждой группе получали образцы сыворотки. Концентрацию общего холестерина и триглицеридов измеряли в соответствии с методом обычной ферментной реакции, и результаты показаны в таблицах 5 и 6.
| Таблица 5 | ||
| Группа животных | Общий холестерин * (мг/дл) | Соотношение уровня холестерина к контролю (%) |
| 1-я группа (контроль) | 671,5 ±84,1 | 100 |
| 2-я группа (ZOCOR®) | 567,9 ±93,2 | 84,6 |
| 3-я группа (композиция пролонгированного высвобождения Примера 5) | 453,0 ±77,0 | 67,5 |
| 4-я группа (нормальная) | 81,0 ±8,2 | - |
| *средняя концентрация общего холестерина ± стандартное отклонение |
| Таблица 6 | ||
| Группа животных | Триглицериды * (мг/дл) | Соотношение уровня триглицеридов к контролю (%) |
| 1я группа (контроль) | 242,4 ±12,6 | 100 |
| 2-я группа (ZOCOR®) | 187,0 ±24,6 | 77,1 |
| 3-я группа (композиция пролонгированного высвобождения Примера 5) | 157,0 ±18,0 | 64,8 |
| 4-я группа (нормальная) | 120,3 ±10,1 | - |
| * средняя концентрация трглицеридов ± стандартное отклонение |
Как показано в таблицах 5 и 6, концентрация в крови холестерина и триглицеридов 1-й группы превышала в 8 раз и в 2 раза выше, чем таковая 4-й группы (контроль), соответственно, из-за введения высокохолестериновой диеты в течение 2 недель. Во 2-й (ZOCOR®) и 3-й (композиция пролонгированного высвобождения примера 5) группах, при воздействии высокохолестериновой диеты и лекарственного средства в течение 2 недель концентрация в крови общего холестерина и триглицеридов была значительно ниже, чем таковая контрольной группы. В частн