Полипептиды для индукции защитного иммунного ответа против staphylococcus aureus
Иллюстрации
Показать всеИзобретение относится к полипептидным иммуногенам, способным вызывать защитный иммунный ответ против Staphylococcus aureus. Полипептиды по изобретению включают аминокислотную последовательность, структурно родственную последовательности SEQ ID NO:1, приведенной в тексте описания. Изобретение относится к использованию таких полипептидов в качестве иммуногенов, в том числе в составе композиций. Изобретение раскрывает также экспрессионные системы для продуцирования таких полипептидов. Последовательность SEQ ID NO:1 представляет собой усеченное производное полноразмерного полипептида S. aureus. Этот полноразмерный полипептид обозначается в изобретении как полноразмерный "ORF0657n". Установлено, что полипептиды, описанные в изобретении и содержащие аминокислотную последовательность SEQ ID NO:1, вызывают защитный иммунный ответ против S. aureus. 11 н. и 32 з.п. ф-лы, 12 ил., 6 табл.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США 60/489840, поданной 24 июля 2003, и предварительной заявки на патент США 60/520115, поданной 14 ноября 2003, каждая из которых приведена здесь в качестве ссылки.
Предшествующий уровень техники
Цитируемые в настоящей заявке работы не должны рассматриваться как прототипы заявленного изобретения.
Staphylococcus aureus представляет собой патоген, ответственный за развитие большого числа заболеваний и состояний. Примерами заболеваний и состояний, вызываемых S. aureus, являются бактериемия, инфекционный эндокардит, фолликулит, фурункулы, карбункулы, импетиго, буллезное импетиго, целлюлит, ботриомиозит, синдром токсического шока, синдром обожженной кожи, инфекции центральной нервной системы, инфекционные и воспалительные заболевания глаз, остеомиелит и другие инфекционные заболевания суставов и костей, и инфекции дыхательных путей (The Staphylococci in Human Disease, Crossley & Archer (eds.), Churchill Livingstone Inc. 1997).
Для борьбы против инфекций, вызываемых S. aureus, и их распространения могут быть применены иммунологические стратегии. Иммунологические стратегии включают пассивную и активную иммунизацию. Пассивная иммунизация предусматривает использование иммуноглобулинов, конъюгированных с S. aureus. Активная иммунизация предусматривает индукцию иммунного ответа против S. aureus.
Предполагаемые вакцины нацелены на полисахариды и полипептиды S. aureus. Нацеливание может быть достигнуто с использованием подходящих полисахаридов или полипептидов S. aureus в качестве компонентов вакцины. Примеры возможных полисахаридных компонентов вакцины включают капсульные полисахариды S. aureus типа 5 и типа 8 (Shinefield et al., N. Eng. J. Med. 346:491-496, 2002). Примеры полипептидов, которые могут быть использованы в качестве возможных компонентов вакцины, включают коллаген, адгезин, фибриноген-связывающие белки и фактор свертывания крови (Mamo et al., FEMS Immunology and Medical Microbiology 10:47-54, 1994, Nilsson et al., J. Clin. Invest. 101:2640-2649, 1998, Josefsson et al., The Journal of Infectious Diseases 184:1572-1580, 2001).
Сведения о полипептидных последовательностях S. aureus были получены из данных секвенирования генома S. aureus (Kuroda et al., Lancet 357:1225-1240, 2001, Baba et al., Lancet 359:1819-1827, 2000, Kunsch et al., европейская патентная заявка ЕР 0786519, опубликованная 30 июля 1997). Для характеристики полипептидных последовательностей, полученных на основе данных секвенирования генома, были предприняты попытки применения некоторых методов биоинформатики (Kunsch et al., Европейская патентная заявка ЕР 0786519, опубликованная 30 июля 1997).
Для идентификации генов, кодирующих возможные антигены, могут быть частично применены такие методы, как технологии молекулярного дисплея и технологии с использованием сыворотки от инфицированных пациентов (Foster et al., Международная заявка № WO 01/98499, опубликованная 27 декабря 2001, Meinke et al., Международная заявка № WO 02/059148, опубликованная 1 августа 2002).
Описание сущности изобретения
Настоящее изобретение относится к полипептидам, содержащим аминокислотную последовательность, структурно относящуюся к SEQ ID NO:1, к использованию таких полипептидов и к экспрессионным системам для получения таких полипептидов. SEQ ID NO:1 представляет собой усеченное производное полноразмерного полипептида S. aureus. Этот полноразмерный полипептид обозначен здесь как полноразмерный "ORF0657n". Было обнаружено, что полипептиды, содержащие аминокислотную последовательность SEQ ID NO:1, вызывают защитный иммунный ответ против S. aureus.
Термин "защитный" иммунитет или иммунный ответ означает определяемый уровень защиты против инфекции S. aureus. Уровень защиты может быть оценен на моделях животных, например на моделях, описанных в настоящей заявке.
Таким образом, в первом своем аспекте настоящее изобретение относится к полипептидному иммуногену, содержащему аминокислотную последовательность, которая по крайней мере на 90% идентична SEQ ID NO:1, где полипептид не содержит карбокси-концевой конец, состоящий из аминокислот 609-645 SEQ ID NO:2, и где полипептид обеспечивает защитный иммунитет против S. aureus. SEQ ID NO:2 представляет собой полноразмерный полипептид ORF0657n, где аминокислоты 609-645 составляют карбокси-концевой домен, начинающийся с мотива LPXTG (называемый здесь "сигналом сортировки белков клеточной стенки").
Термин "иммуноген" означает вещество, обладающее способностью вызывать защитный иммунитет.
Выражение "содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична SEQ ID NO:1" подразумевает присутствие области, родственной SEQ ID NO:1, и возможное присутствие других полипептидных областей. Если присутствуют другие полипептидные области, то указанный полипептид не содержит карбокси-концевой мотив LPXTG, состоящий из аминокислот 609-645 SEQ ID NO:2.
В другом своем аспекте настоящее изобретение относится к иммуногену, содержащему аминокислотную последовательность, которая вызывает защитный иммунитет против S. aureus. Иммуноген содержит аминокислотную последовательность, которая по крайней мере на 90% идентична SEQ ID NO:1, и одну или несколько дополнительных областей или частей, ковалентно связанных на карбоксильном конце или амино-конце, где каждая указанная область или часть независимо выбрана из области или части, обладающих по крайней мере одним из следующих свойств: способностью усиливать иммунный ответ, способностью облегчать очистку полипептида или способностью обеспечивать его стабильность.
Термин "дополнительная область или часть" обозначает область или часть, отличную от ORF0657n-родственного полипептида, который может продуцироваться в биологическом хозяине, таком как прокариотический или эукариотический хозяин. Такой дополнительной областью или частью могут быть, например, дополнительная полипептидная область или не-пептидная область.
В другом своем аспекте, настоящее изобретение относится к композиции, способной индуцировать у пациента защитный иммунитет против S. aureus. Указанная композиция содержит фармацевтически приемлемый носитель и иммунологически эффективное количество иммуногена, обеспечивающего выработку защитного иммунитета против S. aureus.
Иммунологически эффективным количеством является количество, достаточное для выработки защитного иммунитета против инфекции, вызываемой S. aureus. Такое количество должно быть достаточным для надежного предупреждения вероятности возникновения или обострения инфекции, вызываемой S. aureus.
В другом своем аспекте, настоящее изобретение относится к нуклеиновой кислоте, содержащей рекомбинантный ген, кодирующий полипептид, который вызывает защитный иммунитет против S. aureus. Рекомбинантный ген содержит рекомбинантную нуклеиновую кислоту, кодирующую полипептид, вместе с регуляторными элементами для "правильной" транскрипции и процессинга (которыми могут быть трансляционные и посттрансляционные элементы). Указанный рекомбинантный ген может присутствовать независимо от генома хозяина, либо он может быть частью генома хозяина.
Рекомбинантная нуклеиновая кислота представляет собой нуклеиновую кислоту, которая имеет последовательность и/или форму, не встречающуюся в природе. Примеры рекомбинантной нуклеиновой кислоты включают очищенную нуклеиновую кислоту; нуклеиновую кислоту, в которой две или несколько областей нуклеиновых кислот, объединены вместе и образуют нуклеиновую кислоту, не встречающуюся в природе; и нуклеиновую кислоту, в которой отсутствует одна или несколько областей нуклеиновых кислот (например, в 3′-5′ направлении или в 5′-3′ направлении), связанных друг с другом в природе.
В другом своем аспекте настоящее изобретение относится к рекомбинантной клетке. Эта клетка содержит рекомбинантный ген, кодирующий полипептид, который вызывает защитный иммунитет против S. aureus.
В другом своем аспекте настоящее изобретение относится к способу получения полипептида, вызывающего защитный иммунитет против S. aureus. Указанный способ предусматривает культивирование рекомбинантной клетки, содержащей рекомбинантную нуклеиновую кислоту, кодирующую указанный полипептид, и очистку полипептида.
В другом своем аспекте настоящее изобретение относится к полипептиду, который вызывает защитный иммунитет у хозяина против S. aureus и который получают способом, предусматривающим стадию культивирования рекомбинантной клетки, содержащей рекомбинантную нуклеиновую кислоту, кодирующую указанный полипептид, и очистку этого полипептида. Для этих целей могут быть использованы различные клетки-хозяева. В одном из вариантов настоящего изобретения указанной клеткой-хозяином является дрожжевая клетка.
В другом своем аспекте настоящее изобретение относится к способу индукции у пациента защитного иммунного ответа против S. aureus. Указанный способ предусматривает стадию введения пациенту иммунологически эффективного количества иммуногена, вызывающего защитный иммунитет против S. aureus.
В другом своем аспекте настоящее изобретение относится к способу индукции анамнетической реакции у пациента. Указанный способ предусматривает стадию введения пациенту эффективного количества иммуногена для продукции анамнетической реакции.
В другом своем аспекте настоящее изобретение относится к нуклеиновой кислоте, кодирующей ORF0657n-родственный полипептид, который оптимизирован для экспрессии в дрожжах. Для экспрессии в дрожжах оптимизируют один или несколько кодонов.
В другом своем аспекте настоящее изобретение относится к способу получения полипептида, вызывающего защитный иммунитет против S. aureus в рекомбинантной дрожжевой клетке. Указанный способ предусматривает:
(а) стадию культивирования рекомбинантной дрожжевой клетки в условиях, благоприятных для экспрессии полипептида, где указанная рекомбинантная дрожжевая клетка содержит рекомбинантный ген, кодирующий указанный полипептид, и где указанным полипептидом является полноразмерный полипептид ORF0657n, вызывающий защитный иммунитет против инфекции, вызываемой S. aureus, или его фрагмент, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична последовательности SEQ ID NO:1; и
(b) стадию очистки указанного полипептида.
Если конкретные термины являются взаимоисключающими, то слово "или" означает одну из двух возможностей. Используемое иногда сочетание слов "и/или" означает любую или обе возможности.
Неограничивающие термины, такие как "включает" подразумевают присутствие дополнительных элементов или стадий. Используемое иногда сочетание слов "один или несколько" вместе с ограничивающим или неограничивающим условием подразумевает возможность наличия дополнительных элементов или стадий.
Если это не оговорено особо, то употребление артиклей "а" или "an" не подразумевает ограничение лишь единственным числом. Так, например, употребление слова "a cell" (клетка) не исключает множественного числа, то есть "cells" (клетки). Используемое иногда сочетание слов, такое как "один или несколько", может означать присутствие множества элементов.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из приведенного ниже дополнительного описания, включая различные примеры. Приведенные примеры иллюстрируют различные компоненты и методику, применяемую для осуществления настоящего изобретения. Эти примеры не ограничивают объема притязаний настоящего изобретения. Исходя из описания настоящего изобретения, любой средний специалист может идентифицировать и использовать другие компоненты и методы, которые могут быть применены для практического осуществления настоящего изобретения.
Краткое описание графического материала
На фиг.1А, 1В, 1С и 1D схематически проиллюстрированы полипептидные области, родственные полипептиду ORF0657n и скринированные на наличие защитного ответа у животных, а также некоторые другие последовательности ORF0657n. На фиг.1А схематически проиллюстрированы протестированные полипептиды, которые, как было обнаружено, являются защитными (показаны черными прямоугольниками); протестированные полипептиды, которые, как было обнаружено, не являются защитными (показаны незаштрихованными прямоугольниками); и не протестированные полипептиды (показаны штрихом). На фиг.1В представлена полноразмерная последовательность, используемая на фиг.1А как эталонная (SEQ ID NO:2). На фиг.1С представлена последовательность SEQ ID NO:28. SEQ ID NO:28 содержит карбокси-концевую "His-метку" (LEHHHHHH; SEQ ID NO:64). Последовательность SEQ ID NO:28, содержащая карбокси-концевую His-метку, также обозначена здесь "His-tag-ORF0657n". На фиг.1D представлена последовательность ORF0657nI+.
На фиг.2А-2Е проиллюстрировано сравнение последовательностей различных ORF0657n-родственных последовательностей в области ORF0657nН. На фигурах SEQ ID NO: обозначают "ID".
На фиг.3А, 3В и 3С проиллюстрирована способность ORF0657n-родственных полипептидов, содержащих полноразмерную последовательность, а именно область ORF0657nН и область ORF0657nI, вызывать защитный иммунитет против S. aureus Becker. Эти полипептиды использовали вместе с адъювантом, а именно с гидроксифосфатом алюминия (АНР). На фиг.3А представлены результаты, полученные с использованием SEQ ID NO:28. На фиг.3В представлены результаты, полученные с использованием SEQ ID NO:4, содержащей карбокси-концевую His-метку. На фиг.3С представлены результаты, полученные с использованием SEQ ID NO:5, содержащей карбокси-концевую His-метку. Термин "карбоксильная His-метка" означает His-метку группы LEHHHHHH (SEQ ID NO:64), присутствующую на карбоксильном конце.
На фиг.4А-4Н проиллюстрирована способность ORF0657n-родственных полипептидов вызывать защитный иммунитет против заражения другими S. aureus. Полипептид SEQ ID NO:28 использовали в качестве иммуногена. На фиг.4А представлены результаты, полученные при провокационном заражении штаммом CL-10 (2,2х108 к.о.е./мл). На фиг.4В представлены результаты, полученные при провокационном заражении штаммом CL-10 (2,1х108 к.о.е./мл). На фиг.4С представлены результаты, полученные при провокационном заражении штаммом CL-13 (2,9х108 к.о.е./мл). На фиг.4D представлены результаты, полученные при провокационном заражении штаммом CL-13 (2,8х108 к.о.е./мл). На фиг.4Е представлены результаты, полученные при провокационном заражении штаммом CL-30 (3,1х108 к.о.е./мл). На фиг.4F представлены результаты, полученные при провокационном заражении штаммом CL-30 (3,0х108 к.о.е./мл). На фиг.4G представлены результаты, полученные при провокационном заражении штаммом CL-18 (1,0х108 к.о.е./мл). На фиг.4Н представлены результаты, полученные при провокационном заражении штаммом CL-21 (1,6х108 к.о.е./мл).
На фиг.5А и 5В проиллюстрированы карты экспрессионных плазмид S. cerevisiae. На фиг.5А представлена плазмидная карта вектора рGAL110. На фиг.5В представлена плазмидная карта для piUC-1, где показана последовательность, оптимизированная по кодонам для экспрессии дрожжей и клонированная под контролем промотора гена GAL1 вектора рGAL110.
На фиг.6А и 6В представлены Вестерн-блоты, иллюстрирующие внутриклеточную экспрессию полноразмерного ORF0657n, имеющего аминокислоты 1-646 SEQ ID NO:28 (SEQ ID NO:28 без карбокси-концевой His-метки). Дорожка 1: стандарты молекулярных масс; дорожка 2: рекомбинантная полноразмерная область ORF0657n (SEQ ID NO:28), продуцированная в очищенной E.coli, 100 нг; дорожки 3-6 содержат 20 мкг лизата дрожжевых клеток; дорожки 3-4: клеточные лизаты, полученные после двух дубликатных ферментаций трансформантов 1260 (фиг.6А) и 1309 (фиг.6В), содержащих только вектор рGAL110; дорожки 5-6: клеточные лизаты, полученные после двух дубликатных ферментаций трансформантов 1260 (фиг.6А) и 1309 (фиг.6В), содержащих pRUnkC-рGAL110, которые экспрессируют полноразмерную область ORF0657n (SEQ ID NO:28 без карбокси-концевой His-метки).
На фиг.7А и 7В проиллюстрированы кумасси-окрашивание ДСН-ПААГ-геля и Вестерн-блот-анализ, с помощью которых была продемонстрирована внутриклеточная экспрессии S. cerevisiae из нуклеиновой кислоты, кодирующей SEQ ID NO:3. Дорожка 1, панель А, BSA, 1,25 мкг; панель В, рекомбинантный полноразмерный ORF0657n в очищенной E.coli (SEQ ID NO:28), 100 нг; дорожка 2, клеточный лизат продуцента ORF0657nН (SEQ ID NO:4 с карбокси-концевой His-меткой) в E.coli; панель А, 1,25 мкг, панель В, 0,5 мкг. Дорожки 3-7, панели А и В содержат 1,25 и 0,5 мкг лизата дрожжевых клеток соответственно; дорожка 3, трансформант, содержащий только вектор рGAL110; дорожка 4, трансформант, содержащий полноразмерный ORF0657n (SEQ ID NO:28 без карбокси-концевой His-метки); дорожки 5, 6 и 7, трансформант 1-1, содержащий piUC-S(-), экспрессирующий область зрелого ORF0657nН (SEQ ID NO:3); дорожка 7 содержит клеточный лизат (трансформанта 1-1), который замораживали, а затем оттаивали. Дорожка 8 содержит стандарты молекулярной массы.
На фиг.8А-8U проиллюстрированы примеры различных последовательностей нуклеиновой кислоты, кодирующих ORF0657n-родственные полипептиды. На фиг.8А представлена последовательность нуклеиновой кислоты (SEQ ID NO:29), кодирующая SEQ ID NO:2 плюс карбокси-концевая His-метка. На фиг.8В представлена последовательность нуклеиновой кислоты (SEQ ID NO:30), кодирующая SEQ ID NO:4 плюс карбокси-концевая His-метка. На фиг.8С представлена последовательность нуклеиновой кислоты (SEQ ID NO:31), оптимизированная по кодонам для экспрессии в дрожжах и кодирующая SEQ ID NO:28 без карбокси-концевой His-метки. На фиг.8D представлена последовательность нуклеиновой кислоты (SEQ ID NO:32), оптимизированная по кодонам для экспрессии в дрожжах и кодирующая SEQ ID NO:3. На фиг.8Е представлена последовательность нуклеиновой кислоты (SEQ ID NO:33), оптимизированная по кодонам для экспрессии в дрожжах и кодирующая SEQ ID NO:1. На фиг.8F-8M представлены последовательности нуклеиновой кислоты (SEQ ID NO:34, 35, 36, 37, 38, 39, 40 и 41), оптимизированные по кодонам для экспрессии в дрожжах и кодирующие последовательность SEQ ID NO:7, содержащую метионин у амино-конца. На фиг.8N-8U представлены последовательности нуклеиновой кислоты (SEQ ID NO:46-53), оптимизированные по кодонам для экспрессии в дрожжах и кодирующие различные ORF0657n-родственные полипептиды на основе последовательностей SEQ ID NO:17 или SEQ ID NO:20.
На фиг.9 проиллюстрирован Вестерн-блот-анализ для сравнения внутриклеточной экспрессии ORF0657n-родственных полипептидов в S. cerevisiae. Дорожки 1 и 18: стандарты молекулярной массы. Дорожки 2 и 5: 50 и 100 нг соответственно очищенного ORF0657n, продуцированного в E.coli (SEQ ID NO:4 плюс карбокси-концевая His-метка). Дорожка 5 содержит 500 нг белка клеточных лизатов контроля, трансформированного вектором S. cerevisiae. Дорожки 7, 8 и 9 содержат 1,0, 2,0 и 4,0 мкг белка клеточных лизатов от S. cerevisiae-трансформанта, продуцирующего SEQ ID NO:28 без карбокси-концевой His-метки. Дорожки 11 и 12 содержат 50 и 100 нг соответственно белка клеточного лизата от S. cerevisiae-трансформанта, продуцирующего ORF0657nН (SEQ ID NO:3). Дорожки 14 и 15 содержат 250 и 500 нг соответственно белка клеточного лизата от S. cerevisiae-трансформанта, продуцирующего ORF0657nG (SEQ ID NO:44). Дорожка 17 содержит 250 нг белка клеточного лизата от E.coli, продуцирующей ORF0657nG (SEQ ID NO:44 плюс карбокси-концевую His-метку). Дорожки 4, 6, 10, 13 и 16 являются пустыми.
На фиг.10 представлены данные, демонстрирующие, что ORF0657n-родственные полипептиды, продуцированные в E.coli и в дрожжах, вызывают защитный иммунный ответ. Обозначение "ORF0657nН (E.coli)" соответствует последовательности SEQ ID NO:4 с карбокси-концевой His-меткой. Обозначение "ORF0657nI (E.coli)" соответствует последовательности SEQ ID NO:5 с карбокси-концевой His-меткой. Обозначение "ORF0657nС (E.coli)" соответствует последовательности SEQ ID NO:28. Обозначение "ORF0657nН (дрожжи)" соответствует последовательности SEQ ID NO:3.
На фиг.11 проиллюстрирован Вестерн-блот-анализ для сравнения внутриклеточной экспрессии ORF0657nI в S. cerevisiae. Дорожки 1 и 25, стандарты молекулярной массы. Дорожки 2, 3 и 24: 25, 50 и 100 нг соответственно очищенной области полипептида ORF0657nН (SEQ ID NO:4 с карбокси-концевой His-меткой), продуцированного в E.coli. Дорожки 4-23 содержат белок клеточных лизатов от дрожжевых трансформантов. Дорожки 13-21 представляют дубликаты клеточных лизатов, полученных из того же самого ферментированного образца, как и лизаты на дорожках 4-12. Дорожки 4 и 13 содержат 200 нг белка контрольного векторного трансформанта, содержащего рGAL110. Дорожки 5 и 14 содержат 100 нг белка от трансформанта 1-1, продуцирующего область ORF0657nН (SEQ ID NO:3). Дорожки 6 и 15 содержат 200 нг белка от трансформанта 1-1. Дорожки 7 и 16 содержат 100 нг белка, а дорожки 8 и 17 содержат 200 нг белка от трансформанта I1. Дорожки 9 и 18 содержат 100 нг белка, а дорожки 10 и 19 содержат 200 нг белка трансформанта I2. Дорожки 11 и 20 содержат 100 нг белка, а дорожки 12 и 21 содержат 200 нг белка от трансформанта I3. Дорожки 22 и 23 содержат 100 и 200 нг белка клеточного лизата, полученного ранее путем предварительной ферментации трансформанта 1-1.
На фиг.12 приводятся данные иммунизации макак-резусов. Макак-резусов иммунизировали либо продуцируемым в дрожжах ORF0657n-родственным полипептидом (ORF0657nН, SEQ ID NO:3), либо экспрессируемым в E.coli ORF0657n-родственным полипептидом (полноразмерным полипептидом ORF0657nС, SEQ ID NO:28), приготовленными в АНР или без него. Обезьянам, входящим в группу вакцинации, внутримышечно вводили 50 мкг ORF0657n-родственных полипептидов.
Подробное описание изобретения
Было обнаружено, что ORF0657n-родственные полипептиды, включая полноразмерные и более короткие производные, содержащие область ORF0657nI, вызывают у животных-моделей защитный иммунитет против S. aureus. На фиг.1А показана локализация различных ORF0657n-родственных полипептидных областей, вызывающих защитный иммунитет против инфекции, вызываемой S. aureus, а также локализация областей, которые не вызывают защитного иммунитета. На фиг.1А ORF0657n означает полноразмерную последовательность, соответствующую SEQ ID NO:2; ORF0657nI означает область, соответствующую SEQ ID NO:1 (без амино-концевого метионина), а ORF0657nН означает область, соответствующую SEQ ID NO:3 (без амино-концевого метионина).
"ORF0657n-родственный" полипептид содержит область, которая является структурно родственной полноразмерному ORF0657n или его фрагменту. ORF0657n-родственные полипептиды представляют собой полипептиды, последовательность которых по крайней мере примерно на 90% идентична последовательности соответствующей области природного ORF0657n. Сравниваемый полипептид ORF0657n, показанный на фиг.1, соответствует полипептиду ORF0657n, происходящему от COL S. aureus (SEQ ID NO:2).
Процент идентичности сравниваемой последовательности определяют путем выравнивания данной полипептидной последовательности со сравниваемой последовательностью и определения числа идентичных аминокислот. Это число делят на общее число аминокислот в сравниваемых последовательностях, а затем результат умножают на 100 и округляют до ближайшего целого числа.
Фиг.1А позволяет проиллюстрировать важное значение коровой области, содержащей аминокислотную последовательность, структурно родственную последовательности SEQ ID NO:1. SEQ ID NO:1 содержит аминокислоты 42-486 ORF0657n COL. SEQ ID NO:1 также содержит амино-концевой метионин для облегчения экспрессии. Полипептидные фрагменты, состоящие из аминокислот 461-609, аминокислот 82-486 или аминокислот 42-196 SEQ ID NO:2, не являются защитными.
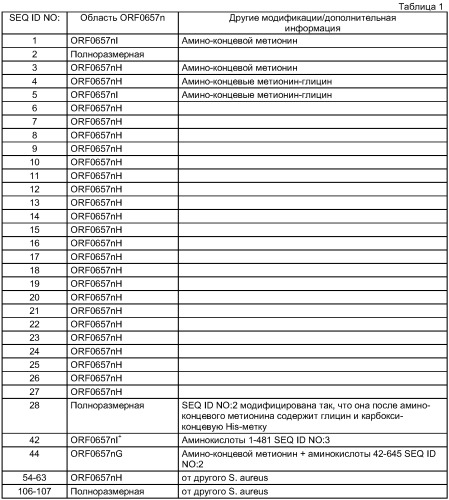
В описании настоящей заявки приводятся и другие аминокислотные последовательности и последовательности нуклеиновых кислот. В таблице 1 систематизированы некоторые полипептидные последовательности с указанием области, показанной на фиг.1, и дополнительных модификаций. В таблице 2 в систематизированном виде представлены некоторые последовательности нуклеиновых кислот.
SEQ ID NO:1 Родственные полипептиды
Полипептидная область, структурно родственная SEQ ID NO:1, содержит аминокислоту по крайней мере на 90% идентичную последовательности SEQ ID NO:1. Полипептиды, содержащие область, структурно родственную SEQ ID NO:1, могут быть сконструированы в соответствии с настоящим изобретением, в результате чего могут быть получены полипептиды, вызывающие защитный ответ против S. aureus.
С использованием SEQ ID NO:1 в качестве основы и принимая во внимание аминокислотную последовательность различных природных полипептидов ORF0657n и известные свойства аминокислот, могут быть созданы различные модификации. Такими модификациями являются одно или несколько из добавлений, делеций и/или замен. Общий эффект различных модификаций может быть оценен описанными здесь методами для подтверждения способности конкретного полипептида вызывать защитный иммунитет.
Было обнаружено, что ORF0657n является достаточно консервативным по всей совокупности патологически и таксономически отличающихся клинических изолятов S. aureus. (см. ниже, пример 5). На фиг.2 проиллюстрировано сравнение различных аминокислотных последовательностей, содержащих SEQ ID NO:1. Сравнение этих последовательностей представлено для области ORF0657nН. Область ORF0657nН включает меньшую по размеру защитную область ORF0657nI.
На фиг.2 приводится сравнение последовательностей SEQ ID NO:1 и 3-27. Это сравнение иллюстрирует различие между аминокислотными последовательностями клинических изолятов S. aureus, которые могут быть использованы для внесения потенциальных модификаций в полипептиды, родственные полипептидам S. aureus, таким как SEQ ID NO:1 и 3. Кроме того, такие модификации могут быть внесены с учетом известных свойств аминокислот. Последовательности SEQ ID NO:1, 3-6 и 8-26 являются природными последовательностями, в которые, начиная с положения 3, а в некоторых последовательностях, с положений 1 и 2 со стороны амино-конца были введены метионин или метионин-глицин. Последовательности SEQ ID NO:11-26 были получены из различных клинических изолятов. SEQ ID NO:7 и 27 представляют собой варианты области ORF0657nН SEQ ID NO:4, которая содержит пять аминокислотных замен в области, расположенной за пределами коровой области SEQ ID NO:1.
При сравнении последовательностей, проводимом для поиска нужных модификаций, могут быть использованы дополнительные последовательности ORF0657n. Примеры дополнительных последовательностей областей ORF0657nН S. aureus представлены в SEQ ID NO:54-63, а полноразмерные последовательности SEQ ID NO:17 и 20 представлены в SEQ ID NO:106 и 107.
В общих чертах, для сохранения активности при заменах различных аминокислот предпочтительно, чтобы заменяемые аминокислоты имели аналогичные свойства. При замене аминокислот следует учитывать такие факторы, как размер, заряд, полярность и гидрофобность аминокислот. Влияние различных аминокислотных R-групп на свойства аминокислот хорошо известно специалистам (см., например, Ausubel, Current Protocols in Molecular Biology, John Wiley, 1987-2002, Appendix IC).
Для сохранения активности при замене аминокислот заменяемая аминокислота должна иметь одно или несколько свойств, аналогичных свойствам замененной аминокислоты, она должна иметь примерно такой же заряд, и/или размер, и/или такую же полярность, и/или гидрофобность. Так, например, хорошими кандидатами на замену, которая не приводит к изменению функции полипептида, являются замены лейцина на валин, лизина на аргинин и глутамина на аспарагин.
Модификациями, вносимыми для достижения конкретной цели, являются модификации, создаваемые для стимуляции продуцирования или повышения эффективности данного полипептида или для клонирования кодирующей нуклеиновой кислоты. Продуцирование полипептида может быть стимулировано с использованием инициирующего кодона (например, кодирующего метионин), подходящего для рекомбинантной экспрессии. Такой метионин может быть затем удален во время клеточного процессинга. Процесс клонирования может быть облегчен, например, путем введения рестрикционных сайтов, которое может быть осуществлено вместе с добавлением или заменой аминокислот.
Эффективность индуцирования иммунного ответа полипептидом может быть увеличена путем "усиления" эпитопа. Усиление эпитопа может быть осуществлено различными методами, такими как введение модификаций якорных остатков для повышения аффинности пептида по отношению к молекулам МНВ и увеличения аффинности комплекса "пептид-МНС" по отношению к Т-клеточному рецептору (Berzofsky et al., Nature Review 1:209-219, 2001).
Что касается области полипептида, родственной последовательности SEQ ID NO:1, то в различных вариантах осуществления изобретения эта область по крайней мере на 90%, по крайней мере на 94% или по крайней мере на 99% идентичная последовательности SEQ ID NO:1 и отличается от последовательности SEQ ID NO:1 модификациями, число которых может составлять 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 или до 50, либо указанная область состоит или, в основном, состоит из ORF0657nI-родственной области, выбранной из группы, состоящей из:
аминокислот 1-442 SEQ ID NO:11, 15, 16, 18 или 54;
аминокислот 1-443 SEQ ID NO:63,
аминокислот 1-444 SEQ ID NO:57 или 59,
аминокислот 1-445 SEQ ID NO:7, 8, 9, 10, 12, 13, 14, 17, 19, 20, 55, 56 или 58,
аминокислот 1-446 SEQ ID NO:23 или 24,
аминокислот 1-446 или 2-446 SEQ ID NO:1 или 3,
аминокислот 1-447 SEQ ID NO:25 или 26,
аминокислот 1-447, 2-447 или 3-447 SEQ ID NO:4, 5 или 27,
аминокислот 1-449 SEQ ID NO:61 или 62,
аминокислот 1-453 SEQ ID NO:60 и
аминокислот 1-454 SEQ ID NO:6, 21 или 22.
Термин "в основном, состоит" из указанных аминокислот означает, что помимо указанных аминокислот могут также присутствовать дополнительные аминокислоты. Такими дополнительными аминокислотами могут быть аминокислоты, находящиеся у карбокси- или у амино-конца. В различных вариантах настоящего изобретения могут присутствовать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дополнительных аминокислот. В предпочтительных вариантах изобретения у амино-конца присутствует метионин либо метионин-глицин.
В одном из вариантов настоящего изобретения указанный полипептид состоит из аминокислотной последовательности, которая по крайней мере на 90% идентична последовательности SEQ ID NO:42 или ее фрагменту, содержащему аминокислотную последовательность, структурно родственную последовательности SEQ ID NO:1. Что касается SEQ ID NO:42, то в других вариантах настоящего изобретения указанный полипептид по крайней мере на 94% или по крайней мере на 99% идентичен SEQ ID NO:42 и отличается от SEQ ID NO:42 модификациями, число которых может составлять 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 или до 50 или до 65, либо указанный полипептид состоит или, в основном, состоит из SEQ ID NO:42 или ORF0657nI+-родственной области, выбранной из группы, состоящей из:
аминокислот 1-477 SEQ ID NO:11, 15, 16, 18 или 54;
аминокислот 1-478 SEQ ID NO:63,
аминокислот 1-479 SEQ ID NO:57 или 59,
аминокислот 1-480 SEQ ID NO:7, 8, 9, 10, 12, 13, 14, 17, 19, 20, 55, 56 или 58,
аминокислот 1-481 SEQ ID NO:23 или 24,
аминокислот 1-481 или 2-481 SEQ ID NO:1 или 3,
аминокислот 1-482 SEQ ID NO:25 или 26,
аминокислот 1-482, 2-482 или 3-482 SEQ ID NO:4, 5 или 27,
аминокислот 1-484 SEQ ID NO:61 или 62,
аминокислот 1-488 SEQ ID NO:60 и
аминокислот 1-489 SEQ ID NO:6, 21 или 22.
В другом варианте осуществления настоящего изобретения указанный полипептид состоит из аминокислотной последовательности, которая по крайней мере на 90% идентична последовательности SEQ ID NO:3 или ее фрагменту, содержащему аминокислотную последовательность, структурно родственную последовательности SEQ ID NO:1. Что касается SEQ ID NO:3, то в других вариантах настоящего изобретения указанный полипептид по крайней мере на 94% или по крайней мере на 99% идентичен SEQ ID NO:3; отличается от SEQ ID NO:3 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или 25 модификациями, или 50 модификациями, или 65 модификациями либо состоит или, в основном, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 3, 4, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 54, 55, 56, 57, 58, 59, 60, 61, 62 и 63.
В другом варианте изобретения указанный полипептид состоит или, в основном, состоит из полипептида SEQ ID NO:2, модифицированного путем включения глицина после инициирующего метионина, или из указанного полипептида без инициирующего метионина.
В другом варианте изобретения таким полипептидом является очищенный полипептид. Термин "очищенный полипептид" означает, что этот полипептид присутствует в окружении, не содержащем одного или нескольких других полипептидов, с которыми он обычно ассоциирован в природе, и/или содержащем другие полипептиды в количестве, составляющем по крайней мере примерно 10% от общего присутствующего белка. В других вариантах изобретения очищенный полипептид составляет по крайней мере примерно 50%, по крайней мере примерно 75% или по крайней мере примерно 95% от общего белка, присутствующего в образце или в препарате.
В другом варианте изобретения указанный полипептид является "в основном, очищенным". "В основном, очищенным" является полипептид, который присутствует в окружении, не содержащем всех или большинства других полипептидов, с которыми он обычно ассоциирован в природе. Так, например, в основном, очищенный полипептид S. aureus присутствует в окружении, не содержащем всех или большинства других полипептидов S. aureus. Таким окружением может быть, например, образец или препарат.
Термин "очищенный" или "в основном, очищенный" не означает, что данный полипептид должен быть подвергнут любой очистке; так, например, он может представлять собой химически синтезированный полипептид, который не был очищен.
Стабильность полипептида может быть увеличена путем модификации карбоксильного или амино-конца полипептида. Примерами возможных модификаций является введение амино-концевых защитных групп, таких как ацетил, пропил, сукцинил, бензил, бензилоксикарбонил или трет-бутилоксикарбонил, и карбокси-концевых защитных групп, таких как амид, метиламид и этиламид.
В одном из вариантов настоящего изобретения защитный полипептид является частью иммуногена, состоящего из полипептида и одной или нескольких дополнительных областей или частей, ковалентно присоединенных к полипептиду у карбоксильного конца или у амино-конца. Каждая область или часть должна быть независимо выбрана из области или части, обладающей по крайней мере одним из нижеследующих свойств: способности усиливать иммунный ответ, способности облегчать очистку или способности повышать стабильность полипептидов. Стабильность полипептида может быть увеличена, например, с использованием таких групп, как полиэтиленгликоль, который может присутствовать у амино-конца или у карбоксильного конца.
Очистка полипептида может быть облегчена путем присоединения к карбоксильному концу или к амино-концу группы, способствующей облегчению очистки. Примерами групп, которые могут быть использованы для облегчения очистки, являются полипептиды, представляющие собой аффинные метки. Примерами таких аффинных меток являются метка из шести гистидинов, trpE, глутатион и белок, связывающийся с мальтозой.
Способность полипептида продуцировать иммунный ответ может быть усилена с использованием групп, которые обычно стимулируют иммунный ответ. Примерами групп, которые могут быть присоединены к полипептиду для усиления иммунного ответа против указанного полипептида, являются такие цитокины, как IL-2 (Buchan et al., 2000, Molecular Immunology 37:545-552).
Продуцирование полипептидов
Полипептиды могут быть получены стандартными методами, включая методы химического синтеза полипептидов и методы их очистки из клетки, продуцирующей эти полипептиды. Методы химического синтеза полипептидов хорошо известны специалистам (см., например, Vincent, Peptide and Protein Drug Delivery, New York, N.Y., Decker, 1990).
Способы очистки полипептида из клетки проиллюстрированы в примерах, описанных ниже. Другие примеры методов очистки хорошо известны специалистам (см., например, Ausubel, Current Protocols in Molecular Biology, John Wiley, 1987-2002).
Выделение полипептидов из клетки может быть осуществлено с использованием техники рекомбинантных нуклеиновых кислот для продуцирования полипептидов. Техника рекомбинантных нуклеиновых кислот, применяемая для продуцирования полипептида, предусматривает введение в клетку или продуцирование в этой клетке рекомбинантного гена, кодирующего полипептид, и экспрессию данного полипептида.
Рекомбинантный ген содержит нуклеиновую кислоту, кодирующую полипептид вместе с регуляторными элементами для экспрессии полипептида. Рекомбинантный ген может присутствовать в клеточном геноме, либо он может быть частью экспрессирующего вектора.
Регуляторными элементами, которые могут присутствовать как часть рекомбинантного гена, являются элементы, обычно ассоциированные с последовательностью, кодирующей данный полипептид, и экзогенные регуляторные элементы, которые обычно не ассоциированы с последовательностью, кодирующей этот полипептид. Экзогенные регуляторные элементы, такие как экзогенный промотор, могут быть использованы для экспрессии рекомбинантного гена в конкретном хозяине или для повышения уровня его экспресси