Способ продуцирования l-лизина или l-треонина с помощью бактерий escherichia, имеющих аттенуированную активность малеинового фермента
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ продуцирования L-лизина или L-треонина, включающий культивирование бактерии в среде для продуцирования и секреции L-лизина или L-треонина, сбор и выделение L-лизина или L-треонина из среды. При этом указанная бактерия представляет собой бактерию Escherichia, которая обладает способностью продуцировать L-лизин или L-треонин, при этом указанная бактерия модифицирована так, что нарушена нормальная функция малеинового фермента в клетке, при этом малеиновый фермент кодируется геном sfcA и/или геном b2463. Изобретение позволяет получать L-лизин или L-треонин с высокой степенью эффективности. 11 з.п. ф-лы, 4 ил., 11 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу продуцирования L-лизина или L-треонина с помощью бактерии Escherichia. L-лизин и L-треонин, как известно, являются незаменимыми аминокислотами и используются в качестве компонентов в фармацевтических композициях и различных питательных смесях, таких как пищевые добавки и животные корма.
Предшествующий уровень техники
L-аминокислоты, такие как L-треонин и L-лизин, производят в промышленных масштабах путем ферментации с использованием продуцирующих L-аминокислоты бактерий, таких как коринебактерии или бактерий Escherichia, которые обладают способностью продуцировать L-аминокислоты. Для повышения продуктивности в качестве бактерии, продуцирующей L-аминокислоты, используют выделенный природный штамм, его мутант, полученный искусственным путем, или рекомбинант, у которых активность фермента биосинтеза L-аминокислот усилена в результате генной рекомбинации. Способ продуцирования L-лизина описан в патентах 1-4. Способ продуцирования L-треонина описан в патентных документах 5-8.
К способам усиления способности продуцирования аминокислот, таких как L-треонин и L-лизин, относится способ усиления энергетической эффективности путем модификации пути дыхательной цепи (патентный документ 13) и способ усиления способности вырабатывать никотинамидадениндинуклеотидфосфат путем амплификации никотинамиднуклеотидтрансдегидрогеназы (патентный документ 9), а также способ повышения уровня экспрессии фермента эндогенного биосинтетического пути.
Кроме того, известны способы модификации общих путей систем биосинтеза аминокислот, которые включают модификацию анаплеротических путей продуцирующих L-аминокислоты бактерий, таких как продуцирующая L-лизин коринебактерия, в которой усилена активность пируваткарбоксилазы (патентный документ 10), продуцирующая L-лизин бактерия Escherichia, дефектная по пируваткиназе (патентный документ 11), и продуцирующая L-лизин коринебактерия, дефектная по малатхининоксидоредуктазе (патентный документ 12).
Малеиновый фермент является одним из ферментов анаплеротического пути. Известно, что у бактерий Escherichia каждый из генов sfcA и b2463 кодируетмалеиновый фермент(непатентный документ 9). Однако независимо от снижения активности малеиновых ферментов, кодируемых генами sfcA и b2463, об эффективности усиления продуцирования L-лизина или L-треонина не сообщалось.
Анализ метаболического потока, также названный как анализ баланса потока, является методом предсказания распределений внутриклеточного метаболического потока путем конструирования стехиометрической модели внутриклеточных биохимических реакций и линейной оптимизации. Этот метод применяется для изучения возможностей систем биохимических реакций микроорганизмов или для предсказания распределений внутриклеточного метаболического потока при различных внешних условиях (непатентные документы 1, 2 и 3). Также имеются сообщения о конструировании стехиометрической модели для Escherichia coli (непатентные документы 4 и 5). Также известен пример использования такой стехиометрической модели в метаболической инженерии продуцирования лизина, разработанной для Corynebacterium glutamicum и используемой в производстве аминокислот (непатентный документ 6). Кроме того, имеются сообщения о большом числе теоретических и экспериментальных методов анализа метаболического потока и их применения (непатентные документы 7 и 8, патентные документы 14, 15 и 16). В патентном документе 14 описывают способ предсказания гена, необходимого для роста на основе стехиометрической модели. В патентном документе 15 описывают метод генетического и эволюционного изменения клеток с целью придания им оптимальных функций в клетках. Далее в патентном документе 16 представляют способ применения ограничений качественной кинетической информации, ограничений качественной контрольной информации и ограничений, основанных на экспериментальных данных, полученных на ДНК-микрочипах, в различных условиях стехиометрической модели. Хотя все они являются способами предсказания более желательных распределений внутриклеточного метаболического потока, не разработали способ теоретического предсказания специфического потока как мишени направленного усиления продуцирования клеточного вещества.
<Патентный документ 1>
Выложенная заявка на патент Японии № 10-165180
<Патентный документ 2>
Выложенная заявка на патент Японии № 11-192088
<Патентный документ 3>
Выложенная заявка на патент Японии № 2000-253879
<Патентный документ 4>
Выложенная заявка на патент Японии № 2001-57896
<Патентный документ 5>
Выложенная заявка на патент Японии № 5-304969
<Патентный документ 6>
Международная публикация № WO98/04715
<Патентный документ 7>
Выложенная заявка на патент Японии № 5-227977
<Патентный документ 8>
Опубликованная заявка на патент США № 2002/0110876
<Патентный документ 9>
Патент Японии № 2817400
<Патентный документ 10>
Выложенная заявка на патент Японии № 2002-508921
<Патентный документ 11>
Международная публикация № WO03/008600
<Патентный документ 12>
Опубликованная заявка на патент США № 2003/0044943
<Патентный документ 13>
Выложенная заявка на патент Японии № 2002-17363
<Патентный документ 14>
Международная публикация № WO00/46405
<Патентный документ 15>
Международная публикация № WO02/061115
<Патентный документ 16>
Международная публикация № WO02/055995
<Непатентный документ 1>
Varma A. and Palsson B.O. Appl. Environ. Microbiol. 60:3724-3731, 1994
<Непатентный документ 2>
Schilling C.H. et al., Biotechnol. Prog., 15:288-295, 1999
<Непатентный документ 3>
Schilling C.H. et al., Biotechnol. Prog., 15:296-303, 1999
<Непатентный документ 4>
Pramanik J. and Keasling J.D., Biotechnol. Bioeng., 56:398-421, 1997
<Непатентный документ 5>
Ibarra R.U. et al., Nature, 420:186-189, 2002
<Непатентный документ 6>
Vallino J.J. and Stephanopoulos G., Biotechnol. Bioeng., 41:633-646, 1993
<Непатентный документ 7>
Wiechert W., Journal of Biotechnology, 94:37-63, 2002
<Непатентный документ 8>
Wiechert W., Metabolic Engineering, 3:195-205, 2001
<Непатентный документ 9>
van der Rest M.E., Frank C., Molenaar D.J., J. Bacteriol., 182(24):6892-6899, 2000
Описание изобретения
В настоящем изобретении предлагается бактерия Escherichia, которая имеет улучшенную способность продуцирования L-лизина или L-треонина, и способ продуцирования L-лизина или L-треонина с помощью бактерии.
Авторы настоящего изобретения для решения проблемы провели тщательное исследование и в результате установили, что производительность метаболического потока, влияющего на продуцирование вещества, может быть определена путем: 1) выбора определенного числа свободных потоков как степени свободы стехиометрической матрицы, рассчитанной по формулам биохимических реакций на субстрате для продуцируемого желательного вещества; 2) расчета распределений метаболического потока на основе выборки случайных комбинаций свободных потоков, достаточной для статистического анализа, основанного на стехиометрической матрице; 3) получения уравнения регрессии, включающего минимальное число свободных потоков, которое коррелирует с продуцированием вещества по рассчитанным распределениям метаболического потока на основе статистического анализа.
Определение метаболических потоков бактерии, продуцирующей L-лизин или L-треонин, с помощью этого способа показало, что модификация, нарушающая нормальную функцию малеинового фермента, вызывает увеличение продуктивности бактерии. Настоящее изобретение выполнено на основе вышеупомянутых данных и предлагает следующее:
1) бактерию Escherichia, которая имеет способность продуцировать L-лизин или L-треонин, и где указанная бактерия модифицирована так, что нарушена нормальная функция малеинового фермента в клетке;
2) бактерию по (1), где ген, кодирующий указанный малеиновый фермент на бактериальной хромосоме, является мутированным и/или мутированной является последовательность, контролирующая экспрессию этого гена, что нарушает нормальную функцию малеинового фермента в клетке;
3) бактерию по (1), где указанный малеиновый фермент не обладает нормальной функцией в результате нарушения гена, кодирующего указанный малеиновый фермент на бактериальной хромосоме;
4) бактерию по (1), где ген, кодирующий указанный малеиновый фермент, содержит sfcA;
5) бактерию по (1), где ген, кодирующий указанный малеиновый фермент, содержит b2463;
6) бактерию по (1), где указанный малеиновый фермент выбран из группы, содержащей:
А) белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:6;
и
B) белок, который имеет аминокислотную последовательность, содержащую замещение, делецию, инсерцию или добавление одного или нескольких аминокислотных остатков в аминокислотную последовательность, представленную в SEQ ID NO:6, и имеет активность малеинового фермента;
7) бактерию по (1), где указанный малеиновый фермент выбран из группы, содержащей:
С) белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:8;
и
D) белок, который имеет аминокислотную последовательность, содержащую замещение, делецию, инсерцию или добавление одного или нескольких аминокислотных остатков в аминокислотную последовательность, представленную в SEQ ID NO:8, и имеет активность малеинового фермента;
8) бактерию по (1), где геном, кодирующим указанный малеиновый фермент, является ДНК, выбранная из группы, содержащей:
а) ДНК, имеющую нуклеотидную последовательность, представленную в SEQ ID NO:5;
b) ДНК, которая гибридизируется с нуклеотидной последовательностью, представленной в SEQ ID NO:5, или зонд, который может быть получен из нуклеотидной последовательности, где указанная гибридизация проходит в жестких условиях и где указанная ДНК кодирует белок, имеющий активность малеинового фермента;
9) бактерию по (1), где геном, кодирующим малеиновый фермент, является ДНК, выбранная из группы, содержащей:
c) ДНК, имеющую нуклеотидную последовательность, представленную SEQ ID NO:7;
и
d) ДНК, которая гибридизируется с нуклеотидной последовательностью, представленной в SEQ ID NO:7, или зонд, который может быть получен из нуклеотидной последовательности, где указанная гибридизация проходит в жестких условиях и где указанная ДНК кодирует белок, имеющий активность малеинового фермента;
10) способ продуцирования L-лизина или L-треонина, включающий культивирование бактерии, как определено в любом из (1)-(9), в среде, обеспечивающей продуцирование и секрецию указанных L-лизина или L-треонина, и сбор и выделение L-лизина или L-треонина из среды.
Краткое описание чертежей
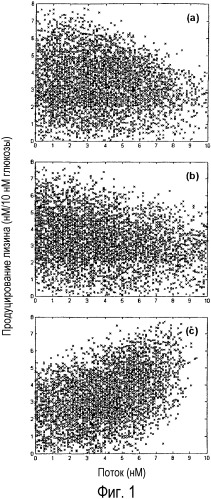
Фиг. 1. График продуцирования лизина как функции различных значений свободных потоков посредством использования набора данных 5000 случайных распределений потоков. Выход лизина показан для: а) потока изоцитратлиазы; b) потока малеинового фермента; c) потока PEP-карбоксилазы.
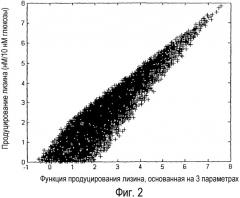
Фиг. 2. График продуцирования лизина как функции величин уравнения 2 для набора данных 5000 случайных распределений потоков. Исходной величиной является поток, выраженный в нм/ч, в расчете на 10 нм/ч потока глюкозы.
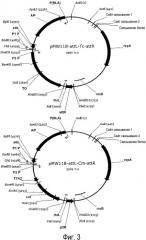
Фиг. 3. Представлена структура плазмид pMW118-attL-Tc-attR и pMW118-attL-Cm-attR.
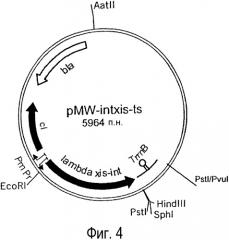
Фиг. 4. Представлена структура плазмиды pMW-intxis-ts.
Лучший способ выполнения изобретения
Далее настоящее изобретение будет объяснено детально.
<I> Бактерия Escherichia настоящего изобретения
Бактерия Escherichia настоящего изобретения является бактерией, принадлежащей к роду Escherichia, которая обладает способностью продуцировать L-лизин или L-треонин и которая модифицирована так, что нарушена нормальная функция малеинового фермента. Бактерия Escherichia настоящего изобретения может иметь способность продуцировать либо L-лизин, либо L-треонин либо может иметь способность продуцировать как L-лизин, так и L-треонин.
Родительский штамм, принадлежащий к роду Escherichia, который использовали для получения бактерии Escherichia настоящего изобретения, включает, но не ограничиваясь ими, штаммы, описанные в книге Neidhardt с сотр. (Neidhardt F.C. с сотр., Escherichia coli and Salmonella Typhimurium, American Society for Microbiology, Washington D. C., 1029, таблица 1). Например, родительским штаммом может быть Escherichia coli. Escherichia coli может быть штаммом W3110 Escherichia coli (ATCC 27325) или штаммом MG1655 Escherichia coli (ATCC 47076), которые оба получены из прототипного штамма K12 дикого типа.
Эти штаммы можно получить, например, из Американской коллекции типовых культур (Адрес: 12301 Parklawn Drive, Rockville, Maryland 20852, United States of America). Штаммам даны соответствующие регистрационные номера. Существует возможность затребовать желательный штамм по его регистрационному номеру. Регистрационные номера, которые соответствуют штаммам, представлены в каталоге Американской коллекции типовых культур.
<1>-1. Придание способности продуцировать L-лизин или L-треонин
Ниже представлен способ придания бактерии Escherichia способности продуцировать L-лизин или L-треонин. Фраза «способность продуцировать L-лизин», как использовано в данном описании, означает способность продуцировать и вызывать накопление или секрецию L-лизина в среде, например, свободного внеклеточного L-лизина, при культивировании бактерии в среде. В частности, фраза «способность продуцировать L-лизин» означает способность вызывать накопление большего количества L-лизина по сравнению с диким типом или родительским штаммом.
Фраза «способность продуцировать L-треонин», как использовано в данном описании, означает способность продуцировать и вызывать накопление или секрецию L-треонина в среде, например, свободного внеклеточного L-треонина, при культивировании бактерии в среде. В частности, эта фраза означает способность вызывать накопление большего количества L-треонина по сравнению с диким типом или родительским штаммом.
Для придания способности продуцировать L-лизин или L-треонин могут быть использованы стандартные способы селекции бактерий Escherichia и коринебактерий, такие как способы получения ауксотрофных мутантных штаммов, штаммов, резистентных к аналогам, или штаммов, мутантных по метаболическому контролю, которые обладают способностью продуцировать L-лизин или L-треонин, и способы продуцирования рекомбинантных штаммов, в которых усилены активности ферментов биосинтеза L-лизина или L-треонина. В селективных бактериях, продуцирующих L-лизин или L-треонин, такие характеристики, как ауксотрофность, резистентность к аналогам и мутации метаболического контроля, могут быть получены по отдельности или в комбинации.
Усиленная активность ферментов биосинтеза L-лизина или L-треонина может быть представлена по отдельности или в комбинации. Далее, получение таких характеристик, как ауксотрофность, резистентность к аналогам и мутации метаболического контроля, может быть комбинировано с усилением активности ферментов биосинтеза L-лизина или L-треонина.
Варианты способов придания или усиления способности продуцировать L-лизин или L-треонин путем усиления активности ферментов биосинтеза L-лизина или L-треонина описаны ниже. Усиление ферментативной активности может быть осуществлено путем, например, введения мутации в ген, кодирующий фермент, или амплификации гена с целью усиления внутриклеточной активности фермента. Это же может быть осуществлено посредством генной рекомбинации.
Гены, кодирующие ферменты биосинтеза L-треонина, включают, но не ограничиваясь ими, ген аспартокиназы III (lysC), ген аспартатполуальдегиддегидрогеназы (asd), аспартокиназу I, кодируемую опероном thr (thrA), ген гомосеринкиназы (thrB), ген треонинсинтазы (thrC). Сокращенное условное обозначение гена показано в круглых скобках. В штамм могут быть введены два или более этих генов. Ген фермента биосинтеза L-треонина может быть введен в бактерию Escherichia, в которой супрессировано расщепление треонина. Примером бактерии Escherichia, в которой супрессировано расщепление треонина, служит штамм TDH6, который является дефектным по активности треониндегидрогеназы (Выложенная заявка на патент Японии № 2001-346578).
Гены, кодирующие ферменты биосинтеза L-лизина, включают, но не ограничиваясь ферментами пути диаминопимелата, такие гены, как ген дигидродипиколинатсинтазы (dapA), ген аспартокиназы (lysC), ген дигидродипиколинатредуктазы (dapB), ген диаминопимелатдекарбоксилазы (lysA), ген диаминопимелатдегидрогеназы (ddh), (все вышеприведенные; Международная публикация № 96/40934), ген фосфоенолпируваткарбоксилазы (ppc) (Выложенная заявка на патент Японии № 60-87788), ген аспартатаминотрансферазы (aspC) (Опубликованная заявка на патент Японии № 6-102028), ген диаминопимелатэпимеразы (dapF) (Выложенная заявка на патент Японии № 2003-135066), ген аспартатполуальдегиддегидрогеназы (asd) (Международная публикация № 00/61723) и ген ферментов пути аминоадипата, такой как ген гомоаконинтатгидратазы (Выложенная заявка на патент Японии № 2000-157276).
Кроме того, бактерия настоящего изобретения может иметь сниженную активность фермента, который катализирует реакцию генерирования соединения, отличающегося от L-лизина, путем ответвления от пути биосинтеза L-лизина или может быть дефектной по такому ферменту. Ферменты, которые катализируют реакцию генерирования соединения, отличающегося от L-лизина, путем ответвления от пути биосинтеза L-лизина, включают гомосериндегидрогеназу и лизиндекарбоксилазу. Штаммы, имеющие сниженные активности ферментов, описаны в патентах WO95/23864 и WO 96/178930.
Усиление активности фермента, кодируемого геном, может быть достигнуто, например, путем амплификации гена биосинтеза L-лизина или L-треонина с плазмидой, автономно реплицирующейся в бактериях Escherichia. Ген биосинтеза может быть интегрирован в бактериальную хромосому. Усиление активности также может быть достигнуто посредством введения гена, который содержит мутацию, вызывающую усиление активности фермента, кодируемого геном. Примерами такой мутации является мутация промоторной последовательности, вызывающей усиление уровня транскрипции гена, и мутация в кодирующей области гена, усиливающая специфическую активность ферментативного белка.
Помимо генной амплификации, как описано выше, экспрессия гена может быть усилена путем замещения последовательности, контролирующей экспрессию, такой как промотор гена на хромосомной ДНК или плазмиде, на функционально более сильную (Международная публикация № WO 00/18935). Сильные промоторы общеизвестны и включают, например, промотор lac, промотор trp, промотор trc, промотор tac и промотор PR бактериофага лямбда.Экспрессия гена может быть усилена путем замещения эндогенного промотора на либо хромосому, либо плазмиду, содержащую функционально более сильный промотор, или путем модификации эндогенного промотора. Модификация последовательности, контролирующей экспрессию, может быть комбинирована с повышением числа копий гена.
Примеры бактерий Escherichia, в которых способность продуцировать L-лизин или L-треонин является приобретенной и которые могут быть использованы в настоящем изобретении, приведены ниже. Однако бактерия настоящего изобретения не ограничена этими примерами, к ней относятся любые бактерии, способные продуцировать L-лизин или L-треонин.
Специфическими примерами штаммов, резистентных к аналогам, или штаммов, мутантных по метаболическому контролю, которые обладают способностью продуцировать L-лизин, являются Escherichia coli AJ11442 (FERM BP-1543, NRRL B-12185; Выложенная заявка на патент Японии № 56-18596 и Патент США № 4346170) и Escherichia coli VL611. Штамм WC196 может быть использован как продуцирующая L-лизин бактерия Escherichia coli (Международная публикация № WO96/17930). Штамм WC196 селектировали путем придания штамму W3110, полученному от штамма K-12 Escherichia coli, резистентности к AEC (S-(2-аминоэтил)цистеину). Этот штамм обозначили как Escherichia coli AJ13069 и депонировали в Национальном институте биологической науки и технологии человека, Агентство по промышленной науке и технике (в настоящее время Национальный институт передовой промышленной науки и технологии, Международная организация по хранению патентов, Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) от 6 декабря 1994 г. и присвоили инвентарный номер FERM P-14690. Его передали в международный депозитарий по условиям Будапештского соглашения от 29 сентября 1995 г. и присвоили инвентарный номер FERM BP-5252.
Примеры бактерий Escherichia, обладающих способностью продуцировать L-треонин, включают продуцирующий L-треонин мутантный штамм, который является резистентным к 6-диметиламинопурину (Выложенная заявка на патент Японии № 5-304969), рекомбинантные штаммы Escherichia coli, такие как штамм, в котором ген биосинтеза треонина, содержащий введенную мутацию, которая вызывает избыточное продуцирование фермента биосинтеза L-треонина, амплифицирован на плазмиде (Опубликованная заявка на патент Японии № 1-29559 и Выложенная заявка на патент Японии № 5-227977), штамм, в котором оперон треонина амплифицирован на плазмиде (Выложенная заявка на патент Японии № 2-109985), и штамм, в котором гены, кодирующие пируваткарбоксилазу и никотинамиднуклеотидтрансгидрогеназу, амплифицированы (Выложенная заявка на патент Японии № 2002-51787).
Escherichia coli VKPM B-3996 (Патент США № 5175107) также относится к настоящему изобретению. Штамм VKPM B-3996 депонировали в Российской национальной коллекции промышленных микроорганизмов (VKPM), ГНИИ Генетика) от 19 ноября 1987 г. и присвоили инвентарный номер VKPM B-3996. VKPM B-3996 содержит плазмиду pVIC40 (Международная публикация № WO 90/04636), которую получили путем введения генов биосинтеза треонина (треониновый оперон thrABC) в предназначенный для широкого круга хозяев вектор, например плазмиду pAYC32 (Chistoserdov A.Y., Tsygankov Y.D., Plasmid, 1986, 16, 161-167). В pVIC40 десенсибилизировано ингибирование обратной связи посредством L-треонина аспартокиназа I-гомосериндегидрогеназы I, кодируемой thrA в треониновом опероне.
Кроме того, Escherichia coli B-5318 (Патент Европы № 0593792) относится к настоящему изобретению. Штамм B-5318 депонировали в Российской национальной коллекции промышленных микроорганизмов (VKPM), ГНИИ Генетика) от 19 ноября 1987 г. и присвоили инвентарный номер VKPM B-5318. Штамм VKPM является прототрофным по отношению к изолейцину и содержит рекомбинантную плазмидную ДНК. Эту плазмида сконструирована так, что треониновый оперон, включающий гены биосинтеза треонина, содержит дефект в области аттенуации, например в эндогенной области регуляции транскрипции. Оперон расположен ниже температурочувствительного репрессора C1 фага лямбда, промотора PR и N-конца белка Cro и сконструирован таким образом, что экспрессия генов биосинтез треонина находится под контролем репрессора фага лямбда и промотора.
<2> Конструирование бактерии Escherichia настоящего изобретения
Бактерия Escherichia настоящего изобретения является бактерией, принадлежащей к роду Escherichia, которая обладает способностью продуцировать L-лизин или L-треонин и которая модифицирована так, что нарушена нормальная функция малеинового фермента.
В процессе селекции бактерия Escherichia настоящего изобретения либо приобретает способность продуцировать L-лизин или L-треонин, либо несет мутацию, нарушающую нормальную функцию малеинового фермента (EC 1.1.1.38, EC 1.1.1.40). Также бактерия Escherichia, обладающая способностью продуцировать L-лизин или L-треонин, может быть модифицирована так, что нарушена нормальная функция малеинового фермента, и способность продуцировать L-лизин или L-треонин может быть придана бактерии Escherichia, которая пока еще не имеет нормальной функции малеинового фермента.
Фраза «активность малеинового фермента» означает активность, которая катализирует обратимую реакцию продуцирования диоксида углерода и пирувата из малата. Известны малеиновые ферменты, которые используют НАД (EC 1.1.1.38) и НАДФ (EC 1.1.1.40) как коферменты. (EC 1.1.1.38 (S)-малат+НАД+=пируват+CO2+НАДН+H+) (EC 1.1.1.40 (S)-малат+НАДФ+=пируват+CO2+НАДФН+H+). Малеиновый фермент также называют «малатдегидрогеназа» или «малатоксидоредуктаза».
Фраза «модифицированный так, что нарушена нормальная функция малеинового фермента в клетке» означает, что он модифицирован так, что функция малеинового фермента должна быть элиминирована или активность малеинового фермента должна быть снижена или аттенуирована по сравнению с немодифицированным штаммом, таким как штамм дикого типа (родительский). Состоянием, когда нормальная функция малеинового фермента нарушена, может быть, например, состояние ингибирования транскрипции или трансляции гена, кодирующего малеиновый фермент, и, следовательно, его продукта, малеиновый фермент не продуцируется, или его продуцирование снижено, или состояние, когда ген, кодирующий малеиновый фермент на бактериальной хромосоме, мутирован, и/или мутирована последовательность, контролирующая экспрессию гена, и таким образом, активность малеинового фермента снижена или элиминирована. Типичным примером бактерии Escherichia, в которой нарушена функция малеинового фермента, является штамм, несущий разрушенный ген, в котором ген, кодирующий малеиновый фермент на бактериальной хромосоме, разрушен с помощью метода генетической рекомбинации, и мутантный штамм, в котором регулирующая экспрессию последовательность или кодирующая область гена малеинового фермента мутированы, и поэтому функциональный малеиновый фермент не продуцируется длительно.
Фраза «модифицированный так, что активность малеинового фермента аттенуирована» означает, что активность малеинового фермента снижена по сравнению с немодифицированным штаммом, например штаммом дикого типа (родительским) бактерии Escherichia. Предпочтительно активность малеинового фермента снижена не более чем на 50%, более предпочтительно не более чем на 30% и наиболее предпочтительно не более чем на 10% на клетку по сравнению с немодифицированным штаммом.
Примерами бактерии Escherichia, которая может действовать в качестве контроля, являются Escherichia coli W3110 (ATCC 27325) и Escherichia coli MG1655 (ATCC 47076). Эти штаммы дикого типа получены из прототипного штамма K12 дикого типа. Активность малеинового фермента с использованием НАД в качестве кофермента может быть определена по способу Korkes S. с сотр., (Korkes S. с сотр., (1950) J. Biol. Chem. 187, 891-905). Активность малеинового фермента с использованием в качестве кофермента НАДФ может быть определена по способу Ochoa S. (Ochoa S. с сотр., (1947) J. Biol. Chem. 167, 871-872).
Термин «аттенуация» включает, но не ограничиваясь этим, полную элиминацию активности. Каждая активность малеинового фермента с использованием в качестве коферментов НАД или НАДФ может быть аттенуированна индивидуально или совместно. В рамках настоящего изобретения достаточно, что бактерия Escherichia имеет аттенуированную активность малеинового фермента по сравнению со штаммом дикого типа или немодифицированным штаммом. Однако предпочтительно, если бактерия Escherichia настоящего изобретения также имеет усиленную способность вызывать накопление или секрецию L-лизина или L-треонина по сравнению со штаммом дикого типа или немодифицированным штаммом и/или улучшенную продуктивность L-лизина или L-треонина вследствие хорошего роста, главным образом за счет улучшенного выхода продукта за вычетом клеток.
Малеиновый фермент настоящего изобретения содержит белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:6 или 8. Малеиновый фермент может быть вариантом аминокислотной последовательности, представленной в SEQ ID NO:6 или 8, в которой он может содержать замещение, делецию, инсерцию или добавление одного или нескольких аминокислотных остатков в аминокислотной последовательности, представленной в SEQ ID NO:6 или 8, при условии, что он имеет активность малеинового фермента. Как использовано в данном описании, «нескольких» означает, например, 2-20, предпочтительно 2-10, более предпочтительно 2-5 аминокислотных остатков.
Замещение, делеция, инсерция или добавление одного или нескольких аминокислотных остатков должно быть консервативной мутацией(ями), с тем чтобы сохранялась активность малеинового фермента. Типичной консервативной мутацией является консервативное замещение. Примеры консервативных замещений включают: замещение Ser или Thr на Ala; замещение Gln, His или Lys на Arg; замещение Glu, Gln, Lys, His или Asp на Asn; замещение Asn, Glu или Gln на Asp; замещение Ser или Ala на Cys; замещение Asn, Glu, Lys, His, Asp или Arg на Gln; замещение Asn, Gln, Lys или Asp на Glu; замещение Pro на Gly; замещение Asn, Lys, Gln, Arg или Tyr на His; замещение Leu, Met, Val или Phe на Ile; замещение Ile, Met, Val или Phe на Leu; замещение Asn, Glu, Gln, His или Arg на Lys; замещение Ile, Leu, Val или Phe на Met; замещение Trp, Tyr, Met, Ile или Leu на Phe; замещение Thr или Ala на Ser; замещение Ser или Ala на Thr; замещение Phe или Tyr на Trp; замещение His, Phe или Trp на Tyr и замещение Met, Ile или Leu на Val.
Фраза «модифицированный так, что нарушена нормальная функция малеинового фермента в клетке» может означать снижение числа молекул малеинового фермента на клетку и снижение активности малеинового фермента на молекулу. В частности, модификация может быть проведена путем получения дефектов гена, кодирующего малеиновый фермент на бактериальной хромосоме, или путем модификации последовательности, контролирующей экспрессию, такой как промотор или последовательность Шайна-Дальгарно (SD). Также модификация может быть проведена путем введения замещения аминокислоты (миссенс-мутация) или стоп-кодона (нонсенс-мутация) в кодирующую область, или введения инсерции или делеции 1-2 оснований в кодирующую область (мутация сдвига рамки считывания), или делетирования части гена (Journal of Biological Chemistry 272:8611-8617(1997)).
Примером гена малеинового фермента (ген mez) на хромосоме является ген sfcA, поскольку его ДНК имеет нуклеотидную последовательность, представленную в SEQ ID NO:5. Эта ДНК кодирует фермент, который использует НАД в качестве кофермента. Другим примером является ген b2463, ДНК которого имеет нуклеотидную последовательность, представленную в SEQ ID NO:7. Эта ДНК кодирует фермент, который использует НАДФ в качестве кофермента.
Ген mez может быть ДНК, которая гибридизируется с нуклеотидной последовательностью, представленной в SEQ ID NO:5 или 7, или зондом, полученным из нуклеотидной последовательности в жестких условиях при условии, что он кодирует белок, который имеет активность малеинового фермента. «Жесткие условия» означают условия, при которых формируется специфический гибрид и неспецифический гибрид не формируется. Например, к жестким условиям относится однократное промывание, предпочтительно 2-3-кратное промывание при концентрации соли, соответствующей 1×SSC, 0,1% SDS, предпочтительно 0,1×SSC, 0,1% SDS при 60°C. Подходящая длина зонда может быть выбрана в зависимости от условий гибридизации, как правило, она составляет 100 п.н.-1 т.п.н.
Ген, кодирующий малеиновый фермент, (sfcA, b2643), может быть получен с помощью ПЦР с использованием в качестве матрицы хромосомы Escherichia coli и олигонуклеотидов, синтезированных на основе следующих последовательностей Escherichia coli, зарегистрированных в GenBank в качестве праймеров: sfcA: AAC74552. NAD-связанный малат...[gi:1787754], комплементарный AE000245.1:1208..2932, b2643: AAC75516, предположительно мультимодальный...[gi:1788806], комплементарный AE000333.1:141..2420.
Хромосомная ДНК может быть получена из бактерии для использования в качестве донорной ДНК посредством, например, способа Saito и Miura (ссылка на H. Saito и K. Miura, Biochem. Biophys. Acta, 72, 619 (1963), Text for Bioengineering Experiments, Edited by the Society for Bioscience and Bioengineering, Japan, pp.97-98, Baifukan, 1992) или т.п.
Ген sfcA или b2643, полученный, как описано выше, или его часть может быть использована для разрушения гена. Достаточным условием для гена, используемого для разрушения гена, является степень гомологии, позволяющая проводить гомологичную рекомбинацию генов sfcA или b2463 на хромосоме бактерии Escherichia. Поэтому может быть использован такой гомологичный ген. Степень гомологии, которая должна разрешать гомологичную рекомбинацию, предпочтительно составляет 70% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более и наиболее предпочтительно 95% или более. Также гомологичная рекомбинация может происходить, если используется ДНК, которая гибридизируется с геном в жестких условиях. «Жесткие условия» являются условиями, в которых формируется специфический гибрид и неспецифический гибрид не формируется. Например, к жестким условиям относится однократное промывание, предпочтительно 2-3-кратное промывание при концентрации соли, соответствующей 1×SSC, 0,1% SDS, предпочтительно 0,1×SSC, 0,1% SDS при 60°C.
Ген sfcA или b2463 может быть разрушен путем, например, получения из гена, как описано выше, гена sfcA или b2463 делеционного типа, в котором частичная последовательность делетирована так, что малеиновый фермент с нормальной функцией не продуцируется. Этим геном делетированного типа или ДНК, содержащей ген, затем может быть трансформирована бактерия Escherichia и вызвана рекомбинация между геном делетированного типа и геном на хромосоме. Разрушение гена посредством подставления гена с помощью гомологичной рекомбинации уже разработано и подтверждено примером с использованием линейной ДНК в способе, разработанном Datsenko К.А. и Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645), также названном как "Red-запускаемая интеграция", и способом, основанным на применении плазмиды, несущей температурочувствительную область инициации репликации (Патент США №6303383 и Выложенная заявка на патент Японии №5-7491). Разрушение гена посредством генного вычитания с помощью гомологичной рекомбинации также может быть выполнено посредством использования плазмиды, которая не обладает способностью к репликации в хозяине.
Кроме того, может быть использован способ, основанный на комбинации способа, названного «red-запускаемая интеграция», и эксцизионной системы, полученной из фага лямбда (J.Bacteriol. 2002 Sep; 184(18): 5200-3). Может быть использовано взаимодействие между интегразой и эксцизионазой в фаге лямбда, вырезающее нуклеопротеиновый комплекс (Cho EH, Gumport RI, Gardner JF.), как способ разрушения гена на хромосоме.
В соответствии со способом red-запускаемой интеграции штамм, несущий разрушенный ген, может быть сконструирован в один этап с использованием ПЦР-продукта, который получают с использованием синтетических олигонуклеотидов в качестве праймеров, которые сконструированы так, что содержат часть адресного гена на своем 5'-конце и часть гена резистентности к антибиотику на своем 3'-конце. Кроме того, интегрированный ген резистентности к антибиотику может быть удален путем введения attL и attR, которые являются сайтами прикрепления фага лямбда, и ПЦР-продукта и комбинирования эксцизионной системы, полученной из фага лямбда, со способом red-запускаемой интеграции.
В частности, штамм, в котором адресный ген разрушен и ген резистентности к антибиотику удален, может быть получен с помощью описанного ниже способа.
В первую очередь получили линейную ДНК-кассету, содержащую ген резистентности к антибиотику, сайты прикрепления фага лямбда и адресный ген. Ее получили, как обычно, с помощью ПЦР с использованием специальной полученной матрицы.
Матрицу, в которой attL и attR (SEQ ID NO:9 (GenBank, инвентарный № M12458 и SEQ ID NO:10 (GenBank, инвентарный № M12459)) являются сайтами прикрепления фага лямбда, вводили в соответствующие концы гена резистентности к антибиотику, который использовали как матрицу линейной ДНК-кассеты. Матрица может быть плазмидой, геном, введенным в хромосому, или синтетическим олигонуклеотидом. Хотя геном резистентности к антибиотику предпочтительно является ген резистентности к хлорамфениколу, может быть использован ген резистентности к стрептомицину, или ген резистентности к ампициллину, или ген резистентности к любому другому антибиотику, при условии, что генные функции в качестве гена резистентности к антибиотику в бактериях Escherichia отличаются от маркерного гена, который может содержаться в двух хелперных плазмидах, как описано ниже. Бесспорным подтверждением приобретения резистентности к антибиотику может быть увеличение уровня экспрессии применяемого гена резистентности к антибиотику путем замещения промоторной последовательности и т.п. или усиление активности фермента в результате введения мутации в последовательность структурного гена. Линейную ДНК-кассету получали в следующем порядке, начиная с 5'-конца: (5'-последовательность адресного гена)-(attL)-(ген резистентности к антибиотику)-(attR)-(3'-последовательность адр