Способ комплексной переработки фукусовых водорослей (варианты)
Иллюстрации
Показать всеИзобретение относится к медицинской, химико-фармацевтической и пищевой промышленности и касается технологии комплексной переработки фукусовых водорослей. Способ комплексной переработки фукуса пузырчатого (Fucus vesiculosus) предусматривает получение липидно-пигментного комплекса - густого экстракта, маннита очищенного, полисахаридного комплекса - сухого экстракта фукуса и альгината натрия. При этом для получения липидно-пигментного комплекса сухие измельченные водоросли экстрагируют смесью метиленхлорида со спиртом этиловым в соотношении 94,2:5,86 об.%, концентрируют и сушат. Для получения маннита водорослевый шрот экстрагируют методом перколяции 85-90% этанолом с принудительной циркуляцией экстрагента через каждый час настаивания в течение 3-5 часов, фильтруют, концентрируют, кристаллизуют, сушат и очищают. Для получения сухого экстракта фукуса оставшийся шрот экстрагируют 5-15% раствором этанола при рН 1-2 в течение 6-9 часов при 40-60°С, концентрируют и сушат. Затем шрот экстрагируют 1,5% раствором карбоната натрия, обрабатывают серной кислотой, концентрируют, очищают, сушат и получают альгинат натрия. Как вариант, способ комплексной переработки фукуса зубчатого (Fucus serratus) или фукуса двустороннего (Fucus distichus) предусматривает получение липидно-пигментного комплекса экстрагированием сухих измельченных водорослей смесью хлороформа с этанолом в соотношении 88,06:11,9 об.%. Маннит получают экстрагированием водорослевого шрота методом перколяции 85-90% этанолом при 45-65°С. Сухой экстракт фукуса готовят путем экстракции оставшегося шрота методом циркуляционной перколяции 10-30% водным этанолом при рН 1-4 в течение 6-12 часов при 45-75°С. Для получения альгината натрия оставшийся шрот экстрагируют методом перколяции 1,5-4% раствором карбоната натрия при 45-65°С, очищают и сушат. Как вариант, способ комплексной переработки фукуса аскофиллума узловатого (Ascophyllum nodosum) предусматривает получение липидно-пигментного комплекса экстрагированием водорослей смесью хлороформа с этанолом в соотношении 1:1 методом перколяции с принудительной циркуляцией экстрагента через каждый час настаивания в течение 20-24 часов. Маннит получают экстракцией оставшегося шрота методом перколяции 85-95% этанолом при 65-75°С. Сухой экстракт аскофиллума готовят путем экстракции оставшегося шрота методом циркуляционной перколяции 5-15% водным этанолом при рН 4-6 в течение 12-18 часов при 70-80°С. Затем шрот экстрагируют методом перколяции 1,5-2,5% раствором карбоната натрия при 65-75°С, вытяжку обрабатывают серной кислотой, полученный осадок альгиновой кислоты растворяют в 1,5% растворе карбоната натрия, концентрируют, очищают, сушат и получают полисахарид альгинат натрия. Изобретение позволяет повысить выход биологически активных веществ в получаемых конечных продуктах. 3 н. и 2 з.п. ф-лы, 10 ил., 4 табл.
Реферат
Изобретение относится к медицинской, химико-фармацевтической и пищевой отраслям промышленности и касается технологии комплексной переработки фукусовых водорослей, преимущественно водорослей Баренцева моря, с получением в едином технологическом цикле как индивидуальных веществ, так и комплексных препаратов.
Способ предлагает использовать в качестве сырья для получения БАВ нетрадиционные виды сырья - фукусовые водоросли Баренцева моря (Fucus vesiculosus, Fucus serratus, Fucus distichus и Ascophyllum nodosum). В качестве конечных продуктов получают: липидно-пигментный комплекс в виде густого экстракта, маннит, полисахаридный комплекс в виде сухого экстракта и альгинат натрия.
Фукусовые водоросли являются природными источниками биологически активных веществ (БАВ). Они содержат маннит, соли (натриевые, кальциевые, калиевые и т.п.) альгиновой кислоты, фукоидан, ламинаран, липиды, пигменты, стерины и другие. Качественные и количественные характеристики этих БАВ водорослей изменяются в зависимости от многих факторов, таких как вид водорослей (видоспецифичность), стадии развития растений, условия их произрастания и т.д. Поэтому для получения БАВ со стандартными характеристиками необходимо учитывать вышеперечисленные факторы.
Фукус пузырчатый (Fucus vesiculosus) - наиболее изученный и широко применяемый вид фукусовых водорослей, что объясняется его повсеместным распространением, а также легкодоступностью для сбора и заготовки. На побережье Баренцева моря произрастают другие виды фукусовых водорослей (Fucus serratus, Fucus distichus и Ascophyllum nodosum), не уступающие фукусу пузырчатому по содержанию БАВ, их запасы достаточны для промышленного использования.
Липидно-пигментные комплексы, выделяемые из разных видов фукусовых водорослей, отличаются составом и содержанием высших жирных кислот, пигментов, стеринов. Общее количество пигментов у фукоидов, произрастающих на побережье Баренцева моря, наибольшее у Fucus vesiculosus и Fucus serratus, а наименьшее у Ascophyllum nodosum, при этом содержание β-каротина выше у водорослей Fucus serratus и Fucus distichus по сравнению с остальными видами. Наибольшее содержание фукоксантина и хлорофилла (а+с) отмечено для Fucus vesiculosus и Fucus serratus. Общее содержание липидов увеличивается в ряду:
A. nodosum > Fucus serratus > F. vesiculosus > F. distichus.
Главными жирными кислотами (ЖК) бурых водорослей являются миристиновая, пальмитиновая, олеиновая, C18 и С20 полиеновые жирные кислоты, соотношение которых различно у разных видов (Хотимченко С. В. Липиды морских водорослей-макрофитов и трав. Владивосток, Дальнаука, 2003). Ascophyllum nodosum no сравнению с другими фукусовыми содержит 12.4-12.6% (от суммы ЖК) миристиновой кислоты, в то время как ее содержание у других видов не превышает 10%. Содержание пальмитиновой кислоты у Fucus serratus достигает 26,4% (от суммы ЖК). Соотношение (n-3) и (n-6) серий полиеновых кислот различно у рассматриваемых видов: Ascophyllum nodosum и Fucus distichus содержат примерно равные их количества, у Fucus vesiculosus и Fucus serratus уровень (n-6) полиненасыщенных жирных кислот выше, чем (n-3). В водорослях Ascophyllum nodosum обнаружены значительные количества (2-4%) редких кислот нерегулярного строения - Δ5,11,14-20:3 и Δ5,11,14,17-20:4.
Учитывая вышесказанное, становится очевидным, что липидно-пигментные комплексы, выделенные из разных видов фукусовых водорослей, будут различаться как по качественному составу, так и по соотношению главных компонентов, и следовательно, по оказываемому фармакологическому воздействию на организм человека.
Фукусовые водоросли содержат три типа полисахаридов: альгиновую кислоту, фукоидан и ламинаран.
Альгиновая кислота является гетерогенным веществом, состоящим из фракций, различных по растворимости и составу уроновых кислот, в основном из блоков маннуроновой (М) и гулуроновой (G), и из изменяющихся цепей этих двух мономеров (Nishide E. et al., Changes in M/G ratios of extracted and residual alginate fractions on boiling with water the dried brown alga. // Hydrobiologia. 1996. V.327. N Jul. P.515-518). Блоки полиманнуроновой кислоты придают вязкость альгинатным растворам, блоки гулуроновой кислоты ответственны за силу геля и специфическое связывание двухвалентных ионов металлов (Stokke B.T. et al. Distribution of uronate residues in alginate chains in relation to alginate gelling. // Macromolecules. 1991. V.24. N 16. P.4637-4345). В разных фракциях альгиновой кислоты содержание маннуроновой и гулуроновой кислот разное. В большой степени свойства альгиновой кислоты и ее солей зависят от молекулярной массы. Значительные колебания молекулярной массы (35-1500 кДа) зависят от вида водоросли и способа получения. Коммерческий альгинат натрия преимущественно выделяют из ламинариевых водорослей.
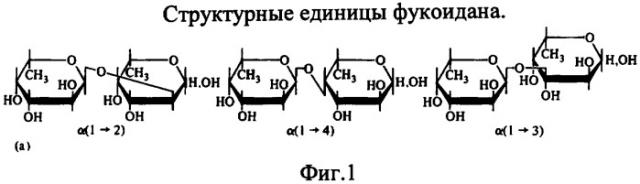
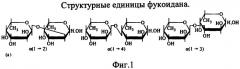
Фукоиданами называют группу высокомолекулярных сульфатированных полисахаридов (молекулярная масса 100-800 кДа), построенных из остатков α-L-фукопиранозы. Эти биополимеры содержат до 30% эфирносвязанной серной кислоты. Остатки фукозы соединены β-1,2-; β-1,3- и β-1,4-связью. Структурные единицы фукоидана представлены на фиг.1.
Содержание и структурные характеристики фукоиданов значительно изменяются в зависимости от вида водорослей. Различия в структуре фукоиданов, имеющих различное происхождение, отражаются на биологической активности данных полисахаридов.
В настоящее время установлено, что фукоидан, выделяемый из водорослей F. vesiculosus, имеет следующую структуру (Lewis G. et а1. Commercial production and applications of algal hydrocolloids. University of Washington. Seattle. 1988):
[→3)-α-L-Fuc(2SO3 -)-(1→4)-α-L-Fuc(3,3diSO3 -)-(1→]n
Для фукоидана из F. vesiculosus характерны антикоагулянтная и антитромботическая активности. Фукоидан из фукуса пузырчатого является коммерческим препаратом и его биологическое действие и структурные характеристики наиболее хорошо изучены.
Фукоидан из водорослей F. serratus (Bilan M.I. et al. Structure of fucoidan from the brown seaweeds Fucus serratus L. // Carbohydr. Res. 2006. 341. P.238-245) имеет структуру:
[→3)-α-L-Fuc(2R1R2)-(1→4)-α-L-Fuc(2SO3 -)-(1→]n
(˜50%):R1=SO3 -, R2=H
(˜50%):R1=H,
R2=α-L-Fuc-(1→4)-α-L-Fuc(2SO3 -)-(1→3)-α-L-Fuc(2SO3 -)-(1→
Фукоидан, выделенный из F. serratus, обладает высоким иммуномодулирующим действием (Green JR. et al. Binding of monoclonal antibodies to vegetative tissue and fucose-containing polysaccharides of Fucus serratus L. // New Phytol. 1993. 124. N 3. P.397-408).
Изучена структура фукоидана из водорослей F. distichus (Bilan M.I. et al. A highly regular fraction of a fucoidan from brown seaweed Fucus distichys L. // Carbohydr. Res. 2004. 339. P.511-517):
[→3)-α-L-Fuc(2,4-di-SO3 -)-(1→4)-α-L-Fuc(2SO3 -)-(1→]n
Полисахарид из этого вида водорослей значительно снижает фертильную способность организма млекопитающих (Serrao E.A. et al. Successful external fertilization in turbulent environments. // Proc. Natl. Acad. Sci. USA. 1996. May. 28. 93. N 11. P.5286-5290).
Фукоидан из водорослей Ascophyllum nodosum (Chevolot L. et al. A disaccharide repeat unit is the major structure in fucoidans from two species of brown algae. // Carbohydr. Res. 2001. 330. P.529-535) имеет следующую структуру:
[→3)-α-L-Fuc(2SO3 -)-(1→4)-α-L-Fuc(2,3-diSO3 -)-(1→]n
Фукоидан из A. nodosum обладает антиопухолевыми и антипролиферативными свойствами (Riou D.et al. An antithcancer and antiproliferation activities of a fucoidan fraction from Ascophyllum nodosum. // Anticancer Res. 1996. 16. P.1213-1218).
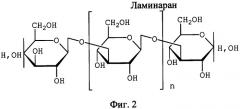
Ламинаран - низкомолекулярный полисахарид, состоит из остатков D-глюкопиранозы, соединенных в линейные цепи β-1-3-связями (могут содержать слаборазветвленные участки β-1-6). До 75% молекул присоединены β--1-3-связью к остатку D-маннита. Молекулярная масса 3500-5000 Да (Mayer A.M. et al. Biological activity in Macrocystis purifera from Argentina: Sodium alginate, fucoidan and laminaran. // XII-th Intern. Seaweed Symp.1987. V.151-152. P.497-500). Структурная формула ламинарана представлена на фиг.2.
Ламинараны являются криопротекторами и противораковыми средствами. Содержание ламинаранов у фукусовых водорослей невелико (1-4%), они входят в состав их водорастворимых экстрактов.
Известен способ комплексной переработки бурых водорослей с получением йодсодержащих и полисахаридных продуктов (патент РФ №2233104 от 09.12.02 г.). Поставленная задача решается путем измельчения сырья (ламинарии японской), экстракции его водно-спиртовым раствором (65-75% этанолом), отделения водно-спиртовой вытяжки, отстаивания, разделения водной и липидной фракции. Из водной фракции получают йодсодержащий минерально-маннитный комплекс, из липидной - йодсодержащий липидный комплекс.
Шрот (I) экстрагируют 0.1 Н раствором соляной кислоты в течение 6-10 ч при комнатной температуре, затем нагревают реакционную массу до температуры 45-55°С в течение 4-6 ч. Солянокислую вытяжку нейтрализуют карбонатом калия или натрия, концентрируют под вакуумом и осаждают 96% этанолом.
Шрот (II) экстрагируют раствором карбоната натрия в течение 10-15 ч при комнатной температуре, затем выдерживают реакционную массу при температуре 80-85°С, отделяют фильтрат, получают в качестве биологически активного вещества альгилозу кальция или альгилозу натрия. Альгилозу кальция получают при добавлении к фильтрату 10% раствора хлористого кальция, альгилозу натрия - путем добавления к альгиновой кислоте карбоната натрия. Альгиновую кислоту осаждают из фильтрата 10% раствором соляной кислоты.
Предлагаемый способ комплексной переработки водорослей позволяет одновременно получить несколько пищевых добавок, содержащих биологически активные вещества: два йодсодержащих продукта - йодсодержащий минерально-маннитный и йодсодержащий липидный комплексы, альгилозу натрия и альгилозу кальция, а также концентрат фукоидана. Полученные пищевые добавки обладают широким спектром фармакологических свойств.
Недостатком разработанной технологии является длительное экстрагирование сырья и шрота при получении концентрата фукоидана неэффективным методом (однократной мацерацией) без создания необходимой разности концентраций в системе сырье - экстрагент. Получаемый продукт характеризуется низким содержанием фукоидана (33-40%), содержит значительное количество минеральных веществ (31-35%). Выход данного продукта также невысок и составляет 10-12%. Еще одним недостатком данного способа является получение БАД с низким содержанием БАВ водорослей: 0.7-1.0% йода, 28-39% маннита, 7-8% аминокислот, минеральных веществ 40-50%. Содержание указанных БАВ в сырье (L. japonica) незначительно ниже, поэтому основная цель при создании БАД - получение концентратов БАВ и увеличение их биодоступности, не достигается.
Известен способ получения биологически активных веществ из ламинарии для медицинских целей (патент РФ №2194525 от 16.07.01 г.). Согласно способу измельченное сырье (ламинарию сахаристую) обезжиривают хлороформом в соотношении сырье: экстрагент 1:20 в течение 1.5 ч, последовательно экстрагируют 90-96% этанолом, горячей водой и 1.5% раствором карбоната натрия. Этанольное извлечение после фильтрования диализуют через целлофановую мембрану, концентрируют и кристаллизуют из него маннит. Водное извлечение трехкратно осаждают при температуре 4°С, диализуют, упаривают, осаждают из него с помощью 90% этанола белково-полисахаридный препарат (БПК) «Ламинарид-СБ», который сушат лиофильным способом. Из карбонатного извлечения после предварительной обработки концентрированной серной кислотой, охлаждения при температуре 4°С и диализа осаждают альгинат натрия, лиофильно сушат. Данный способ имеет ряд отличий и недостатков по сравнению с заявляемым способом:
1) в качестве сырья используют ламинарию сахаристую;
2) при обезжиривании сырья хлороформом удаляются ценные БАВ - липиды, пигменты, стерины;
3) для обработки сырья хлороформом используется низкоэффективный метод однократной мацерации при комнатной температуре;
4) извлечение маннита осуществляют в аппарате Сокслета методом циркуляционной экстракции, при котором экстрагирование происходит в верхней части аппарата при температуре экстрагента не выше 20±5°С. Известно, что выход маннита повышается с увеличением температуры экстрагента этанола;
5) извлечение, содержащее полисахаридно-белковый комплекс, выдерживают при пониженной температуре (4°С) троекратно, при этом белки выпадают в осадок, что приводит к потере целевых компонентов комплекса;
6) для осаждения полисахаридно-белкового комплекса и альгината натрия применяют 90% этанол, что приводит к значительным потерям полисахаридов (более 30%). Кроме того, в вытяжке, содержащей полисахаридно-белковый комплекс, после осаждения этанолом остается существенное количество ламинарана, растворимого в этаноле с концентрацией ниже 60%;
7) один из целевых продуктов - полисахаридно-белковый препарат - содержит фукоидан с главной цепью, построенной только из 1→3-связанных остатков фукозы, так как выделяется из ламинариевых водорослей (Усов А.И. и др. Полисахариды водорослей 53. Бурая водоросль Laminaria saccharina (L.) Lam. как источник фукоидана. // Биоорг. химия. 1998. Т.24. С.437-445). Фукоиданы, выделяемые из фукусовых водорослей, имеют в основе полисахаридную цепь из чередующихся 3- и 4-связанных остатков фукозы. Различия в структуре фукоиданов - представителей ламинариевых и фукусовых водорослей взаимосвязаны с особенностями фармакологического действия данных полисахаридов.
Известен способ комплексной переработки бурых водорослей с получением препаратов для медицины и косметологии (патент РФ №2240816 от 28.07.03 г.). Способ заключается в том, что растительное сырье (бурые водоросли) обрабатывают этанолом в течение 20-24 ч при температуре 40-60°С, извлечение отделяют, этанол отгоняют, получают концентрат биологически активных веществ и низкомолекулярных соединений, затем шрот высушивают и экстрагируют разб. раствором соляной кислоты в течение 10-14 ч при температуре 20-25°С при перемешивании. Извлечение концентрируют на ультрафильтрационной установке, нейтрализуют до рН 6,0 раствором гидроксида натрия и упаривают. Получают концентрат - полисахарид-1, содержащий смесь ламинарана и фукоидана, последовательно осаждают этанолом фукоидан (F1) и ламинаран (L1). Шрот водорослей последовательно дважды экстрагируют горячей водой при рН 3,5-4,0 при перемешивании в течение 2-4 ч и 1-2 ч соответственно. Извлечения объединяют, концентрируют на ультрафильтрационной установке, упаривают. Получают полисахарид-2, представляющий собой смесь ламинарана, фукоидана и полиманнуровой кислоты. Затем доводят рН экстракта до значения 2,0-2,5, отделяют осадок полиманнуровой кислоты центрифугированием. Для получения соли полиманнуровой кислоты осадок растворяют в минимальном объеме гидроксида натрия или оксалата аммония, или гидроксида кальция, или гидроксида магния, затем раствор нейтрализуют и осаждают соль полиманнуровой кислоты (М) добавлением двух объемов этанола, осадок промывают этанолом и высушивают. Супернатант нейтрализуют, осаждают этанолом последовательно фукоидан (F2), ламинаран (L2). Шрот водорослей экстрагируют раствором гидроксида натрия (или кальция, или магния) или оксалата аммония при рН 8-9 в течение 2-4 ч при температуре 55-65°С, извлечение концентрируют на ультрафильтрационной установке, нейтрализуют и осаждают этанолом полисахарид-3, представляющий соль альгиновой кислоты (А), который промывают этанолом и высушивают.
Данный способ разработан для комплексной переработки дальневосточных видов бурых водорослей (L. cichorioides, L. japonica, F. evanescence и др.), однако авторы утверждают, что способ является универсальным и может быть применен к другим видам бурых водорослей с получением в каждом конкретном случае определенного набора кислых и нейтральных полисахаридов. Следует отметить, что при применении данной схемы для фукусовых водорослей Баренцева моря нецелесообразно получать индивидуальные ламинараны, т.к. в данных видах их содержание невысоко (0,5-3%), также сомнительно получение полиманнуронатов.
Особенностью данного способа является и использование водорослей в свежем или замороженном виде. Переработку свежих водорослей необходимо осуществлять в течение ближайших 48 ч, т.к. очень быстро начинаются процессы ферментативного гидролиза полисахаридов, окисления липидов и пигментов. Для этой цели необходимо обеспечить быструю доставку сырья до перерабатывающего предприятия, что часто невозможно. Для замороженных водорослей необходимо соблюдать строгий режим хранения, недопустимо их размораживание, т.к. при этом будут происходить потери целевых компонентов - водорастворимых веществ (фукоидана, ламинарана, витаминов, аминокислот и др.).
Основными недостатками способа являются его многостадийность и применение неэффективных методов экстрагирования - однократной или двукратной мацерации (настаивания).
Наиболее близким к заявляемому изобретению является способ комплексной переработки фукусовых водорослей Fucus vesiculosus (Облучинская Е.Д. Комплексное использование бурых водорослей; Рос. Хим. Ж., 2004, т.XLVII, №3, с.136-142). Способ заключается в том, что сухие слоевища водорослей, а именно фукуса пузырчатого, измельчают и последовательно экстрагируют азеотропной смесью, этанолом, водно-спиртовой смесью и гидроксидом натрия. Для получения густого экстракта фукуса пузырчатого измельченные водоросли экстрагируют азеотропной смесью в аппарате Сокслета, концентрируют в вакууме на роторном испарителе, сушат в вакууме на роторном испарителе, сушат в вакуум-сушильном шкафу. Для получения маннита шрот экстрагируют 96% этанолом методом циркуляционной экстракции в аппарате Сокслета, фильтруют, концентрируют в вакууме на роторном испарителе, кристаллизуют, фильтруют на нутч-фильтре, сушат и очищают методом колоночной хроматографии с использованием оксида алюминия. Затем оставшийся шрот экстрагируют методом циркуляционной перколяции водно-спиртовой смесью 5-30% водным этанолом, концентрируют на ультрафильтрационном аппарате с одновременным диализом, сушат и получают полисахаридный комплекс - сухой экстракт фукуса. Для получения альгината натрия шрот экстрагируют методом бисмацерации 2% раствором карбоната натрия, обрабатывают серной кислотой, растворяют в 1,5% растворе карбоната натрия, очищают диализом и сушат. Данная технология разработана и используется для переработки только фукуса пузырчатого.
Задачей данного изобретения является развитие вышеуказанного способа и совершенствование способов комплексной переработки других видов фукусовых водорослей с получением БАВ со стандартными характеристиками, применимыми в медицине, химико-фармацевтической промышленности и в пищевой промышленности.
Техническими результатами являются: получение определенного набора БАВ со стандартными характеристиками из фукусовых водорослей видов Fucus vesiculosus, Fucus serratus, Fucus distichus и Ascophyllum nodosum; увеличение выхода целевых продуктов на 5-17% в зависимости от видов водорослей при одновременном увеличении степени их чистоты, в том числе из фукуса пузырчатого на 7-17%, а именно: ЛПК - на 15-17%, маннита - на 7%, фукоидана - на 10-17%, альгината натрия - на 8-16%; из фукуса двустороннего: ЛПК - на 5%, маннита - на 4-7%, фукоидана - на 14-17%, альгината натрия - на 6-15%; из фукуса зубчатого: ЛПК - на 9%, маннита - на 6-8%, фукоидана - на 9-14%, альгината натрия - на 6-15%; и аскофиллума узловатого: ЛПК на 15-24% при содержании хлорофилла не менее 8%, маннита 11-13%%, полисахаридного комплекса 18-24% и альгината натрия на 12-15%.
Способ, как и известные, заключается в том, что сухие слоевища водорослей измельчают, экстрагируют смесью органических экстрагентов, концентрируют в вакууме на роторном испарителе, сушат в вакууме на роторном испарителе, сушат в вакуум-сушильном шкафу с получением липидно-пигментного комплекса - густого экстракта, затем последовательно экстрагируют этанолом, водно-спиртовой смесью и гидроксидом натрия с получением маннита, сухого экстракта и альгината натрия.
Технический результат достигается тем, что:
1. Для переработки фукусовых водорослей вида фукуса пузырчатого (Fucus vesiculosus):
для получения липидно-пигментного комплекса (густого экстракта фукуса) экстрагирование осуществляют смесью метиленхлорида со спиртом этиловым в соотношении 94,2:5,86% в аппарате Сокслета, для получения маннита водорослевый шрот экстрагируют методом перколяции 85-90% этанолом с принудительной циркуляцией экстрагента через каждый час настаивания в течение 3-5 часов, для получения сухого экстракта фукуса шрот экстрагируют 5-15% раствором этанола при рН 1-2 и временем настаивания 6-9 часов при температуре 40-60°С.
2. Для переработки фукусовых водорослей видов фукуса зубчатого (Fucus serratus) или фукуса двустороннего (Fucus distichus):
для получения липидно-пигментного комплекса (густого экстракта фукуса) экстрагирование осуществляют азеотропной смесью метиленхлорида со спиртом этиловым в соотношении 94,2:5,86% или азеотропной смесью хлороформа с этанолом в соотношении 88,06:11,9% в аппарате Сокслета, затем водорослевый шрот экстрагируют методом перколяции 85-95% этанолом при температуре 45-65°С, фильтруют, концентрируют в вакууме на роторном испарителе, кристаллизуют, фильтруют на нутч-фильтре, сушат, очищают методом колоночной хроматографии с использованием оксида алюминия и получают маннит очищенный, затем оставшийся шрот экстрагируют методом циркуляционной перколяции 10-30% водным этанолом при рН 1-4, временем настаивания 6-12 часов при температуре 45-75°С, очищают вакуум-концентрированием с последующим диализом через целлофановую мембрану или концентрированием на ультрафильтрационном аппарате с одновременным диализом, сушат лиофилизацией или в вакуум-сушильном шкафу и получают полисахаридный комплекс - сухой экстракт фукуса, затем шрот экстрагируют методом перколяции 1,5-4% раствором карбоната натрия при температуре 45-65°С, вытяжку обрабатывают серной кислотой, полученный осадок альгиновой кислоты растворяют в 1,5% растворе карбоната натрия, концентрируют на роторном испарителе, очищают диализом через целлофановую мембрану, сушат в вакуум-сушильном шкафу или лиофилизацией и получают полисахарид альгинат натрия.
3. Для переработки фукусовых водорослей вида аскофиллум узловатый (Ascophyllum nodosum):
для получения липидно-пигментного комплекса (густого экстракта аскофиллума) экстрагирование осуществляют смесью хлороформа с этанолом в соотношении 1:1 методом перколяции с принудительной циркуляцией экстрагента через каждый час настаивания в течение 20-24 часов, затем водорослевый шрот экстрагируют методом перколяции 85-95% этанолом при температуре 65-75°С, фильтруют, концентрируют в вакууме на роторном испарителе, кристаллизуют, фильтруют на нутч-фильтре, сушат, очищают методом колоночной хроматографии с использованием оксида алюминия и получают маннит очищенный, затем оставшийся шрот экстрагируют методом циркуляционной перколяции 5-15% водным этанолом при рН 4-6, временем настаивания 12-18 часов при температуре 70-80°С, вытяжку фильтруют, концентрируют под вакуумом на роторном испарителе, диализуют в воде, очищенной через целлофановую мембрану, сушат лиофилизацией или в вакуум-сушильном шкафу и получают полисахаридный комплекс - сухой экстракт аскофиллума, затем шрот экстрагируют методом перколяции 1,5-2,5% раствором карбоната натрия при температуре 65-75°С, вытяжку обрабатывают серной кислотой, полученный осадок альгиновой кислоты растворяют в 1,5% растворе карбоната натрия, концентрируют на роторном испарителе, очищают диализом в воде, очищенной через целлофановую мембрану, сушат в вакуум-сушильном шкафу или лиофилизацией и получают полисахарид альгинат натрия.
Предлагаемый нами способ предусматривает использование высушенного сырья (сушка при температуре не выше 60°С).
Сущность способа и влияние существенных признаков формулы на достигаемый результат поясняется для каждого вида фукусовых водорослей:
1. Использование в качестве сырья водорослей Fucus vesiculosus (фукуса пузырчатого). Получение липидно-пигментного комплекса ЛПК. Слоевища сухих водорослей измельчали, экстрагировали в аппарате Сокслета азеотропной смесью (метиленхлорид - этиловый спирт в соотношении 94,2:5,86%) до максимального истощения сырья. По окончании процесса экстракции вытяжку концентрировали в вакууме на роторном испарителе и сушили в вакуум-сушильном шкафу. Выход ЛПК составил 3,20±0,39% (выход ЛПК от содержания в сырье - технологический выход - 88,09±0,89%). Получаемый продукт представляет собой густой экстракт буро-зеленого цвета, маслянистого вида, имеющий своеобразный запах. Качественный анализ методом тонкослойной хроматографии («Силуфол» марки 254) показал наличие β-каротина (Fluka), α-токоферола (Fluka), β-ситостерина (Fluka), фукостерина (Fluka). Количественный анализ хлорофилла осуществляли спектрофотометрическим методом с использованием в качестве калибровочного раствора реактива Гетри (Сиренко Л.А. и др. Методы физиолого-биохимического исследования водорослей в гидробиологической практике, Киев: Наукова думка. 1975). Содержание хлорофилла в ЛПК из фукуса пузырчатого составляло 8,63±0,35%.
По сравнению с аналогом увеличено время настаивания с 1 до 5 ч, что приводит к повышению выхода ЛПК с 71,17 (в аналоге) до 88,09%, а также увеличению содержания хлорофилла с 5,5-6,2 до 8,63%. Увеличение времени настаивания и применение определенного соотношения азеотропной смеси позволяет получить существенный количественный рост технического результата.
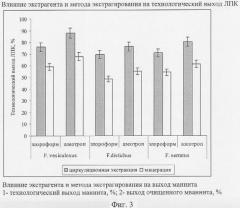
Результаты, отраженные на фиг.3 и в табл.4, показывают, что применением экстрагирования в аппарате Сокслета азеотропной смесью метиленхлорид - этиловый спирт в соотношении 94,2:5,86% удалось повысить технологический выход ЛПК на 15-17%, это подтверждено высоким значением технологического выхода (88,1±0,9%), а также качественными и количественными характеристиками ЛПК.
Получение маннита. Для получения маннита использовали водорослевый шрот, оставшийся после выделения ЛПК. В отличие от аналога для получения маннита по заявляемому способу используется метод перколяции с принудительной циркуляцией экстрагента, экстракцию проводят этанолом 85-90% при температуре 45-65°С в течение 3-5 часов, для чего во время настаивания через каждый 1 час производили циркуляцию экстрагента. В аналоге используется циркуляционный метод экстракции в аппарате Сокслета при температуре 20°С, в качестве экстрагента - этанол 95%. На фиг.4 представлены данные о влиянии метода экстрагирования на выход маннита. Из них видно, что при использовании заявляемого способа выход маннита увеличился не менее чем на 7% по сравнению с аналогом и составил 99,2%, следовательно, удалось более полно извлечь целевой компонент - маннит.
Затем вытяжку фильтровали, концентрировали в вакууме на роторном испарителе. Далее осуществляли кристаллизацию при 0÷+4 С в течение 24 ч. Выпавшие кристаллы маннита фильтровали на путч-фильтре и сушили. Получали технический маннит. Далее маннит очищали методом колоночной хроматографии с использованием оксида алюминия. Полученный маннит представлял собой белый кристаллический порошок, физико-химические характеристики которого представлены в табл.1.
Предлагаемый способ получения маннита сравнивали с традиционным методом, применяемым на Архангельском опытно-промышленном водорослевом комбинате (АОПВК), а также методом циркуляционной экстракции. Маннит получают на АОПВК методом мацерации с нагреванием при температуре кипения экстрагента - спирта этилового с концентрацией 80-96%. Результаты исследований, представленные на фиг.4, подтверждают высокую эффективность применения метода перколяции по сравнению с существующими способами: выход маннита увеличился на 7-10% (в сравнении с цируляционной экстракцией) и на 30-34% (в сравнении с мацерацией).
Получение полисахаридного комплекса «Фукоидан-П» (сухого экстракта). В аналоге шрот водорослей экстрагировали методом циркуляционной перколяции 5-30%-ным водным этанолом без нагревания. Технологический выход 83,37%. Содержание основного действующего вещества фукоидана 71% (определяется по формуле Ф=количество фукозы х2, см. табл.2).
По заявляемому способу шрот водорослей экстрагировали методом циркуляционной перколяции 5-15%-ным водным этанолом, рН=1-2. Время настаивания 6-9 ч, температура 40-60°С. Уменьшен диапазон применяемых концентраций экстрагента, реакция среды заменена с нейтральной на кислую, определены оптимальные условия проведения экстракции - время и температурный режим. Таким образом, условия перколяции фукоидана отличаются от аналога температурой, рН, временем. Именно такой оптимальный подбор всех условий экстрагирования обеспечил не известное из уровня техники количественное увеличение выхода фукоидана на 10-17%, составившее 93-99%. Доказательства влияния именно таких режимов экстрагирования при использовании известного метода циркуляционной перколяции на выход фукоидана представлены на фиг.8 и 9.
Затем вытяжку фильтровали, концентрировали под вакуумом на роторном испарителе. Концентрированное извлечение диализовали в воде, очищенной через целлофановую мембрану. Сушили в вакуум-сушилке либо лиофилизацией. Полисахаридный комплекс «Фукоидан-П» представляет собой порошок от светло-коричневого до темно-коричневого цвета, содержащий фукоидан и ламинаран, легко растворимый в воде с образованием вязких растворов бурого цвета, физико-химические характеристики которого представлены в табл.2.
Экстрагирование методом перколяции осуществляли по следующей методике: шрот смачивали экстрагентом, послойно загружали в перколятор, заливали экстрагентом до образования «зеркала», прижимали грузом и настаивали 6-9 ч. Экстрагирование проводили с принудительной циркуляцией экстрагента (10% этанол), для чего во время настаивания через каждый 1 ч производили циркуляцию экстрагента, вытяжку фильтровали и определяли содержание в ней фукоидана.
Результаты определений, представленные на фиг.5, наглядно демонстрируют преимущество метода перколяции. Содержание фукоидана в извлечениях, полученных данным способом, выше на 3-6% (на 20-40% в пересчете на содержание в сырье). Существенное влияние на выход фукоидана оказывает и увеличение температуры. При экстрагировании фукуса пузырчатого методом перколяции оптимальным является диапазон 40-60°С, при котором достигается высокий выход фукоидана - 93-99% (в пересчете на содержание в сырье). Дальнейшее увеличение температуры не приводит к значительному увеличению выхода фукоидана.
Получение альгината натрия. Согласно аналогу шрот экстрагировали методом бисмацерации 2% раствором карбоната натрия при температуре 50-60°С. Вытяжку обрабатывали серной кислотой, образовывался осадок альгиновой кислоты, который растворяли в 1,5% растворе карбоната натрия. Раствор альгината натрия концентрировали на роторном испарителе, очищали от балластных веществ диализом в воде, очищенной через целлофановую мембрану. Сушили в вакуум-сушильном шкафу. Технологический выход альгината натрия составил 81,73±1,69%, чистота составила 92,17%.
В отличие от аналога по заявляемому способу шрот экстрагировали методом циркуляционной перколяции 1,5-2,5% раствором карбоната натрия при температуре 40-60°С. Вытяжку обрабатывали серной кислотой, образовывался осадок альгиновой кислоты, который растворяли в 1,5% растворе карбоната натрия. Раствор альгината натрия концентрировали на роторном испарителе, очищали от балластных веществ диализом в воде, очищенной через целлофановую мембрану. Сушили в вакуум-сушильном шкафу либо лиофильно. При этом выход альгината натрия составил 18-19,8% (фиг.6), что в пересчете на содержание альгината в сырье составило 89-97%, что превышает данный показатель в аналоге на 8-16%, чистота целевого компонента также выше по сравнению с аналогом и составила 96,1% (табл.3). Методом математического планирования по Боксу-Уилсону был определен оптимальный диапазон концентрации экстрагента и температуры, который был использован для получения альгината натрия из фукуса пузырчатого по заявляемому способу: 1,5-2,5% раствор карбоната натрия при температуре 40-60°С методом циркуляционной перколяции.
Таким образом, замена метода экстрагирования и определение оптимума концентрации экстрагента и температуры позволило увеличить выход целевого продукта и степень его чистоты при комплексной переработке сырья, что не известно из уровня техники. На фиг.6 представлены результаты анализа содержания альгиновой кислоты в вытяжках, полученных разными способами из шрота. Полученные результаты подтверждают преимущество метода перколяции по сравнению с традиционным способом - мацерацией для экстрагирования альгиновой кислоты. Поэтому для получения альгината натрия из шрота фукуса пузырчатого выбран метод перколяции.
2. Использование в качестве сырья водорослей Fucus distichus (фукуса двустороннего). Получение липидно-пигментного комплекса ЛПК. Слоевища сухих водорослей измельчали, экстрагировали в аппарате Сокслета азеотропной смесью (хлороформ - этанол в соотношении 88,06:11,9%) до максимального истощения сырья. По окончании процесса экстракции вытяжку концентрировали в вакууме на роторном испарителе и сушили в вакуум-сушильном шкафу. Выход ЛПК составил 3,1±0,6% (технологический выход 76,3%). Получаемый продукт представляет собой густой экстракт буро-зеленого цвета, маслянистого вида, имеющий своеобразный запах. Качественный анализ методом тонкослойной хроматографии («Силуфол» марки 254) показал наличие β-каротина (Fluka), α-токоферола (Fluka), β-ситостерина (Fluka), фукостерина (Fluka). Количественный анализ хлорофилла осуществляли спектрофотометрическим методом с использованием в качестве калибровочного раствора реактива Гетри (Сиренко и др., 1975). Содержание хлорофилла в ЛПК из фукуса двустороннего составляло 5,8±0,5%.
Для сравнения полученных данных с существующими способами получен ЛПК методом мацерации с нагреванием. Результаты, отраженные на фиг.3, показывают, что применение метода циркуляционной экстракции привело к повышению технологического выхода ЛПК на 5%.
Получение маннита. Для получения маннита использовали водорослевый шрот, оставшийся после выделения ЛПК. Шрот экстрагировали методом перколяции этанолом 85-95% при температуре 45-65°С. Затем вытяжку фильтровали, концентрировали в вакууме на роторном испарителе. Далее осуществляли кристаллизацию при 0÷+4°С в течение 24 ч. Выпавшие кристаллы маннита фильтровали на нутч-фильтре и сушили. Получали технический маннит. Далее маннит очищали методом колоночной хроматографии с использованием оксида алюминия. Полученный маннит представлял собой белый кристаллический порошок, физико-химические характеристики которого представлены в табл.1.
В аналоге используется циркуляционный метод экстракции в аппарате Сокслета при температуре 20°С, в качестве экстрагента - этанол 95%. Результаты исследований, представленные на фиг.4, подтверждают высокую эффективность именно метода перколяции по сравнению с существующими способами: выход маннита увеличился на 4-7% (в сравнении с цируляционной экстракцией) и на 27-31% (в сравнении с мацерацией).
Получение полисахаридного комплекса «Фукоидан-Д» (сухого экстракта). Шрот водорослей экстрагировали методом циркуляционной перколяции 10-20%-ным водным этанолом, рН=1-2. Время настаивания 6-9 ч, температура 50-70°С. Затем вытяжку фильтровали, концентрировали под вакуумом на роторном испарителе. Концентрированное извлечение диализовали в воде, очищенной через целлофановую мембрану. Сушили в вакуум-сушилке либо лиофилизацией. Полисахаридный комплекс «Фукоидан-Д» представляет собой порошок от светло-коричневого до темно-коричневого цвета, содержащий фукоидан и ламинаран, легко растворимый в воде с образованием вязких растворов бурого цвета, физико-химические характеристики которого представлены в табл.2.
При поиске оптимальных условий была проведена серия экспериментов с различными диапазонами вышеуказанных факторов, в том числе и используемые в аналоге. Некоторые результаты экспериментов отражены на фиг.10. Из представленных данных следует, что совокупное влияние факторов привело к повышению технологического выхода фукоидана до 98%, что превысило соответствующий показатель в аналоге на 14-17%.
Получение альгината натрия. Шрот экстрагировали методом перколяции 1,5-2,5% раствором карбоната натрия при температуре 45-55°С. Вытяжку обрабатывали серной кислотой, образовывался осадок альгиновой кислоты, который растворяли в 1,5% растворе карбоната натрия. Раствор альгината натрия концентрировали на роторном испарителе, очищали от балластных веществ диализом в воде, очищенной через целлофановую мембрану. Сушили в вакуум-сушильном шкафу либо лиофильно. Полученный целевой продукт - альгинат натрия, представлял собой порошо