Производные 1н-имидазола в качестве модуляторов каннабиноидных рецепторов
Иллюстрации
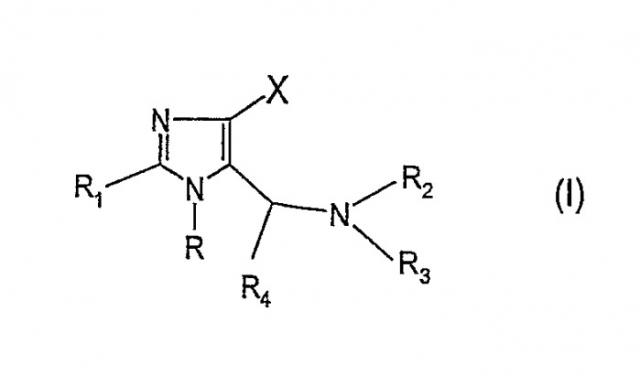
Показать всеИзобретение относится к новым соединениям общей формулы (I)
где - R и R1 обозначают фенил, который может быть замещен 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми или разными, выбранными из группы, состоящей из хлора, иода, брома, фтора, трифторметила и циано, - R2 и R3являются одинаковыми или разными и обозначают С1-5 разветвленную или линейную алкильную группу, причем алкильная группа может быть замещена 1-3 атомами фтора, или - R2 и R3- вместе с атомом азота, с которым они связаны, образуют пирролидиновое или пиперидиновое кольцо, - R7обозначает водород, С3-8 циклоалкил, пирролидинил или пиперидинил, и к их фармакологически приемлемым солям. Изобретение также относится к соединениям общей формулы (IV), к фармацевтической композиции и к применениям соединений по п.1. Технический результат - получение новых биологически активных соединений, обладающих активностью модулятора каннабиноидных рецепторов. 5 н. и 4 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к группе производных 1H-имидазола, которые являются модуляторами каннабиноидных рецепторов, способам получения этих соединений, новым промежуточным соединениям, применяемым для синтеза указанных производных имидазола, способам получения этих промежуточных соединений, фармацевтическим композициям, содержащим в качестве действующего ингредиента одно или более этих производных имидазола, и применению этих фармацевтических композиций для лечения психиатрических и неврологических расстройств, связанных с каннабиноидными рецепторами.
Изобретение также относится к применению раскрытого здесь соединения для изготовления оказывающего благоприятное воздействие лекарственного средства. Благоприятное воздействие раскрывается в описании или оно очевидно для специалиста в данной области из описания и известного уровня техники. Изобретение также относится к применению соединения изобретения для изготовления лекарственного средства для лечения или предупреждения болезни или состояния. Более конкретно, изобретение относится к новому применению для лечения болезни или состояния, раскрытого здесь или очевидного для специалиста в данной области из описания и известного уровня техники. В вариантах осуществления изобретения раскрытые здесь конкретные соединения применяются для изготовления лекарственного средства.
Производные 1H-имидазола уже известны в качестве модуляторов CB1-рецепторов из патентной заявки WO 03/027076. Однако соединения, описанные в патентной заявке WO 03/027076, характеризуются относительно низкой растворимостью в воде. Цель настоящего изобретения заключалась в повышении растворимости в воде производных 1H-имидазола при сохранении их активности в качестве модуляторов каннабиноидных рецепторов. Из известного уровня техники неочевидно как достичь этой цели.
Неожиданно было обнаружено, что введение 5-аминометильного фрагмента в ядро 1H-имидазола приводит к повышению растворимости в воде. Кроме того, производные, содержащие названный 5-аминометильный фрагмент, сохраняют активность в качестве модуляторов каннабиноидных рецепторов, такую как рецепторный антагонизм, рецепторный обратный агонизм или рецепторный (частичный) агонизм.
Изобретение относится к соединениям общей формулы (I)
где:
- R и R1 являются одинаковыми или разными и обозначают фенил, тиенил, пиридинил, пиримидинил, пиразинил, пиридазинил или триазинил, которые могут быть замещены 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми или разными, выбранными из группы, состоящей из метила, этила, пропила, метокси, этокси, гидрокси, гидроксиметила, гидроксиэтила, хлора, иода, брома, фтора, трифторметила, трифторметокси, метилсульфонила, фенила и циано, или R обозначает нафтил, или R обозначает С1-8 разветвленную или линейную алкильную группу, С3-7 циклоалкильную группу, С3-7 циклоалкил-C1-2 алкильную группу, С3-8 разветвленную или линейную гетероалкильную группу, С5-7 гетероциклоалкильную группу или С5-7 гетероциклоалкил-C1-2 алкильную группу, которые могут быть замещены атомом фтора или CF3 или OH группой,
- R2 и R3 являются одинаковыми или разными и обозначают H, С1-5 разветвленную или линейную алкильную группу, которая может быть замещена гидроксильной группой или 1-3 атомами фтора, или
R2 обозначает разветвленную или линейную С1-3 алкокси группу, при условии, что R3 обозначает H или метильную группу,
- R2 и R3 - вместе с атомом азота, с которым они связаны, образуют насыщенную или ненасыщенную неароматическую, моноциклическую или бициклическую, гетероциклическую группу, имеющую от 5 до 10 атомов в кольце, и эта гетероциклическая группа содержит в кольце один или два гетероатома из группы (N, O, S), и эти гетероатомы могут быть одинаковыми или разными, и эта гетероциклическая группа может быть замещена С1-3 алкильной группой, гидроксильной группой или атомом фтора,
- R4 обозначает H или метильную, этильную, пропильную, изопропильную или н-бутильную группу,
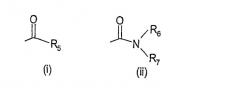
- X обозначает одну из подгрупп (i) или (ii),
где:
- R5 обозначает атом водорода, или C1-8 разветвленную или линейную алкильную группу, C1-3-алкил-SO2-C1-4-алкильную группу, C3-7 циклоалкильную группу, C3-7-циклоалкил-C1-2-алкильную группу, C5-7-гетероциклоалкил-C1-2-алкильную группу, которые могут быть замещены гидроксильной, метильной или трифторметильной группой или атомом фтора, и где C5-7-гетероциклоалкил-C1-2-алкильная группа содержит один или два гетероатома из группы (O, N, S), или R5 обозначает фенильную, бензильную, фенетильную или фенилпропильную группу, которая может быть замещена в фенильном кольце 1-3 заместителями Y, где Y имеет вышеприведенное значение, или R5 обозначает пиридильную или тиенильную группу,
- R6 обозначает атом водорода или разветвленную или линейную С1-3 алкильную группу,
- R7 обозначает водород, разветвленную или линейную С1-8 алкил или С3-8-циклоалкил-C1-2-алкильную группу, разветвленный или линейный C1-8 алкокси, С3-8 циклоалкил, C5-10 бициклоалкил, C5-10 бициклоалкил-C1-2-алкил, С6-10 трициклоалкил, С6-10 трициклоалкилметил и эти группы могут содержать один или более гетероатомов из группы (O, N, S), и эти группы могут быть замещены гидроксильной группой, 1-3 метильными группами, этильной группой или 1-3 атомами фтора, или R7 обозначает фенильную, фениламино, фенокси, бензильную, фенетильную или фенилпропильную группу, необязательно замещенную в фенильном кольце 1-3 заместителями Y, где Y имеет вышеуказанное значение или R7 обозначает пиридильную или тиенильную группу или R7 обозначает группу NR8R9, где
- R8 и R9 - вместе с атомом азота, с которым они связаны, образует насыщенную или ненасыщенную, моноциклическую или бициклическую, гетероциклическую группу, имеющую от 4 до 10 атомов в кольце, и эта гетероциклическая группа содержит один или более гетероатомов из группы (O, N, S), и эта гетероциклическая группа может быть замещена разветвленной или линейной C1-3 алкильной группой, фенильной, гидроксильной или трифторметильной группой или атомом фтора, или
- R6 и R7 - вместе с атомом азота, с котором они связаны, образуют насыщенную или ненасыщенную, моноциклическую или бициклическую, гетероциклическую группу, имеющую от 4 до 10 атомов в кольце, и эта гетероциклическая группа содержит один или более гетероатомов из группы (O, N, S), и эта гетероциклическая группа может быть замещена разветвленной или линейной C1-3 алкильной группой, фенильной, амино, гидроксильной или трифторметильной группой или атомом фтора; и их фармакологически приемлемые соли и пролекарства.
К изобретению относятся все соединения, имеющие формулу (I), рацематы, смеси диастереомеров и индивидуальные стереоизомеры. Соответственно относятся к изобретению соединения, в которых заместители при возможных асимметрических атомах углерода находятся или в R-конфигурации или S-конфигурации.
Пролекарствами являются терапевтические средства, которые неактивны per se, но превращаются в один или несколько активных метаболитов. Пролекарствами являются биообратимые производные молекул лекарства, применяемые для преодоления некоторых препятствий к применению молекулы исходного лекарственного вещества. Эти препятствия включают, но ими не ограничиваются, растворимость, проницаемость, стабильность, пресистемный метаболизм и ограничение по целевой доставке соединения (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F. D. King, p.215; J. Stella, "Prodrugs as therapeutics", Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P. Ettmayer et al., "Lessons learned from marketed and investigational prodrugs", J.Med.Chem., 47, 2393-2404, 2004). Пролекарства, например соединения, которые при введении в человеческий организм любым известным способом, метаболизируются до соединений формулы (I), относятся к изобретению. Особенно это относится к соединениям с первичной или вторичной аминогруппой или гидроксильной группой. С такими соединениями могут реагировать органические кислоты с образованием соединений формулы (I), в которых присутствует дополнительная группа, легко удаляемая после введения в организм, например, но не как ограничение, амидин, енамин, основание Манниха, гидрокси-метиленовое производное, производное O-(ацилоксиметиленкарбамата), карбамат, сложный эфир, амид или енаминон.
В частности, изобретение относится к соединениям формулы (I), в которых X обозначает подгруппу (ii), и все другие символы имеют значения, описанные выше.
Более конкретно, изобретение относится к соединениям формулы (I), в которых X обозначает подгруппу (ii), и R обозначает фенил, тиенил, пиридинил, пиримидинил, пиразинил, пиридазинил или триазинил, которые могут быть замещены 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми и различными из группы метил, этил, пропил, метокси, этокси, гидрокси, гидроксиметил, гидроксиэтил, хлор, иод, бром, фтор, трифторметил, трифторметокси, метилсульфонил, фенил или циано, или R обозначает нафтил, и все другие символы имеют значения, описанные выше.
Общие аспекты синтеза
Соединения формулы (I) и синтетические промежуточные соединения формулы (II) и (VI) соответственно могут быть получены с помощью различных методик. Синтез структурно близких имидазолов как модуляторов каннабиноидных рецепторов описан в патентных заявках WO 03/027076 и WO 03/063781. Синтез структурно близких имидазолов как соединений против ожирения описан также в патентной заявке WO 03/040107. Выбор конкретного метода зависит от таких факторов, как совместимость функциональных групп с применяемыми реагентами, возможность применения защитных групп, катализаторов, активирующих и связывающих агентов и окончательных структурных особенностей синтезируемого конечного соединения. Более подробную информацию о способах активации и сочетания аминов с карбоновыми кислотами можно найти в:
a) M. Bodanszky and A. Bodanszky: The Practice of Peptide Synthesis, Springer-Verlag, New York, 1994; ISBN: 0-387-57505-7;
b) K. Akaji et al., Tetrahedron Lett., 1994, 35, 3315-3318;
c) F. Albericio et al., Tetrahedron Lett., 1997, 38, 4853-4856.
Более подробную информацию по реакциям амидирования сложных эфиров, промотируемым триметилалюминием Al(CH3)3, можно найти в: J. I. Levin, E. Turos, S. M. Weinreb, Synth Commun. 1982, 12, 989-993). Для дополнительной информации по нуклеофилам, электрофилам и по концепции уходящей группы см.: M. B. Smith and J. March: Advanced organic chemistry, p.275, 5th ed., (2001) John Wiley & Sons, New York, ISBN: 0-471-58589-0). Дополнительную информацию по введению и последующему удалению защитных групп в органическом синтезе можно найти в: T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", third edition, John Wiley & Sons, Inc., New York, 1999.
Подходящим синтезом для соединений изобретения является следующий:
Путь синтеза А
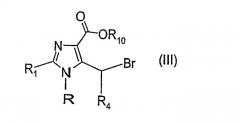
Взаимодействие соединения формулы (II)
где R, R1, R4 имеют значения, приведенные выше, и R10 обозначает разветвленную или линейную (С1-4) алкильную группу или бензильную группу, с региоселективным бромирующим соединением, таким как N-бромсукцинимид (NBS), в органическом растворителе, таком как CCl4, в присутствии инициатора свободных радикалов, такого как перекись дибензоила, может дать соединение формулы (III)
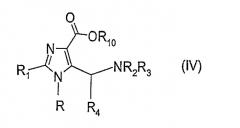
где R, R1, R4 и R10 имеют значения, приведенные выше. Реакция соединения формулы (III) с амином общей формулы R2R3NH может дать соединение общей формулы (IV)
где R, R1 R2, R3, R4 и R10 имеют значения, приведенные выше.
Соединения общей формулы (IV), которые получают согласно пути синтеза А, могут быть превращены в соединения общей формулы (I), где X обозначает подгруппу (ii), аналогично методикам, описанным в патентной заявке WO 03/027076.
Путь синтеза В
Взаимодействие соединения формулы (IV), где R, R1 R2, R3 и R4 имеют значения, приведенные выше, и R10 обозначает атом водорода
с N-метокси-N-метиламином может дать соединение формулы (V),
где R, R1 R2, R3 и R4 имеют значения, приведенные выше. Взаимодействие соединения формулы (V) с металлоорганическим соединением общей формулы R5-MgBr (реактивом Гриньяра) или R5-Li (литийорганическим реагентом) может дать соединение общей формулы (I), где X обозначает подгруппу (i). Такую реакцию предпочтительно проводят в атмосфере N2 в безводном инертном органическом растворителе.
Путь синтеза С
2-Арил-(1H)-имидазол-4-карбоксилаты могут быть получены согласно методике, описанной в Tetrahedron Lett. (1971), 18, 1439-1440 (Heindel and Chun). Последующее получение производных (например, реакция N-арилирования или N-алкилирования) по соответствующему N-атому имидазола может приводить к образованию соединений формулы (VI). Взаимодействие соединения формулы (VI)
где R и R1 имеют значения, приведенные выше, и R10 обозначает разветвленную или линейную (С1-4) алкильную группу или бензильную группу, с ненуклеофильным основанием, таким как диизопропиламид лития (ЛДА), с последующим взаимодействием с электрофилом, таким как этиловый эфир муравьиной кислоты, в инертном безводном органическом растворителе, таком как ТГФ, может дать соединение общей формулы (VII)
где R, R1, R4 и R10 имеют значения, приведенные выше в этом пути синтеза. Восстановительное аминирование соединения формулы (VII) амином общей формулы R2R3NH в присутствии восстановителя, например NaCNBH3, может дать соединение общей формулы (IV)
где R, R1 R2, R3, R4 и R10 имеют значения, приведенные выше в этом пути синтеза.
Соединения общей формулы (IV), которые получены согласно пути синтеза С, могут быть превращены в соединения общей формулы (I), где X обозначает подгруппу (ii), аналогично методикам, описанным в патентной заявке WO 03/027076.
Фармацевтически приемлемые соли могут быть получены по стандартным, хорошо известным специалистам методикам, например, смешением соединения настоящего изобретения с соответствующей кислотой, например неорганической кислотой, такой как хлористоводородная кислота, или с органической кислотой.
Благодаря активности в качестве модулятора каннабиноидного рецептора эти соединения согласно изобретению пригодны для применения для лечения психиатрических расстройств, таких как психоз, тревожное состояние, депрессия, дефицит внимания, расстройства памяти, расстройства мышления, расстройства аппетита, ожирение, особенно юношеское ожирение и ожирение, вызванное приемом лекарств, наркомания, влечение, лекарственная зависимость и неврологические расстройства, такие как нейродегенеративные расстройства, слабоумие, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, удар, болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона, синдром Туретта, церебральная ишемия, церебральная апоплексия, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные расстройства, склероз с бляшкообразованием, вирусный энцефалит, расстройства, связанные с демиелинизацией, также как и для лечения болевых ощущений, включая невропатические боли, и другие заболевания, связанные с каннабиноидной нейротрансмиссией, включая лечение септического шока, глаукомы, рака, диабета, рвоты, тошноты, астмы, респираторных заболеваний, желудочно-кишечных заболеваний, сексуальных расстройств, цирроза печени, язвы желудка, диареи и сердечно-сосудистых расстройств.
Активность этих соединений изобретения в качестве модуляторов каннабиноидных рецепторов делает их особенно полезными при лечении ожирения, юношеского ожирения и ожирения, вызванного приемом лекарств, когда их применяют в комбинации с ингибиторами липазы. Конкретными примерами соединений, которые могут применяться в таких комбинированных препаратах, являются (но не являются ограничениями) синтетический ингибитор липазы орлистат, ингибиторы липазы, выделенные из микроорганизмов, такие как липстатин (из Streptomyces toxytricini), ebelactone В (из Streptomyces aburaviensis), синтетические производные этих соединений, а также экстракты растений, о которых известно, что они обладают активностью по ингибированию липазы, например экстракты Alpinia officinarum или соединения, выделенные из таких экстрактов, такие как 3-метиловый простой эфир галангина (из A. officinarum).
Соединения изобретения могут быть переведены в удобные для введения формы обычными способами, используя вспомогательные вещества и/или жидкие или твердые вещества-носители.
Соединения изобретения обычно вводят в виде фармацевтических композиций, являющихся из-за присутствия в них раскрытых в описании соединений, особенно специфических соединений, важными и новыми воплощениями изобретения. Типы фармацевтических композиций, которые могут быть использованы, включают, но не в качестве ограничений, таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, суппозитории, суспензии и другие типы, раскрытые здесь или очевидные для специалистов в этой области из описания и известного уровня техники. В воплощениях изобретения предлагается фармацевтический пакет или набор, содержащий один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтической композиции изобретения. К таким контейнерам могут прилагаться различные рукописные материалы, например инструкции по применению, или заключение государственного органа, контролирующего вопросы производства, применения или продажу фармацевтических продуктов, в котором отражается одобрение государственного органа по поводу производства, применения или безопасности введения лекарственного препарата для человека или животного.
Фармакологические методы
Аффинность к каннабиноидным-СВ1 рецепторам in vitro
Аффинность соединений изобретения к каннабиноидным СВ1 рецепторам может быть определена в результате использования мембранных препаратов из клеток яичников китайского хомяка (СНО), в которых человеческий каннабиноидный СВ1 рецептор стабильно трансфицируют в сочетании с [3H]CP-55940 в качестве радиолиганда. После инкубации свежеприготовленного клеточного мембранного препарата с [3H]-лигандом, с или без добавления соединений изобретения, осуществляют разделение связанного и свободного лиганда фильтрацией на фильтрах из стекловолокна. Радиоактивность на фильтре измеряли жидкостным сцинтилляционным счетчиком.
Аффинность к каннабиноидным-СВ2 рецепторам in vitro
Аффинность соединений изобретения к каннабиноидным СВ2 рецепторам может быть определена в результате использования мембранных препаратов из клеток яичников китайского хомяка (СНО), в которых человеческий каннабиноидный СВ2 рецептор стабильно трансфицируют в сочетании с [3H]CP-55940 в качестве радиолиганда. После инкубации свежеприготовленного клеточного мембранного препарата с [3H]-лигандом, с или без добавления соединений изобретения, осуществляют разделение связанного и свободного лиганда фильтрацией на фильтрах из стекловолокна. Радиоактивность на фильтре измеряли жидкостным сцинтилляционным счетчиком.
Антагонизм каннабиноидного-CB1 рецептора in vitro
Антагонизм СВ1 рецептора in vitro может быть оценен с человеческим СВ1 рецептором, клонированным в клетки яичников китайского хомяка (СНО). Клетки СНО культивировали на среде Игла, модифицированной Дульбекко (DMEM) с добавлением инактивированной нагреванием 10% фетальной телячьей сыворотки. Среду аспирировали и заменяли на DMEM без фетальной телячьей сыворотки, но содержащую [3H]-арахидоновую кислоту, и выдерживали в течение ночи в инкубаторе (5% CO2/95% воздух; 37°C; насыщенная водой атмосфера). В течение этого периода [3H]-арахидоновая кислота внедряется в фосфолипиды мембраны. В день проведения теста среду аспирировали и клетки отмывали три раза 0,5 мл DMEM, содержащей 0,2% бычий сывороточный альбумин (BSA). Стимулирование CB1 рецептора при помощи WIN 55212-2 приводит к активации PLA2 и последующему высвобождению [3H]-арахидоновой кислоты в среду. Это вызванное WIN 55212-2 высвобождение является концентрационно зависимо антагонизируемым антагонистами CB1 рецепторов.
Антагонизм каннабиноидного-CB1 рецептора in vivo
Антагонизм СВ1 рецептора in vivo может быть оценен при помощи теста вызванной CP-55940 гипотензии у крыс. Мужские особи крыс с нормальным кровяным давлением (225-300 г; Harlan, Horst, The Netherlands) анестезируют пентобарбиталом (80 мг/кг ip). Кровяное давление измеряют с помощью катетера, вставленного в левую сонную артерию, при помощи датчика давления Spectramed DTX-plus (Spectramed B.V., Bilthoven, The Netherlands). После усиления при помощи усилителя постоянного тока Nihon Kohden (Type AP-621G; Nihon Kohden B.V., Amsterdam, The Netherlands) сигнал кровяного давления регистрируют на персональном компьютере (Compaq Deskpro 386s) при помощи программы сбора данных Po-Ne-Mah (Po-Ne-Mah Inc., Storrs, USA). Сердечный ритм получают из пульсирующего сигнала кровяного давления. Все соединения вводят перорально в виде микросуспензии в 1% метилцеллюлозе за 30 минут до введения анестезии, которая проводится на 60 минут раньше введения агониста CP-55940 CB1 рецептора. Объем инъекции составляет 10 мл/кг. После гемодинамической стабилизации вводят агонист CP-55940 СВ1 рецептора (0,1 мг/кг i.v.) и определяют гипотензивный эффект (Wagner, J. A.; Jarai, Z.; Batkai, S.; Kunos, G. Hemodynamic effects of cannabinoids: coronary and cerebral vasodilation mediated by cannabinoid CB1 receptors. Eur. J. Pharmacol. 2001, 423, 203-210); (Lange, J. H. M. et al., J. Med. Chem. 2004, 47, 627-643).
Агонистическая (частичная) активность каннабиноидного-CB1 рецептора in vivo
Агонистическая или частичная агонистическая активность соединений изобретения в отношении каннабиноидного рецептора может быть определена на основе опубликованных методов, например оценка каннабимиметических эффектов in vivo (Wiley, J. L. et al., J. Pharmacol. Exp. Ther. 2001, 296, 1013).
Определение растворимости в воде
Для получения исходных растворов с концентрацией 10 мг/мл соединения растворяют в ДМСО. Эти исходные растворы разделяют на несколько чашек. Проводят разбавление с помощью ДМСО для получения нескольких разбавленных растворов с концентрацией 5, 2,5, 1,25, 0,625 и 0,3125 мг/мл соответственно. Исходный раствор и каждый раствор, полученный разбавлением исходного раствора, разбавляют в 100 раз водой или водой, содержащей буфер. В каждом случае получают водный раствор, содержащий 1% ДМСО (объем.) и 100, 50, 25, 12,5 и 6,25 и 3,125 микрограмм соединения/мл соответственно. Образование осадка определяется в каждой чашке. Измерения проводили при pH 7, применяя буфер HEPES, и при pH 2, используя хлористоводородную кислоту. Растворимость в воде выражается в микрограмм/мл в нижеприведенной таблице.
Предполагается, что конкретные соединения, синтез которых описан ниже, далее более детально иллюстрируют изобретение и поэтому не следует считать, что они как-либо ограничивают объем изобретения.
Пример 1
Синтез конкретных соединений
Синтез соединения 1
Часть A: Этил-5-бромметил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1H-имидазол-4-карбоксилат. К перемешиваемой магнитной мешалкой смеси этил 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-метил-1H-имидазол-4-карбоксилата (2,05 г, 5,00 ммол) в CCl4 (25 мл) добавляли N-бромсукцинимид (NBS) (1,34 г, 7,53 ммоль) и перекись дибензоила (10,0 мг, анализ 75%, 0,0310 ммоль) и полученную смесь нагревали при кипении с обратным холодильником в течение 38 часов. Образовавшийся осадок удаляли фильтрацией. Фильтрат последовательно промывали рассолом и водой, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали флэш-хроматографией (CH2Cl2/ацетон=98/2 (объем/объем)), получая в результате этил-5-бромметил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1H-имидазол-4-карбоксилат (1,29 г, 53% выход) в виде твердого аморфного вещества, 1H-ЯМР (200 МГц, CDCl3): δ 1,45 (т, J=7 Гц, 3H), 4,48 (кв, J=7 Гц, 2H), 4,72 (с, 2H), 7,18-7,43 (м, 7H).
Часть B: К перемешиваемому магнитной мешалкой раствору этил-5-бромметил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1H-имидазол-4-карбоксилата (11,69 г, 23,9 ммоль) в ацетонитриле (40 мл) добавляли диизопропилэтиламин (DIPEA) (5,2 мл, 30 ммоль) и пирролидин (1,7 г, 23,9 ммоль) и в образующемся растворе происходило взаимодействие при комнатной температуре в течение 2 часов. Добавляли воду (250 мл) и полученную смесь экстрагировали три раза дихлорметаном. Собранные слои дихлорметана сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Последующая очистка флэш-хроматографией (петролейный эфир/EtOAc = 20/80 (объем/объем)) давала этил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(пирролидин-1-илметил)-1H-имидазол-4-карбоксилат (3,7 грамм, 32% выход). 1H-ЯМР (200 МГц, CDCl3): δ 1,42 (т, J=7 Гц, 3Н), 1,62-1,72 (м, 4Н), 2,42-2,50 (м, 4Н), 3,83 (с, 2Н), 4,43 (кв, J=7 Гц, 2H), 7,17-7,40 (м, 7H).
Часть C: Циклогексиламин (0,91 мл, 8 ммоль) растворяли в дихлорметане (20 мл) и добавляли (СН3)3Al (4 мл 2 M раствора в гептане, 8 ммоль). Полученную смесь перемешивали в течение 10 минут при комнатной температуре и добавляли этил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(пирролидин-1-илметил)-1H-имидазол-4-карбоксилат (1,8 г, 3,8 ммоль). Получающуюся смесь перемешивали при комнатной температуре в течение 16 часов, приливали к водному раствору NaHCO3, перемешивали в течение 30 минут и фильтровали через фильтр марки hyflo. Фильтрат дважды экстрагировали дихлорметаном. Органические слои сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Последующая флэш-хроматография (дихлорметан/метанол = 98/2 (объем/объем)) давала N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(пирролидин-1-илметил)-1H-имидазол-4-карбоксамид, соединение 1 (1,06 грамм, 53% выход). Температура плавления: 155-157°C.
Аналогично были получены следующие соединения 2-6:
2. N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(N-этил, N-метиламинометил)-1H-имидазол-4-карбоксамид. Температура плавления: 135-136°C.
3. N-(пиперидин-1-ил)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(N,N-диметиламинометил)-1H-имидазол-4-карбоксамид. Температура плавления: 163-166°C.
4. N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(N,N-диметиламинометил)-1H-имидазол-4-карбоксамид. 1H-ЯМР (400 МГц, CDCl3): δ 1,12-1,68 (м, 6H), 1,72-1,80 (м, 2H), 1,99-2,06 (м, 2H), 2,18 (с, 6H), 3,65 (с, 2H), 3,88-4,00 (м, 1H), 7,22-7,37 (м, 8H).
5. N-(пиперидин-1-ил)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(пирролидин-1-илметил)-1H-имидазол-4-карбоксамид. 2HCl. 1H-ЯМР (400 МГц, ДМСО-d6): δ 1,46-1,56 (м, 2H), 1,79-1,96 (м, 8H), 2,90-3,00 (м, 2H), 3,26-3,50 (м, 6H), 4,57 (уш.с, 2H), 7,45-7,60 (м, 6H), 7,70 (д, J=8 Гц, 1H), 10,95 (уш.с, 2H).
6. N-(пиперидин-1-ил)-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(N-этил, N-метиламинометил)-1H-имидазол-4-карбоксамид. 1H-ЯМР (400 МГц, CDCl3): δ 0,86 (т, J=7 Гц, 3H), 1,38-1,46 (м, 2H), 1,72-1,78 (м, 4H), 2,14 (с, 3H), 2,36 (кв, J=7 Гц, 2H), 2,82-2,86 (м, 4H), 3,72 (с, 2H), 7,21-7,31 (м, 6H), 7,34 (д, J=2 Гц, 1H), 8,16 (уш.с, 1H).
Пример 2
Определение растворимости в воде
Определяли растворимость в воде двух соединений общей формулы (I), соединений 1 и 4, и соединения 1-(4-хлорфенил)-2-(2,4-дихлорфенил)-N-циклогексил-1H-имидазол-4-карбоксамид (соединение 3 из патентной заявки WO 03/063781) согласно выше описанной методике. Результаты приведены в таблице 1.
| Таблица 1Растворимость в воде (выраженная в микрограмм/мл) | ||
| Название соединения | Растворимость в воде в микрограмм/мл при: | |
| pH 2 | pH 7 | |
| N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(пирролидин-1-илметил)-1H-имидазол-4-карбоксамид (соединение 1) | >100 | 50 |
| N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-5-(N,N-диметиламинометил)-1H-имидазол-4-карбоксамид (соединение 4) | >100 | 50 |
| N-циклогексил-1-(4-хлорфенил)-2-(2,4-дихлорфенил)-1H-имидазол-4-карбоксамид (WO 03/063781) | 25 | 25 |
Пример 3
Фармакологические данные
Результаты фармакологического испытания соединений изобретения, полученные по вышеописанной методике, приведены ниже в таблице 2.
| Таблица 2Фармакологические данные | |
| Соединение | Человеческий каннабиноидный-СВ1 рецептор |
| Аффиность in vitro - значение pKi | |
| Соединение 1 | 8,1 |
| Соединение 2 | 8,2 |
| Соединение 3 | 7,0 |
| Соединение 4 | 7,5 |
| Соединение 5 | 6,3 |
| Соединение 6 | 6,9 |
1. Соединения общей формулы (I)
где
R и R1 обозначают фенил, который может быть замещен 1, 2, 3 или 4 заместителями Y, которые могут быть одинаковыми или разными, выбранными из группы, состоящей из хлора, иода, брома, фтора, трифторметила и циано,
R2 и R3 являются одинаковыми или разными и обозначают С1-5 разветвленную или линейную алкильную группу, причем алкильная группа может быть замещена 1-3 атомами фтора, или
R2 и R3 вместе с атомом азота, с которым они связаны, образуют пирролидиновое или пиперидиновое кольцо,
R7 обозначает водород, C3-8циклоалкил, пирролидинил или пиперидинил,
и их фармакологически приемлемые соли.
2. Соединения общей формулы (IV)
где R, R1, R2 и R3 имеют такие же значения как в п.1, и R10 обозначает метил, н-пропил, изопропил, н-бутил, 2-бутил, изобутил или 2-метил-н-пропил или бензильную группу.
3. Фармацевтическая композиция, обладающая активностью модулятора каннабиноидных рецепторов, содержащая в качестве активного компонента по меньшей мере одно соединение по п.1.
4. Соединение по п.1 или его соль для применения в качестве модулятора каннабиноидных рецепторов.
5. Применение соединения по п.1 для получения фармацевтической композиции для лечения расстройств, связанных с каннабиноидной нейротрансмиссией.
6. Применение по п.5, где к указанным расстройствам относятся психоз, тревожное состояние, депрессия, дефицит внимания, расстройства памяти, расстройства мышления, расстройство аппетита, ожирение, особенно юношеское ожирение и ожирение, вызванное приемом лекарств, наркомания, влечение, лекарственная зависимость и неврологические расстройства, такие как нейродегенеративные расстройства, слабоумие, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, удар, болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона, синдром Туретта, церебральная ишемия, церебральная апоплексия, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные расстройства, склероз с бляшкообразованием, вирусный энцефалит, расстройства, связанные с демиелинизацией, также как и для лечения болевых ощущений, включая невропатические боли, и другие заболевания, связанные с каннабиноидной нейротрансмиссией, включая лечение септического шока, глаукомы, рака, диабета, рвоты, тошноты, астмы, респираторных заболеваний, желудочно-кишечных заболеваний, сексуальных расстройств, цирроза печени, язвы желудка, диареи и сердечно-сосудистых расстройств.
7. Применение по п.5, где указанными расстройствами являются расстройства питания, в частности ожирение, юношеское ожирение и ожирение, вызванное приемом лекарств.
8. Применение соединения по п.1 для получения фармацевтической композиции для лечения расстройств питания, в частности ожирения, юношеского ожирения и ожирения, вызванного приемом лекарств, где указанная фармацевтическая композиция также содержит по меньшей мере один ингибитор липазы.
9. Применение по п.8, где указанным ингибитором липазы является орлистат или липстатин.