Способ получения 6 -метилгидрокортизона или его 11 -алканоилоксипроизводных (варианты), способ получения 6 -метилпреднизолона или его 11 -алканоилоксипроизводных с использованием полученного 6 -метилгидрокортизона или его 11 -алканоилоксипроизводных
Иллюстрации
Показать всеИзобретение относится к улучшенным способам получения 6α-метилгидрокортизона или его 11β-алканоилоксипроизводных и 6α-метилпреднизолона или его 11β-алканоилоксипроизводных с использованием полученного 6α-метилгидрокортизона или его 11β-алканоилоксипроизводных. Получают 6α-метилгидрокортизон и его 11β-алканоилоксипроизводные способом, включающим предварительную защиту 11β,- 17α- и 21-гидроксильных групп гидрокортизона или его 21-ацилоксипроизводного поэтапно с образованием 17α,20;20,21-бисметилендиоксипроизводного (БМДО-защита диоксиацетоновой боковой цепи) и последующей этерификацией 11β-гидроксильной группы, метиленированием С6 положения, восстановлением 6-метиленовой группы в 6α-метильную. Реакцией 1,2-дегидрирования 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных путем микробиологической трансформации с помощью микробных клеток получают 6α-метилпреднизолон или его 11β-алканоилоксипроизводные. 2 н. и 15 з.п. ф-лы.
Реферат
Настоящее изобретение относится к области органического синтеза, конкретно касается получения стероидных соединений (кортикостероидов), таких как 6α-метилгидрокортизон и 6α-метилпреднизолон, и может быть использовано в химической, микробиологической и фармацевтической отраслях промышленности.
6α-Метилпреднизолон - кортикостероидный препарат, обладающий глюкокортикоидной активностью. По активности близок к преднизолону, но в отличие от преднизолона практически не обладает минералокортикоидной активностью [М.Д.Машковский. Лекарственные средства. 14-е издание. Том 2, с.30. Изд-во «Новая волна», Москва, 2002 г.]. Так, хорошо известный лекарственный препарат преднизолон (1,2-дегидропроизводное гидрокортизона) применяют при ревматизме, инфекционном неспецифическом полиартрите, бронхиальной астме, острой лимфатической и миелоидной лейкемии, инфекционном мононуклеозе, нейродермитах, экземе и других заболеваниях.
6α-Метилпреднизолон (1,2-дегидропроизводное 6α-метилгидрокортизона) по сравнению с преднизолоном обладает более высокой противовоспалительной и противоаллергической активностью и оказывает меньше побочных действий, в частности не раздражает слизистую оболочку желудочно-кишечного тракта.
Известные медицинские препараты 6α-метилпреднизолона [Depo-Medrol (Pharmacia Upjohn, Belgium); Medrol (Pharmacia Italia, Italia), Methylprednisolone (Sopharma, Bulgaria); Urbason, Medeson, Metypred (Corporation Finland) и др.] также применяются при заболеваниях ревматического характера, бронхиальной астме, сенной лихорадке, при переливании крови и в трансплантологии.
6α-Метилпреднизолон используется и в качестве субстрата для получения его производных, которые применяются как лекарственные препараты для местной обработки при различных кожных заболеваниях и ожогах, и для получения ингаляционных средств для терапии различных аллергических заболеваний дыхательных путей.
Известны способы получения 6α-метилпреднизолона из 6α-метилгидрокортизона с использованием методов микробиологической трансформации.
В частности, известен способ получения 6α-метилпреднизолона, включающий выращивание клеток бактерий Arthrobacter globiformis 193 и трансформацию 6α-метилгидрокортизона при аэрации с последующим выделением целевого продукта, в котором после выращивания клеток проводят их иммобилизацию в полиакриламидном геле, затем трансформацию ведут в неростовой среде в две стадии, причем на первой стадии процесс осуществляют, используя гидрокортизон в качестве субстрата и индуктора, по окончании первой стадии процесса из среды выделяют преднизолон, а на второй стадии в качестве субстрата используют 6α-метилгидрокортизон, при этом аэрацию осуществляют, подавая воздух импульсно с вытеснением всего объема отработанного газа [SU 1616147, 30.11.1994].
Известен способ получения 1,2-дегидропроизводных 4-дельта-3-кетостероидов путем трансформации 4-дельта-3-кетостероидов с помощью микроорганизма Arthrobacter globiformis 193 в присутствии циклодекстрина, отличающийся тем, что в качестве циклодекстрина используют водорастворимые химически модифицированные производные β-циклодекстрина [RU 2156302, 20.09.2000]. Однако известным способом получают преднизолон и в нем не описано получение 6α-метилпреднизолона из 6α-метилгидрокортизона.
Известен способ получения дегидроаналогов стероидов, включающий микробиологическую трансформацию соответствующих Δ4-3-кетостероидов в присутствии полимерного материала с последующим выделением из реакционной среды целевого продукта, отличающийся тем, что в качестве полимерного материала используют гомо- или сополимер N-винилкапролактама с мол.м. 104-106 или сополимеры N-винилкапролактама с виниловым спиртом, винилацетатом или винилметилацетамидом с содержанием оных до 46%, 45% и 15% соответственно [RU 2042687, 27.08.1995]. Однако известный способ заявлен в общем виде и изобретение не проиллюстрировано примерами, в нем не описано получение 6α-метилпреднизолона из 6α-метилгидрокортизона.
Промежуточным соединением в синтезе 6α-метилпреднизолона из гидрокортизона является 6α-метилгидрокортизон.
Известные способы введения С6-метильного заместителя в стероидную молекулу можно разделить на 2 группы.
В первую группу входят синтезы, включающие промежуточную эпоксидацию Δ5-двойной связи действием надкислоты. Для образования Δ5 - двойной связи исходные Δ4-3-кетосоединения подвергают кетализации, при этом одновременно проводя защиту 3 и 20-кетогрупп. Последующее раскрытие 5,6-эпоксида с одновременным введением метильной группы осуществляют метилирующим реагентом, например метиллитием или метилмагнийбромидом (схема 1). Так, например, известен способ введения метильной группы в положение С6, заключающийся в обработке 11β,17α,21-тригидрокси-5-прегн-4-ен-3,20-дион 3,20-бис(алкиленкеталя) (I) пербензойной кислотой в хлороформе, взаимодействием полученного 5α,6α-оксидо-11β,17α,21-тригидроксиаллопрегнан-3,20-дион 3,20-бис-(алкиленкеталя) (II) с метилмагнийбромидом в среде тетрагидрофурана, приводящим к 5α,11β,17α,21-тетрагидрокси-6α-метилаллопрегнан-3,20-дион 3,20-бис-(алкиленкеталю) (III). Последующее снятие защитной кетальной группы 2 н. серной кислотой в метаноле приводит к 5α,11β,17α,21-тетрагидрокси-6α-метилаллопрегнан-3,20-диону (IV), обработка которого водным 0,1 н. раствором гидроксида натрия в абсолютном этаноле приводит к целевому соединению - 6α-метилгидрокортизону (V) [US 2928851, 15.03.1960; G.B.Spero et al., J. Am. Chem. Soc., 1956, 78(23), 6213-6214].
Недостатками данного способа являются многостадийность, образование большого количества побочных продуктов, с чем связана необходимость дорогостоящей очистки конечных продуктов и, как следствие, невысокие выходы промежуточных и целевого соединений.
В другую группу входят способы синтеза 6α-метил-соединений, в частности 6α-метилгидрокортазона, ключевой стадией в которых является введение метиленовой группы в положение С6. Восстановление метиленовой группы в метальную группу приводит к целевому 6α-метал-соединению.
Введение С6-метиленовой группы осуществляют с использованием в качестве метиленирующего агента формальдегида или его производных. Эти способы предусматривают обязательную предварительную енолизацию α,β-ненасыщенного кетона кольца А, необходимую для поляризации системы двойных связей с образованием нуклеофильного атома углерода С6, с последующим замещением атома водорода при С6 на формильную или метиленовую группу и различаются тем, что в одних случаях образованный промежуточный диенол выделяют в виде эфира [D.Bum et al., Tetrahedron, 1965,21(6), 1619-1624] или диенамина [F.Schneider et al., Helv. Chim. Acta, 1973, 56(7), 2396-2404], в других же енолизация проводится in situ без выделения промежуточного продукта.
Известно несколько вариантов С6-метиленирования енолизованных Δ4-3-кето-стероидов. К первой группе методов С6-метиленирования можно отнести способ с применением формилирования по Вильсмейеру, ко второй группе - методы так называемой прямой конденсации с формальдегидом или его производными:
- метод прямого метиленирования, описанный Анненом и соавторами [US 4322349, 30.03.1982; Synthesis, 1982, №1, p.34-40; Liebigs Ann. Chem. 1983, (4), p.712; EP 0100874, 22.02.1984; EP 0149222, 24.07.1985]
- и метод конденсации с реагентом Манниха [R.Bohlmann et al., DE 4121484, 07/01.1993].
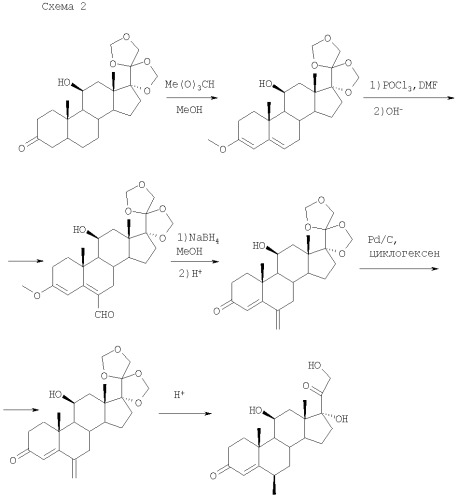
Метод с применением реактива Вильсмейера включает следующую последовательность реакций: присоединение реактива Вильсмейера к 3 - алкиловому эфиру Δ3,5-прегнадиена с образованием 6-формильного замещённого; дальнейшее превращение формильного производного реакцией восстановления до оксиметильного производного и последующими гидролизом и дегидратацией - в метиленовое [US 3074935, 22.01.1963; US 3112305, 26.11.1963; Burn D. et al., Tetrahedron, 1964, 20(3), 597-609]. Последующее каталитическое гидрирование двойной связи 6-метиленовой группы завершается образованием 6α-метильного заместителя [Burn D. et al., Tetrahedron, 1965, 21(6), 1619-1624; Burn D. et al., Tetrahedron, 1969, 25(5), 1155-1158; US 3117966, 14.01.1964 (схема 2)].
Метод прямого метиленирования, предложенный Анненом и соавторами, заключается во взаимодействии стероида с производными формальдегида (такими как диметилацеталь, диэтилацеталь формальдегида или метоксиметилацетат) в хлорированных растворителях при температуре кипения в присутствии избытка хлорокиси фосфора и ацетата натрия [Annen К. et al., Synthesis, 1982, №1, р.34-40; EP 0034115, 19.08.1981; DE 3004508, 06.08.1981; EP 0100874, 22.02.1984; EP 0149222, 24.07.1985; DE 3204281, 21.07.1983 (схема 3)].
Однако, несмотря на значительно более короткий путь к целевому продукту, этот способ не позволяет получать выход 6-метиленового производного из 21-ацетата гидрокортизона выше чем 50% [US 4322349; 30.03.1982, Annen, K.; Hofmeister, H.; Laurent, H. and Wiechert, R.Synthesys, 1982, №1, p.34-40].
Известен способ получения 6-метиленстероида из Δ4-3-кетостероида, в частности из 21-ацетата гидрокортизона, или его 3-енолэфира и формальдегида, отличающийся тем, что взаимодействие протекает в присутствии первичного или вторичного амина [DE 4121484, 07.01.1993], и заключающийся в том, что Δ4-3-кетостероид путем нагревания в среде тетрагидрофурана с этилортоформиатом в присутствии каталитического количества сульфокислоты превращают в соответствующий 3-енолэфир, который затем взаимодействует с реактивом Манниха, образующимся in situ из водного раствора формальдегида и N-метиланилина в присутствии того же катализатора. Последующая обработка соляной кислотой приводит к целевому продукту. Однако выход 6-метилен-производного 21-ацетата гидрокортизона также не превышает 50%.
Низкий выход можно объяснить наличием побочных реакций с участием незащищенных гидроксигрупп при С11 и С17. В жёстких условиях реакции прямого метиленирования (кипячение в хлорированных углеводородах с хлорокисью фосфора в течение 5-6 часов) или в условиях реакции Манниха в присутствии свободного гидроксила при С17 можно ожидать появление нежелательных продуктов дегидратации и D-гомоаннелирования. Поэтому даже применение защиты 11β-гидроксильной группы в виде трифторацетата или триметилсилильного эфира не позволяет достичь высоких выходов на стадии метиленирования при наличии свободной 17α-гидроксигруппы [US 4322349, 30.03.1982].
Для защиты диоксиацетоновой боковой цепи часто используют бисметилендиокси-защиту (БМДО-защита), позволяющую в одну стадию защитить имеющиеся в боковой цепи функциональные группы, включая гидроксильные. Однако формилирование 17,20;20,21-бисметилендиоксипроизводного гидрокортизона с незащищенной 11β-гидроксигруппой в условиях реакции Вильсмейера (ДМФ, POCl3 или фосген) также, по-видимому, не дает хорошего результата (авторы [GB 1070414; 01.06.1967] не приводят выход 6-формильного продукта), так как реакция формилирования при С6 в данном случае может осложняться побочными реакциями с участием 11β-гидроксигруппы. При этом достигаемый выход при С6-формилировании 21-пропионата 3-этокси-Δ3,5-производного также не превышает 53% [GB 1070414; 01.06.1967; D. Bum et al., Tetrahedron, 1969, 25(5), p.1155-1158].
Таким образом, мы пришли к выводу, что помимо обязательного выполнения условия енолизации существует другой общий для всех вариантов фактор, обеспечивающий успешность осуществления процесса С6 функционализации без образования нежелательных продуктов сопутствующих реакций по гидроксильным группам. Это необходимость предварительной защиты всех гидроксильных групп, имеющихся в структуре молекулы исходного стероида: не только защиты диоксиацетоновой боковой цепи, но и 11-гидроксигруппы.
Известно, что для защиты 11β-гидроксигруппы ее обычно превращают в тригалоацетат (в частности, трифторацетат) или используют триметилсилильную защиту. Эти защиты наиболее приемлемы, так как не только легко образуются, но и легко удаляются. Применение для защиты ангидридов низших кислот возможно, однако было ограничено (в частности, ранее не применялось при С6-метиленировании) из-за проблем, возникающих при их последующем удалении с помощью химических методов сольволиза.
Поэтому третьим существенным моментом в синтезе 6α-метилгидрокортизона является селективное удаление защитных групп без модификации структуры молекулы. Однако известно, что снятие защиты гидроксила при С11 применением традиционных методов химического сольволиза (например, щелочного гидролиза) может привести к образованию нежелательных продуктов трансдиаксиального элиминирования сложноэфирной группы с образованием Δ9(11)-двойной связи или продукта переэтерификации сложноэфирной группы с образованием трудноотделимого простого эфира.
Определенную трудность представляет удаление БМДО-защиты диоксиацетоновой боковой цепи, что является серьезным препятствием ее использования, особенно в коммерческих целях. Обычно используют для удаления БМДО-защиты смесь уксусной (или муравьиной) и концентрированной соляной кислот, а также концентрированной фтористоводородной кислоты [GB 1138173, 27.12.1968]. В этих условиях происходит образование побочных продуктов, например возможна этерификация свободных гидроксильных групп в стероидном ядре или в свободной боковой цепи (например, образование 11β-формиата, 21-формиата или продуктов D-гомо-перегруппировки). Попытка далее химически гидролизовать 11β-формиат, что требует значительно более жестких условий гидролиза, приводит к образованию существенного количества продуктов D-гомоаннелирования, а также к образованию продуктов деградации диоксиацетоновой боковой цепи. Все это приводит к снижению выхода конечного продукта и загрязнению его относительно большим количеством нежелательных побочных продуктов. Выход продукта гидролиза, как правило, не превышает 65-70%.
Общим недостатком использования известных способов является то, что при образовании значительных количеств примесей указанные выше методы неэффективны и при многократной кристаллизации происходят большие потери основного продукта. Для того чтобы избежать потерь основного продукта и повысить эффективность способа выделения, прибегают к различным приемам, например к хроматографированию на колонке с силикагелем.
Наиболее близким по сущности к предложенному способу получения 6α-метилгидрокортизона в части образования промежуточного С6-метилен-производного является способ получения 6-метилен-Δ4-3-кетостероида [US 4322349, 30.03.1982], включающий реакцию соответствующего Δ4-3-кетостероида с производным формальдегида в инертном растворителе при температуре от 20 до 80°С в присутствии сильного кислого конденсирующего агента, причем в качестве производного формальдегида могут быть использованы Н2С(ОХ)2 (где Х метил, этил или изопропил) или триоксан, а в качестве конденсирующего агента - производные фосфорной кислоты (например, пентоксид фосфора на носителе или оксихлорид фосфора в присутствии ацетата натрия), или сильно кислая катионообменная смола, или сильная кислота с рКа ∠1, такая как концентрированная серная кислота, хлористоводородная кислота, п-толуолсульфокислота или хлорная кислота. Способ проиллюстрирован примером (пример 5), заключающимся в том, что в синтезе 6-метиленпроизводного прямой конденсацией с производным формальдегида в присутствии сильного кислого конденсирующего агента используют гидрокортизон, 21-гидроксигруппа которого защищена с помощью образования ацетоксипроизводного, 11β- и 17α-гидроксигруппы защищены образованием нитроэфиров.
Так, раствор 21-ацетокси-11β,17α-динитроокси-4-прегнен-3,20-диона и метилаля в дихлорметане обрабатывают смесью пентоксида фосфора и силикагеля. Смесь перемешивают 3 дня при комнатной температуре и затем добавляют новые порции метилаля, пентоксида фосфора и силикагеля. Через 2 дня реакционную смесь отфильтровывают, остаток промывают дихлорметаном и упаривают в вакууме досуха. Продукт хроматографируют на силикагеле, используя градиентное элюирование. Из 5 г исходного соединения получают 2,6 г 6-метилен-замещенного.
Недостатками описанного в US 4322349 процесса являются:
- низкий выход продукта метиленирования - 21 -ацетокси-11β, 17α-динитроокси-6-метиленпрегн-4-ен-3-она;
- применение для очистки 21-ацетокси-11β,17α-динитроокси-6-метиленпрегн-4-ен-3-она колончатой хроматографии с градиентным элюированием, существенно усложняющей технологический процесс;
- отсутствие информации о способах удаления защитных групп и выходе 11β,17α,21-тригидрокси-6-метиленпрегн-4-ен-3-она.
Наиболее близким по сущности к предложенному способу получения 6α-метилпреднизолона является способ получения 1,2-дегидропроизводных кортикостероидов путем микробиологической трансформации кортикостероидов с помощью микроорганизма вида Arthrobacter globiformis в присутствии β-циклодекстрина и вещества, снижающего трансмембранный потенциал, с последующим выделением целевого продукта [RU 1830949, 09.07.1995], заключающийся в том, что с целью повышения эффективности процесса трансформации за счет снятия ингибирования субстратом при увеличении его исходной концентрации и увеличения степени превращения в качестве трансформирующего микроорганизма используют штамм Arthrobacter globiformis ИБФМ 193, а в качестве вещества, снижающего трансмембранный потенциал, используют аминокислоту (глицин, или оксипролин, или глутаминовую кислоту, или цистеиновую кислоту), или α-кетоглутаровую кислоту, или никотинамид, или ацетат ретинола, или их сочетания, а трансформацию проводят как свободными, так и иммобилизованными клетками микроорганизма.
Недостатками описанного в RU 1830949 процесса являются:
- применение дорогостоящих интенсификаторов процесса (аминокислот и других);
- использованные нагрузки исходного 6α-метилгидрокортизона не превышают 10 г/л.
Кроме того, использование иммобилизации клеток штамма-трансформатора (включение в полиакриламидный гель) значительно усложняет процесс и создает определенные трудности при его масштабировании: использование токсичных реагентов для иммобилизации (акриламид, метиленбисакриламид), невозможность использования стандартного ферментационного оборудования из-за механического разрушения биокатализатора в процессе трансформации.
Технической задачей одного из изобретений заявленной группы является, таким образом, повышение эффективности и технологичности проведения микробиологического 1,2-дегидрирования и получение 6α-метилпреднизолона (или его 11β-алканоилоксипроизводных) из 6α-метилгидрокортизона (или его 11β-алканоилоксипроизводных) способом, лишенным вышеуказанных недостатков.
Технической задачей в заявленной группе изобретений является увеличение выхода целевых продуктов путем снижения вероятности протекания побочных реакций на стадии функционализации положения С6 стероидной молекулы, практически полное исключение образования побочных продуктов и осмоления реакционной массы на стадии удаления защитных группировок и получение 6α-метилгидрокортизона и 6α-метилпреднизолона способами, лишенными вышеуказанных недостатков.
Техническая задача решается способом получения 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных общей формулы (I)
где R1=H, или CF3СО, или СН3СО - группы,
из гидрокортизона или его 21-ацилоксипроизводного общей формулы (II)
где R=H или Acyl,
включающим предварительную последовательную защиту 11β,- 17α- и 21-гидроксильных групп гидрокортизона (или его 21-ацилоксипроизводного) сначала путем введения БМДО-защиты - защиты диоксиацетоновой боковой цепи (17α- и 21-гидроксильных групп) с образованием 17α,20;20,21-бисметилендиоксипроизводного - и последующей алканоилокси- защиты 11β-гидроксильной группы с образованием 11β-алканоилокси- замещенного; С6-метиленирование образовавшегося 17α,20;20,21-бисметилендиокси-11β-алканоилоксипроизводного гидрокортизона, например, реакцией формилирования с помощью реактива Вильсмейера или конденсацией с формальдегидом или его производным при соотношении их соответственно от 1 до 10 молей реагента на 1 моль стероида с образованием 17α,20;20,21-бисметилендиокси-11β-алканоилокси-6-метиленпроизводного; восстановление полученного 6-метиленпроизводного в 6α-метилпроизводное, последовательное удаление защиты гидроксильных групп химическим путем (сольволизом) или поэтапно удалением БМДО-защиты химическим путем, а защиты 11β-гидроксильной группы - ферментативным дезацилированием; выделение 6α-метилгидрокортизона из культуральной жидкости, при этом восстановление 6-метиленпроизводного в 6α-метилпроизводное осуществляют до или после удаления защиты 11β,- 17α- и 21- гидроксильных групп полностью или частично.
В случае удаления защитной 11β-ацилоксигруппы микробиологическим дезацилированием его осуществляют с помощью штамма Agromyces mediolanus ВКМ Ас-1388 (syn. Corynebacterium mediolanum) или Nocardioides sp. ABT 13.
Еще одним изобретением заявленной группы является получение 6α-метилпреднизолона или его 11β-алканоилоксипроизводных 1,2-дегидрированием с использованием в качестве исходного вещества 6α-метилгидрокортизона или его 11β-алканоилоксипроизводных, полученных вышеописанным способом по изобретению, методом микробиологической трансформации с помощью микроорганизмов и последующего выделения целевого продукта из культуральной жидкости. При этом микробиологическую трансформацию осуществляют, например, с помощью микроорганизмов рода Nocardioides (например, Nocardioides, Arthrobacter).
Техническая задача в части получения 6α-метилпреднизолона (или его 11β-алканоилоксипроизводных) с использованием в качестве исходного (промежуточного соединения) полученного 6α-метилгидрокортизона или его 11β-алканоилоксипроизводных достигается получением 6α-метилпреднизолона или его 11β-алканоилоксипроизводных общей формулы (III)
где R1=Н, или CF3СО, или СН3СО - группы,
из 6α-метилгидрокортизона или его 11β-алканоилоксипроизводных общей формулы (I)
где R1=H, или CF3CO, или СН3СО - группы,
методом микробиологического 1,2-дегидрирования, например, в присутствии полимерных синтетических или природных соединений (включая химически модифицированные природные полимеры) с использованием концентраций исходного субстрата до 15 г/л и выделение целевого продукта из культуральной жидкости.
Таким образом, сущность заявленной группы изобретений, в которую входят получение 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных и далее 6α-метилпреднизолона (или его 11β-алканоилоксипроизводных) с их использованием заключается в том, что гидрокортизон (или его 21-ацилоксипроизводное) сначала подвергают защите 11β,- 17α- и 21- гидроксильных групп, затем метиленированию положения С6, восстановлению 6-метиленовой группы, удалению защитных группировок полностью или частично с последующим проведением микробиологической реакции 1,2-дегидрирования.
С целью повышения выхода и упрощения процесса защищенный по 11β,- 17α- и 21- гидроксильным группам гидрокортизон подвергают метиленированию положения С6 и далее восстановлению 6-метиленовой группы в 6α-метильную, которое проводят до или после удаления защитных группировок полностью или частично.
При этом защиту гидроксильных групп проводят поэтапно образованием 17α,20;20,21-бисметилендиоксипроизводного и последующей этерификацией 11β-гидроксила, а удаление защитных группировок осуществляют поэтапно: сначала БМДО-защиты химическим методом с последующим химическим сольволизом 11β-алканоилокси-защиты в оптимальных условиях или наоборот.
Кроме того, 6-метиленирование может быть осуществлено с применением реактива Вильсмейера или методом конденсации с формальдегидом или его производным.
Кроме того, удаление защитных групп может быть проведено поэтапно удалением БМДО-защиты химическим путем, а защиты 11β-гидроксильной группы (например, CF3СО- и СН3СО - группы) микробиологическим дезацилированием или химическим сольволизом (например, CF3СО - группы).
Кроме того, микробиологическое дезацилирование осуществляют с использованием в качестве биокатализатора клеток бактерий Agromyces mediolanus BKM Ac-1388 или Nocardioides sp. ABT 13.
Кроме того, микробиологическое дезацилирование может быть проведено после восстановления 6-метиленовой группы в 6-метильную.
Кроме того, проведение последующего 1,2-дегидрирования с целью получения 6α-метилпреднизолона или его 11β-алканоилоксипроизводных может быть осуществлено микробиологически с применением бактериальных культур рода Nocardioides (например, Nocardioides, Arthrobacter).
Проведение 1,2-дегидрирования осуществляют с использованием отмытых клеток бактериальных культур рода Nocardioides.
Кроме того, микробиологическое дезацилирование может быть проведено после микробиологического 1,2-дегидрирования.
Кроме того, получение 6α-метилпреднизолона (III, R1=H) может быть проведено 1,2-дегидрированием 11β-алканоилоксипроизводных 6α-метилгидрокортизона (II, R1=CF3СО или СН3СО) комбинацией микробиологических процессов дегидрирования и дезацилирования с использованием концентраций исходного субстрата до 12, 5 г/л с выделением или без выделения промежуточного 11β-алканоилоксипроизводного 6α-метилпреднизолона (III, R1=CF3СО или СН3СО - группы).
Преимущества заявляемого способа состоят в следующем:
- проведение защиты всех гидроксильных групп;
- отсутствие необходимости использования многократной кристаллизации основного продукта или хроматографирования с целью его очистки, так как удаление БМДО-защиты может быть осуществлено до удаления защиты 11β-гидроксильной группы, что приводит к незначительному появлению побочных соединений;
- значительно сокращаются потери основного продукта;
- общий выход 6-метилгидрокортизона из гидрокортизона составляет 68%.
Получение 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных общей формулы (I) осуществляется по схеме 4.
Получение 6α-метилпреднизолона и его 11β-алканоилоксипроизводных общей формулы (III) осуществляется по схеме 5.
Ниже приводится в качестве примера подробное описание сущности изобретения. Гидрокортизон (11β,17α,21 - тригидроксипрегн-4-ен-3,20-дион) или его 21-ацилоксипроизводное общей формулы (II)
где R=H или R=Acyl,
подвергают последовательной защите 11β,-17α- и 21- гидроксильных групп сначала путем введения БМДО-защиты - защиты диоксиацетоновой боковой цепи (17α- и 21-гидроксильных групп) с образованием 17α,20;20,21-бисметилендиоксипроизводного (IV) - и последующей алканоилокси-защиты 11β-гидроксильной группы с образованием 11β-алканоилокси-замещенного (V). Полученный с выходом до 98,5% 17α,20;20,21-бисметилендиокси-11β-алканоилоксигидрокортизон (V) подвергают енолизации Δ4-3-кетосистемы (с выделением продукта енолизации VI или in situ), например, действием каталитического количества п-толуолсульфокислоты и взаимодействию с реактивом Вильсмейера с образованием формильного производного (VII) с последующим превращением его в 6-метиленовоепроизводное (VIII) или конденсации с производным формальдегида с образованием 6-метиленпроизводного (VIII), который далее превращают в 17α,20;20,21-бисметилендиокси-11β-алканоилокси-6α-метилгидрокортизон (IX). Затем удалением 17α,20;20,21-бисметилендиокси-защиты химическим путем и последующим химическим или микробиологическим депротекционированием 11β-алканоилоксигруппы соединения (IX) с применением дезацилирующей культуры (предпочтительно Agromyces mediolanus BKM Ac-1388 или Nocardioides sp. ABT 13) и введением 1,2-двойной связи методом микробиологического дегидрирования культурой (предпочтительно рода Nocardioides) получают 6α-метилпреднизолон (III). Депротекционирование 11β-алканоилоксигруппы может быть реализовано после введения 1,2-двойной связи в соединение (I). Депротекционирование 11β-алканоилоксигруппы может быть проведено одновременно с введением 1,2-двойной связи в соединение (I). Могут быть использованы как растущие, так и покоящиеся клетки культуры Agromyces mediolanus BKM Ac-1388 или Nocardioides sp. ABT 13, при этом нагрузка исходного субстрата составляет до 12,5 г/л, а продолжительность ферментации - от 6 до 24 часов. Нагрузка субстрата на стадии дегидрирования составляет до 15 г/л, продолжительность ферментации - от 6 до 24 часов.
Выделение 6α-метилгидрокортизона из культуральной жидкости осуществляют традиционной экстракцией несмешивающимся с водой растворителем или экстракцией стероида из пасты биомассы любым подходящим растворителем после ее предварительного отделения от водной фазы. Для извлечения стероида может быть также применен сорбционный способ извлечения. Выход 6α-метилгидрокортизона на стадии микробиологического дезацилирования составляет 96-98%.
Выделение 6α-метилпреднизолона и его 11β-алканоилоксипроизводных из культуральной жидкости осуществляют экстракцией из культуральной жидкости несмешивающимся с водой растворителем или сорбционным способом извлечения. Выход 6α-метилпреднизолона или его 11β-алканоилоксипроизводных на стадии микробиологического 1,2-дегидрирования составляет 98,5-99%.
Получают целевой продукт с выходом на стадиях биотрансформации до 97% суммарно.
Общий выход 6α-метилпреднизолона из гадрокортизона или его 21-ацилоксипроизводного составляет от 52 до 67% в зависимости от использованного варианта защиты 11β-гидроксильной группы и метода метиленирования.
Полученный в соответствии с предлагаемым способом 6α-метилгидрокортизон может быть использован не только как исходный субстрат для дальнейшего превращения в 6α-метилпреднизолон, а также как самостоятельный лекарственный препарат в виде 21-эфиров [J. Am. Chem. Soc., 1956, 78(23), 6213-6214; US 4912098, 27.03.1990].
Заявленная группа изобретений иллюстрируется следующими примерами, не ограничивающими ее.
Образование бисметилендиокси защиты диоксиацетоновой боковой цепи молекулы гадрокортизона или его 21-ацилоксипроизводного проводят с использованием минимально необходимого количества формальдегида (не менее 2 молей на 1 моль стероида) и неполярного растворителя в присутствии кислого катализатора.
В качестве донора формальдегида при осуществлении изобретения - способа получения 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных - могут быть использованы полимерные соединения формальдегида (формалин, параформ, триоксан и т.п.).
В качестве неполярного растворителя при осуществлении изобретения - способа получения 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных - используют, например, хлорированные углеводороды (хлористый метилен, дихлорэтан, хлороформ и т.п.), ароматические углеводороды (например, бензол, толуол и т.п.).
В качестве кислого катализатора могут быть использованы минеральные кислоты (предпочтительно серная кислота).
Ацилирование свободной гидроксильной группы при С11 проводят с использованием минимально необходимого количества ангидрида (или хлорангидрида) карбоновой кислоты (не менее 1 моля на 1 моль стероида) в безводных условиях в апротонном растворителе.
В качестве апротонного растворителя при осуществлении изобретения - способа получения 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных - используют, например, хлорированные углеводороды (хлористый метилен, дихлорэтан, хлороформ и т.п.), диалкилкетоны (например, ацетон, метилэтилкетон), циклические эфиры (например, тетрагидрофуран, диоксан).
В качестве производного формальдегида при получении 6-метиленпроизводных (как промежуточных продуктов при получении 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных) используют диалкилацетали формальдегида (например, метилаль, диэтилацеталь и т.п.), реагенты Манниха, полученные при взаимодействии формальдегида и органического основания (например, метиламин, диметиламин, N-метиланилин и т.п.).
В качестве восстановителей в реакции восстановления 6-метиленпроизводных в 6α-метилпроизводные в заявленном изобретении используют, например, борогидрид натрия, циклогексен и другие традиционно используемые восстановители, а также восстановление осуществляют гидрированием в присутствии традиционно используемых катализаторов, например палладия, адсорбированного на угле (палладиевый катализатор) и другие.
В качестве среды для проведения реакции восстановления могут быть использованы полярные растворители, такие как низшие карбоновые кислоты (например, уксусная кислота), алифатические спирты (например, метанол, этанол) или их эфиры (например, этилацетат).
Для удаления 17α,20;20,21-бисметилендиокси-защиты при осуществлении изобретения - способа получения 6α-метилгидрокортизона и его 11β-алканоилоксипроизводных - используют, например, минеральные кислоты (предпочтительно галоидоводородные, в частности соляную или фтористоводородную) в среде низшей карбоновой кислоты (муравьиная, уксусная и т.п.).
Удаление защиты 11β-гидроксильной группы (например, трифторацетильной) может быть реализовано химическим методом (сольволизом) или (например, ацильной или трифторацетильной) проведено микробиологическим методом.
Микробиологическое дезацилирование может быть реализовано как растущими, так и покоящимися клетками бактерий Agromyces mediolanus BKM.Ас-1388 (syn. Corynebacterium mediolanus) или Nocardioides Sp. АВТ 13.
Микробиологическое 1,2-дегидрирование может быть осуществлено покоящимися (отмытыми) клетками бактерий рода Nocardioides, например N. simplex Ac-1118, или Arthrobacter simplex ABT 21.
Микробиологическое дезацилирование и микробиологическое 1,2-дегидрирование могут быть осуществлены одновременно смесью бактерий N. simplex Ac-1118 (или Arthrobacter simplex ABT 21) и A. mediolanus BKM Ac-1388 (или Nocardioides. sp.ABT 13).
Пример 1. Получение 17α,20;20,21-бисметилендиокси-11β-гидроксипрегн-4-ен-3-она (IV).
Вариант 1.
К 290 г раствора 35 г формальдегида в 60%-ной серной кислоте добавляют 100 г гидрокортизона (IIa) и 2 л дихлорэтана при температуре 10-15°С. Реакционную массу перемешивают в течение 45 минут, слои разделяют. Органический слой промывают водой и 5% раствором бикарбоната натрия до рН 7. Растворитель упаривают досуха. Остаток растирают в метаноле, осадок отфильтровывают. Получают 103,1 г 17α,20;20,21-бисметилендиокси-11β-гидрокси-прегн-4-ен-3-она (IV) с выходом 92,4% и т.пл. 209-210°С.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.11 с (3Н, 18-СН3), 1.43 с (3Н, 19-СН3), 3.96 д, 3.99 д (АВ, 2Н, 21-СН2, J=9.1), 4.45 кв (1Н, 11-H, J=3.0 Гц), 5.01 с (1Н, OCH2O), 5.01 с (1Н, ОСН2О), 5.03 с (1Н, OCH2O), 5.20 с (1Н, OCH2O), 5.66 д (1Н, 4-Н, J=1.3 Гц).
Вариант 2.
К раствору 0,5 г формальдегида в 70% серной кислоте добавляют 1 г 21-ацетата гидрокортизона (II b) и 50 мл толуола. Реакционную массу перемешивают при комнатной температуре. По окончании реакции реакционную массу обрабатывают аналогично варианту 1. Получают 0,86 г соединения IV с выходом 86% и т.пл. 206-208°С.
Пример 2. Получение 11β-трифторацетокси-17α,20;20,24-бисметилендиокси-прегн-4-ен-3-она (Va).
К суспензии 4,6 г 17α,20;20,21-бисметилендиокси-11β-гидрокси-прегн-4-ен-3-она (IV) в 46 мл безводного ацетона при температуре не выше +5°С добавляют 4,6 мл триэтиламина и 2,73 мл трифторуксусного ангидрида. Реакционную массу перемешивают 30 минут при этой же температуре и выливают в 165 мл воды. Осадок отфильтровывают, промывают водой до рН 7.
Получают 5,6 г 11β-трифторацетокси-17α,20;20,21-бисметилендиокси-прегн-4-ен-3-она (V а) с выходом 98,5% и т.пл. 165-167°С.
Спектр ЯМР 1H (CDCl3, δ, м.д., J/Гц): 0.97 с (3Н, 18-СН3), 1.27 с (3Н, 19-СН3), 3.97 с (2Н, 21-СН2), 4.99 с (2Н, ОСН2O), 5.01 с (1Н, ОСН2О), 5.15 с (1Н, ОСН2О), 5.65 кв (1Н, 11-Н, J=2.8 Гц), 5.71 д (1Н, 4-Н, J=1.3 Гц).
Пример 3. Получение 11β-ацетокси-17α,20;20,21-бисметилендиокси-прегн-4-ен-3-она (Vb).
К раствору 10 г 17α,20;20,21-бисметилендиокси-11β-гидрокси-прегн-4-ен-3-она (IV) в 140 мл хлористого метилена добавляют при перемешивании 7 мл триэтиламина, 20 мл уксусного ангидрида и 0.6 г диметиламинопиридина. Реакцио