Способ получения рекомбинантного полипептида-антагониста соматотропного гормона со сниженным содержанием изоформных примесей (варианты)
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Варианты способов заключаются в том, что трисульфидную изоформу вводят в контакт с меркаптосоединением, либо с хелатообразователем, либо с солью металла. Способы позволяют получать полипептидный продукт со сниженным количеством трисульфидных изоформных примесей. 3 н. и 27 з.п. ф-лы, 5 ил.
Реферат
Перекрестная ссылка на родственную заявку
Настоящая заявка представляет собой постоянную заявку, претендующую на приоритет соответствующей временной заявки 60/406533, поданной 28 августа 2002 года, включенной в настоящую заявку в полном объеме посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение направлено, в целом, на рекомбинантные способы получения необходимого полипептида. Эти способы позволяют получать полипептидный продукт, включающий сниженное количество изоформных примесей. В частности, настоящее изобретение направлено на (1) рекомбинантный способ получения соматотропного гормона со сниженным количеством изоформных примесей и (2) рекомбинантный способ получения антагониста соматотропного гормона, например пегвисоманта, и его белкового промежуточного продукта, который также содержит сниженное количество изоформных примесей. Конкретнее, изоформные примеси, количество которых уменьшается способами, соответствующими настоящему изобретению, представляют собой трисульфидные и дефенилаланиновые изоформные примеси соматотропного гормона и антагониста соматотропного гормона (либо его промежуточного продукта), соответственно.
Предпосылки создания изобретения
Пегвисомант (pegvisomant) (сомаверт (Somavert®); Pharmacia Corp.) является антагонистом рецептора человеческого соматотропного гормона. Это аналог человеческого соматотропного гормона (hGH), подвергшегося структурному изменению. Аминокислотная последовательность белкового компонента/промежуточного продукта (В-2036) пегвисоманта отличается от аминокислотной последовательности человеческого соматотропного гормона в девяти положениях. Конкретные аминокислотные замены выглядят следующим образом: H18D, H21N, G120K, R167N, К168А, D171S, K172R, E174S и I179T. Как принято в данной области техники, первая литера (т.е. H18D) обозначает аминокислоту последовательности человеческого соматотропного гормона, занимающую пронумерованное положение (т.е. аминокислоту в восемнадцатом положении, как обозначено H18D), которая заменяется аминокислотой, обозначенной второй литерой (т.е. H18D). Таким образом, H18D обозначает замену аминокислоты гистидина. занимающей 18 положение в аминокислотной последовательности человеческого соматотропного гормона дикого типа, на аминокислоту аспарагин.
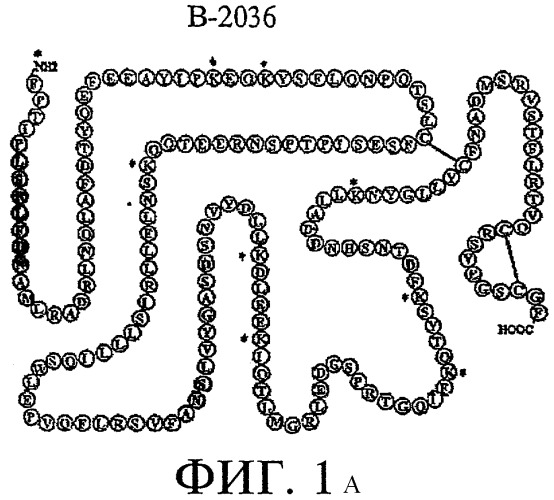
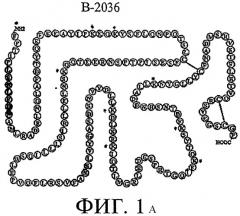
На Фиг.1А схематически показана структура аминокислотной последовательности белкового компонента/промежуточного продукта (В-2036) пегвисоманта (PEG В-2036), где звездочками указаны потенциальные участки присоединения полиэтиленгликолевого полимера ("PEG"-единицы). В дополнение к этому, листинг аминокислотной последовательности белкового компонента/промежуточного продукта (В-2036 - без присоединения PEG-единицы) пегвисоманта обозначен в данном описании как Последовательность 1 (SEQ. ID NO 1). Для сравнения, листинг аминокислотной последовательности человеческого соматотропного гормона обозначен в данном описании как Последовательность 2 (SEQ. ID NO 2). Оба листинга последовательностей прилагаются к настоящему описанию. Последовательность человеческого соматотропного гормона см. также в работе Йоргенсен (Jorgensen) и другие, "Quantifying biosynthetic human growth hormone in Escherichia coli with electrophoresis under hydrophobic conditions" ("Количественное определение биосинтетического человеческого соматотропного гормона в Escherichia coli посредством электрофореза в гидрофобных условиях"), J. Chromatography A 817:205-214 (1998).
В структурном отношении пегвисомант представляет собой белок (включающий 191 аминокислотный остаток), с которым ковалентно связано преимущественно от 4 PEG-единиц до 6 PEG-единиц. Молекулярная масса белкового компонента/промежуточного продукта (В-2036) пегвисоманта составляет 21998 Да (дальтон). Молекулярная масса каждой PEG-единицы пегвисоманта составляет приблизительно 5000 Да. Таким образом, преимущественные молекулярные массы пегвисоманта составляют приблизительно 42000 Да (4 PEG-единицы/молекулу), 47000 Да (5 PEG-единиц/молекулу) и 52000 Да (6 PEG-единиц/молекулу).
Обращаясь к агонисту и не связывая себя теоретическими выкладками, полагают, что эндогенный человеческий соматотропный гормон активирует свои рецепторы, когда одиночная молекула человеческого соматотропного гормона связывается с двумя смежными (и идентичными) рецепторными молекулами, индуцируя гормоноопосредованную гомодимеризацию рецептора. См. патенты США 5849535 и 6057292. Активность человеческого соматотропного гормона зависит от его способности связывать два смежных (и идентичных) рецептора через два отдельных сайта связывания (сайт 1 и сайт 2) одной молекулы человеческого соматотропного гормона. Эти сайты связывания человеческого соматотропного гормона, обозначенные как сайт 1 и сайт 2, помечены цифрами 1 и 2 для отображения порядка их связывания с двумя смежными (и идентичными) рецепторами человеческого соматотропного гормона, которые опосредуют гомодимеризацию, зависящую от человеческого соматотропного гормона.
Далее, не связывая себя теоретическими выкладками, полагают, что пегвисомант избирательно связывается с рецепторами человеческого соматотропного гормона ("рецепторы соматотропного гормона") на поверхностях клеток, где он блокирует связывание эндогенного человеческого соматотропного гормона, препятствуя тем самым трансдукции сигнала человеческого соматотропного гормона. Структурные модификации белковой части (называемой также "компонентом" либо "промежуточным продуктом") пегвисоманта (относительно человеческого соматотропного гормона) позволяют пегвисоманту конкурентно блокировать взаимодействие между молекулой человеческого соматотропного гормона и рецептором человеческого соматотропного гормона. Пегвисомант связывается с рецептором соматотропного гормона, блокируя тем самым связывание соматотропного гормона, поскольку рецептор занят. Структурные модификации предупреждают димеризацию рецептора, вследствие чего не происходит трансдукция сигнала. Блокируя подобным образом необходимое тесное взаимодействие между молекулой человеческого соматотропного гормона и рецептором человеческого соматотропного гормона, пегвисомант блокирует опосредуемую человеческим соматотропным гормоном гомодимеризацию рецепторов человеческого соматотропного гормона, что наделяет пегвисомант его антагонистической активностью.
Этот антагонист применяется для лечения состояний, включающих (но ею не ограничивающихся) акромегалию, у пациентов, которые неадекватно реагируют на хирургическое вмешательство, лучевую терапию и/или другие традиционные способы лечебного воздействия или же не могут переносить эти способы лечебного воздействия. В дополнение к этому, структурные модификации белковой части (В-2036) пегвисоманта являются причиной того, что последний демонстрирует сродство к связыванию с рецептором пролактина, которое ниже сродства к связыванию с рецептором человеческого соматотропного гормона, что ведет к снижению до минимального уровня наблюдающихся при лактации нежелательных побочных эффектов, связанных с применением пегвисоманта.
Белковый промежуточный продукт (В-2036) пегвисоманта синтезируется штаммом бактерии Escherichia coli, генетически модифицированной посредством добавления плазмиды, которая несет ген антагониста рецептора соматотропного гормона (В-2036). После этого В-2036 выделяют из микробных клеток и очищают. В последующем очищенный В-2036 подвергают полиэтиленгликолизации с получением пегвисоманта (PEG В-2036). В патентах США 5849535 и 6057292 описывают способы получения
В-2036 и способы конъюгирования одной или нескольких PEG-единиц с В-2036, хотя и без подробностей относительно того, каким образом снизить, уменьшить, ликвидировать, обратить и/или предотвратить образование неприемлемо высоких уровней трисульфидных и дефенилаланиновых изоформных примесей.
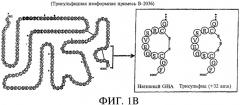
Одной из проблем, с которыми сталкиваются в случае применения традиционных рекомбинантных способов получения В-2036, является образование изоформных примесей последнего, например, дефенилаланиновой и трисульфидной изоформ. Дефенилаланиновая изоформная примесь представляет собой такую примесь, в которой у молекулы В-2036 отсутствует аминоконцевой фенилаланин. См. Фиг.1А, на которой представлен обсуждаемый аминоконцевой фенилаланиновый остаток (т.е. обозначенный литерой "F"), примыкающий к -NI-12-концевой области В-2036. Трисульфидная изоформная примесь представляет собой такую примесь, в которой молекула В-2036 включает добавочный атом серы, который образует "трисульфидный мостик" в пределах молекулы. См. часть страницы на Фиг.1В, заключенную в рамку. См. также работу Андерссон (Andersson) и другие, "Isolation and characterization of a trisulfide variant of recombinant human growth hormone formed during expression in Escherichia coli" ("Выделение и определение характеристик трисульфидного варианта рекомбинантного человеческого соматотропного гормона, полученного посредством экспрессии в Escherichia coli"). Int. J. Peptide Protein Res. 47:311-321 (1996), а также работу А. Йесперсон (A. Jesperson) и другие, "Characterisation of a trisulphide derivative of biosynthetic human growth hormone produced in Escherichia coli" ("Определение характеристик трисульфидной производной биосинтетического человеческого соматотропного гормона, полученной в Escherichia coli"), Eur. J. Biochem. 219:365-373 (1994). He связывая себя теоретическими выкладками, полагают, что эти изоформные примеси образуются, как правило, в процессе роста клеток (например, ферментации) и экспрессии (синтез и секреция) В-2036 в генетически модифицированных клетках-хозяевах и/или в процессе экстрагирования и очистки белка В-2036.
Что касается определенных примесей, в международной заявке WO 94/24157 (опубликованной 27 октября 1994 года) раскрывается гидрофобная производная человеческого соматотропного гормона, включающая дополнительный атом серы, сравнительно с нативным человеческим соматотропным гормоном. См. WO 94/24157, стр.3, строки 3-10. Дополнительный атом серы гидрофобной производной человеческого соматотропного гормона образует "трисульфидный мостик", что дает трисульфидный вариант человеческого соматотропного гормона. См. WO 94/24157, стр.7, строки 11-16. В упомянутой в качестве ссылки WO 94/24157 дополнительно утверждается, что этот трисульфидный вариант человеческого соматотропного гормона может быть превращен обратно в нативную форму человеческого соматотропного гормона посредством обработки трисульфидного варианта человеческого соматотропного гормона меркаптосоединением, например цистеином, глутатионом, 2-меркаптоэтанолом либо дитиотреитолом. См. WO 94/24157, стр.4-5.
В международной заявке WO 96/02570 (опубликованной 1 февраля 1996 года) описывается еще один способ превращения трисульфидного варианта человеческого соматотропного гормона обратно в нативную форму с помощью сульфита натрия, сульфита калия, сульфита аммония либо сульфита щелочно-земельного металла, например сульфита магния либо сульфита кальция. См. WO 94/24157, стр.4, строки 17-21.
В международной заявке WO 00/02900 (опубликованной 20 января 2000 года), озаглавленной "Method for the production of recombinant peptides with a low amount of trisulfides" ("Способ получения рекомбинантных пептидов с низким содержанием трисульфидов"), обсуждается "способ снижения количества трисульфидов при получении рекомбинантных пептидов, например, как белков, так и пептидов меньшей величины. Основой изобретения является новое и неожиданное открытие того, что количество трисульфидов при получении рекомбинантных пептидов может быть уменьшено посредством добавления соли металла, предпочтительно с избытком, уже на стадии ферментации либо после нее, а не посредством, как предполагалось ранее, превращения образовавшихся трисульфидов соматотропного гормона в нативную форму". (В тексте выделено). См. WO 00/02900, стр.2, строки 21-27. В приведенной в качестве ссылки WO 00/02900 дополнительно утверждается, что "упомянутым белком может быть любой рекомбинантный белок, которым предпочтительно является рекомбинантный соматотропный гормон как человеческого, так и животного происхождения, например, человеческий соматотропный гормон (hGH), соматотропный гормон крупного рогатого скота (bGH) и свиной соматотропный гормон (pGH)". (В тексте выделено). См. WO 00/02900, стр.3, строки 4-6.
Международная заявка WO 02/057478 (опубликованная 25 июля 2002 года), озаглавленная "Methods and Composition For Extracting Proteins From Cells" ("Способы и состав для экстрагирования белков из клеток"), направлена на способ выделения белка из клетки-хозяина посредством контактирования клетки-хозяина с восстановителем и детергентом. В упомянутой ссылке утверждается, что цель применения восстановителя заключается в "облегчении выделения белков в их нативных конформациях". См. WO 02/057478, стр.2, строки 16-18. В дополнение к этому, WO 02/057478 описывает, что "одним или несколькими восстановителями являются восстановители,... которые восстанавливают дисульфидные связи и/или сохраняют сульфгидрильные остатки в восстановленной форме. Применяться может любой такой восстановитель либо восстановители. В примере осуществления изобретения, которому отдают предпочтение, один или несколько применяемых восстановителей выбирают из группы, включающей дитиотриетол (DTT); дитиоэритритол (DTE); цистеин (Cys) и трис 2-карбоксиэтилфосфин (ТСЕР)". (В тексте выделено). См. WO 02/057478 со стр.3, строка 24, до стр.4, строка 4.
В вышеупомянутых ссылках, однако, ничего не говорится относительно предотвращения, обращения, снижения либо ликвидации образования изоформных примесей, связанных с антагонистом соматотропного гормона, например, пегвисомантом либо его белковой частью, В-2036. Соответственно, существует необходимость в улучшенных способах получения В-2036, которые снижают, уменьшают, предотвращают, сводят к минимуму, обращают и/либо ликвидируют образование изоформных примесей последнего (трисульфидных и/или дефенилаланиновых). Подобным же образом, упомянутые ссылки также ничего не говорят относительно обнаружения, уменьшения, сведения к минимуму, обращения, снижения либо ликвидации образования дефенилаланиновой изоформной примеси соматотропного гормона. Соответственно, существует необходимость в улучшенных способах получения соматотропного гормона, которые снижают, уменьшают, предотвращают, сводят к минимуму, обращают и/либо ликвидируют образование дефенилаланиновых изоформных примесей последнего.
Краткое описание чертежей
На Фиг.1А изображена аминокислотная последовательность В-2036, соответствующая Последовательности 1. Звездочками (*) на Фиг 1А обозначены девять (9) потенциальных участков для ковалентного присоединения PEG-единиц к каждой молекуле В-2036. Следует обратить внимание, что несмотря на то, что обозначены девять (9) возможных участков, не все 9 участков должны быть ковалентно связанными с PEG-единицами. Предпочтительно на молекулу В-2036 приходится 4-6 PEG-единиц.
На Фиг.1В представлена структура трисульфидной изоформной примеси В-2036 (обозначенная "Трисульфид (+32 amu)"), в сравнении с его желаемой формой (обозначенной "Нативный GHA" ("Нативный антагонист соматотропного гормона")).
Краткое изложение сущности изобретения
Учитывая вышеупомянутую необходимость предоставления улучшенного способа получения рекомбинантного агониста соматотропного гормона, рекомбинантного агониста человеческого соматотропного гормона, рекомбинантного антагониста соматотропного гормона и/или рекомбинантного антагониста человеческого соматотропного гормона со сниженными количествами их нежелательных изоформных примесей, настоящее изобретение направлено на улучшенные способы или на получение рекомбинантного соматотропного гормона (включая, но не ограничиваясь, человеческий соматотропный гормон) и рекомбинантного антагониста соматотропного гормона (включая, но не ограничиваясь, антагонист человеческого соматотропного гормона) со сниженными количествами их дефенилаланиновых и/или трисульфидных изоформных примесей.
Что касается рекомбинантного соматотропного гормона (включая, но не ограничиваясь человеческим соматотропным гормоном), образование его дефенилаланиновой изоформной примеси снижается добавлением достаточного количества (1) хелатообразователя или (2) соли металла, соответственно.
Что касается рекомбинантного антагониста соматотропного гормона (включая, но не ограничиваясь антагонистом человеческого соматотропного гормона), количество его трисульфидной изоформной примеси снижается посредством достаточного контакта между трисульфидной изоформной примесью и (1) меркаптосоединением, (2) хелатообразователем, (3) солью металла, (4) меркаптосоединением вместе с солью металла либо (5) меркаптосоединением после контактирования с хелатообразователем, но при отсутствии хелатообразователя, соответственно.
Что касается рекомбинантного антагониста соматотропного гормона (включая, но не ограничиваясь человеческим антагонистом соматотропного гормона), образование его дефенилаланиновой изоформной примеси снижается добавлением (1) хелатообразователя или (2) соли металла, соответственно.
Подробное описание предпочтительных примеров осуществления изобретения
Термины "антагонист соматотропного гормона" и "антагонист рецептора соматотропного гормона" включают (но не ограничиваются ими) полипептиды, которые угнетают либо иным образом антагонизируют связывание соматотропного гормона с его рецептором соматотропного гормона, блокируя биологический(-е) эффект(-ы) соматотропного гормона. Предпочтительно "антагонистом соматотропного гормона" или "антагонистом рецептора соматотропного гормона" является В-2036 либо его вариант. Такие "варианты" включают (но не ограничиваются ими) его гомологи (в частности, гомологи с консервативными аминокислотными заменами, добавлениями либо делениями относительно В-2036), аналоги, фрагменты, псевдопептиды, антитела и т.п. (соответственно), обладающие активностью антагониста рецептора соматотропного гормона.
Термины "агонист соматотропного гормона" и "агонист рецептора соматотропного гормона" включают (но не ограничиваются ими) полипептиды, которые связываются с рецептором соматотропного гормона и активируют его. Предпочтительно "агонистом соматотропного гормона" или "агонистом рецептора соматотропного гормона" является человеческий соматотропный гормон либо его вариант. Такие "варианты" включают (но не ограничиваются ими) гомологи (в частности, гомологи с консервативными аминокислотными заменами, добавлениями либо делениями относительно человеческого соматотропного гормона), аналоги, фрагменты, псевдопептиды, антитела и т.п. (соответственно), обладающие активностью агониста рецептора соматотропного гормона.
Термин "СОМАТОТРОПНЫЙ ГОРМОН И ЕГО АНТАГОНИСТ" означает агониста соматотропного гормона (т.е. "СОМАТОТРОПНЫЙ ГОРМОН") и антагониста соматотропного гормона (т.е. "И ЕГО АНТАГОНИСТ").
Термин "и" может означать "и" либо "или", в зависимости от того, что является подходящим или необходимым для объяснения способа получения необходимого снижения количества соответствующей примеси (например, трисульфидной либо дефенилаланиновой изоформной примеси).
Термин "или" может означать "и" либо "или", в зависимости от того, что является подходящим или необходимым для объяснения способа получения необходимого снижения количества соответствующей примеси (например, трисульфидной либо дефенилаланиновой изоформной примеси).
Термин "снижение" (или его очевидные варианты), используемый в настоящем описании, означает, если не указано иное, ликвидацию, сведение к минимуму, сокращение, предотвращение и/или уменьшение количества соответствующей изоформной примеси, будь то трисульфидная изоформная примесь либо дефенилаланиновая изоформная примесь.
Термин "клетка-хозяин" (или его очевидные варианты), означает, если не указано иное, любую клетку-хозяина, в которой может образовываться рекомбинантный В-2036 либо рекомбинантный человеческий соматотропный гормон. Соответственно, клеткой-хозяином может быть клетка-хозяин млекопитающего, клетка-хозяин растения либо клетка-хозяин микроба, например, Е. coli или даже дрожжевые клетки. Важно обратить внимание на то, что клеткой-хозяином является клетка, достаточная для выращивания в ней необходимого рекомбинантного белкового компонента В-2036 либо рекомбинантного человеческого соматотропного гормона. При этом не существует ограничений относительно того, какой может быть упомянутая клетка-хозяин, за исключением того, что она должна быть способной к рекомбинантному продуцированию представляющего интерес белкового компонента В-2036 либо рекомбинантного человеческого соматотропного гормона или их "вариантов".
Далее, термин "выращивание" (или его очевидные варианты, например, культивирование), используемый в настоящем описании, включает (но не ограничивается ими), если не указано иное, ферментирование и культивирование либо вызывание иным образом пролиферации клетки(-ок)-хозяина(-ев), достаточной для получения необходимых количеств рекомбинантного белкового компонента В-2036 либо рекомбинантного человеческого соматотропного гормона.
Далее, несмотря на то, что настоящее изобретение описывается относительно рекомбинантного В-2036 и рекомбинантного PEG В-2036, если не указано иное, следует понимать, что настоящее изобретение может применяться с любым рекомбинантным агонистом соматотропного гормона, рекомбинантным антагонистом соматотропного гормона, будь то соматотропный гормон млекопитающего или его антагонист, человеческий соматотропный гормон или его антагонист или же соматотропный гормон крупного рогатого скота или его антагонист и т.п.
Пегвисомант (PEG В-2036) представляет собой полиэтиленгликолизированную форму рекомбинантного белка (В-2036), продуцируемого рекомбинантными клетками-хозяевами (например, рекомбинантными, генетически модифицированными клетками-хозяевами Е. coli). Белок В-2036 продуцируется в процессе роста клетки (например, посредством ферментации) и экспрессии (синтез и секреция). После продуцирования В-2036 выделяют (например, посредством гомогенизации) с последующей очисткой (например, посредством экстрагирования, центрифугирования, обращенно-фазового и анионообменного хроматографирования и буферного обмена). Однако, как указывалось, во время рекомбинантного продуцирования белка В-2036 образуются нежелательные изоформные примеси В-2036, которые представляют собой трисульфидную и дефенилаланиновую изоморфные примеси В-2036.
Как указывалось, Фиг.1А иллюстрирует аминокислотную последовательность В-2036 со стандартными 1-литерными сокращениями, указывающими, какая аминокислота присутствует в каждом обозначенном литерой положении. Для справки, см. приведенное ниже соответствие между литерой и связанной с ней аминокислотой.
| Полипептидная аминокислота | ||
| Ala (A) | ||
| Glu (E) | ||
| Gin (Q) | ||
| Asp (D) | ||
| Asn (N) | ||
| Leu (L) | ||
| Gly (G) | ||
| Lys (K) | ||
| Ser (S) | ||
| Val (V) | ||
| Arg (R) | ||
| Thr (T) | ||
| Pro (P) | ||
| He (I) | ||
| Met (M) | ||
| Phe (F) | ||
| Tyr (Y) | ||
| Cys (C) | ||
| Trp (W | ||
| His (H) |
В дополнение к этому, аминокислотная последовательность В-2036 приведена в настоящем описании, как Последовательность 1, а аминокислотная последовательность человеческого соматотропного гормона приведена в настоящем описании, как Последовательность 2.
1. Рекомбинантный антагонист соматотропного гормона и его трисульфидная изоформная примесь
Фиг.1В иллюстрирует структуру аминокислотной последовательности трисульфидной изоформной примеси В-2036. В частности, трисульфидная изоформная примесь включает добавочный атом серы в мостике между цистеинами в положениях 182 и 189 белкового компонента В-2036.
а. Снижение содержания трисульфидной изоформной примеси с помощью меркаптосоединения(-й)
Не связывая себя теоретическими выкладками, полагают, что следствием контакта между избранным(-и) меркаптосоединением(-ями) и трисульфидной изоформной примесью рекомбинантного антагониста соматотропного гормона В-2036 является обратное превращение трисульфидного мостика цистеин-S-S-S-цистеин в его нативную форму цистеин-3-3-цистеин. В дополнение к этому, также не связывая себя теоретическими выкладками, возможно, что присутствие меркаптосоединения(-й) препятствует дополнительному образованию самого трисульфидного мостика.
Меркаптосоединение(-я), как правило, добавляется(-ются) к клетке(-ам)-хозяину(-евам), синтезирующей(-им) необходимый рекомбинантный белковый компонент В-2036 во время или после (или во время и после) выращивания клетки(-ок)-хозяина(-ев). Кроме того, после завершения стадий выращивания и контактирования, предпочтение отдается очистке белка В-2036. В последующем, очищенный белок предпочтительному подвергается полиэтиленгликолизации с получением PEG В-2036 (пегвисоманта). Процедуры полиэтиленгликолизации см. в патенте США 5849535.
В связи с настоящим изобретением может применяться любое меркаптосоединение, которое, при контактировании (предпочтительно с соответствующим перемешиванием) с белковым компонентом В-2036 вместе с его трисульфидной изоформной примесью, оказывается достаточным для снижения уровня трисульфидной изоформной примеси, предпочтительно без разложения (либо значительного разложения) выхода В-2036. К числу предпочтительных меркаптосоединений, пригодных для применения с настоящим изобретением, относятся (но ими не ограничиваются) сульфиты, глутатион, бета-меркаптоэтанол, дитиотреитол, меркаптоэтиламин, дитиоэритритол, гидрохлорид трис(2-карбоксиэтил)фосфина, цистеин и цистеин в сочетании с цистином.
Другие меркаптосоединения, пригодные для применения с настоящим изобретением, приведены в представленных ниже ссылках: (1) Дж.Хок (J.Houk) и Г.М.Вайтсайдс (G.M.Whitesides) "Structure-Reactivity Relations for Thiol-Disulfide Interchange", J. M. Chem. Soc., 109:6825-6836 (1987); (2) Зигмунд M. (Sigmund M.), The Chemistry&Biochemistry of the Sulfhydro Group in Ammo Acids, Peptides and Proteins, первое издание, Pergamon, New York (1973). В частности, перечень примерных меркаптосоединений, пригодных для применения с настоящим изобретением, см. в Таблице II работы Хок (Houk) и других в пункте (1).
Из числа подходящих меркаптосоединений наиболее предпочтительным является цистеин либо цистеин в сочетании с цистином (димеризованным цистеином). Количество цистеина либо сочетания цистеина и цистина (димеризованного цистеина, в случае его присутствия), пригодное для применения с настоящим изобретением, должно быть достаточным для снижения трисульфидной изоформной примеси по меньшей мере приблизительно на 10% от ее наивысшей полученной равновесной концентрации (либо ее наивысшей средней равновесной концентрации, в случае усреднения многочисленных партий). Предпочтительно снижение количества трисульфидной изоформной примеси составляет по меньшей мере около 20%, 30%, 40% или 50%, соответственно, от ее наивысшей полученной равновесной концентрации (либо ее наивысшей средней равновесной концентрации). Исходная объединенная концентрация цистеина и любого цистина, пригодная для применения с настоящим изобретением, составляет предпочтительно по меньшей мере около 0,1 мМ, от приблизительно 0,1 мМ до приблизительно 10 мМ либо от приблизительно 1 мМ до приблизительно 5 мМ, соответственно.
Меркаптосоединение предпочтительно предоставляется в буфере. Буфер предпочтительно является пригодным для применения с настоящим изобретением, т.е. не препятствует образованию белкового компонента В-2036 либо не разрушает его после образования. Подходящие буферы для применения в связи с настоящим изобретением включают (однако ими не ограничиваются) трис, фосфат, ГЭПЭС-буфер, лимонную кислоту, триэтиламин и гистидин. Предпочтительным буфером является трис. Предпочтительная исходная концентрация буфера составляет от приблизительно 1 мМ до приблизительно 200 мМ, более предпочтительно от приблизительно 5 мМ до приблизительно 100 мМ, еще более предпочтительно от приблизительно 8 мМ до приблизительно 70 мМ и наиболее предпочтительно от приблизительно 10 мМ до приблизительно 50 мМ. Могут применяться другие подходящие буферы. Предпочтительно количество этих буферов является достаточным для поддержания рН среды для выращивания где-то в пределах от приблизительно 4 до приблизительно 9, от приблизительно 7,5 до приблизительно 8,5 или от приблизительно 7,5 до приблизительно 8,0, соответственно. Примечательно, что в случае применения более высоких концентраций меркаптосоединения, переноситься могут более высокие уровни рН, например, в пределах 9,5. Таким образом, например, если цистеин применяется с большим избытком относительно В-2036, в таком случае рН буфера может достигать уровня приблизительно 9,5.
Как указывалось выше, меркаптосоединение предпочтительно предоставляется в буфере. Кроме того, количество меркаптосоединения в буфере должно быть таковым, чтобы мольное отношение молей меркаптосоединения к молям белка В-2036 составляло от приблизительно 0,5 до приблизительно 1000. Это особенно важно в том случае, когда применяемым меркаптосоединением является цистеин и факультативно цистеин в сочетании с цистином. Согласно альтернативному варианту мольное отношение молей меркаптосоединения к молям белка В-2036 может составлять от приблизительно 1 до приблизительно 1000, от приблизительно 1 до приблизительно 500 либо от приблизительно 1 до приблизительно 10, соответственно.
В типичном случае, после достаточного контакта (для снижения количества трисульфидной изоформной примеси) между меркаптосоединением и белковым компонентом В-2036 (осуществленного в пределах либо за пределами клетки(-ок)-хозяина(-ев)), концентрация белкового компонента В-2036 в буфере составляет от приблизительно 0,1 мг/мл до приблизительно 30 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл либо от приблизительно 1 мг/мл до приблизительно 10 мг/мл, соответственно.
Кроме того, температура среды для выращивания вместе с буфером, меркаптосоединением(-ями) и другими компонентами, включая (но не ограничиваясь им) В-2036, должна поддерживаться в пределах предпочтительно от приблизительно 0°С до приблизительно 25°С после добавления меркаптосоединения к клетке(-ам)-хозяину(-евам) либо лизату, содержащему белковый компонент В-2036. Также предпочтительно температура клетки(-ок)-хозяина(-ев) и/или лизата, содержащего компонент В-2036, поддерживается в пределах от приблизительно 1°С до приблизительно 15°С, от приблизительно 2°С до приблизительно 10°С либо от приблизительно 2°С до приблизительно 8°С, соответственно. Важно обратить внимание на то, что денатурация белка В-2036 происходит при температуре приблизительно +40°С. Вследствие этого температуру гомогената (т.е. содержащего клетки-хозяева, среду для выращивания, буфер, меркаптосоединения, В-2036 и т.п.) желательно поддерживать на уровне ниже температуры денатурации белка В-2036.
В дополнение к этому, продолжительность контакта между компонентом В-2036 и меркаптосоединением должна быть достаточной для снижения содержания трисульфидной изоформной примеси. Примерная подходящая продолжительность контакта для снижения содержания трисульфидной изоформной примеси должна составлять по меньшей мере приблизительно 30 мин, от приблизительно 1 ч до приблизительно 24 ч либо от приблизительно 1 ч до приблизительно 4 ч, соответственно.
В типичном случае, после достаточного контакта между меркаптосоединением(-ями) и компонентом В-2036 буфер, их содержащий, имеет объем от приблизительно 1 л до приблизительно 5000 л, от приблизительно 10 л до приблизительно 500 л либо от приблизительно 100 л до приблизительно 300 л, соответственно. Другие подходящие примерные объемы могут составлять где-то от 160 л до приблизительно 500 л.
К числу других параметров, которые могут представлять интерес в процессе контактирования меркаптосоединения(-ий) и компонента В-2036, относится скорость перемешивания. Скорость перемешивания должна быть достаточной для получения однородной смеси (клетки(-ок)-хозяина(-ев), лизата, буфера, меркаптосоединения(-ий), компонента В-2036 и любых других компонентов в одной среде для выращивания) со сведением к минимуму количества пены, которая может образовываться. Рядовые специалисты могут легко определить достаточную необходимую скорость смешивания. Очевидно, что скорость смешивания должна быть такой, при которой температура поддерживается в вышеупомянутых пределах и любое разрушение белкового компонента В-2036 сводится к минимуму.
b. Снижение содержания трисульфидной изоформной примеси с помощью хелатообразователя(-ей)
Не связывая себя теоретическими выкладками, полагают, что следствием контакта между избранным(-и) хелатообразователем(-ями) и (1) трисульфидной изоформной примесью, (2) рекомбинантным антагонистом соматотропного гормона В-2036, (3) клеточным(-и) компонентом(-ами) клетки-хозяина (для рекомбинантного продуцирования антагониста) и (4) всеми комбинациями (1)-(3) является обратное превращение трисульфидного мостика цистеин-S-S-S-цистеин в его нативную форму цистеин-8-5-цистеин или снижение уровней содержания примеси. В дополнение к этому, также не связывая себя теоретическими выкладками, возможно, что присутствие хелатообразователя(-ей) препятствует дополнительному образованию самого трисульфидного мостика.
Хелатообразователь(-и), как правило, добавляется(-ются) к клетке(-ам)-хозяину(-евам), синтезирующей(-им) необходимый рекомбинантный белковый компонент В-2036 во время или после (или во время и после) выращивания клетки(-ок)-хозяина(-ев). Кроме того, после завершения стадий выращивания и контактирования, предпочтение отдается очистке белка В-2036. В последующем, очищенный белок предпочтительно подвергается полиэтиленгликолизации с получением PEG В-2036 (пегвисоманта). Процедуры полиэтиленгликолизации см. в патенте США 5849535.
В связи с настоящим изобретением может применяться любой хелатообразователь, который, при контактировании (предпочтительно, с соответствующим перемешиванием) с белковым компонентом В-2036 вместе с его трисульфидной изоформной примесью, оказывается достаточным для снижения уровня трисульфидной изоформной примеси, предпочтительно без разложения (либо значительного разложения) выхода В-2036. К числу предпочтительных хелатообразователей, пригодных для применения с настоящим изобретением, относятся (но ими не ограничиваются) EDTA (этилендиаминтетрауксусная кислота), EGTA (этиленгликольтетрауксусная кислота) и DTPA (диэтилентриаминпентауксусная кислота). К числу дополнительных примерных хелатообразователей относятся (но ими не ограничиваются) дефероксамин, натрийдитиокарб, двунатрийкальцийэдетат, двунатрийэдетат, натрийэдетат, тринатрийэдетат, пеницилламин, тринатрийкальцийпентетат, пентетеновая кислота, сукцимер и триэнтин. Следует обратить внимание на то, что натрийэдетат представляет собой солевую форму EDTA.
Другие хелатообразователи, пригодные для применения с настоящим изобретением, приведены в представленных ниже ссылках: (1) The Merck Index, 12-е издание, под редакцией С.Будавари (S.Budavari), Merck&Co., Inc., Therapeutic Category and Biological Activity Index, p.THER-19 (в разделе "ХЕЛАТООБРАЗОВАТЕЛЬ"), Whitehouse Station, NJ (1996) и каждое последующее издание до настоящего времени; (2) Remington's Pharmaceutical Sciences, 16-e издание, под редакцией Артура Осол (Arthur Osol), Mack Publishing Co., Easton, Pennsylvania (1980) и каждое последующее издание до настоящего времени; (3) Фармакопея США (The United States Pharmacopeia), 21-е пересмотренное и исправленное издание (16-е издание), United States Phannacopeial Convention, Inc., Rockville, Maryland (1985) и каждое последующее издание до настоящего времени; (4) SIGMA, Biochemicals and Reagents for Life Science Research Catalogue, St. Louis, Missouri (2002-2003); и (5) Aldrich, Handbook of Fine Chemicals and Laboratory Equipment, Milwaukee, Wisconsin, издания (2000-2001) и (2002-2003).
Из числа подходящих хелатообразователей наиболее предпочтительным является EDTA. Количество хелатообразователя, пригодное для применения с настоящим изобретением, должно быть достаточным для снижения трисульфидной изоформной примеси по меньшей мере приблизительно на 10% от ее наивысшей полученной равновесной концентрации (либо ее наивысшей средней равновесной концентрации, в случае усреднения многочисленных партий). Предпочтительно снижение количества трисульфидной изоформной примеси составляет по мень