Способ очистки гетерологичного полипептида
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ предусматривает добавление к ферментационному бульону или гомогенату из Е.coli эффективного количества раствора этакридинлактата для осаждения загрязнений из клеток-хозяев в условиях, когда большая часть полипептида остается растворимой, и выделение гетерологичного полипептида из бульона или гомогената. Изобретение позволяет упростить очистку целевого полипептида и получить его с высокой степенью чистоты. 22 з.п. ф-лы, 13 ил., 3 табл.
Реферат
Основа создания изобретения
1. Область, к которой относится изобретение
Данное изобретение относится к способу очистки интересующих полипептидов из бульона после микробиологической ферментации или из гомогената. Более конкретно, в бульон или гомогенат вводят осаждающее средство, например, для осуществления удаления белка, ДНК или клеточного дебриса.
2. Описание предшествующего уровня техники
Развитие рекомбинантной технологии сейчас позволяет получать в подходящим образом трансформированных клетках высокие уровни белков. В результате существует повышенная потребность в быстрых, надежных и эффективных способах получения созданных рекомбинантным способом белков. Как правило, белки получают культивированием таких клеток, как клеточные линии млекопитающих, насекомых, грибов и бактерий, сконструированных для продукции интересующего белка посредством вставки рекомбинантной плазмиды, несущей ген данного белка. Так как используемые клеточные линии представляют собой живые организмы, им необходимо обеспечивать питание в виде комплексной среды для роста, содержащей сахара, аминокислоты и ростовые факторы, как правило, получаемые из препаратов сыворотки животных. Отделение желательного белка от смеси компонентов для питания клеток и от субпродуктов самих клеток до чистоты, достаточной для применения в качестве лекарственного средства для человека, представляет собой значительную проблему.
Процедуры очистки белков от клеточного дебриса исходно зависят от места экспрессии белка. Некоторые белки могут секретироваться напрямую из клетки в окружающую питательную среду; другие синтезируются внутриклеточно. Для белков, образующихся в клетках млекопитающих, схема очистки значительно проще, чем для полипептидов, образующихся в других типах клеток-хозяев. Клетки млекопитающих экспортируют полипептиды так, что их можно собрать из питательной среды, где они существуют в относительно чистой форме. Однако если полипептид образуется в клетках, отличных от клеток млекопитающих, например в клетках таких микроорганизмов, как грибы или E. coli, белок будет получен внутри клетки или в периплазматическом пространстве (Kipriyanov and Little, Molecular Biotechnology, 12: 173-201 (1999); Skerra and Pluckthun, Science, 240: 1038-1040 (1988)). Следовательно, необходимо высвободить белок из клеток во внеклеточную среду посредством экстракции, такой как лизис клеток. Такое разрушение превращает полное содержимое клетки в гомогенат и дополнительно образует субклеточные фрагменты, которые трудно удалить ввиду их малого размера. Их, как правило, удаляют посредством дифференциального центрифугирования или посредством фильтрации.
Лизис клеток, как правило, сопровождают применением способов механического разрушения, таких как гомогенизация или head milling. Хотя интересующий белок, как правило, выделяется эффективно, у таких способов есть несколько недостатков (Engler, Protein Purification Process Engineering, Harrison eds., 37-55 (1994)). Повышение температуры, что часто происходит в течение обработки, может приводить к взаимодействию белка. Кроме того, образующаяся в результате суспензия содержит широкий спектр загрязняющих белков, нуклеиновых кислот и полисахаридов. Нуклеиновые кислоты и полисахариды увеличивают вязкость раствора, потенциально затрудняя последующую обработку посредством центрифугирования, фильтрацию в поперечном потоке или хроматографию. Сложные ассоциации данных загрязнителей с интересующим белком могут осложнять процесс очистки и приводить к неприемлемо малым выходам.
По существу, более селективные способы высвобождения внутриклеточных белков облегчают дальнейшую дополнительную обработку. Для нарушения проницаемости клеточной мембраны и/или экстрагирования клеточных белков описаны несколько способов. Данные способы включают в себя применение растворителей, детергентов, хаотропных средств, антибиотиков, ферментов и хелатирующих средств для увеличения клеточной проницаемости и/или содействия экстракции. Описано, что добавки в течение роста культуры к среде ферментации определенных соединений, таких как глицин, также способствуют высвобождению определенных внутриклеточных ферментов. Наконец, также показано, что такие способы, как обработка способом замораживания-оттаивания или осмотическим шоком, высвобождают подклассы внутриклеточных белков.
Однако данные способы необязательно применимы ко всем внутриклеточным белкам микроорганизмов, и они все имеют ограниченное применение для крупномасштабной обработки и/или другие недостатки. Например, хотя такие растворители, как толуол или хлороформ, способствуют высвобождению внутриклеточных белков, известно, что данные вещества являются токсичными и/или канцерогенными (Windholtz et al., The Merck Index 10th Edition: 300 and 1364 (1983)). Ионные детергенты, такие как SDS, часто необратимо денатурируют выделяемые белки. Хотя неионные детергенты, как правило, не денатурируют, выделенные белки часто ассоциированы с мицеллами детергента, что может требовать дополнительной обработки для получения белка без детергента. Хаотропные средства, такие как мочевина и гуанидингидрохлорид, могут являться денатурирующими при концентрациях, необходимых для полного высвобождения, и их эффективность может зависеть от фазы роста культуры. Применение лизоцима, обеспечивающее относительно мягкое средство выделения белков, ограничено вследствие его относительно высокой стоимости и вследствие необходимости последующей очистки интересующего белка от фермента. Кроме того, хелатирующие средства, часто применяемые для увеличения эффективности других способов нарушения проницаемости мембран/выделения, таких как экстракция с применением лизоцима или толуола, страдают недостатком неспецифического выделения белков хозяина.
У других способов выделения белков также существуют недостатки. Например, для осмотического шока, при котором клетки суспендируют в среде с высоким осмотическим давлением, извлекают, а затем помещают в буфер с низким осмотическим давлением, необходимы дополнительные стадии обработки по отношению к другим альтернативам для экстракции (Moir et al., Separation Processes in Biotechnology, Asenjo eds: 67-94 (1990)) или необходимо поддерживать большие объемы жидкости при низких температурах. Это делает способ непривлекательным для широкомасштабной обработки.
Обработка замораживанием-оттаиванием также высвобождает внутриклеточные белки, однако относительно низкие выходы часто приводят к многократным циклам и дополнительным необходимым условиям для обработки. Кроме того, замораживание клеточной массы представляет собой дополнительное нетривиальное необходимое условие обработки по сравнению с другими альтернативами для экстракции.
Наконец, в течение ферментации добавляли реагенты, такие как глицин, для содействия высвобождению белков во внеклеточную среду (Aristidou et al., Biotechnology Letters15: 331-336 (1993)).Хотя сообщалось о частичном высвобождении некоторых внутриклеточных белков, данный подход требует прямого сопряжения стратегий ферментации и выделения и последующего отделения интересующего белка от потенциально сложного внеклеточного бульона.
После высвобождения интересующего полипептида из клетки-хозяина необходима его очистка от других клеточных компонентов. К сожалению, большинство способов экстракции, такие как лизис клеток, не только оставляют белок незащищенным от возможной деградации клеточными протеазами, но также делают отделение белка от других элементов полученной смеси более сложным. Например, присутствие отрицательно заряженных молекул, таких как ДНК, РНК, фосфолипиды и липополисахариды (LPS), часто требует применения анионообменной хроматографии (Sassenfeld, TIBTECH, 8: 88-93 (1990); Spears, Biotechnology, vol. 3--Bioprocessing, Rehm eds:40-51 (1993)) и/или осаждения поликатионами, такими как протаминсульфат (Kelley et al., Bioseparation,1: 333-349 (1991); Scopes, Protein Purification Principles and Practice, 2nd edition, Cantor eds., pp. 21-71 (1987)), стрептомицинсульфат (Wang et al., eds, Fermentation and Enzyme Technology: 253-256 (1979)), полиэтиленимин (PEI) (Kelley et al., выше; Sassenfeld, выше; Cumming et al., Bioseparation, 6: 17-23 (1996); Jendrisak, The use of polyethyleneimine in protein purification. Protein purification: micro to macro, ed. Alan R., Liss, Inc, 75-97 (1987); Salt et al., Enzyme and Microbial Technology, 17: 107-113 (1995)), и/или водной двухфазной экстракции в несмешивающихся полимерных системах, таких как полиэтиленгликоль (PEG)/фосфат или PEG/декстран (Kelley et al., выше, Strandberg et al., Process Biochemistry26: 225-234 (1991)).
Альтернативно интересующий белок можно отделить от небелковых полианионных загрязняющих веществ посредством добавления нейтральной соли, такой как сульфат аммония или хлорид калия (Wheelwright, Protein Purification: Design and Scale up of Downstream Processing: 87-98 (1991); Englard et al., Methods in Enzymology Volume 182, Deutscher eds.: 285-300 (1990)), и/или полимера, такого как PEG или сульфат декстрана (Wang et al.,выше; Wheelwright, выше). Когда интересующий белок заряжен положительно, он стремиться связаться с отрицательно заряженными молекулами, находящимися рядом, что делает очистку белка фактически невозможным.
Как правило, для отделения нарушающих работу полианионов от интересующего белка исследователи применяют описанные выше начальные стадии фракционирования. К сожалению, каждый из этих начальных способов разделения обладает серьезными недостатками, особенно когда их применяют в производстве фармацевтических реагентов. Например, большие количества небелковых полианионных загрязняющих веществ, находящихся в бактериальных лизатах, ведут к уменьшению связывающих способностей смол для анионообменной хроматографии. Кроме того, протоколы регенерации часто оказываются неэффективными вследствие прочного связывания полианионов со смолами (Spears, выше). В заключение, условия с низкой ионной силой, благоприятствующие белковому связыванию, неэффективны при разрушении взаимодействий полианион-белок и приводят к отсутствию разделения (Scopes, Protein Purification Principles and Practice, 3rd edition, Cantor eds., p. 171 (1994)). Препараты протаминсульфата загрязнены протеазными и вирусными загрязняющими веществами. Кроме того, при применении данного реагента может произойти нежелательное выпадение в осадок (Scopes, Protein Purification Principles and Practice, 2nd edition, Cantor eds., 21-71 (1987)).
При получении фармацевтических белков, как правило, стрептомицинсульфат не применяют вследствие общего опасения применять антибиотики в качестве реагентов для получения (Scawen et al., Handbook of Enzyme Biotechnology 2nd edition, Wiseman eds.: 15-53 (1985)). Препараты PEI часто загрязнены различными количествами мономера этиленимина, у которого подозревают наличие канцерогенных свойств (Scawen et al.,выше). PEI также приводит к необратимому связыванию со многими хроматографическими смолами, тем самым ограничивая его эфффективность и количество потенциально доступных для применения после очищения с применением PEI хроматографических смол. В общих чертах, поведение систем водной двухфазной экстракции трудно предсказать и часто для определения условий, при которых интересующих белок уходит в соответствующую водную фазу, необходим эмпирический подход (Kelley et al., выше).
Способы, которые специфически осаждают интересующий белок, часто приводят к захвату в осадок небелковых загрязняющих веществ, делая разделение неэффективным (Scopes, выше; Wheelwright, выше).
Примеры патентов, описывающих получение и очистку белка, включают в себя следующее:
В Патенте США № 5665866 описан способ получения антител в растворимой и правильно уложенной и собранной форме. Он включает в себя стадию одномоментного поднятия рабочей температуры от 34 до 60°C в процессе, выбранном для облегчения последующего выделения растворимого, правильно уложенного и собранного антитела, существенно очищенного от других связанных с антителом веществ.
В патенте США № 5760189 описан способ высвобождения подобного тиоредоксину гибридного белка вместе с отрицательно заряженным небелковым веществом из E. coli в раствор посредством добавления к раствору хелатора и осаждения отрицательно заряженного небелкового вещества из раствора посредством добавления к раствору раствора двухвалентного катиона/спирта с формированием первой растворимой фракции, содержащей белок, и первой нерастворимой фракции, содержащей нежелательные загрязняющие вещества. Необязательно температура до добавления хелатора может являться значительно холоднее, чем после добавления хелатора. Двухвалентный катион включает в себя, например, магний, марганец и кальций, отдельно или в сочетании.
В патенте США №5714583 описаны способы очистки фактора IX в растворе, включающие в себя стадии нанесения содержащего фактор IX раствора на анионообменную смолу, отмывки анионообменной смолы раствором с электрической проводимостью, меньшей, чем необходимо для элюции со смолы фактора IX, элюции анионообменной смолы первым элюантом с формированием первого элюата, нанесение элюата на гепарин или подобную гепарину смолу (например, отрицательно заряженный матрикс), элюирование гепарина или подобной гепарину смолы вторым элюантом с формированием второго элюата, нанесение второго элюата а гидроксиапатитную смолу, а затем элюирование гидроксиапатитной смолы третьим элюантов с формированием третьего элюата, содержащего очищенный фактор IX.
В патенте США №6322997 описан способ получения полипептида, включающий в себя воздействие на содержащую полипептид композицию реагента, связывающего или модифицирующего полипептид, где реагент иммобилизован на твердой фазе; а затем пропускание композиции через фильтр, несущий заряд, противоположный заряду реагента в композиции, для удаления из композиции выщелоченного реагента.
В патенте США №6214984 описана хроматография на основе гидрофобных взаимодействий при низком рН для очистки антител.
Конкретно данный патент относится к способу очистки антитела от загрязнений, включающему в себя нанесение содержащей антитела и загрязняющие вещества смеси на колонку для хроматографии на основе гидрофобных взаимодействий и элюцию антитела с колонки буфером с pH приблизительно 2,5-4,5. Как правило, pH смеси, наносимой на колонку, приблизительно такой же, как и элюирующий буфер.
Патент США № 6121428 относится к способу получения полипептида, включающему в себя воздействие на содержащую полипептид композицию связывающегося или модифицирующего полипептид реагента, где реагент иммобилизован на твердой фазе; а затем пропускание композиции через фильтр, несущий заряд, противоположный заряду реагента в композиции для удаления из композиции выщелоченного реагента.
Патент США № 5641870 относится к способу очистки антитела, где содержащую антитела и загрязняющие вещества смесь подвергают LPHIC, необязательно при низкой концентрации солей. Антитело элюируют с колонки в не связывающейся с ней фракции. На стадии экстракции осадки замороженных клеток ресуспендируют при комнатной температуре в 20 мМ буфере MES, pH 6,0, содержащем 5 мМ ЭДТА и 20 мМ 4,4'-DTP, предварительно растворенном в этаноле (3 литра буфера/кг клеточного осадка). Суспендированные клетки разрушают двукратным пропусканием через гомогенизатор Mantin Gaulin при скорости от 5500 до 6500 фунтов/дюйм2. Гомогенат доводят до 0,25% (об./об.) полиэтиленимином (PEI) и разводят равным объемом очищенной воды с температурой 2-8°C. Разведенный гомогенат затем центрифугируют. Фрагменты антитела находятся в супернатанте.
Исторически иммуноглобулин G (IgG) очищали из человеческих сыворотки и плазмы (Putnam, ed., The Plasma Proteins, vol. 1 (Academic Press, 1975)). Процесс очистки часто включал в себя одну или несколько стадий осаждения. Наиболее часто применяемая схема для получения IgG представляет собой фракционирование по Коэну (Cohn et al., J. Amer. Chem. Soc., 72: 465 (1950)). Однако сообщали о других способах осаждения (Niederauer and Glatz, Advances in Biochemical Engineering Biotechnology, v. 47 (Springer-Verlag Berlin Heidelberg, 1992); Steinberg and Hershberger, Biochim. et Biophys. Acta, 342: 195-206 (1974)). Первая работа по очистке IgG из плазмы с применением высокоароматического катионного красителя 6,9-диамино-2-этоксиакридинлактата (наименование USAN, а здесь называемого этакридинлактат и также известного под наименованиями ETHODIN™ или RIVANOL™) напечатана Horsjsi and Smetana, Acta Med. Scand., 155: 65 (1956). В последующую декаду был выпущен ряд публикаций, показывающих способность 6,9-диамино-2-этоксиакридинлактата очищать IgG и другие белки (Miller, Nature, 184: 450 (1959); Steinbuch and Niewiarowski, Nature, 186: 87 (1960); Neurath and Brunner, Experientia, 25: 668 (1969)) от биологических веществ, например плазмы и среды роста. Опубликовано применение этакридинлактата для получения антител и других белков из других источников. См. Tchernov et al., J. Biotechnol., 69: 69-73 (1999); SU 944580 опубликовано 28 июля 1982 года; Franek and Dolnikova, Biotech-Forum-Eur, 7: 468-470 (1990); EP 250288 опубликовано 23 декабря 1987 года; DE3604947 опубликовано 20 августа 1987 года; Rothwell et al., Anal. Biochem.,149: 197-201 (1985); Lutsik and Antonyuk, Biokhimiya, 47: 1710-1715 (1982); and Aizenman et al., Mikrobiol-Zh., 44: 69-72 (1982).
На первой стадии получения полипептидов из микроорганизмов наиболее часто проводят удаление твердого вещества, например клеток или клеточного дебриса. Важно осознавать необходимость в разделении желательного продукта от присутствующих в кондиционируемой среде компонентов, с которыми он специфически взаимодействует. Когда интересующий белок заряжен положительно, это приводит к связыванию любых присутствующих отрицательно заряженных молекул, тем самым делая очень трудной очистку белка традиционными способами. Дополнительное удаление в течение данной стадии загрязняющего растворимого белка из грубых микробиологических экстрактов, например гомогената E. coli, могло бы упростить дальнейшие стадии хроматографии. Такое дополнительное удаление могло бы являться особенно полезным для промышленного получения, приводя к уменьшению размера хроматографических колонок и времени получения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к очистке, как указано в формуле изобретения.
Конкретно в одном из аспектов изобретение относится к способу очистки желательного гетерологического полипептида из бульона или гомогената после микробиологической ферментации, в котором получение и растворение данного полипептида включает в себя добавление к бульону или гомогенату эффективного количества раствора 6,9-диамино-2-этоксиакридинлактата (этакридинлактата) для осаждения загрязняющих клетки-хозяева веществ в условиях, когда большая часть полипептида остается растворимой, и выделение желательного полипептида из бульона или гомогената.
В другом аспекте изобретение относится к ферментационному бульону или гомогенату микробиологических клеток, содержащему этакридинлактат и полипептид, гетерологичный для клеток.
Добавление этакридинлактата в качестве осаждающего средства неожиданно приводит к существенному удалению дебриса хозяина, включая белки хозяина. В данном процессе большинство белков хозяина вместе с клеточным дебрисом уходят в осадок, а полипептид остается в очищенном супернатанте. Увеличенная при применении этакридинлактата чистота очищенного экстракта приводит к уменьшению объема среды или смолы для хроматографии, необходимых для колонок, тем самым уменьшая размер, необходимый для последующей очистки. Это также приводит к исключению некоторой стадии(й) хроматографии, что улучшает время обработки и стоимость. Кроме того, указанный способ приводит к стабильному исходному сырью и его можно применять при нейтральном pH.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
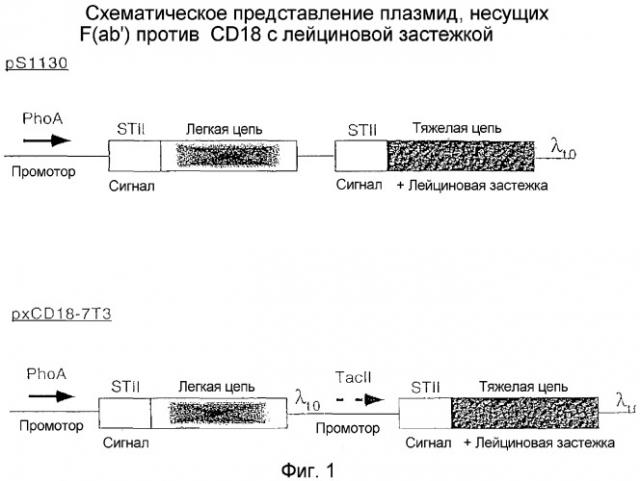
Фигура 1 представляет собой схематическое изображение конструкции плазмид pS1130 (один промотор) и pxCD18-7T3 (двойной промотор), кодирующих связанные лейциновой застежкой F(ab')2 к CD18.
На фигуре 2 изображена вставленная последовательность нуклеиновой кислоты (обозначенная как Anti-CD18-7T3.ДНК; SEQ ID № 1) конструкции pxCD18-7T3 с двойным промотором.
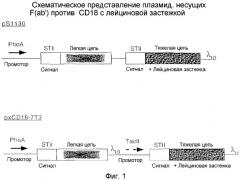
На фигурах 3A и 3B изображены аминокислотные последовательности (в совокупности обозначенные как Anti-CD18-7T3.Белок), кодируемые двумя трансляционными единицами в конструкции pxCD18-7T3 (SEQ ID №№ 2 и 3), обозначенные как STII + Anti-CD18 легкая цепь (фиг. 3A) и STII + Anti-CD18 тяжелая цепь (фиг. 3B) соответственно. N-концевые секреторные сигнальные последовательности STII подчеркнуты.
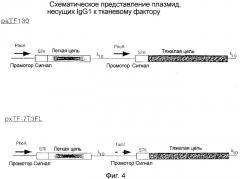
Фигура 4 представляет собой схему плазмид paTF130 (промоторы phoA/phoA) и pxTF-7T3FL (промоторы phoA/tacII), кодирующих IgG1 к тканевому фактору.
На фигуре 5 изображена вставленная последовательность нуклеиновой кислоты (обозначенная как Anti-TF-7T3FL.ДНК; SEQ ID № 4) конструкции pxTF-7T3FL с промотором phoA/tacII.
На фигурах 6A и 6B изображены аминокислотные последовательности (в совокупности обозначенные как Anti-TF-7T3FL.Белок), кодируемые двумя трансляционными единицами в конструкции pxTF-7T3FL (SEQ ID №№ 5 и 6), обозначенные как STII + Anti-TF легкая цепь (фиг. 6A) и STII + Anti-TF тяжелая цепь (фиг. 6B) соответственно. N-концевые секреторные сигнальные последовательности STII подчеркнуты.
На фигуре 7 изображена схематическая структура этакридинлактата.
На фигурах 8A-8C приведен анализ трех супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных значениях pH, как указано на каждой дорожке. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената E. coli, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 8А, 8В и 8С соответственно). Гомогенаты разводили в 4 раза 0,8% раствором этакридинлактата, т.е. до конечной концентрации этакридинлактата в каждом эксперименте 0,6%. Во всех образцах до нанесения на гель компенсировали объем. Следовательно, если достигнуто 100% получение, интенсивность полос должна являться сравнимой с экстрактом (X). Стрелки указывают на полосу продукта.
На фигурах 9А-9С приведен анализ супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных концентрациях этакридинлактата, как указано на каждой дорожке. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената Е. coli, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 9А, 9В и 9С соответственно). рН F(ab')2 к CD18, F(ab')2 к TF и полноразмерных антител к TF составлял 8,5, 7,5 и 6,0 соответственно. Удельная электропроводность в образцах составляла 3,2±0,2 мСм/см. Во всех образцах до нанесения на гель компенсировали объем. Следовательно, если достигнуто 100% получение, интенсивность полос должна являться сравнимой с экстрактом (X). Стрелки указывают на полосу продукта.
На фигурах 10А и 10В приведен анализ двух супернатантов после разведения водой или этакридинлактатом соответственно в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных уровнях электрической проводимости. Для данного исследования применяли гомогенаты Е. coli, содержащие F(ab')2 к CD18. Гомогенат разбавляли в 4 раза или водой (фиг.10А) или 0,8% раствором этакридинлактата, т.е. до конечной концентрации этакридинлактата в каждом эксперименте 0,6% (фиг.10 В), а рН доводили до 8,3. Для изменения электрической проводимости в образцы добавляли NaCl в различных концентрациях в диапазоне 0-400 мМ (как указанно на фигурах). Стрелки указывают на полосу продукта.
На фигуре 11 приведена диаграмма растворимости этакридинлактата при увеличении концентраций хлорида натрия. Образцы перед определением концентрации растворимого этакридинлактата три часа инкубировали при комнатной температуре. Пустыми символами указан 1,2% раствор этакридинлактата, а сплошными символами - 0,6% раствор. Сплошная линия представляет собой 0,6% раствор этакридинлактата при рН 6,0, пунктирная линия представляет собой 1,2% раствор этакридинлактата при рН 6, точечная линия представляет собой 0,6% раствор этакридинлактата при рН 9, и пунктирная линия с точками представляет собой 1,2% раствор этакридинлактата при рН 9.
На фигурах 12А-12С приведен анализ трех супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при повышенных температурах. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената Е. coll, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 12А, 12В и 12С соответственно). Гомогенат разводили в 4 раза до конечной концентрации этакридинлактата 0,6%, а pH для F(ab')2 к CD18, F(ab')2 к TF и полноразмерных антител к TF доводили до 8,5, 7,5 и 6,0 соответственно. Температура и время инкубации указаны на фигурах. Стрелки указывают на полосу продукта.
На фигуре 13 представлена диаграмма мутности как функции времени для трех различных супернатантов. Супернатанты из гомогената с F(ab')2 к CD18, обработанные 0,6% этакридинлактатом, обозначены как заштрихованные окружности (4°C) или пустые окружности (21°C), а образцы, обработанные 0,2% PEI, представлены как заштрихованные квадраты (4°C) и пустые квадраты (21°C). Супернатант, полученный из очищенного гомогената с F(ab')2 к CD18, который перед концентрацией разводили водой, представлен как заштрихованные треугольники (4°C) и пустые треугольники (21°C). Во всех случаях гомогенат с F(ab')2 к CD18 разводили в 4 раза, а pH составлял 7,2.
ПОДРОБНОЕ ОПИСАНИЕ И ПРЕДПОЧТИТЕЛЬНЫЕ ОСУЩЕСТВЛЕНИЯ
Определения
Выражение "бульон или гомогенат после микробиологической ферментации" относится к бульону, пасте или экстракту, предпочтительно ресуспендированным, полученным из микроогранизмов, включающих в себя дрожжи, грибы и прокариоты, такие как бактерии, которые культивировали и которые потребляли питательные вещества, вне зависимости от применяемого сосуда для культивирования, например, встряхиваемой колбы или ферментера. Предпочтительно бульон или гомогенат получают из дрожжей или прокариот. Наиболее предпочтительно бульон или гомогенат получают из бактерий. Здесь предпочтителен гомогенат. В некоторых случаях, если раствор обладает очень высокой удельной электропроводностью, это может являться предпочтительным для сбора клеток и их ресуспендирования, но в других случаях предпочтительно применять гомогенат, такой как гомогенат непосредственно из ферментера. Компоненты бульона или гомогената включают в себя клеточный дебрис, белок клетки-хозяина, ДНК, РНК и т.п. Таким образом, добавление сюда лактата приводит к избирательному осаждению белков клетки-хозяина и т.д., обеспечивая лучшую степень очистки, чем без применения лактата.
Выражение "в условиях, когда большая часть полипептида остается растворимой" относится к добавлению этакридинлактата в бульон или гомогенат в количествах и при температуре и уровне электрической проводимости, которые предотвращают выпадение в осадок из бульона или гомогената большей части интересующего белка. Предпочтительно такие состояния предотвращают от выпадения в осадок приблизительно более чем 60% полипептида, более предпочтительно - приблизительно более чем 70%, еще более предпочтительно - приблизительно более чем 75%, даже более предпочтительно - приблизительно более чем 80%, даже еще более предпочтительно - приблизительно более чем 85%, даже еще более предпочтительно - приблизительно более чем 90%, а наиболее предпочтительно - приблизительно более чем 95%. Данную степень растворимости измеряют посредством соответствующего анализа, например, такого как RP-HPLC, аффинная хроматография, ELISA, RIA и сочетание SDS-PAGE и высокоэффективной аффинной хроматографии (НРАС). Выбор анализа зависит от таких факторов, как тип применяемой клетки-хозяина и получаемого пептида.
"Бактерии" для целей данного описания включают в себя эубактерии и архебактерии. Предпочтительными из них являются эубактерии, включающие в себя грамположительные и грамотрицательные бактерии. Более предпочтительными являются грамотрицательные бактерии. Одним из предпочтительных типов бактерий являются Enterobacteriaceae. Примеры бактерий, принадлежащих Enterobacteriaceae, включают в себя Escherichia, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella. Другие типы пригодных бактерий включают в себя Azotobacter, Pseudomonas, Rhizobia, Vitreoscilla и Paracoccus. Здесь предпочтительны E. coli. Пригодные хозяева E. coli включают в себя E. coli W3110 (ATCC 27325), E. coli 294 (ATCC 31446), E. coli B и E. coli X1776 (ATCC 31537). Данные примеры являются иллюстративными, а не ограничивающими, а предпочтительным является W3110. Также можно использовать мутантные клетки любых указанных выше бактерий. Естественно, что необходимо выбрать подходящие бактерии, принимая во внимание реплицируемость репликона в таких бактериальных клетках. Например, в качестве хозяина соответствующим образом можно использовать виды E. coli, Serratia или Salmonella, когда для поддержания репликона применяют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Относительно примеров пригодных бактериальных клеток-хозяев см. далее ниже.
Как применяют здесь, выражение "клетка", "клеточная линия", "штамм" и "клеточная культура" применяют попеременно и все такие обозначения включают в себя потомство. Таким образом, слова "трансформанты" и "трансформированные клетки" включают в себя исходную обрабатываемую клетку и культуры, полученные из нее, вне зависимости от количества пересадок. Также понятно, что все потомство может являться не абсолютно идентичным по содержанию ДНК вследствие намеренных или случайных мутаций. Сюда включают мутантное потомство, обладающее той же функцией или биологической активностью, как показано для исходной трансформированной клетки. Когда подразумевают особые обозначения, это будет ясно из контекста.
Как применяют здесь, "полипептид", как правило, относится к пептидам и белкам из любого клеточного источника, состоящим из более чем приблизительно десяти аминокислот. "Гетерологичные" полипептиды представляют собой полипептиды, чужеродные для применяемой клетки-хозяина, такие как человеческий белок, продуцируемый E. coli. Хотя гетерологичный полипептид может являться прокариотическим или эукариотическим, предпочтительно он является эукариотическим, более предпочтительно - млекопитающих, а наиболее предпочтительно - человека. Предпочтительно он является продуцируемым рекомбинантным способом или рекомбинантным полипептидом.
Полипептид продуцируется и растворяется в ферментационном бульоне или гомогенате, означая, что он получен в таком бульоне или гомогенате и находится или уже в растворимой фракции, получаемой в процессе продукции, или находится в нерастворимой фракции, или форме, или фазе, которые обрабатывают и приводят в контакт с растворяющим средством, таким как хаотропное средство (например, мочевина или гуанидин) или детергент (такой как додецилсульфат натрия (SDS)), с восстанавливающим средством (таким как дитиотреитол или бета-меркаптоэтанол), так чтобы растворить полипептид. "Растворимый", "растворенный", "растворение", "разбавленный" или "разбавление" в используемом здесь смысле означает, что полипептид после центрифугирования находится в супернатанте, а не в твердой фракции. Можно определить выпадение осадка или степень растворимости, например, посредством соответствующих анализов, как отмечено выше.
Примеры полипептидов млекопитающих включают в себя такие молекулы, как, например, ренин, гормон роста, включающий в себя человеческий гормон роста; бычий гормон роста; фактор, высвобождающий гормон роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины; 1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; тромбопоэтин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы коагуляции, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы, противодействующие свертыванию, такие как протеин C; атриальный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназ или человеческая моча или тканевой активатор плазминогена (t-PA) и его варианты, такие как RETEVASE™ и TNKASE™; бомбезин; тромбин; гемопоэтический ростовой фактор; фактор некроза опухолей-альфа и -бета; антитела к домену(ам) ErbB2, такие как 2C4 (WO 01/00245; гибридома ATCC HB-12697), связывающиеся с областью во внеклеточном домене ErbB2 (например, одним или несколькими остатками в области ErbB2 приблизительно от остатка 22 до приблизительно 584 включительно), энкефалиназа; сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующее Мюллеровы протоки вещество; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный ассоциированный с гонадотропином пептид; микробиологический белок, такой как бета-лактамаза; ДНКаза; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы для гормонов или факторов роста; интегрин; протиен A или D; ревматоидные факторы; нейротропный фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротропин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF; кардиотрофины (фактор гипертофии сердца), такой как кардиотрофин-1 (CT-1); тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга), белки, связывающие инсулиноподобный фактор роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенный белок кости (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; сывороточный альбумин, такой как человеческий сывороточный альбумин (HSA) или бычий сывороточный альбумин (BSA); колониестимулирующие факторы (CSF), например M-CSF, GM-CSF, и G-CSF; интерлейкины (IL), например, начиная от IL-1 до IL-10; антитела к HER-2; лиганд Apo2; супероксиддисмутаза; рецепторы T-клеток; поверхностные мембранные белки; комплементзависимый стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки ВИЧ; транспортные белки; рецепторы "хоминга"; аддрессины; регуляторные белки; антитела; и фрагменты любого из перечисленных выше полипептидов.
Предпочтительные здесь полипептиды включают в себя человеческий сывороточный альбумин (HSA), 2C4, тканевой фактор, антитело к тканевому фактору, антитело к CD20, антитело к HER-2, херегулин, антитело к IgE, антитело к CD11a, антитело к CD18, VEGF и его рецепторы и антитела к нему, такие как rhuFab V2 и AVASTIN™, гормон роста и его варианты, такие как hGH, рецепторы гормона роста, белок, высвобождающий гормон роста (GHRP), LIV-1 (EP 1263780), TRAIL, фактор некроза опухолей (TNF) и антитела к нему, рецептор TNF и связанные антитела, рецептор TNF-IgG, ассоциированные с рецептором TNF факторы (TRAF) и их ингибиторы, фактор VIII, домен B фактора VIII, интерфероны, такие как интерферон-гамма, трансформирующие факторы роста (TGF), такие как TGF-бета, антитело к TGF, такие как антитело к TGF-бета, активин, ингибин, антитело к активину, антитело к ингибину, активаторы тканевого плазминогена и их варианты, такие как t-PA, RETEPLASE™ и TNKase, антитела к Fas, лиганду Apo-2; ингибитор лиганда Apo-2; рецептор Apo-2, Apo-3, факторы апоптоза, Ced-4, DcR3, рецептор гибели и антитела-агонисты (DR4, DR5), лимфотоксин (LT), пролактин, рецептор пролактина, белки SOB, WISP (индуцируемые wnt секретируемые белки), нейротоксин-3 (NT-3), фактор роста нервов (NGF) и антитело к NGF, ДНКаза, антиген вируса гепатита, антиген вируса простого герпеса, лептин, инсулиноподобные факторы роста (IGFs), такие как IGF-1 и IGF-2 и связывающие их белки и рецепторы, такие как IGFBP-1-IGFBP-6, инсулин, факторы роста фибробластов (FGF), такие как FGF-17, белок Toll, лиганды TIE, CD40 и антитело к CD40, иммуноадгезины, субтилизин, фактор роста гепатоцитов (HGF), тромбопоэтин (TPO), интерлейкины, такие как IL-2, IL-12, IL-17, IL-22, IL-8, IL-9, и антитела к ним, и специфический для простаты опухолевый антиген (PSCA).
Примеры антител, связывающих HER2, включают в себя 4D5, 7C2, 7F3 и 2C4, а также их гуманизированные варианты, включающие в себя huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8, как описано в таблице 3 патента США 5821337; и гуманизированные мутанты 2C4 №№ 560, 561, 562, 568, 569, 570, 571, 574 или 56869, как описано в WO01/00245. 7C2 и 7F3 и их гуманизированные варианты описаны в WO98/17797.
Примеры антител, связывающих антиген CD20, включают в себя "C2B8", названное сейчас "Rituximab" ("RITUXAN®") (патент США № 5736137); меченное иттрием-[90] мышиное антитело 2B8, обозначенное "Y2B8" (патент США № 5736137); мышиное IgG2a "B1", необязательно меченное 131I с получением а