Гексагидропиридоизохинолины в качестве ингибиторов дипептидилпептидазы iv (dpp-iv)
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I)
где
R1 выбирают из
R2 означает водород или (низш.) алкокси; R3, R4, R5 и R6 выбирают каждый независимо из водорода, (низш.) алкила, галоидированного (низш.) алкила, галоида или циклоалкила при условии, что R2, R3, R4, R5 и R6 не означают все водород; R7, R8 и R9 означают каждый независимо водород, (низш.) алкил, (низш.) алкокси, (низш.) гидроксиалкил или галоидированный (низш.) алкил при условии, что R7, R8 и R9 не означают все водород; R10 означает (низш.) алкил или галоидированный (низш.) алкил, и к их фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, а также к применению. Технический результат - получение новых биологически активных соединений, обладающих свойствами ингибиторов дипептидилпептидазы IV (DPP- IV). 3 н. и 13 з.п. ф-лы.
Реферат
Настоящее изобретение относится к новым производным пиридо[2,1-а]изохинолина, их получению и их применению в качестве лекарственных средств.
В частности, изобретение относится к соединениям формулы (I)
где R1 выбирают из
R2 означает водород или (низш.) алкокси;
R3, R4, R5 и R6 выбирают каждый независимо из водорода, (низш.) алкила, галоидированного (низш.) алкила, галоида или циклоалкила при условии, что R2, R3, R4, R5 и R6 не означают все водород;
R7, R8 и R9 означают каждый независимо водород, (низш.) алкил, (низш.) алкокси, (низш.) гидроксиалкил или галоидированный (низш.) алкил при условии, что R7, R8 и R9 не означают все водород;
R10 означает (низш.) алкил или галоидированный (низш.) алкил,
и их фармацевтически приемлемым солям.
Фермент дипептидилпептидаза IV (ЕС.3.4.14.5, сокращенный в дальнейшем как DPP-IV) вовлекается в регуляцию активностей некоторых гормонов. В частности, DPP-IV эффективно и быстро вызывает деградацию глюкагоноподобного пептида 1 (GLP-1), который является одним из наиболее мощных стимуляторов продукции и секреции инсулина. Ингибирование DPP-IV потенцировало бы эффект эндогенного GLP-1 и приводило к более высоким концентрациям инсулина в плазме. У пациентов, страдающих нарушенной толерантностью к глюкозе и сахарным диабетом типа 2, более высокая концентрация инсулина в плазме уменьшала бы опасную гипергликемию и, соответственно, снижала угрозу повреждения ткани. Следовательно, ингибиторы DPP-IV предложены в качестве лекарственных кандидатов для лечения нарушенной толерантности к глюкозе и сахарного диабета типа 2 (например, Villhauer, WO 98/19998). Другой родственный уровень техники может быть найден в WO 99/38501, DE 19616486, DE 19834591, WO 01/40180, WO 01/55105, US 6110949, WO 00/34241 и US 6011155.
Заявители нашли новые ингибиторы дипептидилпептидазы IV, которые очень эффективно снижают уровни глюкозы в плазме. Следовательно, соединения по настоящему изобретению являются полезными для лечения и/или профилактики диабета, особенно инсулиннезависимого сахарного диабета и/или нарушенной толерантности к глюкозе, а также других состояний, при которых усиление действия пептида, обычно инактивируемого дипептидилпептидазой IV, дает терапевтический выигрыш. К удивлению заявителей, соединения по настоящему изобретению могут также использоваться в лечении и/или профилактике ожирения, воспалительных заболеваний кишечника, язвенного колита, болезни Крона и/или метаболического синдрома или β-клеточной защиты. Более того, соединения по настоящему изобретению могут применяться в качестве диуретических агентов и для лечения и/или профилактики гипертензии. Неожиданным оказалось, что соединения по настоящему изобретению обладают улучшенными терапевтическими и фармакологическими свойствами по сравнению с другими ингибиторами дипептидилпептидазы IV, известными в данной области, такими, как, например, в связи с фармакокинетикой и биодоступностью.
Если не указано иначе, следующие дефиниции сформулированы, чтобы проиллюстрировать и определить значения и пределы различных терминов, использованных для описания контекста изобретения.
В данном описании термин «низший» используется для обозначения группы, состоящей из 1-6, предпочтительно 1-4 атомов углерода.
Термин «галоид» относится к фтору, хлору, брому и йоду, причем фтор и хлор являются предпочтительными. Наиболее предпочтительным галоидом является хлор.
Термин «алкил», один или в комбинации с другими группами, относится к разветвленному или линейному одновалентному насыщенному алифатическому углеводородному радикалу из одного до двадцати атомов углерода, более предпочтительно 1-10 атомов углерода. Термин «(низш.) алкил», один или в комбинации с другими группами, относится к разветвленному или линейному одновалентному алкильному радикалу из 1-6 атомов углерода, предпочтительно 1-4 атомов углерода. Данный термин, кроме того, иллюстрируется радикалами, такими, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, 3-метилбутил, н-гексил, 2-этилбутил и тому подобное. Предпочтительными (низш.) алкильными остатками являются метил и этил, причем метил является особенно предпочтительным.
Термин «галоидированный (низш.) алкил» относится к (низш.) алкильной группе, в которой по меньшей мере один из водородов (низш.)алкильной группы заменен атомом галоида, предпочтительно атомом фтора или хлора, наиболее предпочтительно фтором. Среди предпочтительных галоидированных (низш.) алкильных групп - трифторметил, дифторметил, фторметил и хлорметил - фторметил является наиболее предпочтительной группой.
Термин «алкокси» относится к группе R′-O-, в которой R′ означает алкил. Термин «(низш.) алкокси» относится к группе R′-O-, в которой R′ означает (низш.) алкил. Образцами (низш.) алкоксигрупп являются, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и гексилокси, причем метоксигруппа является особенно предпочтительной.
Термин «циклоалкил» относится к одновалентному карбоциклическому радикалу из 3-6, предпочтительно 3-5 атомов углерода. Данный термин, кроме того, иллюстрируется радикалами, такими, как циклопропил, циклобутил, циклопентил и циклогексил, причем циклопропил является предпочтительным.
Термин «фармацевтически приемлемые соли» охватывает соли соединений формулы (I) с неорганическими или органическими кислотами, такими, как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, винная кислота, метансульфоновая кислота, салициловая кислота, n-толуолсульфоновая кислота и тому подобные, которые не являются токсичными для живых организмов. Предпочтительными солями являются формиаты, малеаты, цитраты, гидрохлориды, гидробромиды и соли метансульфоновой кислоты, причем гидрохлориды являются особенно предпочтительными.
В одном варианте воплощения настоящее изобретение относится к соединениям, имеющим формулу (I)
где R1 выбирают из
R2 означает водород или (низш.) алкокси;
R3, R4, R5 и R6 выбирают каждый независимо из водорода, (низш.) алкила, галоидированного (низш.) алкила, галоида или циклоалкила при условии, что R2, R3, R4, R5 и R6 не означают все водород;
R7, R8 и R9 означают каждый независимо водород, (низш.)алкил или (низш.) алкокси при условии, что R7, R8 и R9 не означают все водород;
R10 означает (низш.) алкил или галоидированный (низш.) алкил,
и их фармацевтически приемлемым солям.
В одном варианте воплощения изобретения R1 означает
где R2 означает водород или (низш.) алкокси и
R3, R4, R5 и R6 выбирают каждый независимо из водорода, (низш.) алкила, галоидированного (низш.) алкила, галоида или циклоалкила при условии, что R2, R3, R4, R5 и R6 не означают все водород.
Предпочтительный (низш.) алкоксильный остаток R2 означает метоксигруппу.
Предпочтительные (низш.) алкильные остатки в R3, R4, R5 и R6 означают метил, этил и изопропил, причем метил является особенно предпочтительным. Предпочтительный галоидированный (низш.) алкильный остаток в R3, R4, R5 и R6 означает фторметил. Предпочтительный остаток галоида в R3, R4, R5 и R6 означает хлор. Предпочтительный циклоалкильный остаток в R3, R4, R5 и R6 означает циклопропил.
В одном предпочтительном варианте воплощения изобретения R2, R4, R5 и R6 означают водород, а R3 означает (низш.) алкил, галоидированный (низш.) алкил, галоид или циклоалкил, причем (низш.) алкил, такой, как метил или этил, галоидированный (низш.) алкил, такой, как фторметил, или галоид, такой, как хлор, являются особенно предпочтительными.
В другом предпочтительном варианте воплощения изобретения R2, R4 и R5 означают водород, а R3 и R6 означают каждый независимо (низш.) алкил, галоидированный (низш.) алкил, галоид или циклоалкил, причем (низш.) алкил, такой, как метил, или галоид, такой, как хлор, являются особенно предпочтительными.
В другом варианте воплощения по настоящему изобретению R1 означает
где R7, R8 и R9 означают каждый независимо водород, (низш.) алкил, (низш.) алкокси (низш.) гидроксиалкил или галоидированный (низш.) алкил при условии, что R7, R8 и R9 не означают все водород.
Предпочтительные (низш.) алкильные остатки в R7, R8 и R9 означают метил и этил, причем метил является особенно предпочтительным. Предпочтительный (низш.) алкоксильный остаток в R7, R8 и R9 означает метокси.
В предпочтительном варианте воплощения изобретения R7 и R9 означают водород, а R8 означает (низш.) алкил, такой, как метил или этил, или (низш.) алкокси, такой, как метокси.
В дальнейшем предпочтительном варианте воплощения изобретения R7 и R9 означают водород, а R8 означает (низш.) гидроксиалкил, такой, как гидроксиметил, или галоидированный (низш.) алкил, такой, как фторметил.
Еще в одном варианте воплощения по настоящему изобретению R1 означает
где R10 означает (низш.) алкил или галоидированный (низш.) алкил.
Предпочтительные (низш.) алкильные остатки R10 означают метил и этил, причем метил является наиболее предпочтительным. Предпочтительный галоидированный (низш.) алкильный остаток R10 означает фторметил.
Предпочтительными соединениями общей формулы (I) являются те, которые выбраны из группы, включающей:
гидрохлорид рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-иламина,
рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
9,10-диметокси-3(R)-м-толил-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(S)-м-толил-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(R)-иламин,
рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
9,10-диметокси-3(S)-м-толил-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(R)-м-толил-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(R)-иламин,
рац-9,10-диметокси-3β-(4-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
9,10-диметокси-3(S)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(R)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(R)-иламин,
рац-9,10-диметокси-3β-(6-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-9,10-диметокси-3β-(6-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-9,10-диметокси-3β-(5-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-9,10-диметокси-3β-(5-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-9,10-диметокси-3β-(4-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
9,10-диметокси-3(R)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(S)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(R)-иламин,
рац-9,10-диметокси-3β-(3-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-9,10-диметокси-3β-(3-метилпиридин-2-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(4-этилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(4-этилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(4-этилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(4-этилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(2,5-диметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(3-циклопропилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(6-метоксипиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(2,5-диметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(3-изопропилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(3-циклопропилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(3-фторметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(3-фторметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(4-метокси-2-метилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-9,10-диметокси-3β-(3-метилпиррол-1-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
гидрохлорид рац-3β-(3-хлорфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламина,
гидрохлорид рац-3β-(3-хлорфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламина,
рац-[2-(2α-амино-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-3β-ил)пиридин-4-ил]метанол,
гидрохлорид рац-3β-(4-фторметилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламина,
рац-3β-(4-фторметилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин
и их фармацевтически приемлемые соли.
Особенно предпочтительными соединениями общей формулы (I) являются те, которые выбраны из группы, включающей:
9,10-диметокси-3(R)-м-толил-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а] изохинолин-2(S)-иламин,
9,10-диметокси-3(S)-м-толил-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(S)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(S)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
9,10-диметокси-3(R)-(4-метилпиридин-2-ил)-1,3,4,6,7,11b(R)-гексагидро-2H-пиридо[2,1-а]изохинолин-2(S)-иламин,
рац-3β-(4-этилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(4-этилпиридин-2-ил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а] изохинолин-2β-иламин,
рац-3β-(2,5-диметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-3β-(2,5-диметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
гидрохлорид рац-3β-(3-хлорфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламина,
гидрохлорид рац-3β-(3-хлорфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламина,
рац-3β-(3-фторметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин,
рац-3β-(3-фторметилфенил)-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
рац-9,10-диметокси-3β-(3-метилпиррол-1-ил)-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2α-иламин,
и их фармацевтически приемлемые соли.
Соединения формулы I содержат три или более асимметрических атомов углерода и могут существовать в форме оптически чистых энантиомеров, смесей диастереомеров, рацематов или смесей диастереоизомерных рацематов. Изобретение охватывает все данные формы.
В предпочтительном варианте осуществления изобретения R1 и атом водорода в положении 11b пиридо[2,1-а]изохинолиновой структуры находятся в цис-конфигурации, тогда как аминогруппа в положении 2 пиридо[2,1-а]изохинолиновой структуры находится в транс-конфигурации, т.е.
В другом предпочтительном варианте воплощения изобретения R1, аминогруппа в положении 2 и атом водорода в положении 11b пиридо[2,1-а]изохинолиновой структуры находятся все в цис-конфигурации, т.е.
Будет признано, что соединения общей формулы (I) по данному изобретению могут претерпевать превращения по функциональным группам для получения производных, которые in vivo способны к обратному превращению в родительское соединение.
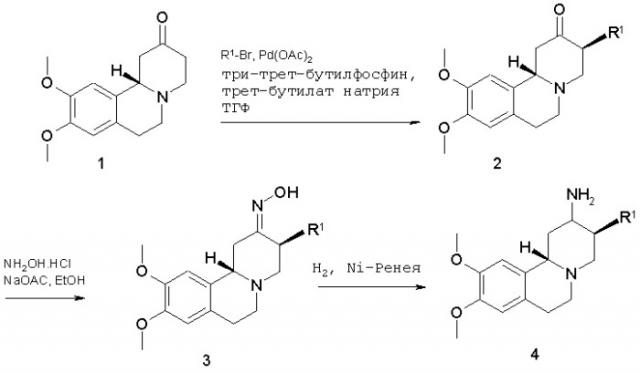
Настоящее изобретение относится также к способу производства соединений формулы I. Соединения по настоящему изобретению могут быть получены, как указано ниже на схемах 1 и 2.
Схема 1
Синтез 3-фенил- и 3-пиридилпроизводных 4 представлен на схеме 1 и может быть осуществлен, используя кетон 1 в качестве исходного вещества, соединение хорошо известное специалистам (Chem. Ber., 95, 1962, с.2132). Взаимодействие соединения 1 с арилгалоидом по реакции, опосредованной металлом, и при соответствующих условиях (основание, отсутствие кислорода) приводит к арил- или гетероарилкетонам 3. Предпочтительными металлическими реагентами являются палладиевые катализаторы. Затем кетогруппы превращают в аминофункции известными способами. Одна из возможностей состоит в превращении кетогруппы в оксим формулы 3, используя гидрохлорид гидроксиламина и ацетат натрия в растворителе, таком, как этанол. Оксимы могут быть восстановлены, например, каталитическим гидрированием, в конечные соединения 4.
Изомер 2α, 3β, 11bβ обычно является преобладающим продуктом, который легко отделяется от другого стереоизомера хроматографией.
Разделение энантиомерной смеси на ее хиральные компоненты может быть достигнуто хроматографией на хиральной фазе.
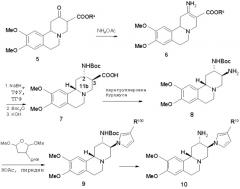
Схема 2
Ra означает метил или этил; R100 означает R10 или C(O)-R101, где R101 означает водород, (низш.) алкил или галоидированный (низш.) алкил; ТФУ означает трифторуксусную кислоту; Boc означает трет-бутилоксикарбонил.
Синтез производных пиррол-1-ила 10 приведен на схеме 2 и начинается с β-кетоэфира 5 (Ra означает метил или этил), соединения, хорошо известного специалистам (Helv. Chim. Acta, 41, 1958, с.119). Реакция соединения 5 с ацетатом аммония в растворителе, таком, как метанол, дает β-енаминоэфир 6, который восстанавливают предпочтительно с натрийборгидридом/трифторуксусной кислотой в соответствующий β-аминоэфир. Затем аминогруппу превращают в трет-бутилкарбаматную, сложноэфирную группу гидролизуют, используя основание, предпочтительно гидроксид калия или натрия в смеси вода/тетрагидрофуран, получая кислоту 7. 2α, 3β, 11bβ-Изомер 7 является преобладающим продуктом и легко отделяется, например, кристаллизацией, от других возможных диастереомеров.
Кислоту 7 перерабатывают в амин 8 посредством перегруппировки Курциуса. Предпочтительным протоколом для данного превращения является двухстадийная последовательность, где кислоту сначала нагревают со смесью дифенилфосфорилазида, основания (например, триэтиламина) и 2-(триметилсилил)этанола в растворителе, таком, как толуол, примерно при 70-100°С. Промежуточный 2-(триметилсилил)этилкарбамат затем деблокируют ионом фтора, например тетрабутиламмонийфторидом, в тетрагидрофуране примерно при 50°С (Tetrahedron Lett., 25, 1984, с.3515).
Реакция амина 8 с соответствующим образом замещенным 2,5-диметокситетрагидрофураном в смеси уксусная кислота/пиридин (J. Org. Chem., 63, 1998, с.6715) примерно при 100°С дает соединение 9, которое превращают в конечное соединение формулы 10, используя способы, известные специалистам.
Кроме того, изобретение относится к соединениям формулы (I), как определено выше, при получении в соответствии с технологией, которая определена выше.
Как описано выше, соединения формулы (I) по настоящему изобретению могут применяться в качестве лекарственных средств для лечения и/или профилактики заболеваний, которые ассоциированы с дипептидилпептидазой IV, таких, как диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, воспалительные заболевания кишечника, язвенный колит, болезнь Крона, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно инсулиннезависимый сахарный диабет и/или нарушенная толерантность к глюкозе. Кроме того, соединения по настоящему изобретению могут быть применены в качестве диуретических агентов или для лечения и/или профилактики гипертензии.
Следовательно, изобретение относится также к фармацевтическим композициям, включающим соединение, как определено выше, и фармацевтически приемлемый носитель и/или вспомогательное средство.
Кроме того, изобретение относится к соединениям, как определено выше, для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, которые ассоциированы с дипептидилпептидазой IV, таких, как диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, воспалительные заболевания кишечника, язвенный колит, болезнь Крона, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно для применения в качестве терапевтически активных веществ для лечения и/или профилактики инсулиннезависимого сахарного диабета и/или нарушенной толерантности к глюкозе. Более того, изобретение относится к соединениям, как определено выше, для применения в качестве диуретических агентов или для применения в качестве терапевтически активных веществ для лечения и/или профилактики гипертензии.
В другом варианте воплощения изобретение относится к способу лечения и/или профилактики заболеваний, которые ассоциированы с дипептидилпептидазой IV, таких, как диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, воспалительные заболевания кишечника, язвенный колит, болезнь Крона, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно для лечения и/или профилактики инсулиннезависимого сахарного диабета и/или нарушенной толерантности к глюкозе, к способу, который включает введение соединения, как определено выше, человеку или животному. Более того, изобретение относится к способу лечения и/или профилактики, как определено выше, где заболеванием является гипертензия или где диуретический агент оказывает благоприятное воздействие.
Изобретение относится далее к применению соединений, как определено выше, для лечения и/или профилактики заболеваний, которые ассоциированы с дипептидилпептидазой IV, таких, как диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, воспалительные заболевания кишечника, язвенный колит, болезнь Крона, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно для лечения и/или профилактики инсулиннезависимого сахарного диабета и/или нарушенной толерантности к глюкозе. Более того, изобретение относится к применению, как определено выше, где заболеванием является гипертензия, или для применения в качестве диуретического агента.
Кроме того, изобретение относится к применению соединений, как определено выше, при получении лекарственных средств для лечения и/или профилактики заболеваний, которые ассоциированы с дипептидилпептидазой IV, таких, как диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, воспалительные заболевания кишечника, язвенный колит, болезнь Крона, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно для лечения и/или профилактики инсулиннезависимого сахарного диабета и/или нарушенной толерантности к глюкозе. Такие лекарственные средства включают соединение, как определено выше. Более того, изобретение относится к применению, как описано выше, где заболеванием является гипертензия, или к применению для получения диуретических агентов.
В контексте способов и применений, определенных выше, следующие заболевания относятся к предпочтительному варианту воплощения изобретения: диабет, особенно инсулиннезависимый сахарный диабет, нарушенная толерантность к глюкозе, ожирение и/или метаболический синдром или β-клеточная защита, предпочтительно инсулиннезависимый сахарный диабет и/или нарушенная толерантность к глюкозе.
Соединения формулы (I) могут быть получены способами, приведенными ниже, способами, приведенными в примерах или аналогичными способами. Соответствующие условия реакций для отдельных стадий реакций известны специалистам в этой области. Исходные вещества или коммерчески доступны, или могут быть получены способами, аналогичными способам, приведенным ниже в примерах, или способами, известными в данной области техники.
Следующие исследования были проведены для того, чтобы определить активность соединений формулы I.
Активность ингибиторов дипептидилпептидазы IV исследовали с природной человеческой дипептидилпептидазой IV, полученной из пула человеческой плазмы, или с рекомбинантной человеческой дипептидилпептидазой IV. Человеческую цитратную плазму от различных доноров объединяли, фильтровали через мембрану 0,2 мкм в стерильных условиях, аликвотные пробы объемом 1 мл подвергали ударному замораживанию и хранили при -120°С до использования. В колориметрическом анализе дипептидилпептидазы IV 5-10 мкл человеческой плазмы и в флуориметрическом анализе 1,0 мкл человеческой плазмы в общем анализируемом объеме 100 мкл использовали в качестве источника фермента. кДНК с последовательностью аминокислот 31-766 человеческой дипептидилпептидазы IV, ограниченную N-концом и трансмембранным доменом, клонировали в экспрессионной дрожжевой системе Pichia pastoris. Человеческую дипептидилпептидазу IV экспрессировали и очищали от культуральной среды, используя общеизвестную колоночную хроматографию, включая эксклюзионную, анионную и катионную хроматографию. Чистота конечного ферментного препарата после электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) при окрашивании кумасси голубым составляла более 95%. При колориметрическом анализе дипептидилпептидазы IV 20 нг рекомбинантной человеческой DPP-IV и при флуориметрическом анализе 2 нг рекомбинантной человеческой DPP-IV в общем анализируемом объеме 100 мкл использовали в качестве источника фермента.
Во флуорогенном анализе в качестве субстрата использовали Ala-Pro-7-амидо-4-трифторметилкумарин (Calbiochem, №125510). Исходный 20 мМ раствор в смеси 10% ДМФА/вода хранили при -20°С до применения. В определениях IC50 использовали конечную концентрацию субстрата 50 мкМ. В анализах для определения таких кинетических параметров, как Кm, Vmax, Ki концентрация субстрата изменялась в интервале между 10 мкМ и 500 мкМ.
В колориметрическом анализе в качестве субстрата использовали гидрохлорид Н-Ala-Pro-n-нитроанилида(pNa) (Bachem, L-1115). Исходный 10 мМ раствор в смеси 10% метанол/вода хранили при -20°С до применения. В анализах для определения таких кинетических параметров, как Кm, Vmax, Кi концентрация субстрата изменялась в интервале между 100 мкМ и 2000 мкМ.
Флуоресценцию определяли на люминесцентном спектрометре, модель LS 50В фирмы Perkin Elmer, при длине возбуждения 400 нм и длине волны испускания 505 им непрерывно каждые 15 сек в течение 10-30 мин. Константы начальных скоростей рассчитывали с помощью оптимальной согласованной линейной регрессии.
Абсорбцию высвобожденного из колориметрического субстрата n-нитроанилида (pNA) аминокислоты определяли на приборе Packard SpectraCount при 405 нм непрерывно каждые 2 мин в течение 30-120 мин. Константы начальных скоростей рассчитывали с помощью оптимальной согласованной линейной регрессии.
Анализы активности дипептидилпептидазы IV проводили в 96-луночных планшетах при 37°С в общем анализируемом объеме 100 мкл. Буфер для анализа состоял из 50 мМ трис/HCl, рН 7,8, содержащего 0,1 мг/мл бычьего сывороточного альбумина (BSA) и 100 мМ NaCl. Исследуемые соединения растворяли в 100% ДМСО, разбавленном до требуемой концентрацией в смеси 10% ДМСО/вода. Конечная концентрация ДМСО в анализе составляла 1% (об./об.). При данной концентрации инактивация фермента диметилсульфоксидом была меньше 5%. Соединения использовали с преинкубацией (10 мин при 37°С) и без преинкубации с ферментом. Ферментные реакции начинали с введения субстрата, за которым следовало незамедлительное смешивание.
Анализы IC50 исследуемых соединений рассчитывали с помощью оптимальной согласованной линейной регрессии ингибирования дипептидилпептидазы IV по меньшей мере для пяти различных концентраций исследуемого соединения.
Соединения по настоящему изобретению имеют значения IC50 в интервале 0,1 нМ-10 мкМ, более предпочтительно 0,1-100 нМ, как показано в следующей таблице.
| Пример | IC50 [мкМ] |
| 2 | 0,029 |
| 9 | 0,0115 |
| 30 | 0,005 |
| 33 | 0,0054 |
| 35 | 0,0042 |
Соединения формулы I и/или их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут быть введены, к примеру, перорально, например, в форме таблеток, таблеток с нанесенным покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов или инфузионных растворов, или местно, например, в форме мазей, кремов или масел. Предпочтительным является пероральное введение.
Получение фармацевтических препаратов может быть осуществлено способом, который известен любому специалисту в этой области, путем приведения описанных соединений формулы I и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными веществами, в галенову форму введения вместе с соответствующими нетоксичными, инертными, терапевтически совместимыми, твердыми или жидкими носителями и, если требуется, обычными фармацевтическими вспомогательными веществами.
Соответствующие носители являются не только неорганическими, но также и органическими носителями. Так, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли могут быть использованы в качестве носителей для таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. Соответствующими носителями для мягких желатиновых капсул являются, например, растительные масла, воск, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента носители могли, однако, не потребоваться в случае мягких желатиновых капсул). Соответствующими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и тому подобное. Соответствующими носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Соответствующими носителями для суппозиториев являются, например, природные или затвердевшие масла, воск, жиры и полутвердые или жидкие полиолы. Соответствующими носителями препаратов для местного введения являются глицериды, полусинтетические и синтетические глицериды, гидрогенизированные масла, жидкий воск, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты, улучшающие консистенцию агенты, ароматизаторы, соли для изменения осмотического давления, буферные вещества, способствующие растворению вещества, красители и маскирующие агенты и антиоксиданты рассматриваются как фармацевтические вспомогательные вещества.
Доза соединений формулы I может изменяться в широких пределах, зависящих от заболевания, которое должно быть под контролем, возраста и индивидуального состояния пациента и способа введения, и будет, безусловно, соответствовать индивидуальным потребностям в каждом конкретном случае. Для взрослых пациентов рассматривается ежедневная доза примерно 1-1000 мг, особенно примерно 1-100 мг. В зависимости от тяжести заболевания и точного фармакокинетического профиля соединение могло бы вводиться в одной или нескольких ежедневных стандартных дозах, например в 1-3 стандартных дозах.
Фармацевтические препараты обычно содержат примерно 1-500 мг, предпочтительно 1-100 мг соединения формулы I.
Следующие примеры служат для более детальной иллюстрации настоящего изобретения. Однако они не претендуют на то, чтобы каким-либо образом ограничить его объем.
Примеры
Пример 1
Гидрохлорид рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-иламина
а) рац-9,10-Диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-он
Ацетат палладия (21 мг, 0,01 ммоля), трет-бутилат натрия (276 мг, 2,87 ммоля) и три-трет-бутилфосфин (23 мг, 0,115 ммоля) растворяли в атмосфере аргона в тетрагидрофуране (2 мл). 3-Бромтолуол (164 мг, 0,957 ммоля) и рац-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-бензо[а]хинолизин-2-он (250 мг, 0,957 ммоля) прибавляли последовательно в токе аргона и смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли водой и трижды экстрагировали эфиром. Объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенный продукт. Неочищенный продукт хроматографировали на силикагеле (в эфире), получая 139 мг (0,39 ммоля, 41%) рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-она в виде твердого вещества светло-желтого цвета.
МС [ионизация распылением при атмосферном давлении (ISP)]: 343,3 (М+Н)+.
1Н-ЯМР (CDCl3, δ): 7,29-7,24 (m, 1Н), 6.99-6,73 (m, 2H), 6,62 (s, 1H), 6,59 (s, 1H), 3,96-3,92 (m, 1H), 3,89-3,80 (m, 6H, 2 метоксигруппы), 3,76-3,72 (m, 1H), 3,43-3,38 (m, 1H), 3,19-3,93 (m, 5H), 2,79-2,64 (m, 3H), 2,32 (s, 3H, Ar-СН3).
6) Гидрохлорид рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-иламина
Растворяли рац-9,10-диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-он (62 мг), NaOAc (16 мг) и гидрохлорид гидроксиламина (14 мг) в этаноле (2 мл) и перемешивали при комнатной температуре в течение 3 ч. Прибавляли воду (2 мл) и сплав Ni-Al (100 мг). Гидроксид натрия в виде 32% водного раствора (0,35 мл) прибавляли по каплям к данной суспензии. Выделялся водород, и реакционная смесь становилась теплой. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Прибавляли такое же количество основания и сплава Ni-Al, и реакционную смесь перемешивали при комнатной температуре в течение последующих 3 ч. Реакционную смесь фильтровали и раствор трижды экстрагировали метиленхлоридом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография на силикагеле (метиленхлорид/метанол/25% водный гидроксид аммония, 100/5/1) дала продукт в виде смеси цис- и транс-диастереоизомеров. Амины растворяли в метиленхлориде и прибавляли раствор хлористого водорода в эфире. Растворитель упаривали, получая продукт (46 мг, 67%) в виде твердого вещества оранжевого цвета.
МС (ISP): 353,3 (М+Н)+.
Пример 2
рац-9,10-Диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2β-иламин
а) рац-9,10-Диметокси-3β-м-толил-1,3,4,6,7,11bβ-гексагидро-2H-пиридо[2,1-а]изохинолин-2-он
Смесь ацетата палладия (1,72 г), трет-бутилата натрия (22,01 г) и рац-9,10-диметокси-1,3,4,6,7,11bβ-гексагидро-2H-бензо[а]хинолизин-2-она (20,0 г) (D.Beke, С.Szantay, Chem. Ber. 95, 1962, с.2132) упаривали в высоком вакууме при 80°С и загружали аргоном 3-5 раз. Прибавляли дегазированный тетрагидрофуран (220 мл) при комнатной температуре в атмосфере аргона. Реакционную