Замещенные карбаматными группами пиразолопиридины
Иллюстрации
Показать всеИзобретение относится к замещенным карбаматными группами пиразолпиридинам общей формулы (I)
где R1 означает группу -NR3C(=O)OR4, R2 означает атом водорода или NH2, R3 означает атом водорода или алкильную группу с числом атомов углерода от одного до четырех, R4 означает алкильную группу с числом атомов углерода от одного до шести, а также к их соли, изомерам и гидратам; к способам их получения, лекарственному средству на их основе, а также к применению данных соединений для получения лекарственных средств для лечения сердечно-сосудистых заболеваний. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами, а также лекарственное средство на их основе. 6 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям, которые стимулируют растворимую гуанилатциклазу, к способу их получения и к их использованию в качестве лекарственных средств, в частности в качестве лекарственных средств для лечения сердечно-сосудистых заболеваний и/или сексуальных расстройств.
Одна из важнейших клеточных медиаторных систем в клетках млекопитающих представлена циклическим гуанозинмонофосфатом (цГМФ). Вместе с монооксидом азота (NO), который выделяется из эндотелия и переносит гормональные и механические сигналы, он образует NO/цГМФ-систему. Гуанилатциклазы катализируют биосинтез цГМФ из гуанозинтрифосфата (ГТФ). Известные до настоящего времени представители этого семейства могут быть разделены на две группы, исходя как из структурных признаков, так и из природы лигандов: специфические стимулируемые натрийуретическими пептидами гуанилатциклазы и растворимые стимулируемые монооксидом азота гуанилатциклазы. Растворимые гуанилатциклазы состоят из двух субъединиц и вероятнее всего содержат на гетеродимер один гем, который представляет собой часть регуляторного центра. Он играет ключевую роль в механизме активации. Монооксид азота может связываться с атомом железа гема и таким образом значительно повышать активность фермента. В отличие от этого формы фермента, в которых гем отсутствует, не могут стимулироваться монооксидом азота. Центральный атом железа гема может также образовывать связь с монооксидом углерода, причем стимуляция монооксидом углерода заметно слабее, чем стимуляция монооксидом азота.
Благодаря образованию циклического гуанозинмонофосфата и вызываемой им регуляции фосфодиэстераз, ионных каналов и протеинкиназ гуанилатциклаза играет решающую роль в различных физиологических процессах, в частности в расслаблении и в пролиферации клеток гладкой мускулатуры, в агрегации и адгезии тромбоцитов и в нейрональной передаче сигналов, а также в заболеваниях, которые основаны на нарушении представленных выше процессов. В патофизиологических условиях NO/цГМФ-система может быть заблокирована, что может приводить, например, к повышению давления крови, к активации тромбоцитов, к усилению пролиферации клеток, к нарушениям функционирования эндотелия, к атеросклерозу, стенокардии, сердечной недостаточности, тромбозам, ударам, к сексуальным расстройствам и к инфаркту миокарда.
Независящая от монооксида азота возможность лечебного воздействия на такие заболевания, нацеленная на влияние на прохождение сигнала цГМФ в организме, имеет многообещающее практическое приложение, ввиду его ожидаемой высокой эффективности и незначительности побочных действий.
Для терапевтической стимуляции растворимой гуанилатциклазы до настоящего времени использовались только такие соединения, как органические нитраты, действие которых основано на монооксиде азота. Он образуется в результате биотрансформации и активирует растворимую гуанилатциклазу, атакуя центральный атом железа в геме.
Наряду с побочными эффектами к решающим недостаткам такого способа лечения относится развитие привыкания.
В последние годы были описаны некоторые вещества, которые активируют растворимую гуанилатциклазу непосредственно, то есть без предшествующего высвобождения монооксида азота; к ним относятся, например, 3-(5'-гидроксиметил-2'-фурил)-1-бензилиндазол (YC-1, Wu и др., Blood 84 (1994), 4226; Mülsch и др., Brit. J.Pharmacol. 120 (1997), 681), жирные кислоты (Goldberg и др., J. Biol. Chem. 252 (1977), 1279), гексафторфосфат дифенилиодония (Pettibone и др., Eur. J. Pharmacol. 116 (1985), 307), изоликвиритигенин (Yu и др., Brit. J. Pharmacol. 114 (1995), 1587), а также различные замещенные производные пиразола (заявка на международный патент №98/16223).
Кроме того, в качестве стимуляторов растворимой гуанилатциклазы в заявках на международные патенты №98/16507, №98/23619, №00/06567, №00/06568. №00/06569, №00/21954, №02/42299, №02/42300, №02/42301, №02/42302, №02/092596 и №03/004503 описаны производные пиразолопиридина. В этих материалах наряду с другими описаны также пиразолопиридины с пиримидиновым остатком в 3-положении. Такие соединения показывают очень высокую активность in vitro по отношению к стимуляции растворимой гуанилатциклазы. Правда, оказалось, что их свойства in vivo отмечены недостатками, например, в том, что касается превращений этих соединений в печени, их фармакокинетических характеристик, соотношений между дозами и вызываемыми ими эффектами или же в отношении их метаболических путей.
В соответствии с изложенным задача настоящего изобретения состояла в получении других производных пиразолопиридина, которые действуют как стимуляторы растворимой гуанилатциклазы, но в то же время лишены перечисленных выше недостатков соединений, известных из уровня техники.
Поставленная задача решается соответствующими изобретению соединениями по п.1 формулы изобретения. Этот новый класс производных пиразолопиридинов отличается наличием в 3-положении пиримидинового остатка, имеющего определенный набор заместителей, а именно карбаматный остаток в 5-положении пиримидинового цикла и аминогруппу в 4-положении пиримидинового цикла.
В частности, настоящее изобретение относится к соединениям формулы (I)
где R1 означает группу -NR3С(=O)OR4,
R2 означает атом водорода или аминогруппу,
R3 означает атом водорода или алкильную группу с числом атомов углерода от одного до четырех,
R4 означает алкильную группу с числом атомов углерода от одного до шести,
а также к их солям, изомерам и гидратам.
Предпочтение отдается соединениям формулы (I), у которых
R1 означает группу -NR3C(=O)OR4,
R2 означает атом водорода или аминогруппу,
R3 означает алкильную группу с числом атомов углерода от одного до четырех,
R4 означает алкильную группу с числом атомов углерода от одного до четырех,
а также к их солям, изомерам и гидратам.
Особое предпочтение отдается соединениям формулы (I), у которых
R1 означает группу -NR3C(=O)OR4,
R2 означает аминогруппу,
R3 означает метальную или этильную группу,
R4 означает метальную, этильную или изопропильную группу,
а также к их солям, изомерам и гидратам.
В частности, предпочтительным соединением является метиловый эфир 4,6-диамино-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]-5-пиримидинил(метил)карбаминовой кислоты по примеру 8 формулы
Соответствующие изобретению соединения формулы (I) могут находиться в виде их солей. В общем случае можно здесь назвать их соли с органическими или неорганическими основаниями или кислотами.
В рамках настоящего изобретения предпочтение отдается физиологически приемлемым солям. Физиологически приемлемыми солями соответствующего изобретению соединения могут быть соли соответствующих изобретению веществ с минеральными кислотами, карбоновыми кислотами или сульфокислотами. Особое предпочтение отдается, например, солям с хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфокислотой, этансульфокислотой, n-толуолсульфокислотой, бензолсульфокислотой, нафталиндисульфокислотой, уксусной кислотой, пропионовой кислотой, молочной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой или бензойной кислотой.
Физиологически приемлемыми солями могут быть также соли с металлами или аммонийные соли соответствующих изобретению соединений, в составе которых есть свободная карбоксильная группа. Особое предпочтение отдается, например, натриевым, калиевым, магниевым или кальциевым солям, а также аммонийным солям, которые получены с аммиаком или с такими органическими аминами, как, например, этиламин, ди- или, соответственно, триэтиламин, ди- или, соответственно, триэтаноламин, дициклогексиламин, диметиламиноэтанол, аргинин, лизин или этилендиамин.
Соответствующие изобретению соединения могут иметь таутомерные формы. Это известно специалистам, и такие формы также входят в объем притязаний изобретения.
Кроме того, соответствующие изобретению соединения могут находиться в виде их возможных гидратов.
Понятие "алкильная группа" относится к линейному или разветвленному алкильному остатку с числом атомов углерода, как правило, от одного до шести, в предпочтительном случае от одного до четырех, в особо предпочтительном случае от одного до трех, например, предпочтение отдается метильной, этильной, н-пропильной, изопропильной, трет-бутильной, н-пентильной и н-гексильной группе.
В рамках изобретения понятие "галоген" относится к фтору, хлору, брому и иоду.
Объектом настоящего изобретения является также способ получения соответствующих изобретению соединений формулы (I). Они могут быть получены приведенными далее способами:
[А] в результате взаимодействия соединений формулы (Iа)
где R4 имеет приведенное выше значение,
с соединениями формулы (II)
где R3 имеет приведенное выше значение и
X1 означает такую уходящую группу, как, например, атом галогена, в предпочтительном случае атом иода, или метилсульфонатная группа,
при этом реакция, протекающая с образованием соединений формулы (I), может быть проведена в органическом растворителе при охлаждении,
или
[Б] в результате взаимодействия соединений формулы (III)
с соединениями формулы (IV)
где R4 имеет приведенное выше значение,
при этом реакция, протекающая с образованием соединений формулы (Iа), может быть проведена в органическом растворителе,
или
[В] в результате взаимодействия соединения формулы (V)
с соединениями формулы (VI)
где R3 и R4 имеют приведенное выше значение,
при этом реакция, протекающая с образованием соединений формулы (1б),
где R3 и R4 имеют приведенное выше значение,
может быть проведена в органическом растворителе при нагревании.
Соединения формулы (II) и (IV) могут быть приобретены коммерческим путем, они известны по литературным источникам или же они могут быть получены известными специалисту способами.
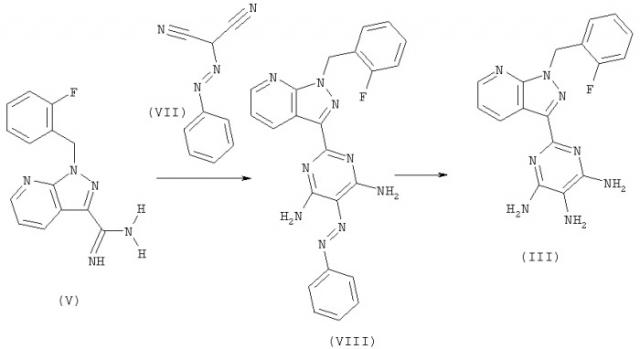
Соединение формулы (III) может быть получено в соответствии с приведенной далее схемой реакций:
Соединение (III) может быть получено в двухстадийном синтезе в результате взаимодействия соединения (V) с соединением (VII) с образованием соединения (VIII) по аналогии со стадией [В] с последующим гидрированием соединения (VIII) в присутствии никеля Ренея в воде. Гидрирование может быть проведено в органическом растворителе, например в диметилформамиде, в предпочтительном случае при повышенном давлении, например при давлении от 50 до 70 бар, предпочтительно при давлении 65 бар, и при перемешивании реакционного раствора в течение многих часов, например в течение 22 часов, при повышенной температуре, например от 40 до 80°С, в предпочтительном случае от 60 до 65°С.
Соединение (VII) может быть получено по аналогии с методикой L.F.Cavalieri, J.F.Tanker, A.Bendich, J. Am. Chem. Soc., 1949, 71, 533.
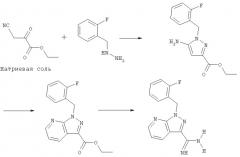
Соединение (V) может быть получено в соответствии с приведенной далее схемой реакции:
Соединение (V) может быть получено в многостадийном синтезе из известной по литературным источникам натриевой соли этилового эфира цианопировиноградной кислоты (Borsche и Manteuffel, Liebigs Ann. Chem., 1934, 512, 97). В результате его взаимодействия с 2-фторбензилгидразином при нагревании в атмосфере инертного газа в таком инертном растворителе, как диоксан, получают этиловый эфир 5-амино-1-(2-фторбензил)пиразол-3-карбоновой кислоты, который может вступать в реакцию циклизации с образованием производного пиридина в результате взаимодействия с диметиламиноакролеином в кислой среде в атмосфере инертного газа при нагревании. Это производное пиридина, этиловый эфир 1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-карбоновой кислоты, в результате многостадийной последовательности превращений, состоящей из перевода сложного эфира действием аммиака в соответствующий амид, дегидратации таким водоотнимающим средством, как ангидрид трифторуксусной кислоты, с образованием соответствующего нитрильного производного, взаимодействия нитрильного производного с метилатом натрия и завершающей реакции с хлоридом аммония, переводят в соединение (V).
Соединения формулы (VI) могут быть синтезированы известными специалисту способами из соответствующих карбаматов в результате реакции с этиловым эфиром муравьиной кислоты. Карбаматы могут быть получены по аналогии с методикой Q. Li. Chu, T.W.Daniel, A.Claibome, C.S.Cooper, C.M.Lee, J. Med. Chem, 39 (1996), 3070-3088.
Взаимодействие соединений формул (Iа) и (II) с образованием соединений формулы (I) может быть проведено путем превращения реагентов в эквимолярных количествах в органическом растворителе, например в диметилформамиде или в тетрагидрофуране, в предпочтительном случае в присутствии от 1 до 2 эквивалентов, предпочтительно от 1,1 до 1,5 эквивалентов основания, например гидрида натрия или N,N-бис(триметилсилил)амида натрия, в предпочтительном случае при нормальном давлении и при перемешивании реакционного раствора в течение нескольких часов, например в течение 1 часа, при охлаждении, например при температуре от -10°С до комнатной температуры, предпочтительно при 0°С.
Взаимодействие соединений формул (III) и (IV) с образованием соединений формулы (Iа) может быть проведено путем превращения реагентов в эквимолярных количествах в органическом растворителе, например в органическом основании, в предпочтительном случае в пиридине, в предпочтительном случае при нормальном давлении и при перемешивании реакционного раствора в течение многих часов, например в течение 12 часов, при температуре от 0°С до комнатной температуры, в предпочтительном случае при комнатной температуре.
Взаимодействие соединений формул (V) и (VI) с образованием соединений формулы (Iб) или, соответственно, взаимодействие соединений формул (V) и (VII) с образованием соединений формулы (VIII) может быть проведено путем превращения реагентов в эквимолярных количествах или, соответственно, с использованием соединения формулы (VI) в небольшом избытке в органическом растворителе, например в таком углеводороде, как толуол или ксилол, или же в N,N-диметилформамиде, в предпочтительном случае в присутствии от 2 до 3 эквивалентов, предпочтительно 2 эквивалентов, такого основания, как, например, триэтиламин или метилат натрия, в предпочтительном случае при нормальном давлении и при перемешивании реакционного раствора в течение многих часов, например в течение 9 часов, при повышенной температуре, например при температуре от 80 до 160°С, в предпочтительном случае в интервале от 100 до 150°С, в частности при 110°С.
Неожиданно оказалось, что соответствующие изобретению соединения формулы (I) обладают ценным спектром фармакологической активности.
Соответствующие изобретению соединения формулы (I) вызывают релаксацию сосудов и блокируют агрегацию тромбоцитов, они приводят к снижению давления крови и к улучшению коронарного кровообращения. Эти эффекты основаны на непосредственной стимуляции растворимой гуанилатциклазы и на повышении содержания циклического гуанозинмонофосфата внутри клетки. Кроме того, соответствующие изобретению соединения формулы (I) усиливают действие веществ, которые повышают уровень циклического гуанозинмонофосфата, например, фактора релаксации из эндотелия, доноров монооксида азота, протопорфирина IX, арахидоновой кислоты или производных фенилгидразина.
В связи с этим они могут найти применение в лекарственных средствах для лечения сердечно-сосудистых заболеваний, например для лечения гипертонии и сердечной недостаточности, хронической и острой стенокардии, заболеваний периферических и коронарных сосудов, аритмий, для лечения таких тромбоэмболических заболеваний и ишемий, как инфаркт миокарда, инсульт, перемежающиеся и ишемические приступы, нарушения периферического кровообращения, для предотвращения рестенозов, например, после тромболитических терапий, перкутанной транслуминальной ангиопластической операции, перкутанной транслуминальной пластической операции на коронарных сосудах, после шунтирования, а также для лечения артериосклероза, астматических заболеваний и болезней мочеполовой системы, например, гипертрофии предстательной железы, нарушения эрекции, женских сексуальных расстройств, остеопороза, глаукомы, легочной гипертонии, гастропареза и недержания.
Соответствующие изобретению соединения формулы (I) могут быть использованы и для лечения заболеваний центральной нервной системы, которые отмечены нарушениями в NO/цГМФ-системе. В частности, они подходят для улучшения восприятия, повышения концентрации внимания, для улучшения обучаемости или для улучшения памяти после расстройств функций, связанных с восприятием, возникающих, в частности, при таких ситуационно-болезненных синдромах, как легкая недостаточность функций, связанных с восприятием ("mild cognitive impairment"), связанные с возрастом нарушения обучаемости и памяти, связанные с возрастом провалы в памяти, васкулярное слабоумие, травмы черепа и мозга, инсульт, слабоумие, проявляющееся после инсульта ("post stroke dementia"), посттравматическое состояние, связанное с травмой черепа и мозга, общие нарушения концентрации внимания, нарушения концентрации внимания у детей, имеющих проблемы с обучением и запоминанием, болезнь Альцгеймера, слабоумие, обусловленное тельцами Леви, слабоумие с дегенерацией лобных долей, включая синдром Пика, болезнь Паркинсона, прогрессирующий ядерный паралич, слабоумие с кортикобазальной дегенерацией, амиолатеральный склероз, болезнь Хантингтона, рассеянный склероз, таламическая дегенерация, слабоумие Крейтцфельда-Якоба, слабоумие при ВИЧ-инфекциях, шизофрения со слабоумием или психоз Корсакова. Они также могут найти применение для лечения таких заболеваний центральной нервной системы, как состояния страха, напряжения и депрессии, связанные с центральной нервной системой сексуальные расстройства и нарушения сна, а также для регуляции болезненных отклонений при питании, пристрастия к наслаждениям и к наркотикам.
Кроме того, соответствующие изобретению соединения формулы (I) подходят также для регуляции церебрального кровообращения и оказываются благодаря этому эффективными средствами для борьбы с мигренью.
Соответствующие изобретению соединения формулы (I) подходят также для профилактики и лечения таких последствий церебрального инфарктного процесса (Apoplexia cerebri), как удар, церебральных ишемий и травм черепа и мозга. Они могут быть также использованы для борьбы с болевыми синдромами.
К тому же соответствующие изобретению соединения формулы (I) оказывают противовоспалительное действие и поэтому они могут быть использованы в качестве противовоспалительных средств.
Кроме того, в объем притязаний настоящего изобретения входят также композиции не менее чем одного соответствующего изобретению соединения формулы (I) с одним или с несколькими органическими нитратами или донорами монооксида азота.
В рамках настоящего изобретения понятие органических нитратов или доноров монооксида азота относится в общем случае к веществам, терапевтическая активность которых проявляется через высвобождение монооксида азота или включающих его веществ. В качестве примеров предпочтительных веществ следует назвать нитропруссид натрия, нитроглицерин, динитрат изосорбида, мононитрат изосорбида, молсидомин и SIN-1.
Кроме того, в объем притязаний настоящего изобретения входят также композиции с одним или с несколькими соединениями, которые ингибируют разложение циклического гуанозинмонофосфата. В предпочтительном случае они представляют собой ингибиторы фосфодиэстераз 1, 2 и 5 (по номенклатуре Beavo и Reifsnyder (1990) TiPS 11, страницы от 150 до 155). Особое предпочтение при этом отдается ингибиторам фосфодиэстеразы 5 (ингибиторы ФДЭ V). В частности, одним из этих соединений является сил-денафил (Viagra™, заявка на европейский патент №А-0463756, заявка на международный патент №94/28902), варденафил (заявка на международный патент №99/24433) или тадалафил (заявка на международный патент №95/19978). Эти ингибиторы усиливают действие соответствующих изобретению соединений и усиливают желаемый фармакологический эффект.
Биологические исследования
Действие на релаксацию сосудов
Кроликов оглушают ударом в затылок и обескровливают их. Извлекают аорту и освобождают ее от связанных с ней тканей, разделяют на кольца шириной 1,5 мм и каждое отдельно переносят с предварительным натяжением в кюветы объемом 5 мл с нагретым до 37°С продутым карбогеном раствором Кребса-Гензелейта следующего состава (ммоль/л): хлорид натрия (119), хлорид калия (4,8), дигидрат хлорида кальция (1), гептагидрат сульфата магния (1,4), монокалийфосфат (1,2), бикарбонат натрия (25), глюкоза (10). Силу сокращения определяют на Statham UC-2-ячейках, усиливают сигнал, оцифровывают его A/D-преобразователем (DAS-1802 НС, Keithley, Instruments, Мюнхен), параллельно с этим регистрируют его с помощью самописца. Сокращение вызывают кумулятивным добавлением в кювету фенилэфрина с нарастанием концентрации. После нескольких контрольных циклов проводят опыты с исследуемым веществом с увеличением его дозы на каждом следующем этапе опыта и сравнивают усилие сокращения с полученным на предыдущем этапе значением. Исходя из этого рассчитывают концентрацию, которая требуется для снижения полученного в контрольном опыте значения на 50% (IC50). Стандартный используемый объем составляет 5 мкл, содержание диметилсульфоксида в растворе в кювете соответствует значению 0,1%.
Значение IC50 для соединения по примеру 1 равно 670 нмоль/л, соответствующее значение для соединения по примеру 8 равно 500 нмоль/л.
Модельные опыты на кроликах
Взрослые самцы кроликов шиншилла весом 3-5 кг после поступления несколько дней адаптируются в одиночном содержании. Они имеют свободный доступ к воде и могут два раза в день принимать корм. Животные содержатся в режиме дня и ночи 10/14 (свет включается в 8.00 часов), температура помещения 22-24°С.
На каждую подопытную группу приходится от трех до шести животных, непосредственно перед началом опыта их взвешивают. Для внутривенного введения вещества растворяют в транскутоле (GATTEFOSSE GmbH) и разбавляют в соотношении 3:7 20%-ным раствором кремофора (Cremophor (BASF), в воде). Инъекцию проводят в ушную вену объемом 0,5 мл/кг. Для инъекции растворимых в воде веществ используют 0,9%-ный раствор поваренной соли.
Для введения через рот исследуемые вещества растворяют в смеси глицерина, воды и полиэтиленгликоля в соотношении 6:10:9,69 и объем 1 мл/кг вводят через глоточный зонд.
В состоянии покоя пенис кролика в срамной части тела не виден и полностью покрыт кожей пениса. Эрекцию оценивают, измеряя длину выступающего пениса с помощью штангенциркуля. Измерение проводят через 5, 10, 15, 30, 45, 60 и 120 минут после введения вещества, а после введения через рот в дополнение к этому еще через 3, 4, 5 и 6 часов. Для этого животных каждый раз извлекают из клетки, держат их за шерсть на загривке и задние лапы, поворачивают на спину и проводят измерение. Проводят соответствующие контрольные опыты с одним растворителем (литература для сравнения: E.Bischoff, K.Schneider, Int. J. of Impotence Res. 2001, 13, 230-235; E.Bischoff, U.Niewoehner, H.Haning, M.Es Sayed, T.Schenke, K.H.Schlemmer, The Journal of Urology, 2001, 165, 1316-1318; E.Bischoff, Int. J. Impotence Res. 2001, 13, 146-148).
Минимальная эффективная доза соединения по примеру 8 при введении через рот составляет 0,03 мг/кг (при одновременном внутривенном введении нитропруссида SNP в дозе 0,2 мг/кг).
Определение фармакокинетических показателей после внутривенного и перорального введения
Животным (например, мышам, крысам, собакам) вводят исследуемое вещество внутривенно в виде раствора, пероральное введение осуществляют в виде раствора или суспензии через глоточный зонд. После введения вещества в определенные интервалы времени у животных берут кровь, обрабатывают ее гепарином и после этого центрифугированием получают из нее плазму. Количественное определение вещества в плазме проводят с помощью жидкостной хроматомасс-спектрометрии. На основе полученных таким путем зависимостей концентрации в плазме от времени рассчитывают фармакокинетические показатели с помощью сертифицированной фармакокинетической расчетной программы.
После перорального введения 0,3 и 1,0 мг/кг (в виде раствора в смеси солутола, этанола и воды в соотношении 1:1:8) для соединения по примеру 8 получают на крысах приведенные далее концентрации в плазме (AUC):
AUCnorm (0,3 мг/кг)=0,326 [кг·ч/л]
AUCnorm (1,0 мг/кг)=0,548 [кг·ч/л]
Ингибирование ферментов цитохром-Р450
Потенциал ингибирования Р-450 изоферментов, которые имеют важное значение для метаболизма, исследуют в автоматическом режиме в 96-луночном формате. При этом используют два различных эксперимента.
В основанном на образовании флуоресцирующих метаболитов эксперименте используют рекомбинантные ферменты (например, CYP1A2, 2С8, 2С9, 2С19, 2D6 или 3А4) и в общем случае субстраты, включающие флуоресцеиновые или кумариновые структуры. В каждом отдельном случае используют одну концентрацию субстрата и 8 концентраций потенциального ингибитора. После инкубирования с соответствующим рекомбинатным CYP ферментом определяют с помощью флуоресцентного анализатора количество флуоресцирующих метаболитов, сравнивают с контрольным опытом (без ингибитора) и определяют значение IC50 (Anal. Biochem. 248, 188 (1997)).
Во втором эксперименте в качестве источника ферментов используют микросомы печени человека, а в качестве субстратов, селективных по отношению к CYP-изоформе, используют фенацетин (CYP1A2), диклофенак (CYP2C9), декстрометорфан (CYP2D6) и мидазолам (CYP3A4). Образование соответствующих метаболитов определяют с помощью жидкостной хроматомасс-спектрометрии. Предположив, что ингибирование имеет конкурентный характер, на основании уменьшения образования метаболитов по сравнению с контрольными опытами рассчитывают константы ингибирования Кi (одна концентрация субстрата и три концентрации ингибитора).
Индукция ферментов цитохром-Р450 в культурах клеток печени человека
Для исследования потенциала побочного действия соответствующих изобретению веществ по отношению к индукции ферментов цитохром-Р450 в течение восьми дней культивируют первичные гепатоциты человека с плотностью клеток 2,5×105 клеток между двумя слоями коллагена в 24-луночном планшете для микротитрования при 37°С с 5% диоксида углерода. Среду для культивирования клеток меняют каждый день.
Через 48 часов культивирования гепатоциты в течение пяти дней, дублируя эксперимент, обрабатывают различными концентрациями исследуемых веществ и сравнивают их с такими индукторами, как рифампицин (RIF, 50 мкмоль/л), омепразол (ОМЕ, 100 мкмоль/л) и фенобарбитал (РВ, 2 ммоль/л). Конечные концентрации исследуемых веществ лежат в пределах 0,01-10 мкг/мл.
На восьмой день в клеточных культурах определяют индуктивный эффект исследуемых веществ на образование ферментов цитохром(СУР)-Р450 1А2, 2В6, 2С19 и 3А4, прибавляя в качестве субстратов 7-этоксирезоруфин (CYP1A2), [14С]-S-мефенитоин (CYP2B6 и 2С19) и [14C]-тестостерон (CYP3A4). На основании определенных активностей ферментов CYP1A2, 2В6, 2С19 и 3А4 в обработанных клетках по сравнению с необработанными клетками определяют индуктивный потенциал исследуемых веществ. В следующей далее таблице приведены результаты, полученные на соединении по примеру 8 в сравнении с индукторами рифампицином, фенобарбиталом и омепразолом.
| Индуктивный эффект на активности ферментов печени в культурах гепатоцитов человека через 8 дней инкубирования (нормировано) | |||||
| Концентрация | CYP1A2 | CYP2B6 | CYP2C19 | CYP3A4 | |
| Контроль | 0 | 1,0 | 1,0 | 1,0 | 1,0 |
| RIF | 50 мкмоль/л | н.о. | 5,15 | 15,21 | 9,15 |
| РВ | 2000 мкмоль/л | н.о. | 14,69 | 4,00 | 6,70 |
| ОМЕ | 100 мкмоль/л | 28,57 | 1,54 | 1,61 | 1,45 |
| Пример 8 | 0,01 мкг/мл | 0,76 | 1,92 | 1,30 | 1,37 |
| 0,1 мкг/мл | 0,70 | 1,62 | 1,30 | 1,60 | |
| 1,0 мкг/мл | 0,90 | 1,85 | 1,12 | 1,51 | |
| 10 мкг/мл | 1,38 | 2,54 | 1,97 | 3,47 | |
| н.о. - определение не проводилось |
Еще один объект настоящего изобретения представлен лекарственными средствами, которые содержат не менее чем одно соответствующее изобретению соединение, в предпочтительном случае вместе с одним или с несколькими фармакологически допустимыми вспомогательными веществами или носителями, а также их использование с названными выше целями.
Активное вещество может оказывать системное и/или местное действие. С этой целью его применяют соответствующим способом, например его вводят через рот, парэнтерально, через легкие, используют назальное, сублингвальное, лингвальное, буккальное, ректальное введение, введение через кожу, через конъюктиву, используют наружно или в виде имплантанта.
Для этих способов введения активное вещество может быть использовано в соответствующих лекарственных формах.
Для приема через рот подходят известные лекарственные формы, которые быстро и/или в модифицированном режиме высвобождают активное вещество, например, это таблетки (без покрытия, а также таблетки снабженные покрытием, например покрытием, которое устойчиво в желудочном соке, или пленочным покрытием), капсулы, драже, грануляты, пилюли, порошки, эмульсии, суспензии, растворы и аэрозоли.
Парентеральное введение можно проводить так, чтобы исключить процесс резорбции (внутривенно, внутриартериально, интракардиально, интраспинально или интралумбально) или же с участием процесса резорбции (внутримышечно, подкожно, в кожу, через кожу или внутрибрюшинно). Для парентерального введения могут быть использованы наряду с другими такие лекарственные формы, как составы для инъекций и для вливаний в виде растворов, суспензий, эмульсий, лиофилизатов и стерильных порошков.
Для других способов введения подходят, например, лекарственные формы для ингаляций (в том числе порошковые ингаляторы, аэрозольные ингаляторы), капли в нос или растворы, аэрозоли; таблетки или капсулы на язык, под язык или за щеку, суппозитории, лекарственные формы для введения в уши или в глаза, вагинальные капсулы, водные суспензии (лосьоны, микстуры, требующие встряхивания), липофильные суспензии, мази, кремы, молочко, пасты, средства для опудривания или имплантанты, например стенты.
В перечисленные лекарственные формы активные вещества могут быть переведены известными способами. Для этого используют инертные нетоксичные фармацевтически приемлемые вспомогательные вещества. Наряду с другими к ним относятся носители (например, микрокристаллическая целлюлоза), растворители (например, жидкие полиэтиленгликоли), эмульгаторы (например, додецилсульфат натрия), диспергирующие средства (например, поливинилпирролидон), синтетические и натуральные биополимеры (например, альбумин), стабилизаторы (например, такие антиоксиданты, как аскорбиновая кислота), окрашенные вещества (например, такие неорганические пигменты, как оксиды железа) или же добавки для коррекции вкуса и/или запаха. В отдельных случаях активное вещество в одном или в нескольких из приведенных выше носителей может также находиться в микрокапсулированном виде.
Терапевтически эффективное соединение формулы (I) должно находиться в представленных выше фармацевтических композициях в концентрации от примерно 0,1 до 99,5 мас.%, в предпочтительном случае от примерно 0,5 до 95 мас.% от всей смеси.
Приведенные выше фармацевтические композиции наряду с соответствующим изобретению соединением формулы (I) могут содержать также другие фармацевтические активные вещества.
В общем случае для достижения желаемых результатов, как при лечении людей, так и в ветеринарной медицине, оправдало себя введение соответствующего изобретению активного вещества в суммарном количестве от примерно 0,001 до примерно 50 мг, в предпочтительном случае от 0,001 до 10 мг на килограмм массы тела каждые 24 часа, причем это количество может быть разделено на отдельные дозы. В предпочтительном случае одна отдельная доза содержит от примерно 0,001 до примерно 30 мг, в частности от 0,001 до 3 мг соответствующего изобретению активного вещества на килограмм массы тела.
Далее настоящее изобретение более детально иллюстрируется предпочтительными примерами, которые не могут быть использованы для ограничения объема притязаний. Если не указано иное, все количественные данные относятся к процентам массы. Соотношения растворителей, пропорции разбавления и данные по концентрациям растворов жидкость/жидкость в каждом отдельном случае относятся к объемам.
| Используемые сокращения | |
| CAN | Ацетонитрил |
| ВАВА | н-Бутилацетат/н-бутанол/ледяная уксусная кислота/фосфатный буфер рН 6 (50:9:25.15; органическая фаза) |
| DC | Тонкослойная хроматография |
| DCI | Прямая химическая ионизация (при масс-спектроскопии) |
| DCM | Дихлорметан |
| DIEA | N,N-Диизопропилэтиламин |
| DMSO | Диметилсульфоксид |
| DMF | N,N-Диметилформамид |
| d. Th. | От теории |
| ЕЕ | Этилацетат (этиловый эфир уксусной кислоты) |
| EI | Ионизация при электронном ударе (при масс-спектроскопии) |
| ESI | Ионизация электрораспылением (при масс-спектроскопии) |
| Fp. | Температура плавления |
| ges. | Насыщенный |
| H | Часов |
| HPLC | Высокоэффективная жидкостная хроматография (при высоком давлении, ВЭЖХ) |
| konz. | Концентрированный |
| LC-MS | Жидкостная хроматомасс-спектроскопия |
| LDA | Диизопропиламид лития |
| МСРВА | м-Хлорнадбензойная кислота |
| MS | Масс-спектроскопия |
| NMR | Спектроскопия ядерного магнитного резонанса |
| proz. | Процентный |
| Rf | Индекс удерживания (при тонкослойной хроматографии) |
| RP-HPLC | ВЭЖХ с обращением фаз |
| RT | Комнатная температура |
| Rt | Время удерживания (при ВЭЖХ) |
| THF | Тетрагидрофуран |
| Подвижные фазы для тонкослойной хроматографии | |
| T1 E1: | Толуол - этилацетат (1:1) |
| T1 EtOH1: | Толуол - этанол (1:1) |
| C1 E1: | Циклогексан - этилацетат (1:1) |
| С1 Е2: | Циклогексан - этилацетат (1:2) |
Способы проведения анализов методами жидкостной хроматомасс-спектрометрии и ВЭЖХ
Способ 1 (жидкостная хроматомасс-спектрометрия)
Прибор: Micromass Platform LCZ, HP1100; колонка: Symmetry C18, 50 мм × 2,1 мм, 3,5 мкм; элюент А: ацетонитрил + 0,1% муравьиной кислоты, элюент Б: вода + 0,1% муравьиной кислоты; градиент: 0,0 минут 10% А→4,0 минуты 90% А→6,0 минут 90% А; термостат: 40°С; скорость потока: 0,5 мл/мин; УФ-детектор: 208-400 нм.
Способ 2 (жидкостная хроматомасс-спектрометрия)
Прибор: Micromass Quattro LCZ, HP1100; колонка: Symmetry C18, 50 мм × 2,1 мм, 3,5 мкм; элюент А: ацетонитрил + 0,1% муравьиной кислоты, элюент Б: вода + 0,1% муравьиной кислоты; градиент: 0,0 минут 10% А→4,0 минуты 90% А→6,0 минут 90% А; термостат: 40°С; скорость потока: 0,5 мл/мин; УФ-детектор: 208-400 нм.
Способ 3 (жидкостная хроматомасс-спектрометрия)
Прибор: Waters Alliance 2790 LC; колонка: Symmetry C18, 50 мм × 2,1 мм, 3,5 мкм; элюент А: вода + 0,1% муравьиной кислоты, элюент Б: ацетонитрил + 0,1% муравьиной кислоты; градиент: 0,0 минут 5% Б→5,0 минут 10% Б→6,0 минут 10% Б; температура: 50°С; скорость потока: 1,0 мл/мин; УФ-детектор: 210 нм.
Способ 4 (ВЭЖХ)
Прибор: HP 1100 с цифровым диодно-матричным детектором (DAD); колонка: Kromasil RP-18, 60 мм × 2 мм, 3,5 мкм; элюент А: 5 мл HClO4 в 1 л воды, элюент Б: ацетонитрил; градиент: 0,0 минут 2% Б, 0,5 минуты 2% Б, 4,5 минуты 90% Б, 6,5 минут 90% Б; скорость потока: 0,75 мл/мин; температура 30°С; УФ-детектор 210 нм.
Препаративная ВЭЖХ с обращением фаз
Колонка: YMC-Gel; элюент: ацетонитрил/вода (гради