Способы получения эплеренона
Иллюстрации
Показать всеИзобретение относится к улучшенным способам получения фармацевтически полезного соединения - эплеренона: (9α,11α-эпокси-17β-гидроксипрегн-4-ен-3-он-7α,21-дикарбоновой кислоты, γ-лактон, метиловый эфир) с использованием новых промежуточных продуктов. Способы проводят с использованием преобразования Δ4,6-3-кетостероида или его кеталя в соответствующую Δ4-3-кетостероид-7α-карбоновую кислоту через ряд стадий, включающих стадии окисления, метилирования, эпоксидирования. Способ обеспечивает сокращение числа стадий процесса и высокий выход продукта. 3 н. и 8 з.п. ф-лы.
Реферат
1. Область изобретения
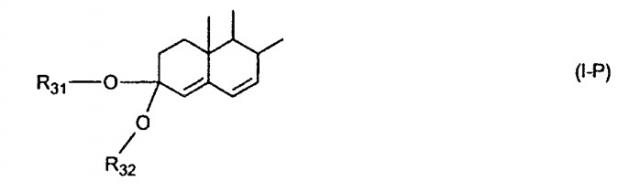
Настоящее изобретение относится к способу преобразования 3-енольного эфира Δ3,5-стероида в соответствующий Δ4,6-3-кеталь стероида (I-P).
Настоящее изобретение относится к способу преобразования Δ4,6-3-кетостероида или его кетали (I) в соответствующую Δ4-кетостероид-7α-карбоновую кислоту (VI).
Настоящее изобретение также относится к новым способам и новым промежуточным соединениям для получения фармацевтически полезного соединения эплеренона.
Также изобретение относится к способам преобразования 11α-гидрокси-17-лактона (CI) или 11α-гидрокси стероидов (CIV) в соответствующий Δ9(11)-17-лактон (CII) или Δ9(11)-стероиды (CV), используя N-фторалкиламиновые реагенты (CVI).
2. Уровень техники
Известно, что преобразование 3-кето-Δ4,6-стероидов в соответствующие стероидные Δ4,6-3-кетали осуществляется путем кислотно-катализируемой кетализации. Выходы являются небольшими, и разрыв двойной связи может происходить как конкурентный процесс. Например, Δ4,6-холестадиен-3-он-3-циклоэтиленкеталь получали путем кетализации Δ4,6-холестадиен-3-она с выходом 64%, см. J. Org. Chem. 26, 2549 (1961). Также 17β-гидроксиандроста-4,6-диен-3-он-3-циклоэтиленкеталь получали путем кетализации 6-дегидротестостерона с выходом твердого вещества 55%, см. J. Am. Chem. Soc., 86, 2183 (1964). Стероидные Δ4,6-3-кетали (I-P) могут использоваться в качестве исходных веществ в способе получения эплеренона.
В J. Org. Chem., 29, 601 (1964) говорится о том, что Δ3,5-3-алкокси стероиды взаимодействуют с DDQ в присутствии воды с получением соответствующих Δ4,6-3-кетостероидов. Способ по настоящему изобретению заключается во взаимодействии Δ3,5-3-алкокси стероидов (3-алкиловый енольный эфир) с DDQ в присутствии спирта в сильно обезвоженных условиях с получением Δ4,6-3-кеталя стероида (I-P). Более того, по предшествующему уровню техники способы получения Δ4,6-3-кеталя стероида (I-P) включают две стадии, 6-дегидрогенизацию енольного эфира до Δ4,6-3-кетостероида с последующей кетализацией, тогда как по настоящему изобретению имеется одна стадия взаимодействия.
Эплеренон, также известный как эпоксимексренон, является полезным фармацевтическим агентом и химически представляет собой 9α,11α-эпокси-17β-гидроксипрегн-4-ен-3-он-7α,21-дикарбоновую кислоту, γ-лактон, метиловый эфир.
В международной публикации WO98/25948 PCT заявки PCT/US97/23090 описан эплеренон и много различных способов получения эплеренона. В частности, смотри схемы 1-10.
В патенте США № 4874754 описаны 19-норстероиды с 7α-арильным замещением. 7α-Арильный заместитель включает в себя много групп, включая фенил, тиенил, фурил, тиазолил, пирролил, оксазолил, имидазолил, пиразолил, триазолил, тетразолил, изотиазолил и изоксазолил, пиридинил, пиридазинил, пиримидинил и пиразинил. Независимо от того, какую группу использовали, 19-норсоединения обладали антипролиферативными, противоэстрогенными и/или эстрогенными свойствами и не являются полезными промежуточными соединениями для получения эплеренона, так как не существует практических способов введения 19-метильной группы в 19-норстероиды. 7α-Замещенные стероиды (II) по настоящему изобретению являются промежуточными соединениями, не конечными продуктами, и не обладают эстрогенными свойствами, так как они не являются 19-норстероидами.
В патенте США № 4502989 описано несколько Δ11-стероидных-γ-лактонов, многие из которых замещены в 7α-положении, которые обладает антагонистической активностью по отношению к альдостерону. 7α-Заместители представляют собой 6α,7α-метилен-, 7α-триметилацетилтио-, 7α-ацетилтио- и 7α-бензоилтио-, смотри пункт 1 формулы изобретения. Эти соединения отличаются от соединений по изобретению тем, что двойная связь C-кольца находится в положении Δ11-, и 7α-заместители являются такими, что соединения не могут использоваться таким же образом, что и 7α-замещенные стероиды (II).
В Het., 25, 399 (1987) и Bull. Soc. Chim. Fr. 131, 900 (1994) описано использование трифторидбордиэтилэфирата для катализируемого связующего добавления не-стероидного 2-метилфурана к α,β-ненасыщенным кетонам в этаноле/нитрометане. Способ по настоящему изобретению включает стероидные фураны. Кроме того, еноновые субстраты по Het., 25, 399 (1987) и Bull. Soc. Chim. Fr. 131, 900 (1994) не содержат стерические центры, так что в этом случае стереохимический контроль не достигается.
Способы связующего добавления карбоновых нуклеофильных реагентов к 9(11)-насыщенным-Δ4,6-3-кетостероидам с получением стереоселективно 9(11)-насыщенных-7α-замещенных стероидов известны. В J. Am. Chem. Soc., 94, 4654 (1972) описано связующее нуклеофильных карбоновых реагентов к 9(11)-насыщенным-Δ4,6-3-кетостероидам с получением стереоселективно 9(11)-насыщенных-7α-замещенных стероидов. В Tet., 49, 9955 (1993) и Tet. Lett., 29, 1533 (1988) описано стереоселективное добавление аллилтриметилсилана к канренону (тетрахлорид титана, метиленхлорид, -78o) с получением смеси двух трудноразделяемых продуктов (7α-аллил-канренон и соответствующий 6α,7α-конденсированный силилциклопентан) с низкими выходами (43-73% и 7-15% соответственно). Замечено, что в этих случаях стероидный субстрат является 9(11) насыщенным. Из-за отсутствия стереоконтроля все попытки применения этих способов или подобных способов к 9(11) ненасыщенным стероидным субстратам были неудачными. Например, в патенте США №4559332, пример 7, описано, что триметилсульфоксоний йодид добавляли к Δ9(11)-канренону (I), используя гидрид натрия в ДМСО при комнатной температуре с получение только 6β,7β-метилен-Δ9(11)-канренона. Также нитрометан добавляли к Δ9(11)-канренону (I) в тетраметилгуанидине при комнатной температуре в течение 7,5 часов с получением только 7β-стереоизомера (7β-нитрометил-Δ9(11)-6,7-дигидроканренон).
В Helv. Chim. Acta, 80, 566 (1997) и патенте США №4559332 описано взаимодействие Δ9(11)-канренона с цианидом диэтилалюминия с получением 7α-циано-Δ9(11)-6,7-дигидроканренона, а сырой продукт описывается как "коричневатый аморфный осадок", который "фильтровали через силикагель, получая аморфный" полуочищенный продукт, "который использовали без дополнительной очистки на следующей стадии." Соотношение 7-α- к 7-β-эпимерам не указано.
В J. Am. Chem. Soc.79, 3120 (1957), J. Am. Chem. Soc.82, 6136 (1960), и J. Org. Chem.27, 1192 (1962) описано разложение не-стероидных ендионов до карбоновых кислот через гидроксигидропероксидные промежуточные соединения и не алкоксигидропероксидные промежуточные соединения. Способ по настоящему изобретению включает стероидные ендионы.
Известен окислительный разрыв связей фуранов до карбоновых кислот или производных карбоновой кислоты путем прямого озонолиза. Однако выходы продукта обычно достаточно низкие. В J. Org. Chem., 61, 9126 (1996) сообщается, что 2,5-дизамещенный фуран при озонировании подвергается скорее частичному разложению до енольного ацетата, чем полному разложению до карбоновой кислоты. В Het., 34, 895 (1992) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 59%. В J. Am. Chem. Soc. 101, 259 (1979) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 55%. В J. Am. Chem. Soc., 107, 7762 (1985) сообщается о прямом озонировании 2-сахар-замещенного фурана, с получением, после восстановления бораном, простого спирта с выходом 50%. В Tet. Lett., 34, 7323 (1993) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 60%. В Carb. Res., 150, 163 (1986) сообщается о прямом озонировании 2-сахар-замещенного фурана с получением, после восстановления трифенилфосфином, затем гидридом литий алюминия, простого спирта с выходом 11%. В Tet. Lett., 22, 141 (1981) сообщается о прямом озонировании 2-замещенного фурана с получением, после окисления, карбоновой кислоты с выходом приблизительно 30%. В J. Am. Chem. Soc., 109, 2082 (1987) сообщается о прямом озонировании 2-замещенного фурана, с получением, после этерификации, метилового эфира с выходом 77%. В Tet. Lett., 39, 7013 (1998) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 78%-87%. В J. Org. Chem.,54, 2085 (1989) сообщается о прямом озонировании двух 2-замещенных фуранов с получением карбоновой кислоты с выходом 89-95%, однако в этом исследовании 2-замещенные фураны были очень простыми (то есть они не содержали какой-либо иной активной функциональной группы, кроме фурана). Нет описаний двух стадий разрыва связей фурана и затем окислительного разложения до карбоновой кислоты, которая дает высокие выходы продукта.
В J. Org. Chem.63, 7505 (1998) описывается использование диброматина, бикарбоната натрия и водного ацетона для разрыва связей не-стероидных фуранов с получением ендионов. Способ по настоящему изобретению включает стероидные фураны.
В Chem. Lett., 1771 (1983) описывается использование хлористоводородной кислоты в эфире для катализа изомеризации не-стероидных цис-ендионов до транс-ендионов. Способ по настоящему изобретению включает стероидные ендионы.
В J. Am. Chem. Soc.,79, 3120 (1957), J. Am. Chem. Soc., 82, 6136 (1960) и J. Org. Chem., 27, 1192 (1962) описывается разложение ендионов до карбоновых кислот через промежуточные соединения алкоксигидропероксида путем использования озона и агента окислительного расщепления. Выходы продукта не очень высокие. Например, выход бензойной кислоты из транс-дибензоилэтилена составлял 54%. После этого способа метоксигидропероксид (IV-OOH) (где R7-2 = -CH3) давал 65,2/34,8 смесь желаемой карбоновой кислоты (VI) и α-кетометилового эфира, где (Rb = OMe). α-Кетометиловый эфир не может быть преобразован в полезное эплеренон-соединение, а его получение делает способ коммерчески непригодным. Для сравнения, в способе по данному изобретению ендион (III) распадается до карбоновой кислоты (VI) через промежуточное соединение гидроксигидропероксида (IV-OOH, где R7-2 = -H), которое неожиданно преобразовывается в желаемую карбоновую кислоту (VI) с почти количественным выходом. В способе по настоящему изобретению используется озон, гидроперокси-деокислительный агент и затем агент окислительного расщепления для избежания получения α-кетометилового эфира и получения больших выходов продукта.
В Drugs of the Future, 24, 488 (1999) описывается преобразование 5,7-лактона (VII) в соответствующий метиловый эфир (VIII) путем обработки "метилйодида в основной среде". Способ метилирования по настоящему изобретению представляет собой последовательный процесс.
В международной публикации WO98/25948 главным образом описаны (5,7)-17-бислактоны и 3 защищенные формы.
В международной публикации WO98/25948 описано преобразование стероидной 7α-кислоты в (5,7)-17-бислактон. Для этого способа необходим ортоэфир. Для способа по настоящему изобретению ортоэфир не требуется.
В международной публикации WO98/25948 описано преобразование (5,7)-17-бислактона в соответствующий 7α-CO-OCH3 в одну стадию. В настоящем изобретении используется две стадии, но с большим выходом продуктов и расходуется меньше реагента.
Эплеренон представляет собой 9(11)α-эпокси-17β-гидроксипрегн-4-ен-3-он-7α,21-дикарбоновую кислоту, γ-лактон, метиловый эфир, и как таковой он содержит 7α-карбометокси-заместитель. С точки зрения производства, основная трудность при получении эплеренона заключается во введении 7α-карбометокси-заместителя. Настоящее изобретение включает улучшенный проверенный способ введения 7α-заместителя.
Известно, что карбоновая кислота может быть получена из (замещенного)фурана в одну стадию путем озонолиза. Однако выход продукта довольно низок. Более того, известно, что эти фураны могут распадаться до ендионов. Также известно, что ендионы могут быть окислены до карбоновых кислот.
В Bulletin of the Chemical Society of Japan, 52, 3377-3380 (1979) описывается, что н-(1,1,2,2,3,3,3)гексафторпропил-диэтиламин, "реагент Ишикавы (Ishikawa reagent)", используется для замены гидроксильной группы на атом фтора или для элиминирования гидроксильной группы до олефина. Для циклогексанола, простой моноциклической системы, продукт элиминирования олефина составлял 78%. Однако, когда "реагент Ишикавы" применяли к стероиду, холестерину, получали соответствующее соединение фтора фторид холестерина с 83% выходом; продукт элиминирования не описывался.
В J. Org. Chem., 2187-2195(1964) описывается взаимодействие 11α-гидроксипрег-4-ен-3,20-диона с 2-хлор-1,1,2-трифтортриэтиламином с получением продукта элиминирования, прегна-4,9(11)-диен-3,20-диона, с 86% выходом. В способе по настоящему изобретению не используется 2-хлор-1,1,2-трифтортриэтиламин, также известный как реагент Яровенко. Кроме того, применение 2-хлор-1,1,2-трифтортриэтиламина является проблемой, поскольку он не является стабильным в достаточной степени для его практического использования. В дополнение, он является производным хлорфторуглерода и не является безопасным с экологической точки зрения.
В Tetrahedron Letters, 1065-1069 (1962) также описывается взаимодействие 11α-гидроксипрегн-4-ен-3,20-диона с 2-хлор-1,1,2-трифтортриэтиламином с получением продукта элиминирования, прегна-4,9(11)-диен-3,20-диона.
В Стероиды, 29, 2187 (1964) описывается взаимодействие стероидных спиртов с 2-хлор-1,1,2-трифтортриэтиламином для замены гидроксильной группы фтором. В настоящем изобретении 2-хлор-1,1,2-трифтортриэтиламин не используется, он не участвует в замене гидроксильной группы атомом фтора.
В J. Fluorine Chem., 109, 25-31 (2001) описано и оценено применение 1,1,2,2-тетрафторэтил-N,N-диметиламина, а также реагента Яровенко-Ракша и Ишикава в качестве фторирующих и дегидратирующих агентов. Хотя в документе описаны примеры реакций элиминирования как для алифатических, так и для циклических систем, основным использованием является использование в качестве фторирующего агента. Единственным примером для стероида было взаимодействие 1,1,2,2-тетрафторэтил-N,N-диметиламина с холестерином с получением продукта, содержащего фтор в положении C-3 холестерина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Описан способ получения Δ4,6-кеталя формулы (I-P)
где R31 и R32 являются
(1) одинаковыми или различными и представляют собой C1-C3 алкил и
(2) взятые вместе с присоединенным -O-C-O-, образуют циклический кеталь, содержащий 5 или 6 атомов, формулы
-(CH2)-(CR33R34)n1-(CH2)-,
где n1 равно 0 или 1;
где R33 и R34 являются одинаковыми или различными и представляют собой
-H,
C1-C3 алкил,
который включает
(1) взаимодействие Δ3,5-3-энольного эфира формулы (алкиловый енольный эфир)
| алкиловый енольный эфир |
где R3 представляет собой
C1-C3 алкил,
CH3-CO-,
Φ-CO- или
RSi-1RSi-2RSi-3Si-, где RSi-1, RSi-2 и RSi-3 являются одинаковыми или различными и представляют собой C1-C4 алкил; с улавливателем водорода (a hydride abstractor) и спиртом, выбранным из группы, включающей спирты формулы:
(a) R31-OH, где R31 такой, как определено выше,
(b) R32-OH, где R32 такой, как определено выше,
(c) HO-(CH2)-(CR33R34)n1-(CH2)-OH, где n1, R33 и R34 такие, как определено выше,
(d) HO-CH2-CH2-OH.
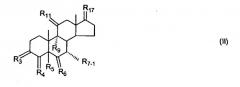
Также описан 7α-замещенный стероид формулы (II)
где
(I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, другой из R4-1 и R4-2, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H;
(II) R3 представляет собой R3-3:R3-4 и R4 представляет собой R4-3:R4-4, где один из R3-3 и R3-4 представляет собой -O-R31, где R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4, взятый вместе с одним из R4-3 и R4-4, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4, взятый вместе с R5, ообразует вторую связь между атомами углерода, к которым они присоединены, а другой из R6-3 и R6-4 представляет собой -H;
(III) R3 представляет собой α-R3-5:β-R3-6, где R3-5 представляет собой -O-R31, и R3-6 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей C1-C3 алкил и R31 и R32, взятые вместе с присоединенным -O-C-O-, образуют циклический кеталь из 5 или 6 атомов формулы
-(CH2)-(CR33R34)n1-(CH2)-,
где n1 равно 0 или 1;
где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R6-5 и R6-6 представляет собой -H;
(IV) R3 представляет собой α-R3-7:β-R3-8, где R3-7 представляет собой -O-R31 и R3-8 представляет собой -O-R32, где R31 и R32 такие, как определено выше; R4 представляет собой R4-7:R4-8, где один из R4-7 и R4-8, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R4-7 и R4-8 представляет собой -H; R6 представляет собой -H:-H;
где R7-1 представляет собой молекулярный фрагмент формулы (-A1)
или формулы (-A2)
где X1 представляет собой:
-S-,
-O- или
-NX1-1- и где X1-1 представляет собой:
-H,
C1-C4 алкил,
-CO-OX1-2, где X1-2 представляет собой C1-C4 алкил или -CH2-φ,
-CO-X1-2, где X1-2 такой, как определено выше,
-CO-φ, где -φ замещен в о-положении -CO-O-(C1-C4 алкил),
-SO2-(C1-C3 алкил),
-SO2-φ, где φ необязательно замещен 1 или 2 группами
C1-C4 алкилами,
C1-C4 алкокси;
где Rb выбран из группы, содержащей
-Н,
C1-C4 алкил или
фенил, необязательно замещенный 1 или 2 группами
C1-C4 алкилами,
C1-C4 алкокси,
где Rc выбран из группы, содержащей:
-H,
C1-C4 алкил,
C1-C4 алкокси,
-O-Si(R)3, где R являются одинаковыми или различными, и представляют собой -H, C1-C4 алкил, -φ, C1-C4 алкокси и -OH,
-F, -Cl, -Br, -I,
-CO-OCH3 и
-CO-Rc-1, где Rc-1 представляет собой C1-C4 алкил или -φ;
где Rd выбран из группы, содержащей
-H,
-C≡N,
C1-C10 алкил;
C1-C4 алкокси;
-CH2-ORd-1, где Rd-1 представляет собой -H или C1-C4 алкил,
-CH2-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и представляют собой:
C1-C4 алкил,
-φ,
-CO-Rd-6a, где Rd-6a представляет собой C1-C4 алкил или -φ,
-CH2-O-CO-Rd-1, где Rd-1 такой, как определено выше,
-CH(ORd-1)2, где Rd-1 такой, как определено выше, и где два Rd-1, взятые вместе, представляют собой:
-CH2-CH2-,
-CH2-CH2-CH2-,
-CH2-C(CH3-)2-CH2-,
-CH(-O-CO-Rd-1)2, где Rd-1 такой, как определено выше,
-Si(R)3, где R такой, как определено выше,
-O-Si(R)3, где R такой, как определено выше,
-Sn(Rb-1)3, где Rb-1 такой, как определено выше,
-S-Rd-5, где Rd-5 представляет собой C1-C4 алкил или -φ,
-N(Rd-6)2, где Rd-6 такой, как определено выше,
где Rc и Rd взяты вместе с атомами, к которым они присоединены, образуют
где E1 являются одинаковыми или различными и представляют собой:
-H,
C1-C4 алкил, F, -Cl, -Br, -I,
-OE1-1, где E1-1 представляет собой:
-H,
C1-C4 алкил,
-φ или
-SiE1-2E1-3E1-4, где E1-2, E1-3 и E1-4 являются одинаковыми или различными и представляют собой C1-C4 алкил или C1-C4 алкокси,
-S-E1-5, где E1-5 представляет собой C1-C4 алкил или -φ,
-S-(O)1-2-E1-5, где E1-5 такой, как определено выше,
-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и являются такими, как определено выше,
-P(O)(O-E1-1)2, где E1-1 такой, как определено выше,
-Si(R)3, где R такой, как определено выше;
где E1 такой, как определено выше, и
где M представляет собой:
(1) =O,
(2) =N-E2, где E2 выбран из группы, содержащей
-H,
C1-C4 алкил,
C1-C4 алкенил, содержащий 1 или 2 двойные связи,
C1-C4 алкинил, содержащий 1 тройную связей,
-CO-OE2-1, где E2-1 представляет собой -H или C1-C4 алкил,
-C(E2-1)2-OE2-2, где E2-1 являются одинаковыми или различными и являются такими, как определено выше, и где E2-2 представляет собой
C1-C4 алкил,
-φ или
-Si(R)3, где три R являются одинаковыми или различными и такие, как определены выше,
-OE2-2, где E2-2 такой, как определено выше,
-S-E2-3, где E2-3 представляет собой C1-C4 алкил или -φ,
-S-(O)1-2-E2-3, где E2-3 такой, как определено выше,
-N(Rd-6)2, где два Rd6 являются одинаковыми или различными и такие, как определено выше;
-Si(R)3, где три R такие, как определено выше;
(3) =C(E2)2, где E2 являются одинаковыми или различными и являются такими, как определено выше,
где E1 и E2 взяты вместе с атомами, к которым они присоединены, образуют кольцо, содержащее от 5 до 7 членов, необязательно содержащее от 3 до 5
-O-,
-S-,
-N=,
-NX1-1-, где X1-1 такой, как определено выше,
-CE2=, где E2 такой, как определено выше,
-C(Rb)2-, где Rb такой, как определено выше, и необязательно содержащий 1 или 2 дополнительных двойных связей;
где E2 такой, как определено выше;
где R9 представляет собой:
(1) -H,
(2) -OH,
(3) -O-(гидрокси-защитную группу), где гидрокси-защитная группа выбрана из группы, содержащей
-Si(-CH3)3,
-Si(-CH2-CH3)3,
-CO-CH3,
-CO-H и
-SiH(CH3)2,
(4) -F;
где R11 представляет собой:
(1) =O,
(2) -H:-H,
(3) α-R11-1:β-R11-2, где R11-1 представляет собой:
(a) -H,
(b) -O-R11-3, где R11-3 представляет собой:
(i) -H,
(ii) гидрокси-защитную группу, где гидрокси-защитная группа такая, как определено выше, и где R11-2 представляет собой:
(a) -H,
(b) -O-R11-4, где R11-4 представляет собой:
(i) -H,
(ii) гидрокси-защитную группу, где гидрокси-защитная группа такая, как определено выше, при условии, что один из R11-1 и R11-2 должен быть -H,
(4) R11-5:R11-6, где один из R11-5 или R11-6 и R9 взяты вместе с R9, образуют вторичную связь между C-9 и C-11, и другой из R11-5 или R11-6 представляет собой -H,
(5) α-R11-7:β-R11-8, где R11-7 и R9 взяты вместе с -O-, образуют эпоксид между C-9 и C-11, и R11-8 представляет собой -H;
где R17 представляет собой:
(1) = O;
(2) α-R17-1:β-R17-2, где R17-1 представляет собой:
(a) -H,
(b) -C≡C-H,
(c) -C≡N,
(d) -C≡C-CH2-O-R17-1-1, где R17-1-1 выбран из группы, содержащей
(i) -H,
(ii) -Si(R17-1-2)3, где R17-1-2 являются одинаковыми или различными и представляют собой C1-C4 алкил,
(iii) 1-этоксиэтил,
(iv) 2-тетрагидропиранил,
(e) -C≡C-CH2-O-(гидрокси-защитная группа), где гидрокси-защитная группа такая, как определено выше,
(f) -CH2-CH2-CH2-OH,
(g) -CH2-CH2-CH2-O-(гидрокси-защитная группа), где гидрокси-защитная группа такая, как определено выше,
(h) -CH2-CH2-CO-O и где R17-2 представляет собой -OH;
(3) α-R17-3:β-R17-4, где R17-3 представляет собой -OH и где R17-4 представляет собой:
(a) -CO-CH3,
(b) -CO-CH2-OH,
(c) -CO-CH2-O-CO-(CH2)0-3-CH3;
(4) α-R17-5:β-R17-6, где R17-5 и R17-6 взяты вместе с присоединенным атомом углерода с образованием трехчленного эпоксида, содержащего -O-CH2-, где присоединение -O осуществлено к R17-6 в β-ориентации и присоединение CH2- осуществлено к R17-5 в α-ориентации;
(5) α-R17-7:β-R17-8, где R17-7 и R17-8 взяты вместе с присоединенным атомом углерода с образованием пятичленного лактона, содержащего-O-CO-CH2-CH2-, где присоединение CH2- осуществлено к R17-7 в α-ориентации и присоединение -O осуществлено к R17-8 в β-ориентации;
(6) -O-CH(OR17-9)-CH2-CH2 ......, где связь от кислорода (-O) представляет собой одну из четырех связей у C-17 в β-конфигурации и связь от метиленовой группы (CH2 ......) представляет собой другую из четырех связей у C-17 в α-конфигурации с образованием 5-членного гетероцикла, содержащего один атом кислорода, где R17-9 представляет собой -H или C1-C3 алкил;
(7) α-R17-11:β-R17-12, где R17-10 представляет собой -(CH2)1-2-CH=CH2 и R17-12 представляет собой
-OH.
Далее описан цис-ендион формулы (III-цис)
и транс-ендион формулы (III-транс)
где
(I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взяты вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H;
(III) R3 представляет собой α-R3-5:β-R3-6, где R3-5 представляет собой -O-R31 и R3-6 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей
C1-C3 алкил и
R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклической кетали, содержащей 5 или 6 атомов, формулы
-(CH2)-(CR33R34)n1-(CH2)-,
где n1 представляет собой 0 или 1;
где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H;
(IV) R3 представляет собой α-R3-7:β-R3-8, где R3-7 представляет собой -O-R31 и R3-8 представляет собой -O-R32, где R31 и R32 такие, как определено выше; R4 представляет собой R4-7:R4-8, где один из R4-7 и R4-8 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-7 и R4-8 представляет собой -H; R6 представляет собой -H:-H;
где R9, R11 R17 такие, как определено выше;
где Rb выбран из группы, включающей
-H,
C1-C4 алкил или
фенил, необязательно замещенный 1 или 2 группами
C1-C4 алкил,
C1-C4 алкокси,
где Rc выбран из группы, включающей:
-H,
C1-C4 алкил,
C1-C4 алкокси,
-O-Si(R)3, где все R являются одинаковыми или различными и представляют собой -H, C1-C4 алкил, -φ, C1-C4 алкокси и -OH,
-F, -Cl, -Br, -I,
-CO-OCH3 и
-CO-Rc-1, где Rc-1 представляет собой C1-C4 алкил или -φ;
где Rd выбран из группы, включающей
-H,
-C≡N,
C1-C10 алкил;
C1-C4 алкокси;
-CH2-ORd-1, где Rd-1 представляет собой -H или C1-C4 алкил,
-CH2-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и представляют собой:
C1-C4 алкил,
-φ,
-CO-Rd-6a, где Rd-6a представляет собой C1-C4 алкил или -φ,
-CH2-O-CO-Rd-1, где Rd-1 такой, как определено выше,
-CH(ORd-1)2, где Rd-1 такой, как определено выше, и где два Rd-1, взятые вместе, представляют собой:
-CH2-CH2-,
-CH2-CH2-CH2-,
-CH2-C(CH3-)2-CH2-,
-CH(-O-CO-Rd-1)2, где Rd-1 такой, как определено выше,
-Si(R)3, где R такой, как определено выше,
-O-Si(R)3, где R такой, как определено выше,
-Sn(Rb-1)3, где Rb-1 такой, как определено выше,
-S-Rd-5, где Rd-5 представляет собой C1-C4 алкил или -φ,
-N(Rd-6)2, где Rd-6 такой, как определено выше,
где Rc и Rd взяты вместе с атомами, к которым они присоединены, с образованием
где E1 являются одинаковыми или различными и представляют собой:
-H,
C1-C4 алкил,
-F, -Cl, -Br, -I,
-OE1-1, где E1-1 представляет собой:
-H,
C1-C4 алкил,
-φ или
-SiE1-2-E1-3E1-4, где E1-2-, E1-3 и E1-4 являются одинаковыми или различными и представляют собой C1-C4 алкил или C1-C4 алкокси,
-S-E1-5, где E1-5 представляет собой C1-C4 алкил или -φ,
-S-(O)1-2-E1-5, где E1-5 такой, как определено выше,
-N(Rd-6)2, Rd-6 являются одинаковыми или различными и являются такими, как определено выше,
-P(O)(O-E1-1)2, где E1-1- такой, как определено выше,
-Si(R)3, где R такой, как определено выше.
Далее описано гидрокси-соединение формулы (IV-OH)
и гидроперокси-соединение (IV-O-OH)
где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс) и где R9, R11 R17 и Rb такие, как определено выше, и где R7-2 представляет собой -H и C1-C4 алкил, необязательно замещенный одним или двумя -OH.
Описано бискарбонильное соединение формулы (V)
где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17 и Rb такие, как определено выше.
Также описан цис-оксиендион формулы (X-цис)
и транс-ендион формулы (X-транс)
где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17, Rb, Rc и Rd такие, как определено выше.
Далее описан 7α-ненасыщенный стероид формулы (XIV)
где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17, Rb и Rd такие, как определено выше.
Дополнительно описана 7α-предкислота формулы (XV)
где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17 и Rb такие, как определено выше.
Описан способ получения 7α-замещенный стероид (II) формулы
где
(I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H;
(II) R3 представляет собой R3-3:R3-4 и R4 представляет собой R4-3:R4-4, где один из R3-3 и R3-4 представляет собой -O-R31, где R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4 взят вместе с одним из R4-3 и R4-4 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-3 и R6-4 представляет собой -H;
(III) R3 представляет собой
α-R3-5:β-R3-6, где R3-5 представляет собой -O-R31 и R3-6 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей
C1-C3 алкил, и
R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклической кетали, содержащей 5 или 6 атомов, формулы
-(CH2)-(CR33R34)n1-(CH2)-,
где n1 представляет собой 0 или 1;
где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H;
(IV) R3 представляет собой α-R3-7:β-R3-8, где R3-7 представляет собой -O-R31 и R3-8 представляет собой -O-R32, где R31 и R32 такие, как определено выше; R4 представляет собой R4-7:R4-8, где один из R4-7 и R4-8 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-7 и R4-8 представляет собой -H; R6 представляет собой -H:-H;
где R7-1, R9, R11 и R17, такие, как определено выше;
который включает:
(1) взаимодействие Δ4,6-3-кетостероида или его кетали (I) формулы
где
(I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены;
(I-кеталь) R3 представляет собой R3-9:R3-10, где R3-9 представляет собой -O-R31 и R3-10 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей
C1-C3 алкил, и
R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклической кетали, содержащей 5 или 6 атомов, формулы
-(CH2)-(CR33R34)n1-(CH2)-,
где n1 представляет собой 0 или 1;
где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой R4-9:R4-10, где один из R4-9 и R4-10 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-9 и R4-10 представляет собой -H;
где R9, R11 и R17 такие, как определено выше, аддуктом, выбранным из соединений
(a) формулы (A)
или
где X1, Rb, Rc и Rd такие, как определено выше, и
где Ra выбран из группы, включающей -H, -ZnL, -BL, -SiL3, -SnL3, -Cu, -CuL, -AlL2, -HgL, -Ag, -MgL, -Li и -COOH, где L представляет собой -OH, C1-C4 алкил, -F, -Cl,