Фтор- и трифторалкилсодержащие гетероциклические сульфонамидные ингибиторы образования бета-амилоида и их производные
Иллюстрации
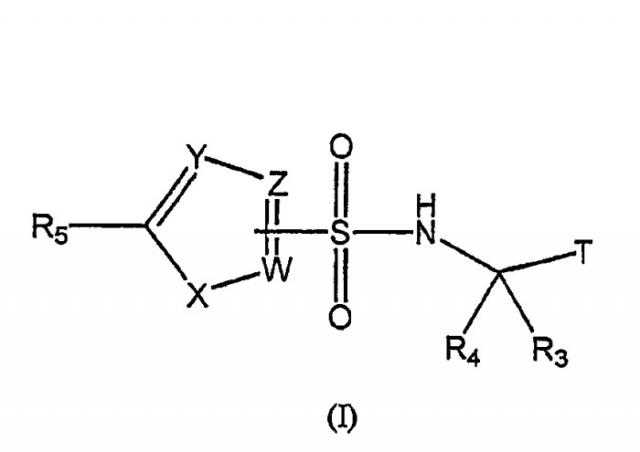
Показать всеНастоящее изобретение относится к фтор- и трифторалкилсодержащим гетероциклическим сульфонамидам общей формулы I
где Т - СНО, COR8 и C(OH)R1R2;
R1 и R2 - водород, C1-6алкил;
R3 - водород;
R4 - (CF3)nалкил, (CF3)nалкилфенил и (F)nциклоалкил;
N равен 1-2;
R5 - водород, галоген, диен, конденсированный с Y, когда Y означает С, и диен, конденсированный с Y, когда Y означает С, и замещенный галогеном;
W, Y и Z - С, CR6 и N, при условии, что, по меньшей мере, один из W, или Y, или Z должен быть С;
R6 - водород, галоген и С1-6алкил;
Х - S и NR7;
R7 - С1-6алкил и
R8 - С1-6алкил.
Соединения могут быть использованы для ингибирования образования бета-амилоида и для лечения болезни Альцгеймера. Описаны также способ получения соединений I, фармацевтическая композиция и применение соединений, промежуточные соединения, используемые в синтезе. 9 н. и 39 з.п. ф-лы, 5 табл.
Реферат
Данное изобретение относится к фтор- и трифторалкилсодержащим гетероциклическим сульфонамидным ингибиторам образования бета-амилоида и их производным, к способам их получения, композициям, содержащим их, и способам лечения с их использованием. В частности, такие ингибиторы применимы при лечении болезни Альцгеймера.
Предпосылки создания изобретения
Болезнь Альцгеймера (AD) является наиболее распространенной формой деменции (потери памяти) у престарелых. Основными паталогическими изменениями при AD, обнаруженными в головном мозге, являются внеклеточные отложения белка бета-амилоида в форме бляшек и ангиопатия и внутриклеточные нейрофибриллярные переплетения агрегированного гиперфосфорилированного тау-белка. Последние данные показывают, что повышенные уровни бета-амилоида в головном мозге не только предшествуют тау-патологии, но также коррелируют с когнитивными ухудшениями. Кроме предположения о причинной роли бета-амилоида при AD, последние исследования показали, что агрегированный бета-амилоид токсичен для нейронов в клеточной культуре.
Бета-амилоидный белок состоит, главным образом, из пептидов в 39-42 аминокислоты и образуется из более крупного белка-предшественника, называемого амилоидным белком-предшественником (АРР), при последовательном воздействии протеаз бета- и гамма-секретазы. Хотя изредка, случаи раннего наступления AD связаны с генетическими мутациями в АРР, которые приводят к сверхпродуцированию или общего бета-амилоида, или его более агрегированной (aggregation-prone) изоформе в 42 аминокислоты. Кроме того, люди с синдромом Дауна имеют дополнительную хромосому, которая содержит ген, кодирующий АРР, и, таким образом, имеют повышенные уровни бета-амилоида и позднее в жизни постоянно развивающуюся AD.
Сохраняется потребность в композициях, полезных при ингибировании образования бета-амилоида и при лечении эффектов состояний, связанных с ним.
Краткое изложение сущности изобретения
Указанные соединения полезны для лечения состояний, при которых повышены уровни бета-амилоида (например, AD, синдром Дауна). Системное введение указанных соединений субъектам с риском появления или страдающих от таких болезней, снижает уровни белка бета-амилоида с последующим уменьшением токсичных бета-амилоидных агрегатов в головном мозге пациентов.
Неожиданно было обнаружено, что трифторалкил- и фторсодержащие гетероциклические сульфонамиды формулы (I) обладают неожиданно хорошей ингибирующей активностью в отношении бета-амилоида. Соединения формулы (I) характеризуются повышенной устойчивостью к окислению (метаболическая устойчивость фазы 1) по сравнению с соответствующими соединениями, не содержащими трифторалкильных или фторгрупп. Кроме того, было обнаружено, что соединения формулы (I), идентифицированные в данном описании, обладают повышенными метаболической устойчивостью и периодом полувыведения из кровообращения, и, таким образом, усиленной биологической активностью по сравнению с соответствующим соединением, не содержащим трифторалкильных или фторгрупп.
Кроме того, было обнаружено, что трифторалкил- и фторсодержащие соединения формулы (I) имеют повышенную эффективность по сравнению с соответствующими нефторированными соединениями. Таким образом, ожидается, что соединения изобретения будут полезны в более низких дозах, чем соединения известного уровня техники.
Указанные и другие аспекты изобретения будут очевидны для специалистов в данной области после прочтения последующего подробного описания изобретения.
Подробное описание изобретения
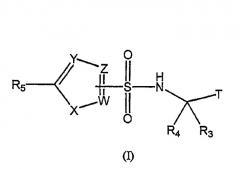
В первом аспекте изобретение раскрывает соединения формулы (I), содержащие их фармацевтические композиции и их применение в модуляции образования бета-амилоида у субъектов, с риском появления или страдающих от AD или других болезней, являющихся результатом повышенных уровней белка бета-амилоида в мозге. Следовательно, настоящее изобретение относится к соединениям формулы (I)
где Т выбирают из группы, состоящей из СНО, COR8 и C(OH)R1R2;
R1 и R2 независимо выбирают из группы, состоящей из водорода, низшего алкила, замещенного низшего алкила, CF3, алкенила, замещенного алкенила, алкинила и замещенного алкинила;
R3 выбирают из группы, состоящей из водорода, низшего алкила и замещенного низшего алкила;
R4 выбирают из группы, состоящей из (CF3)nалкила, (CF3)n(замещенного алкила), (CF3)nалкилфенила, (CF3)nалкил(замещенного фенила) и (F)nциклоалкила;
N равен 1-3;
R5 выбирают из группы, состоящей из водорода, галогена, CF3, диена, конденсированного с Y, когда Y означает C, и замещенного диена, конденсированного с Y, когда Y означает C;
W, Y и Z независимо выбирают из группы, состоящей из С, CR6 и N, при условии, что, по меньшей мере, один из W или Y или Z должен представлять собой С;
R6 выбирают из группы, состоящей из водорода, галогена, низшего алкила и замещенного низшего алкила;
Х выбирают из группы, состоящей из O, S, SO2 и NR7;
R7 выбирают из группы, состоящей из водорода, низшего алкила, замещенного низшего алкила, бензила, замещенного бензила, фенила и замещенного фенила; и
R8 выбирают из группы, состоящей из низшего алкила, CF3, фенила и замещенного фенила;
и их фармацевтически приемлемым солям и/или гидратам или пролекарствам.
Из указанных соединений предпочтительными представителями являются соединения, в которых R4 представляет собой (CF3)nалкил, такой как CF3, CF3CH2, CH(CH3)CH2CF3, CH(CH2CF3)2 или CH(CF3)2. Другими предпочтительными представителями являются соединения, в которых R4 представляет собой (F)nциклоалкил, предпочтительно (F)2циклоалкил, более предпочтительно (F)2циклогексан и бицикло[3.1.0]гексан, и наиболее предпочтительно 4,4-дифторциклогексан и 4,4-дифторбицикло[3.1.0]-3-гексан.
В одном воплощении Т представляет собой С(ОН)R1R2, R1 и R2 представляют собой водород, R3 представляет собой водород, R4 представляет собой (CF3)2СН, предпочтительно, R4 имеет S-стереохимию, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В другом воплощении Т представляет собой СНО, R1 и R2 представляют собой водород, R3 представляет собой водород, R4 представляет собой CH(CH3)CH2CF3, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В другом воплощении Т представляет собой С(О)R8, R1 и R2 представляют собой водород, R3 представляет собой водород, R4 представляет собой CF3CH2(CH3)CH, R5 представляет собой галоген, R8 представляет собой СН3 и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В еще одном воплощении Т представляет собой C(OH)R1R2, R1 и R2 представляют собой водород, R3 представляет собой водород, R4 представляет собой (CH2CF3)2CH, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В еще одном воплощении Т представляет собой C(OH)R1R2, R1 и R2 представляют собой СН3, R3 представляет собой водород, R4 представляет собой CF3CH2(CH3)CH, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В другом воплощении Т представляет собой C(OH)R1R2, R1 представляет собой СН3, R2 представляет собой водород, R3 представляет собой водород, R4 представляет собой (CF3)2CH, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В еще одном воплощении Т представляет собой C(OH)R1R2, R1 и R2 представляют собой водород, R3 представляет собой водород, R4 представляет собой (F)2циклоалкил, R5 представляет собой галоген и W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
Место присоединения гетероциклического W-X-Y-Z-C кольца к группе SO2 не ограничивает настоящее изобретение. Однако в одном предпочтительном воплощении кольцо присоединено к группе SO2 через атом углерода. Однако кольцо может быть присоединено через гетероатом N.
Соединения изобретения могут содержать один или несколько асимметричных атомов углерода, и некоторые соединения могут содержать один или несколько асимметричных (хиральных) центров, и, таким образом, могут образовывать оптические изомеры и диастереомеры. Хотя стереохимия в формуле (I) не показана, когда соединения формулы (I) содержат один или несколько хиральных центров, по меньшей мере, хиральный центр β-аминоспирта является S-стереохимическим. Наиболее предпочтительно атом углерода, к которому присоединены N, R3 и R4, является S-стереохимическим. Таким образом, изобретение включает такие оптические изомеры и диастереомеры, а также рацемические смеси и расщепленные энантиомерно чистые стереоизомеры, а также другие смеси R- и S-стереоизомеров и их фармацевтически приемлемые соли, гидраты и пролекарства.
Термин "алкил" используется в данном описании для обозначения как линейных, так и разветвленных насыщенных алифатических углеводородных групп с одним-десятью атомами углерода, предпочтительно с одним-восемью атомами углерода и наиболее предпочтительно с одним-шестью атомами углерода; используемый в данном описании термин "низший алкил" относится к линейным и разветвленным насыщенным алифатическим углеводородным группам с одним-шестью атомами углерода; подразумевается, что термин "алкенил" включает как линейные, так и разветвленные алкильные группы с, по меньшей мере, одной двойной углерод-углеродной связью и двумя-восемью атомами углерода, предпочтительно с двумя-шестью атомами углерода; подразумевается, что "алкинильная" группа перекрывает как линейные, так и разветвленные алкильные группы с, по меньшей мере, одной тройной углерод-углеродной связью и двумя-восемью атомами углерода, предпочтительно с двумя-шестью атомами углерода.
Термины "замещенный алкил", "замещенный алкенил" и "замещенный алкинил" относятся к алкильной, алкенильной и алкинильной группам, описанным выше, содержащим от одного до трех заместителей, предпочтительно независимо выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклической группы, замещенного арила, замещенной гетероциклической группы, алкокси, замещенного алкокси, арилокси, замещенного арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио. Указанные заместители могут быть присоединены к любому атому углерода алкильной, алкенильной или алкинильной группы, при условии, что присоединение составляет стабильную химическую группу.
Термин "циклоалкил" используется в данном описании для обозначения углеродного насыщенного кольца, содержащего более 3 атомов углерода, образующих стабильное кольцо. Термин "циклоалкил" может включать группы, где две или более циклоалкильных групп конденсированы с образованием стабильного полициклического кольца. Предпочтительно термин "циклоалкил" относится к кольцу, содержащему примерно 4-9 атомов углерода и более предпочтительно примерно 6 атомов углерода.
Термин "замещенный циклоалкил" используется в данном описании для обозначения циклоалкильной группы, описанной выше, содержащей от одного до пяти заместителей, предпочтительно независимо выбранных из группы, состоящей из водорода, галогена, CN, OH, NO2, амино, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино, замещенного алкиламино, арилтио, гетероциклической группы, замещенной гетероциклической группы, аминоалкила и замещенного аминоалкила.
Термин "арил" используется в данном описании для обозначения карбоциклической ароматической системы, которая может быть монокольцевой или системой из нескольких ароматических колец, конденсированных или соединенных вместе так, что, по меньшей мере, одна часть конденсированных или соединенных колец образует конъюгированную ароматическую систему. Арильные группы включают, но, не ограничиваясь ими, фенил, нафтил, бифенил, антрил, тетрагидронафтил, фенантрил и индан.
Термин "замещенный арил" относится к арилу, имеющему указанные выше значения, содержащему один-четыре заместителя, предпочтительно независимо выбранные из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио.
Термин "диен" относится к ненасыщенному углеводороду или диолефину, имеющему две двойные связи. Термин "замещенный диен" относится к диену, замещенному одним-двумя заместителями, предпочтительно независимо выбранными из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, алкокси, замещенного алкокси, арилокси, замещенного арилокси, алкилкарбонила, замещенного алкилкарбонила, алкилкарбокси, замещенного алкилкарбокси, алкиламино, замещенного алкиламино, арилтио или замещенного арилтио.
Как "диен", так и "замещенный диен" используют в контексте R5, воплощении, в котором замещенный диен представляет собой 3-хлор-1,2-бутадиен, который конденсирован с тиофеновым кольцом по R5 и Y с образованием бензотиофена. Другие подходящие диены включают 1,3-бутадиенил и 2-трифторметил-1,3-бутадиенил. Однако можно легко выбрать другие подходящие замещенные и незамещенные диены из числа соединений согласно данному описанию.
Термин "замещенный бензил" относится к бензильной группе, замещенной в бензильном кольце одним или несколькими заместителями, предпочтительно независимо выбранными из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио.
Термин "гетероциклическая группа" используется в данном описании для описания стабильного 4-7-членного моноциклического или стабильного полициклического гетероциклического кольца, которое является насыщенным, частично ненасыщенным или ненасыщенным и которое включает атомы углерода и от одного до четырех гетероатомов, предпочтительно независимо выбранных из группы, состоящей из атомов N, O и S. Атомы N и S могут быть окисленными. К гетероциклическим также относится любое полициклическое кольцо, в котором любое из гетероциклических колец, имеющих указанные выше значения, конденсировано с арильным кольцом. Гетероциклическое кольцо может быть присоединено к любому гетероатому или атому углерода, при условии, что полученная структура является химически стабильной. Такие гетероциклические группы включают, например, тетрагидрофуранил, пиперидинил, пиперазинил, 2-оксопиперидинил, азепинил, пирролидинил, имидазолил, пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил, изоксазолил, морфолинил, индолил, хинолинил, тиенил, фурил, бензофуранил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид, изохинолинил и тетрагидротиопиранил.
Термин "замещенная гетероциклическая группа" используется в данном описании для описания гетероциклической группы, описанной выше, содержащей один-четыре заместителя, предпочтительно независимо выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, алкокси, замещенного алкокси, арилокси, замещенного арилокси, алкилкарбонила, замещенного алкилкарбонила, алкилкарбокси, замещенного алкилкарбокси, алкиламино, замещенного алкиламино, арилтио или замещенного арилтио.
Когда используются термины "замещенный алкил" или "замещенный алкилфенил", замещение может иметь место в алкильной группе или в соответствующем базовом соединении.
Термин "алкокси" используется в данном описании для обозначения группы OR, где R представляет собой алкил или замещенный алкил.
Термин "арилокси" используется в данном описании для обозначения группы OR, где R представляет собой арил или замещенный арил.
Термин "арилтио" используется в данном описании для обозначения группы SR, где R представляет собой арил или замещенный арил.
Термин "алкилкарбонил" используется в данном описании для обозначения группы RCO, где R представляет собой алкил или замещенный алкил.
Термин "алкилкарбокси" используется в данном описании для обозначения группы COOR, где R представляет собой алкил или замещенный алкил.
Термин "аминоалкил" относится как к вторичным, так и к третичным аминам, где алкильные или замещенные алкильные группы, которые могут быть одинаковыми или различными, содержат один-восемь атомов углерода, и место присоединения находится у атома азота.
Термин "галоген" относится к Cl, Br, F или I.
Термин "кольцевая" структура включает моноциклическую структуру, мостиковую циклическую структуру и конденсированную циклическую структуру, если тип кольцевой структуры не определен иначе.
Соединения настоящего изобретения можно использовать в форме солей, образованных с фармацевтически или физиологически приемлемыми кислотами или основаниями. Такие соли включают, но не ограничиваясь ими, соли, полученные с органическими и неорганическими кислотами, такими как уксусная, молочная, лимонная, винная, янтарная, фумаровая, малеиновая, малоновая, миндальная, яблочная, хлористоводородная, бромистоводородная, фосфорная, азотная, серная, метансульфоновая, толуолсульфоновая и подобные известные приемлемые кислоты и их смеси. Другие соли включают соли диэтаноламина, этилендиамина и соли щелочных или щелочноземельных металлов, такие как натриевые (например, гидроксид натрия), калиевые (например, гидроксид калия), кальциевые (например, гидроксид кальция) или магниевые (например, гидроксид магния).
Указанные соли, а также другие соединения изобретения, могут находиться в форме сложных эфиров, карбаматов и других обычных "пролекарственных" формах, которые при введении в такой форме превращаются in vivo в активный фрагмент. В данном предпочтительном воплощении пролекарства представляют собой сложные эфиры. См., например, B. Testa and J. Caldwell, "Prodrugs Revisited: The "Ad Hoc" Approach as a Complement to Ligand Design", Medicinal Research Reviews, 16(3):233-241, ed., John Wiley & Sons (1996).
В одном воплощении соединения формулы (I) представляют собой тиофенсульфонамиды, более предпочтительно 5-галогентиофенсульфонамиды и наиболее предпочтительно 5-галогентиофенсульфонамиды с β-ответвлениями в боковой цепи первичного спирта. Таким образом, в связи с формулой (I), соединение изобретения, желательно, имеет структуру, в которой R1 и R2 представляют собой водород; R3 представляет собой водород; R4 представляет собой (CF3)2CH S-стереохимии, R5 представляет собой галоген, W означает C, X означает S, Y означает CH, Z означает CH, с сульфонамидной группой, присоединенной к С-2 тиофенового кольца.
В другом воплощении соединения формулы (I) представляют собой фурансульфонамиды. Таким образом, в связи с формулой (I), соединение изобретения имеет структуру, в которой X представляет собой О. В одном предпочтительном воплощении фурансульфонамиды характеризуются β-ответвлениями в боковой цепи первичного спирта.
Еще в другом воплощении соединения формулы (I) представляют собой пиразолсульфонамиды. Таким образом, в связи с формулой (I), соединение имеет структуру, в которой Х представляет собой NR7, W представляет собой N и Z и Y представляют собой C или CR6, при условии, что, по меньшей мере, один из Y или Z должен представлять собой С.
Указанные и другие соединения изобретения можно получить, следуя схемам, которые проиллюстрированы ниже.
Синтез
Соединения настоящего изобретения можно получить рядом способов, хорошо известных специалистам в области органического синтеза. Соединения настоящего изобретения можно получить с использованием способов, описанных ниже, наряду с методами синтеза, известными в области органического синтеза, или вариантами таких способов, осуществленных специалистами в данной области. (См., для общего представления, Comprehensive Organic Synthesis, "Selectivity, Strategy & Efficiency in Modern Organic Chemistry", ed., I. Fleming, Pergamon Press, New York (1991); Comprehensive Organic Chemistry, "The Synthesis and Reactions of Organic Compounds", ed. J.F. Stoddart, Pergamon Press, New York (1979)). Предпочтительные способы включают, но не ограничиваясь ими, способы, описанные ниже.
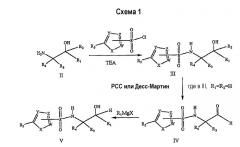
Первый способ получения состоит во взаимодействии 1,2-аминоспирта II с соответствующим сульфонилгалогенидом в присутствии основания, такого как триэтиламин (ТЕА), и в подходящем растворителе, с получением соединений формулы III. Затем, в случае соединений, где R1 и R2 представляют собой водород, окисление первичного N-сульфонилспирта хлорхроматом пиридиния (РСС), реагентом Десса-Мартина периодинаном [D.B. Dess, J.C. Martin, J. Org. Chem., 48:4155 (1983)] или в условиях по Сверну [Omura et al., J. Org. Chem., 41:957 (1976)] дает соответствующий альдегид IV, который можно подвергнуть взаимодействию с реактивами Гриньяра (RMgX, где R представляет собой органический радикал и Х представляет собой галоген) и получить вторичные спирты V в виде смеси диастереомеров, которые можно разделить высокоэффективной жидкостной хроматографией (ВЭЖХ) (схема 1).
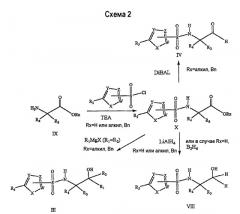
Второй способ получения включает взаимодействие α-аминокислоты или сложного эфира IX с соответствующим сульфонилгалогенидом в присутствии основания, такого как триэтиламин, и в подходящем растворителе, с получением соединений формулы Х (схема 2). Промежуточную N-сульфонилкислоту Х (Rx=H) можно превратить в соответствующий первичный спирт VIII (R1=R2=H), используя стандартную методику, с применением алюмогидрида лития (LiAlH4), B2H6 или хлорангидрида циануровой кислоты/NaBH4. Промежуточный сложный N-сульфонилэфир Х (Rx=алкил, Bn) также можно восстановить до соответствующего первичного спирта VIII (R1=R2=H), используя стандартную методику с применением LiAlH4. Альтернативно, промежуточный N-сульфонилэфир Х (Rx=алкил, Bn) можно превратить в альдегид IV с помощью DIBAL. Наконец, промежуточный сложный N-сульфонилэфир Х (Rx=алкил, Bn) можно подвергнуть взаимодействию с 2 эквивалентами реактива Гриньяра и получить третичные спирты III с R1=R2. Альтернативно, в случае третичных спиртов III, где R1 не равен R2, можно получить по Вейнребу соответствующий амид N-сульфонилкислоты и затем подвергнуть взаимодействию с R1MgX и R2MgX.
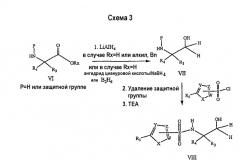
В варианте второго способа получения первичных спиртов сначала α-аминокислоту или сложный эфир (или их N-защищенное производное) VI превращают в соответствующий первичный 1,2-аминоспирт VII (с использованием методики, описанной в предыдущем разделе), который затем после удаления защитной группы (при необходимости) подвергают взаимодействию с соответствующим сульфонилгалогенидом (схема 3), получая соединения формулы VIII.
Для получения соединений, происходящих от неприродных α-аминокислот, содержащих бета-ответвления в боковой цепи аминокислоты, на схеме 4 представлен способ получения, основанный на работе Hruby (Tet. Lett., 38:5135-5138 (1997)). Такой способ вызывает образование α,β-ненасыщенного амида XIV вспомогательного хирального вещества Эванса из ацилбромида XI через последовательность реакций Хорнера-Эммонса с последующим присоединением соли медной кислоты с органическим веществом с образованием сопряжения, захватом полученного енолят-аниона XV N-бромсукцинамидом (NBS), заменой бромида XVI азид-анионом (предоставляемым азидом тетраметилгуанидиния (TMGA) или азидом натрия) с получением XVII, последующим восстановлением до 1,2-аминоспирта и последующим сульфированием с получением целевого соединения XVIII.
Когда гетероцикл, присоединенный в сульфонамидной группе в вышеописанных спиртах, представляет собой тиофен, соответствующее сульфоновое производное ХХ можно получить окислением тиофена XIX 3-хлорпероксибензойной кислотой (МСРВА) (схема 5).
При альтернативном способе получения сульфонамидов производных неприродных 1,2-аминоспиртов используют модификацию Бухерера синтеза α-аминокислот по Стрекеру (схема 6). При таком пути альдегид XXI подвергают взаимодействию с цианид-анионом и карбонатом аммония, получая гидантоин XXII, который гидролизуют до α-аминокислоты XXIII. Затем полученное соединение восстанавливают до XXIV и сульфируют, получая нужные соединения формулы XXV. Альтернативно, промежуточную аминокислоту XXIII можно сначала сульфировать с получением соединения XXVI, которое затем восстанавливают до XXV. Рацемические продукты XXIII, XXV или XXVI специалист в данной области может расщепить до нужного S-энантиомера с использованием стандартной методики.
Для сульфонамидов, образованных от 1,2-аминоспиртов в ряду вторичных спиртов с R1=H и R2=CF3 (соединение XXVII), разработан способ получения, приведенный на схеме 7, исходя из альдегида IV (полученного, как показано на схеме 1).
Когда гетероцикл, присоединенный к сульфонамидной группе в вышеописанных спиртах, представляет собой тиофен, соответствующие производные 5-иод- и 5-фтортиофенов можно получить конверсией производного 5-бромтиофена XXVIII (полученного, как показано на схеме 1) до промежуточного соединения 5-триалкилоловотиофена XXIX, которое можно превратить или в 5-иодтиофен (XXXI) обработкой иодидом натрия и хлорамином Т, или в аналог 5-фтортиофена (ХХХ) обработкой реагентом SELECTELUOR® (Aldrich Chem. Co.) (схема 8).
Другой способ получения хирально чистых N-сульфонил-1,2-аминоспиртов, происходящих от α-аминокислот, приведен на схеме 9. В данном способе сначала получают α,β-ненасыщенный амид XXXIV вспомогательного хирального вещества Эванса из бромацетилбромида XI через последовательность реакций по Хорнеру-Эммонсу. Присоединение соли медной кислоты с органическим веществом с образованием сопряжения и протонирование полученного енолят-аниона дает XXXV, который затем превращают в соответствующий енолят и электрофильно аминируют тризилазидом с образованием ключевого промежуточного соединения XXXVI (J. Am. Chem. Soc., 109:6881-6883 (1987)). Затем промежуточный азид XXXVI гидролизуют до α-азидокислоты XXXVII и восстанавливают до хирально чистой α-аминокислоты XXXVIII, которую можно превратить в соответствующие N-сульфонил-1,2-аминоспирты способами, описанными выше (например, схемы 2 или 3).
Наконец, хирально чистые α-аминокислоты XLI - одни из возможных синтетических предшественников хиральных N-сульфонил-2-аминоспиртов XLIII, также можно получить с использованием вариантов асимметричного синтеза α-аминокислот по Стреккеру, как представлено на схемах 10 (J. Org. Chem., 61:440-441 (1996)) и 11 (J. Org. Chem., 54:1055-1062 (1989)).
Способ получения хирально чистых трифторалкил- или фторсодержащих гетероциклических сульфонамидов формулы (I) представлен на схемах 12 и 13. Схема 12 отображает методики, описанные в литературе, для образования подходящего аминоэфира XLVII [W.H. Vine et al., J. Med. Chem., 1981, 24:1043-1047; и R. Keese et al., Synthesis, 1996, 695-696]. На основании литературных сведений и указаний в данном описании специалисту в данной области будет очевидно, что, в зависимости от нужного аминоэфира, можно легко выбрать другой трифторметилальдегид на стадии 3, в зависимости от заместителей, выбранных для R4' и R3', другое вспомогательное хиральное вещество на стадии 4 или использовать другие реагенты, заместители или другие условия реакции на любой из показанных стадий. Однако, если R3' не равен R4', тогда на стадии 3 схемы 12 получают смесь олефиновых изомеров, которую надо разделить перед стадией 4.
Согласно схеме 13, аминоэфир XLVIII отфильтровывают; обнаружено, что перекристаллизация на данной стадии, которая описана в литературе как существенная, не требуется. Промежуточный сложный аминоэфир XLVIII превращают в N-бензиламиноспирт с помощью DIBAL-H. N-Бензиламиноспирт XLIX гидролизуют в присутствии подходящего катализатора, получая аминоспирт L. Катализатор удаляют фильтрованием и раствор концентрируют до твердого вещества. Аминоспирт L сульфируют, используя BSA/триэтиламин/DMAP (или другой подходящий агент, например TMSCl/аминное основание) и нужный гетероциклический сульфонилхлорид. Реакцию гасят для удаления силильной эфирной группы (например, водной смесью HCl/ТГФ) и фильтруют (например, используя слой SiO2) со смесью этилацетат/гексан в соотношении, которое допускает кристаллизацию хирально чистого трифторметилсодержащего гетероциклического сульфонамида формулы (I) по изобретению.
В дополнение к полезности для получения соединений изобретения способ по схеме 13 можно легко использовать для получения трифторалкил-, включая трифторметил- и фторсодержащих соединений. Более конкретно, данный способ может быть полезен для получения других трифторалкил-, трифторметил- или фторсодержащих сульфонамидов из диастереомерной смеси аминоэфира, имеющего, по меньшей мере, один хиральный центр и, по меньшей мере, одну трифторалкильную или фторгруппу, присоединенную к, по меньшей мере, одному хиральному центру через алкильную группу, или, по меньшей мере, одну фторгруппу, присоединенную к циклоалкильной группе. Как определено в данном описании, алкильная группа может присоединять один или несколько трифторалкилов непосредственно к хиральному центру. Альтернативно, трифторалкил может располагаться в заместителе замещенной алкильной группы.
Соединения изобретения также можно получить взаимодействием вторичного спирта V с хлорхроматом пиридиния (PCC) или реагентом Десса-Мартина периодинаном [D.B. Dess, J.C. Martin, J. Org. Chem., 48:4155 (1983)] c образованием соответствующего альдегида LI (схема 14).
Другой способ получения трифторметилированных или фторированных гетероциклических сульфонамидов включает обработку трифторметилированного или фторированного альдегида дегидратирующим агентом и хиральным сульфинамидом с образованием трифторметилированного или фторированного хирального сульфинамида. Специалист в данной области сможет легко определить подходящий дегидратирующий агент для использования в настоящем способе, включающий, без ограничений, этоксид титана, сульфат магния или молекулярные сита, такие как молекулярные сита 4Å. Затем трифторметилированный или фторированный хиральный сульфинамид можно обработать цианирующим агентом с образованием трифторметилированного или фторированного диастереомерного α-аминонитрила соответственно. Выбор цианирующего реагента для использования в настоящем изобретении находится в компетенции специалиста в данной области и может включать, среди прочих, цианид этилизопропоксиалюминия. Затем трифторметилированный или фторированный диастереомерный α-аминонитрил можно выделить и, необязательно, очистить с использованием методов, хорошо известных специалистам в данной области. Альтернативно, трифторметилированный или фторированный диастереомерный α-аминонитрил можно быть гидролизован до трифторметилированной или фторированной α-аминокислоты соответственно, с использованием методов и агентов, хорошо известных специалистам в данной области. Затем трифторметилированную или фторированную α-аминокислоту можно восстановить до трифторметилированного или фторированного β-аминоспирта соответственно, с использованием методов и агентов, хорошо известных специалистам в данной области. Трифторметилированный или фторированный β-аминоспирт можно подвергнуть взаимодействию с гетероциклическим сульфонилхлоридом с образованием соответствующего трифторметилированного или фторированного гетероциклического сульфонамида настоящего изобретения.
В одном воплощении изобретение относится к способу получения трифторметилированного или фторированного гетероциклического сульфонамида, включающему стадии
(а) фильтрования смеси диастереомеров аминоэфира, причем указанный аминоэфир имеет, по меньшей мере, один хиральный центр и, по меньшей мере, одну трифторметильную или фторгруппу, присоединенную к, по меньшей мере, одному хиральному центру через алкильную группу;
(b) обработки аминоэфира DIBAL-H в толуоле с образованием N-бензиламиноспирта;
(с) гидрирования N-бензиламиноспирта в присутствии катализатора и образования аминоспирта;
(d) сульфирования аминоспирта со стадии (с) гетероциклическим сульфонилхлоридом и
(е) кристаллизации сульфированного продукта со стадии (d) с образованием хирально чистого трифторметилированного или фторированного гетероциклического сульфонамида.
В еще одном воплощении изобретение относится к способу получения трифторметилированного или фторированного гетероциклического сульфонамида, включающему стадии
(а) обработки трифторметилированного или фторированного альдегида дегидратирующим агентом и хиральным сульфинамидом с образованием трифторметилированного или фторированного хирального сульфинамида;
(b) обработки указанного трифторметилированного или фторированного хирального сульфинамида цианирующим агентом с образованием трифторметилированного или фторированного диастереомерного α-аминонитрила;
(с) гидролиза указанного трифторметилированного или фторированного диастереомерного α-аминонитрила до трифторметилированной или фторированной α-аминокислоты;
(d) восстановления указанной трифторметилированной или фторированной α-аминокислоты до трифторметилированного или фторированного β-аминоспирта и
(е) взаимодействия указанного трифторметилированного или фторированного β-аминоспирта с гетероциклическим сульфонилхлоридом с образованием указанного трифторметилированного или фторированного гетероциклического сульфонамида.
Способы применения
Соединения формулы (I) являются ингибиторами образования бета-амилоида. В предварительных исследованиях с использованием специфических анализов на протеазы показано, что представители соединений формулы (I) обнаруживают специфическое ингибирование в отношении протеазной активности. Таким образом, соединения настоящего изобретения полезны для лечения и предупреждения различных состояний, при которых модуляция уровней бета-амилоида обеспечивает лечебное благоприятное действие. Такие состояния включают, среди прочих, например, амилоидную ангиопатию, амилоидную церебральную ангиопатию, системный амилоидоз, болезнь Альцгеймера (AD), наследственное внутримозговое кровоизлияние с амилоидозом по типу Дутча, миозит телец включения, синдром Дауна, умеренное когнитивное ухудшение (MCI).
Кроме того, соединения формулы (I) можно использовать при получении реагентов, полезных в диагностике состояний, связанных с аномальными уровнями бета-амилоида. Например, соединения формулы (I) можно использовать для получения антител, которые будут поле