Миметики с обратной конфигурацией и способы их применения
Иллюстрации
Показать всеИзобретение относится к новым соединениям общей формулы (1), в том числе соединений (VI), относящихся к типу конформационно устойчивых соединений, которые имитируют вторичную структуру участков молекул биологически активных пептидов и белков с обратной конфигурацией. Соединения могут быть использованы как противоопухолевые соединения для лечения и профилактики рака, такого как колоректальный рак, для лечения ревматоидного артрита и язвенного колита. Соединения способствуют повышению апоптоза и усилению разрастания нейрита и ингибируют экспрессию сурвирина в клетке. В соединениях, соответствующих общей формуле (I) и (VI)
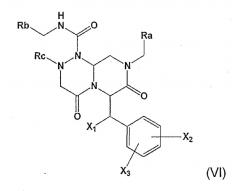
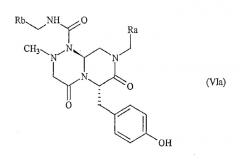
В формуле (I) W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, Z обозначает атом азота или СН, Х обозначает атом азота или СН, n=0 или 1, при условии, что когда Z обозначает СН, то Х обозначает атом азота и n=1; и когда Z обозначает атом азота, то n=0; в формуле (VI) X1 означает гидроксил и по крайней мере один из Х2 и Х3 является гидроксилом, либо X1 означает водород и Х2 и Х3 могут быть одинаковыми или разными и независимо выбраны из водорода, гидроксила и галогена. Другие радикалы имеют значения, указанные в формуле изобретения. 10 н. и 6 з.п. ф-лы, 33 ил., 9 табл.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к структурам миметиков с обратной конфигурацией и к библиотеке соответствующих химических соединений. Настоящее изобретение также относится к применениям при лечении медицинских расстройств, например раковых заболеваний, и к фармацевтическим композициям, включающим миметики.
Описание достигнутого уровня техники
В течение многих лет проводился случайный скрининг молекул на возможную активность в качестве терапевтических средств, что привело к открытию большого числа важных лекарственных средств. Хотя успехи в молекулярной биологии и компьютерной химии вызвали повышенный интерес к тому, что стали называть «рациональной разработкой препаратов», такие методики не доказали своей полезности с точки зрения быстроты или надежности, как это изначально предполагалось. Таким образом, в последние годы снова отмечается усиление интереса к рандомизированному (случайному) скринингу лекарственных препаратов и, соответственно, возвращение к нему. В этой связи были сделаны особые усилия по разработке новых методик, основанных на создании комбинаторных библиотек химических соединений и скрининге таких библиотек для поиска биологически активных агентов.
В целом, комбинаторные библиотеки химических веществ представляют собой просто коллекцию молекул. Такие библиотеки различаются по виду химических соединений, имеющихся в этой библиотеке, а также по способам, используемым как для создания библиотеки, так и для идентификации того, какие представители взаимодействуют с интересующими биологическими мишенями. Хотя данная область является достаточно молодой, способы создания и скрининга библиотек уже стали достаточно разнообразными и усложненными. Например, в последнем обзоре, посвященном различным комбинаторным химическим библиотекам, было идентифицировано большое число таких методик (Dolle, J. Com. Chem., 2(3): 383-433, 2000), включая использование и таких членов библиотек, которые содержат определенные метки, так и таких соединений из их числа, которые таких меток не содержат (Janda, Proc. Natl. Acad. Sci. USA 91: 10779-10785, 1994).
Создаваемые вначале комбинаторные химические библиотеки ограничивались в основном агентами пептидного или нуклеотидного происхождения. В этой связи методики Houghten et al. иллюстрируют пример того способа, который получил название «двойной итеративный» метод и который используется для сборки комбинаторных библиотек растворимых пептидов с помощью методик синтеза с расщеплением (сплит-синтеза) (Nature (London) 354: 84-86, 1991; Biotechniques 13: 412-421, 1992; Bioorg. Med. Chem. Lett. 3: 405-412, 1993). В рамках данной методики получают библиотеки растворимых пептидов, содержащие десятки миллионов членов. Такие библиотеки, как было показано, эффективны в плане идентификации опиоидных пептидов, таких как метионин- и лейцин-энкефалин (Dooley and Houghten, Life Sci. 52, 1509-1517, 1993), а библиотека N-ацилированных пептидов использовалась для идентификации ацеталинов, которые являются мощными антагонистами опиоидов (Dooley et al., Proc. Natl. Acad. Sci. USA 90: 10811-10815, 1993). Совсем недавно была создана библиотека всех опиоидных пептидов, состоящих из D-аминокислот, и был проведен скрининг на их анальгетическую активность против μ-опиоидного рецептора (Dooley et al., Science 266: 2019-2022, 1994).
Хотя комбинаторные библиотеки, содержащие агенты пептидного и нуклеотидного происхождений, играют важную роль, в данной области все еще сохраняется потребность в библиотеках, содержащих агенты другого происхождения. Например, традиционные пептидные библиотеки предназначены в значительной мере просто для варьирования аминокислотной последовательностью в рамках процедур создания новых членов библиотеки. В то время как хорошо известно, что вторичная структура пептидов важна для их биологической активности, такие пептидные библиотеки не обеспечивают представления устойчивой вторичной структуры членам такой библиотеки.
В этой связи ряд исследователей для создания конформационно устойчивой вторичной структуры используют циклизованные пептиды с дисульфидными мостиками (Tumelty et al., J. Chem. Soc. 1067-68, 1994; Eichler et al., Peptide Res. 7: 300-306, 1994). Однако такие циклизованные пептиды в основном являются все еще достаточно гибкими и характеризуются трудной биологической доступностью, из-за чего имеют весьма ограниченный успех.
В последнее время были разработаны непептидные соединения, которые близко имитируют вторичную структуру с обратной конфигурацией, найденную в биологически активных белках или пептидах. Например, в патенте США № 5440013 (Kahn) и в опубликованных заявках PCT WO 94/03494, WO01/00210A1 и WO01/16135A2 (Kahn) описываются непептидные соединения с устойчивой конформацией, которые имитируют трехмерную структуру с обратной конфигурацией. Кроме того, в патенте США № 5929237 и в частично продолженной заявке на патент США № 6013458 (обе принадлежат Kahn) описываются конформационно устойчивые соединения, которые имитируют вторичную структуру областей биологически активных пептидов и белков с обратной конфигурацией. Синтез и идентификация конформационно устойчивых миметиков с обратной конфигурацией и их применение в случае различных заболеваний описаны в обзоре Обрехта (Obrecht, Advances in Med. Chem., 4, 1-68, 1999).
Несмотря на то что были достигнуты существенные успехи в области синтеза и идентификации конформационно устойчивых миметиков с обратной конфигурацией, в данной области все еще остается потребность в малых молекулах, которые бы имитировали вторичную структуру пептидов. В данной области сохраняется также потребность в библиотеках, содержащих такие агенты, а также в методиках синтеза и скрининга представителей таких библиотек относительно интересующих мишеней, в особенности биологических мишеней, с целью идентификации биологически активных представителей таких библиотек.
Настоящее изобретение также удовлетворяет данные потребности и обеспечивает дополнительные преимущества за счет разработки конформационно устойчивых соединений, которые имитируют вторичную структуру областей с обратной конфигурацией, имеющихся в биологически активных пептидах и белках.
Сигнальный путь, вовлекающий Wnt, регулирует большое число процессов, включая рост клеток, онкогенез и развитие (Moon et al., 1997, Trends Genet. 13, 157-162; Miller et al., 1999, Oncogene 18, 7860-7872; Nusse and Varmus, 1992, Cell 69, 1073-1087; Cadigan and Nusse, 1997, Genes Dev. 11, 3286-3305; Peifer and Polakis, 2000 Science 287, 1606-1609; Polakis 2000, Genes Dev. 14, 1837-1851). Сигнальный путь, вовлекающий Wnt, интенсивно исследовался у большого числа организмов. Активация транскрипции, в которую вовлечен TCF4/β-катенин, под действием Wnt сигнальной трансдукции, как было показано, играет ключевую роль в осуществлении ее биологических функций (Molenaar et al., 1996, Cell 86: 391-399; Gat et al., 1998 Cell 95: 605-614; Orford et al., 1999 J. Cell. Biol. 146: 855-868; Bienz and Clevers, 2000, Cell 103: 311-20).
В отсутствие Wnt сигнала происходит одновременное взаимодействие супрессора опухолевого гена, ассоциированного с аденоматозным полипозом кишечника (APC) с гликогенсинтазой киназы сериновой киназы (GSK)-3β и β-катенином (Su et al., 1993, Science 262, 1734-1737; Yost et al., 1996 Genes Dev. 10, 1443-1454; Hayashi et al., 1997, Proc. Natl. Acad. Sci. USA, 94, 242-247; Sakanaka et al., 1998, Proc. Natl. Acad. Sci. USA, 95, 3020-3023; Sakanaka and William, 1999, J. Biol. Chem. 274, 14090-14093). Фосфорилирование APC под действием GSK-3β регулирует взаимодействие АРС с β-катенином, которое, в свою очередь, регулирует сигнальную функцию β-катенина (B. Rubinfeld et al., Science 272, 1023, 1996). Сигнальный эффект Wnt стабилизирует β-катенин, позволяя осуществлять его перемещение в ядро, где он взаимодействует с агентами группы лимфоидного энхансерного фактора (LEF1)/T-клеточного фактора (TCF4), входящими в семейство факторов транскрипции (Behrens et al., 1996 Nature 382, 638-642; Hsu et al., 1998, Mol. Cell. Biol. 18, 4807-4818: Roose et al., 1999 Science 285, 1923-1926).
Недавно было показано, что известный онкоген, c-myc, является геном-мишенью в процессе β-катенин/TCF4-опосредованной транскрипции (He et al., 1998 Science 281, 1509-1512; Kolligs et al., 1999 Mol. Cell. Biol. 19, 5696-5706). Были идентифицированы многие другие важные гены, включая гены циклина D1 и металлопротеиназы, которые также вовлекаются в онкогенез как регулируемые TCF-4/бета-катениновым механизмом транскрипции (Crawford et al., 1999, Oncogene 18, 2883-2891; Shtutman et al., 1999, Proc. Natl. Acad. Sci. USA, 11, 5522-5527; Tetsu and McCormick, 1999 Nature, 398, 422-426).
Кроме того, было показано, что суперэкспрессия некоторых медиаторов, расположенных по ходу сигнального пути, опосредованном Wnt, регулирует апоптоз (Moris et al., 1996, Proc. Natl. Acad. Sci. USA, 93, 7950-7954; He et al., 1999 Cell 99, 335-345: Orford et al., 1999, J. Cell. Biol., 146, 855-868; Strovel and Sussman, 1999, Exp. Cell. Res., 253, 637-648). Суперэкспрессия APC в клетках колоректального рака человека индуцирует апоптоз (Moris et al., 1996, Proc. Natl. Acad. Sci. USA, 93, 7950-7954), а эктопическая экспрессия β-катенина ингибрует апоптоз, ассоциированный с потерей способности присоединяться к внеклеточному матриксу (Orford et al., 1999, J. Cell. Biol., 146, 855-868). Ингибирование транскрипции по пути TCF4/β-катенина за счет экспрессии доминант-негативного мутанта TCF4 блокирует Wnt-1-опосредованную выживаемость клеток и придает клеткам чувствительность к апоптозным стимулам, таким как противораковый агент (Shaoqiong Chen et al., 2001, J. Cell. Biol., 152, 1, 87-96), а мутация APC ингибирует апоптоз, поскольку позволяет конститутивную экспрессию сурвивина - известного антиапоптозного белка (Tao Zhang et al., 2001, Cancer Research, 62, 8664-8667).
Хотя в клетках рака человека не было обнаружено мутаций по гену Wnt, мутация в APC или β-катенине, как в случае большинства колоректальных опухолей, приводит к несоответствующей активации TCF4, суперэкспрессии c-myc и к неопластическому росту (Budinfeld et al., 1997, Science, 275, 1790-1792; Morin et al, 1997, Science, 275, 1787-1790; Casa et al., 1999, Cell. Growth. Differ. 10, 369-376). Равным образом ген-супрессор опухоли (APC) теряется или инактивируется в 85% случаев колоректального рака и в большинстве других видов рака (Kinzler and Vogelstein, 1996, Cell 87, 159-170). Принципиальная роль APC заключается в том, что он является отрицательным регулятором каскада переноса сигнала Wnt. Главной особенностью этого пути является то, что он связан с модуляцией стабильности и локализации цитозольного пула β-катенина через взаимодействие с крупным аксиновым комплексом, который включает APC. Данное взаимодействие приводит к фосфорилированию β-катенина, делая его мишенью для разложения.
Белки, связывающиеся с CREB (CBP)/p300, были первоначально идентифицированы в тестах на взаимодействие белка, определяемых в первую очередь их ассоциацией с фактором транскрипции CREB (Chrivia et al., 1993, Nature, 365, 855-859) и затем взаимодействием с белком E1A, трансформированным аденовирусом (Stein et al., 1990, J. Viol., 64, 4421-4427; Eckner et al., 1994, Genes. Dev., 8, 869-884). CBP может участвовать во множестве клеточных функций, включая функцию коактиватора транскрипции (Shikama et al., 1997, Trends. Cell Biol., 7, 230-236: Janknecht and Hunter, 1996, Nature, 383, 22-23). CBP/p300 потенцирует опосредованную β-катенином активацию промотора siamois как известной Wnt-мишени (Hecht et al., 2000, EMBO J. 19, 8, 1839-1850). β-катенин непосредственно взаимодействует с CREB-связывающим доменом CBP, при этом β-катенин вступает в синергическое взаимодействие с CBP, стимулируя активацию транскрипции TCF-4/β-катенина (Ken-Ichi Takemaru and Randall T. Moon, 2000 J. Cell. Biol., 149, 2, 249-254).
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
На основе приведенного выше краткого описания достигнутого в данной области уровня видно, что TCF4/β-катенин и CBP-комплекс в пути, опосредованном Wnt, могут быть использованы в качестве молекул-мишеней для регуляции клеточного роста, онкогенеза, апоптоза клеток и т.п. Соответственно, настоящее изобретение отвечает на потребность в соединениях, которые способны блокировать транскрипцию через механизм участия TCF4/β-катенина за счет ингибирования CBP, и в этой связи может использоваться для лечения рака и в особенности колоректального рака.
В общих чертах настоящее изобретение относится к новому типу конформационно устойчивых соединений, которые имитируют вторичную структуру участков молекул биологически активных пептидов и белков с обратной конфигурацией. Настоящее изобретение также описывает библиотеки, содержащие такие соединения, а также их синтез и скрининг.
Соединения по настоящему изобретению описываются общей формулой (I):
где А обозначает -(CHR3)- или -(C=O)-, B обозначает -(CHR4)- или -(C=O)-, D обозначает -(CHR5)- или -(C=O)-, E обозначает -(ZR6)- или -(C=O)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(C=O)-(XR9)- или -(C=O)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, серы или -NH-, X и Z независимо обозначают атом азота или CH, n=0 или 1, и R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть одинаковыми или разными и независимо выбраны из фрагмента боковой цепи аминокислот или их производных, а также включают остаток молекулы, линкер и твердую подложку и их стереоизомеры.
В одном варианте, где А обозначает -(CHR3)-, B обозначает -(C=O)-, D обозначает -(CHR5)-, E обозначает -(C=O)- и G обозначает -(XR7)n-, соединения по настоящему изобретению описываются приведенной ниже формулой (II):
где W, X, Y и n определены выше и R1, R2, R3, R5, и R7 определены в приведенном ниже подробном описании.
В том варианте осуществления изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)- и G обозначает -(C=O)-(XR9)-, соединения по настоящему изобретению описываются приведенной ниже формулой (III):
где W, X и Y определены выше, Z обозначает атом азота или CH (при условии, что когда Z обозначает CH, то X обозначает атом азота), и R1, R2, R4, R6 и R9 определены в приведенном ниже подробном описании.
В том варианте осуществления изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)- и G обозначает -(XR7)n-, соединения по настоящему изобретению описываются приведенной ниже формулой (IV):
где W, Y и n определены выше, Z обозначает атом азота или CH (если Z обозначает атом азота, то n равно 0, и когда Z обозначает CH, то Х обозначает атом азота и n не равно 0) и R1, R2, R4, R6, и R7 определены в приведенном ниже подробном описании.
Настоящее изобретение также относится к библиотекам, содержащим одно или несколько соединений приведенной выше формулы (I), а также к способам синтеза таких библиотек и способам их скрининга для идентификации биологически активных соединений. В изобретении описаны также композиции, содержащие соединение по настоящему изобретению в сочетании с фармацевтически приемлемым носителем или разбавителем.
Настоящее изобретение также относится к способам идентификации биологически активного соединения с использованием библиотек, содержащих одно или несколько соединений формулы (I). В родственном аспекте настоящее изобретение относится к способу проведения теста на связывание, включающего: а) получение композиции, содержащей первый коактиватор и взаимодействующий белок, где первый коактиватор включает связывающий мотив LXXLL, LXXLI или FXXFF, где X представляет собой любую аминокислоту; b) объединение первого коактиватора и взаимодействующего белка с исследуемым соединением; и с) выявление наличия изменений в уровне связывания между первым коактиватором и взаимодействующим белком в присутствии соединения общей формулы (I).
Настоящее изобретение также относится к способам профилактики или лечения расстройств, связанных с сигнальным путем через Wnt. Расстройства, которые могут поддаваться лечению или профилактике при использовании соединения или композиции по настоящему изобретению, включают опухоль или рак (например, KSHV-ассоциированную опухоль), рестеноз, вызванный ангиопластикой, поликистоз почек, аберрантный ангиогенез, ревматоидный артрит, язвенный колит, туберозный склероз, облысение и болезнь Альцгеймера. Такие способы включают введение субъекту, нуждающемуся в этом, соединения или композиции по настоящему изобретению в количестве, эффективном для достижения желательного результата.
В родственном аспекте настоящее изобретение также относится к способам усиления разрастания нейрита, дифференцировки невральной стволовой клетки и апоптоза раковых клеток. Такие способы включают введение в соответствующие клетки соединения или композиции по настоящему изобретению в количестве, эффективном для достижения желательного результата.
Эти и другие аспекты настоящего изобретения станут более очевидными из прилагаемых рисунков и схем, а также из подробного описания. В этой связи следует отметить, что в описании цитируются различные документы и другие материалы, которые более подробно раскрывают некоторые детали, относящиеся к раскрываемым соединениям и/или композициям, и которые включены в описание полностью в качестве ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
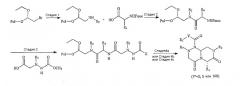
На фиг.1 показана общая схема синтеза, используемая для получения миметиков с обратной конфигурацией по настоящему изобретению.
На фиг.2 приведена общая схема синтеза, используемая для получения миметиков с обратной конфигурацией по настоящему изобретению.
На фиг.3 показан график, полученный на основе измерения показателя IC50 для соединения А по настоящему изобретению с использованием клеток SW480, где ингибирование роста клеток на модели клеток SW480 измеряют при различных концентрациях соединения А, полученного по процедуре примера 4, с получением показателя IC50. Конкретно, определяют степень ингибирования активности люциферазы светлячка и рениллы под действием соединения А. В результате определяют значение показателя IC50 для соединения А на модели роста клеток SW480, как показано в таблице 4. Описание подробных процедур приведено в примере 6.
Фиг.4. Клетки РС-12 культивируют после их наслаивании в чашках в течение 10 дней для дифференцировки под действием 50 нг/мл фактора роста нервных клеток (NGF) (как описано в примере 7). (A, B) клетки PC-12, трансфицированные вектором (A), и клетки PC-12, осуществляющие супреэкспрессию wt PS-1 (B), демонстрируют обширный рост нейрита через 10 дней при наличии NGF. (С) Клетки PC-12, экспрессирующие мутантный PS-1/L286V, не демонстрируют выраженных характерных признаков нейрита при культивировании в тех же условиях. (D, E) Иммунофлуоресцентный анализ GAP-43 (по методике, описанной в примере 7) как молекулярного маркера роста нейрита демонстрирует интенсивное окрашивание GAP-43 в нейритах (D) при трансфекции вектором и суперэкспрессии PS-1/WT в клетках PC-12 (E). (F) В отсутствие роста нейрита отмечается слабое иммунное окрашивание по GAP-43 в мутантных клетках. Приведенные данные отражают результаты по меньшей мере двух независимых экспериментов. (G) Дифференцированные клетки трансфицируют с использованием Topflash, репортерной конструкции, созданной на основе TCF/β-катенина. Клетки лизируют и измеряют активность люциферазы через 6 часов после трансфекции (по методике, описанной в примере 7). Приведенные данные представляют собой среднее арифметическое значение результатов трех независимых экспериментов (±SD (стандартное отклонение)). Звездочкой отмечено значение Р<0,05.
Фиг.5. Соединение D фенотипически корректирует дефицитную нейрональную дифференциацию в мутантной форме осуществляющих суперэкспрессию клеток PC-12, PS-1/L286V. Мутантные клетки подвергают воздействию 10 мкМ соединения D, дополнительно к NGF, в процессе дифференциации (Misner et al., Proc. Natl. Acad. Sci. USA 98, 11714 (2001)). (A) Наблюдают увеличение нейрита и его удлинение в осуществляющих суперэкспрессию клетках PC-12, PS-1/L286V, при обработке соединением D. (B) Уровень GAP-43 (зеленого пигмента) в значительной мере повышается в мутантных клетках и отмечается в нейритах. (C) Количественное определение длины нейрита в клетках PC-12. Количество мутантных клеток, имеющих нейриты с длиной более, чем двойной диаметр клетки, составляет менее 10% от их количества, наблюдаемых в клетках PC-12, трансфицированных вектором и осуществляющих суперэкспрессию, PS-1/WT. Количество мутантных PS-1/L286V клеток, которые содержат нейриты выявляемой длины, значительно повышается после обработки 10 мкМ соединения D. Приведенные результаты представляют собой среднее значение (±SD) результатов трех независимых определений. Звездочкой отмечено значение P<0,05.
Фиг.6. Экспрессия рецептора эфрина B2 (EphB2).
Проводят иммунофлуоресцентный анализ и анализ методом ПЦР-ОТ для выявления экспрессии рецептора EphB2 (как описано в примере 7). (A, B) рецепторы EphB2 четко выявляются в нейритах трансфицированных вектором и осуществляющих суперэкспрессию PS-1/WT клеток. Интенсивность окрашивания коррелирует с высоким уровнем экспрессии. (С) И, наоборот, клетки PS-1/L286V РС-12 характеризовались явно сниженным уровнем экспрессии EphB2. (D) Обработка мутантных клеток соединением D ведет к повышенной экспрессии рецептора EphB2, которая фокусируется в точках роста нейрита. (E) Ранее было показано, что экспрессия рецептора EphB2 регулируется в ходе транскрипции (Guo et al., J. Neurosci. 17, 4212 (1997)). Линия 1: трансфицированные вектором PC-12 клетки; линия 2: клетки PS-1/WT, осуществляющие суперэкспресию; линия 3: мутантные клетки PS-1/L286V, осуществляющие суперэкспресию; линия 4: мутантные клетки, обработанные соединением D. Анализ методом ПЦР-ОТ показывает, что уровень мессенджера для рецептора EphB2 в мутантных суперэкспрессирующих клетках PS-1/L286V снижается в сравнении с трансфицированными вектором и осуществляющими суперэкспрессию wt PS-1 PC-12 клетками. Обработка 10 мкМ соединением D оказывает позитивную регуляцию на мРНК для EphB2. В качестве внутреннего контроля используют GAPDH.
Фиг.7 (А) Соединение D останавливает рост клеток в G1 фазе. Проводят анализ сортированных клеток по интенсивности флуоресценции (FACS анализ) на клетках SW480 (нижняя панель) и клетках HCT116 (верхняя панель), обработанных в течение 24 часов соединением D (25 мкМ) (справа) или контролем (0,5% ДМСО (слева)). 5,5×106 клеток фиксируют и окрашивают йодидом пропидия (PI). (B) Соединение D селективно активирует каспазы клеточной линии клеток карциномы толстой кишки. Клетки SW480 и HCT116 (левый график) (105) вместе с нормальными колоноцитами CCD18Co (правый график) обрабатывают контрольным агентом (0,5% ДМСО) или соединением D (25 мкМ). Через 24 часа после обработки клетки лизируют и измеряют ферментативную активность каспазы-3/7. Вычисляют относительную флуоресценцию в условных единицах (RFU) вычитанием величины слепой пробы (контроль, без клеток) от значения, полученного для обработанных образцов (соединение D или контроль), и строят соответствующий график.
Фиг.8. Соединение D снижает рост колоний в мягком агаре зависимым от дозы образом. В ячейки в тройном повторе к клеткам SW480 (5000 клеток/ячейку) добавляют повышающиеся концентрации 5-фторурацила (5-FU) (0,5-32 мкМ) и соединения D (0,25-5 мкМ). Клетки промывают и суспендируют в полутвердой ростовой среде с агаром. Через 8 дней подсчитывают количество колоний (колонии с диаметром более 60 мкМ) и строят график зависимости от концентрации соединения. Определяют и указывают среднее значение ± стандартная ошибка результатов трех независимых определений. Количество колоний в контрольном образце в отсутствие соединения составляет 1,637 ± 71.
Фиг.9 (А) Соединение С снижает рост опухоли на модели голых мышей (nude). (В) Соединение С слегка снижает вес тела голых мышей.
Фиг.10. Активность сурвивина в процессе транскрипции подвергается позитивной регуляции под действием Wnt1, но выключается соединением D. Процентный уровень люциферазной активности измеряют в клетках дикого типа CBP+/- и в клетках p300+/-3T3 в отсутствие Wnt1 и соединения D или в присутствии Wnt1, соединения D или их обоих.
Фиг.11. Соединение А (правый график) и соединение D (левый график) ингибируют активность сурвивинового репортера люциферазы в клетках SW480. Люциферазную активность, контролируемую промотором сурвивина, измеряют в клетках SW480, обработанных соединением A или D в разных концентрациях.
Фиг.12. Анализ по методу ПЦР-ОТ показывает, что обработка соединением D снижает уровень экспрессии гена сурвивина.
Фиг.13. Соединение D снижает ассоциацию различных белков с промотором сурвивина. Проводят ChIP-тест в клетках SW480, обработанных соединением D (25 мкМ), или в контрольных клетках (0,5% ДМСО) в течение 18 часов.
Фиг.14. Соединение D снижает экспрессию сурвивина на уровне трансляции. (А) Проводят вестерн-блоттинг экстрактов клеток, обработанных только носителем (0,5% ДМСО), 10 мкМ или 25 мкМ соединения D или 5 мкМ 5-FU, с использованием моноклонального антитела против сурвивина 6Е4 (Cell Signaling Technology). (В) Иммунофлуоресцентная микроскопия сурвивина. Культивируемые раковые клетки фиксируют и окрашивают зеленым красителем для выявления сурвивина. (С) Иммунофлуоресцентная микроскопия сурвивина. Клетки SW480, обработанные соединением D, фиксируют и обрабатывают зеленым красителем для выявления сурвивина.
Фиг.15. Соединение D активирует, повышает активность каспазы 3 (но не активность каспазы 2) через подавление экспрессии сурвивина. Клетки культуры после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (2,5 мкМ или 5,0 мкМ) или обоими агентами. Определяют активности каспазы 2 и каспазы 3 в данных клетках.
Фиг.16. Соединение D усиливает гибель клеток через подавление экспрессии сурвивина. Культивированные раковые клетки после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (5,0 мкМ) или обоими агентами. Определяют уровень гибели клеток в данной культуре.
Фиг.17. Соединение D повышает число клеток, находящихся на стадии G0. Культивированные раковые клетки после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (5 мкМ) или обоими агентами. Проводят сортировку клеток по интенсивности флуоресценции (FACS анализ) и определяют процент клеток, находящихся на стадии G0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конформационно устойчивым соединениям, которые имитируют вторичную структуру областей биологических пептидов и белков с обратной конфигурацией (определяемых в настоящем описании также как миметики с обратной конфигурацией), а также описывает относящиеся к ним химические библиотеки.
Миметические структуры с обратной конфигурацией по настоящему изобретению используются в качестве биологически активных агентов, включая (без ограничения) использование их в качестве диагностических, профилактических и/или терапевтических средств. Библиотеки, включающие миметические структуры с обратной конфигурацией по настоящему изобретению, могут применяться при идентификации биологически активных агентов, подходящих для такого использования. В практике осуществления настоящего изобретения такие библиотеки могут содержать от десятков до сотен тысяч (или более) индивидуальных структур с обратной конфигурацией (называемых в настоящем описании также как «составные единицы» библиотеки).
В одном аспекте настоящего изобретения в нем раскрывается миметическая структура с обратной конфигурацией приведенной ниже формулы (I):
где А обозначает -(CHR3)- или -(C=O)-, B обозначает -(CHR4)- или -(C=O)-, D обозначает -(CHR5)- или -(C=O)-, E обозначает -(ZR6)- или -(C=O)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(C=O)-(XR9)- или -(C=O)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, серы или -NH-, X и Z независимо обозначают атом азота или CH, n=0 или 1 и R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть одинаковыми или разными и независимо выбраны из фрагмента боковой цепи аминокислот или их производных, а также включают остаток молекулы, линкер и твердую подложку и их стереоизомеры.
В одном варианте осуществления настоящего изобретения R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из аминоС2-5алкила, гуанидинС2-5алкила, С1-4алкилгуанидиноС2-5алкила, диС1-4алкилгуанидино-С2-5алкила, амидиноС2-5алкила, С1-4алкиламидиноС2-5алкила, диС1-4алкиламидиноС2-5алкила, С1-3алкокси, фенила, замещенного фенила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензильном фрагменте независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бис-фенилметила, замещенного бис-фенилметила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридилС1-4алкила, замещенного пиридилС1-4алкила, (где пиридиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидилС1-4алкила, замещенного пиримидилС1-4алкила (где пиримидиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4алкила, замещенного триазин-2-ил-С1-4алкила (где триазиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолС1-4алкила, замещенного имидазолС1-4алкила (где имидазольные заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинилС1-4алкила, N-амидинопиперазинил-N-С0-4алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, С1-5диалкиламиноС2-5алкила, N-амидинопиперидинилС1-4алкила и 4-аминоциклогексилС0-2алкила.
В одном варианте осуществления изобретения R1, R2, R6 в Е и R7, R8 и R9 в G могут быть одинаковыми или разными и могут представлять собой остаточную часть соединения, и R3 в A, R4 в B или R5 в D выбран из фрагмента боковой цепи аминокислоты или его производного. В контексте настоящего описания термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией в положениях R1, R2, R5, R6, R7, R8 и/или R9. Данный термин также включает фрагменты боковой цепи аминокислоты и их производные.
В другом варианте R3 в А, R5 в D, R6 в Е и R7,R8 и R9 в G могут быть одинаковыми или разными и могут представлять собой остаточную часть соединения, будучи указанными поодиночке или в некотором сочетании, и в одном аспекте все из R1, R2 и R4 в В обозначают боковую цепь аминокислоты. В данном случае термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией в положениях R3, R5, R6, R7, R8 и/или R9. Данный термин также включает фрагменты боковой цепи аминокислот и их производные.
В контексте настоящего описания термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, атом, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией. Данный термин также включает фрагменты боковой цепи аминокислот и их производные. В одном аспекте настоящего изобретения любое одно или более положений из R1, R2, R3, R4, R5, R6, R7, R8 и/или R9 могут обозначать остаточную часть соединения. В одном аспекте осуществления настоящего изобретения один или несколько из R1, R2 и R4 обозначают фрагмент боковой цепи аминокислоты или его производное.
В контексте настоящего описания термин «фрагмент боковой цепи аминокислоты» обозначает любой фрагмент, представляющий собой боковую цепь аминокислоты, присутствующий в природных белках, включая (без ограничения) фрагменты боковой цепи природных аминокислот, приведенные в таблице 1. Другие фрагменты боковой цепи природных аминокислот по настоящему изобретению включают (без ограничения) фрагменты боковой цепи 3,5-дибромтирозина, 3,5-дииодтирозина, гидроксилизина, γ-карбоксиглютамата, фосфотирозина и фосфосерина. Кроме того, в практике осуществления настоящего изобретения могут использоваться гликозилированные боковые цепи аминокислот, включая (без ограничения) гликолизированные треонин, серин и аспарагин.
| Таблица 1 | |
| Фрагмент боковой цепи аминокислоты | Аминокислота |
| -H | Глицин |
| -CH3 | Аланин |
| -CH(CH3)2 | Валин |
| -CH2CH(CH3)2 | Лейцин |
| -CH(CH3)CH2CH3 | Изолейцин |
| -(CH2)4NH3 + | Лизин |
| -(CH2)3NHC(NH2)NH2 + | Аргинин |
| Гистидин | |
| -CH2COO- | Аспарагиновая кислота |
| -CH2CH2COO- | Глутаминовая кислота |
| -CH2CONH2 | Аспарагин |
| -CH2CH2CONH2 | Глутамин |
| Фенилаланин | |
| Тирозин | |
| Триптофан | |
| -CH2SH | Цистеин |
| -CH2CH2SCH3 | Метионин |
| -CH2OH | Серин |
| -CH(OH)CH3 | Треонин |
| Пролин | |
| Гидроксипролин |
Кроме фрагментов боковой цепи природных аминокислот, фрагменты боковой цепи аминокислоты по настоящему изобретению включают различные их производные. В контексте настоящего описания термин «производные» фрагментов боковой цепи аминокислоты включают модификации и/или вариации, введенные во фрагменты боковой цепи природных аминокислот. Например, фрагменты боковой цепи аминокислот аланина, валина, лейцина, изолейцина и фенилаланина могут быть в целом отнесены к классу короткоцепочечных алкильных, арильных или арилалкильных фрагментов