Твердые дозированные формы, включающие фибрат и статин
Иллюстрации
Показать всеИзобретение относится к области лекарственных средств, в частности к материалу в форме частиц для лечения состояний, при которых требуется регуляция липидного метаболизма, включающему в качестве активных веществ один или несколько фибратов и один или несколько статинов или их фармацевтически приемлемую соль, в носителе, выбранном из группы, состоящей из i) смеси полиэтиленгликоля и полоксамера в соотношении от 2:1 до 3:1 и с последующим распылением на лактозу, ii) глицерилмоностеарата с последующим распыленнием на лактозу или на смесь лактозы и ГПМЦ и iii) полиэтиленгликоля, с последующим распыленнием на Aeroperl. Кроме того, изобретение относится к твердым дозированным формам, включающим указанный материал, и способу их получения. Изобретение позволяет установить подходящую биологическую доступность обоих активных ингредиентов при пероральном введении. 3 н. и 53 з.п. ф-лы, 19 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармацевтическим композициям в форме частиц или к твердым дозированным формам, включающим сочетание фибрата, а именно: фенофибрата и статина (так же известного как ингибитор HMG-CoA-редуктазы). При создании композиций нет необходимости добавлять воду или водную среду. В результате получают композиции, имеющие очень низкое содержание влаги (менее 2 мас.% воды), что обеспечивает подходящую стабильность при хранении (и фибраты, и статины разлагаются под действием воды). Кроме того, 80% активных веществ (то есть фибрата и статина) присутствует в композиции в растворенном виде, что обеспечивает подходящую биологическую доступность активных ингредиентов при приеме через рот.
Предпосылки создания изобретения
Фибраты представляют собой лекарственные вещества, которые в основном очень плохо и неоднородно абсорбируются после перорального введения. Обычно их рекомендуют принимать с пищей для повышения биологической доступности. Имеется множество улучшенных дозированных форм, содержащих наиболее часто используемый в настоящее время фибрат, фенофибрат, которые были разработаны с целью повышения биологической доступности лекарственного вещества и, в этой связи, его эффективности. Кроме того, в клинических руководствах указывается, что наиболее эффективным способом регуляции холестеринового и липидного обмена является не только терапия с использованием фибрата, но также комбинированная терапия с использованием, например, фенофибрата и статина. Фактически, лечение фенофибратом часто рекомендуют в сочетании с введением статина, поскольку клиницисты предпочитают использовать, например, фенофибрат в связи с его способностью снижать уровень триглицеридов, тогда как статин используется в связи с его положительным эффектом по снижению уровня ЛПНП-Х и по повышению уровня ЛПВП-Х. Однако, в настоящее время такая комбинированная терапия может быть проведена только при использовании двух отдельных продуктов, то есть пациентам нужно принимать, например, одну таблетку фибрата и другую таблетку или капсулу, содержащую статин.
Как отмечалось выше, существует потребность в получении улучшенных композиций фенофибрата, и, соответственно, в этой связи, появилось множество публикаций, относящихся к такого рода композициям (см., например, WO 04/041250). Хотя такие композиции удобнее для введения фибрата при необходимости соответствующего лечения, они не удовлетворяют имеющимся потребностям в композиции, содержащей сочетание фибрата и статина, которая была бы стабильна при хранении и в то же самое время обладала подходящей биологической доступностью относительно обоих активных веществ.
В WO 03/013608 описываются композиции, содержащие фибрат и статин. Однако, в связи с особенностями использованного способа их получения (активные вещества расплавляются вместе, вводятся в желатиновые капсулы, которые далее охлаждают), при этом могут быть получены только капсулы. Кроме того, с фармацевтической точки зрения процесс производства представляется сложным для его масштабирования, в плане требований, предъявляемых при регистрации препарата, из-за таких свойств, как изменения массы вещества, изменения содержания лекарственного компонента и т.п. Несмотря на то, что описываемая композиция может представлять собой твердую композицию, в данной работе не предусмотрены отступления от основного принципа создания препарата иного типа дозированной формы, нежели капсулы.
Соответственно, все еще сохраняется потребность в разработке фармацевтической композиции, которая представляла бы собой единую форму, содержащую фибрат и статин в качестве активных веществ, причем указанная композиция была бы стабильна и обеспечивала возможность проявления соответствующих биофармацевтических свойств входящих в нее активных веществ (например, подходящую биологическую доступность, меньшую зависимость от приема пищи и т.п.) и, кроме того, чтобы производство данной композиции могло без труда подвергаться масштабированию. Кроме того, все еще сохраняется потребность в разработке композиций, содержащих фибрат и статин, так чтобы такие композиции могли подвергаться дальнейшей обработке с получением фармацевтических дозированных форм, позволяющих выбирать конкретный вид дозирования формы. В фармацевтической области такая гибкость может быть достигнута в том случае, когда такая композиция представляет собой форму твердого продукта в виде порошка или в виде частиц. Соответственно, настоящее изобретение относится к такому материалу в форме частиц, который подходит для дальнейшей обработки с получением, например, таблеток.
Дополнительно, все еще сохраняется потребность в композиции, которая обладала бы подходящей биологической доступностью, что позволило бы существенно снизить или преодолеть существующие различия между биологической доступностью лекарственного вещества, характерной для пациентов, принимающих препарат натощак, и биологической доступностью лекарственного вещества (в частности, фенобирата) у пациентов, принимающих препарат после приема пищи, и/или которая позволила бы существенно снизить или преодолеть вариации, отмечаемые при приеме как для отдельного индивидуума, так и между отдельными индивидуумами при современном режиме лечения. Кроме того, также сохраняется потребность в композиции, которая позволяла бы снизить наблюдаемые подобные эффекты.
В целом, известно, что абсорбция и биологическая доступность терапевтически активного вещества может подвергаться воздействию множества факторов, в случае его введения через рот. Такие факторы включают наличие пищи в желудочно-кишечном тракте и, в целом, более длительное время пребывания лекарственного вещества в желудке в присутствии пищи, чем в состоянии натощак. Если биологическая доступность лекарственного вещества подвергается воздействию сверх некоторой определенной точки, в связи с наличием пищи в желудочно-кишечном тракте, считается, что лекарственное вещество оказывает пищевой эффект. Пищевые эффекты важны, поскольку, при их наличии, у пациента, который недавно принимал пищу, возникает риск, связанный с введением лекарственного вещества. Риск определяется возможностью того, что абсорбция в кровоток может быть ухудшена до такой степени, что может стать недостаточной для пациента, который принимает данный препарат для облегчения того состояния, которое требует данного лечения. В случае, например, фенофибрата, ситуация отличается в том смысле, что принимаемая пища, наоборот, повышает абсорбцию. Так что отсутствие приема пищи одновременно с лекарственными веществами может привести к недостаточной абсорбции. Степень абсорбции коммерчески доступного продукта Трикор® (Tricor®), содержащего фенофибрат (от компании Abbott), повышается примерно на 35% в случае приема пищи, в сравнении с условиями приема препарата натощак.
Как указывалось выше, все еще остается потребность в новых фармацевтических композициях, включающих один или несколько фибратов, которые проявляют подходящую биологическую доступность для активного соединения и/или сниженный или полностью отсутствующий пищевой эффект. В данном контексте термин "подходящая биологическая доступность" означает, что введение композиции по настоящему изобретению будет приводить к достижению повышенной биологической доступности, сравнительно с биологической доступностью, достигаемой после введения активного(ых) вещества(в) в виде простой таблетки; или биологическая доступность будет примерно такой же или повышенной в сравнении с биологической доступностью, получаемой после введения коммерчески доступного продукта, содержащего то/те же самое/самые активное(ые) вещество(а), в тех же количествах. В частности, желательно достигать более быстрой и более значительной и/или более полной абсорбции активного соединения, что позволит, в этой связи, снизить вводимые дозировки или уменьшить число ежедневных введений. Далее, фармацевтические композиции по настоящему изобретению также позволяют снизить или устранить потребность в приеме пищи одновременно с приемом дозированных форм (в частности, это релевантно для одного или нескольких активных веществ, содержащихся в композиции по настоящему изобретению, а именно фибрата, такого как фенофибрат), что даст пациентам больше свободы при выборе времени приема лекарственного препарата.
Описание изобретения
Настоящее изобретение относится к фармацевтическим композициям в форме частиц и твердых дозированных форм, предназначенных для лечения состояний, отзывчивых на лечение фибратом и статином.
Как указывалось выше, имеется потребность в разработке фармацевтических композиций, содержащих сочетание фибрата и статина или их фармацевтически приемлемую соль, для перорального введения, которые улучшали бы лечение тех состояний, при которых требуется регуляция липидного метаболизма (например, при атеросклерозе, ишемической болезни сердца, при диабете, ожирении, избыточном весе, метаболическом синдроме и т.п.).
Кроме того, было бы полезно добиться повышенной биологической доступности, особенно фибратного компонента, что, как будет описано ниже, в ряде случаев будет также существенно и для статинового компонента. Фибрат типа фенофибрата обладает очень низкой растворимостью в воде, и это его свойство рассматривается как одна из основных причин низкой биологической доступности фенофибрата. Соответственно, было бы выгодно получить композицию, в которой фибрат находится преимущественно в растворенном состоянии. То же самое относится к статинам, которые также обладают плохой водорастворимостью.
Повышенная биологическая доступность способствует улучшению результатов лечения. При этом возникает также возможность получить такой же самый терапевтический ответ, но при использовании сниженной дозы и/или при меньшем числе введений, при меньшей вариабельности плазменных уровней и без пищевых ограничений. Другой путь достижения улучшенных результатов лечения таких состояний, при которых показано введение фенофибрата, связан с регуляцией высвобождения фенофибрата в желудочно-кишечном тракте, таким образом, чтобы повышенная концентрация фенофибрата в плазме достигалась сразу же или с некоторой временной задержкой относительно времени введения. Дальнейшее терапевтическое усовершенствование может представлять собой разработку композиций с модифицированным или задержанным высвобождением, которые содержат один или несколько фибратов.
В особенности, имеется потребность в разработке твердой композиции в виде частиц, которая может быть в дальнейшем обработана с получением твердых дозированных форм (например, таблеток и т.п.). Такая композиция должна содержать активные лекарственные вещества, например, фибрат и статин, преимущественно в растворенном виде, но в то же самое время композиция должна быть в форме частиц, которые можно далее подвергнуть обработке с получением твердой дозированной формы, такой как таблетки, то есть материала, состоящего из частиц, который содержит активные вещества преимущественно в растворенном виде и который должен иметь приемлемые свойства, такие как, например, приемлемые свойства применительно к текучести, прилипаемости (она должна быть устранена), способности к прессованию и т.п.
В одном аспекте настоящее изобретение относится к материалу в форме частиц, включающему в качестве активного ингредиента один или несколько фибратов и один или несколько статинов, в котором по меньшей мере 80 мас.% от суммарного количества активных веществ растворено в носителе, выбранном из группы, состоящей из гидрофобного, гидрофильного и смешивающегося с водой носителя.
В норме, по меньшей мере 85 мас.%, по меньшей мере 90 мас.%, по меньшей мере 95 мас.% или по меньшей мере 98 мас.% от общего количества активных веществ растворяется в носителе.
Если имеют место варианты, при которых 100% активных веществ растворено в носителе, то активные вещества присутствуют в форме раствора твердого материала в композиции в форме частиц. Наличие раствора твердого материала может быть определено по методу ДСК (DSC), приведенному в описании. Однако может происходить некоторая кристаллизация активных веществ из растворов твердых компонентов при их хранении. Соответственно, настоящее изобретение включает материал в форме частиц, в котором активные вещества присутствуют в форме раствора твердого материала, но настоящее изобретение также включает в свои рамки возможность осаждения активных веществ при хранении.
Как указывалось выше, требуется достаточная текучесть материала в форме частиц в соответствии с настоящим изобретением, с тем чтобы достичь подходящей текучести, открывающей возможность получения разных дозированных форм. Соответственно, материал в форме частиц по настоящему изобретению имеет приемлемую текучесть, определяемую, в соответствии с методикой Европейской Фармакопеи, путем измерения скорости истечения композиции из воронки с диаметром сопла 10,0 мм.
Материал в форме частиц по настоящему изобретению включает два активных вещества, а именно: фибрат и статин, или их фармацевтически приемлемую соль. Ниже приводится описание активных веществ.
Фибраты
Фибраты включают гемифиброзил, фенофибрат, бензафибрат, клофибрат и ципрофибрат. Они используются в качестве средств, регулирующих липидный обмен. Они рассматриваются как пролекарства, которые метаболизируются in vivo до активных метаболитов.
В конкретном варианте осуществления настоящего изобретения фибрат представляет собой фенофибрат или его аналог. Обычно концентрация фибрата в носителе составляет по меньшей мере 10 мас.% относительно общего веса фибрата, статина и носителя. В частности, концентрация фибрата в носителе составляет по меньшей мере 15 мас.%, по меньшей мере 16 мас.%, по меньшей мере 17 мас.% или по меньшей мере 20 мас.%, предпочтительно по меньшей мере 25 мас.%, более предпочтительно по меньшей мере 30 мас.%, и в особенности по меньшей мере 35 мас.% относительно общего веса фибрата, статина и носителя.
Только для целей иллюстрации можно указать конкретный пример фибрата, а именно фенофибрат. Так, например, фенофибрат метаболизируется до фенофибриновой кислоты, которая является активным веществом. Фенофибриновая кислота имеет период полувыведения примерно 20 часов. Определение выявляемых количеств фенофибриновой кислоты в крови пациента может отражать эффективность поглощения фенофибрата.
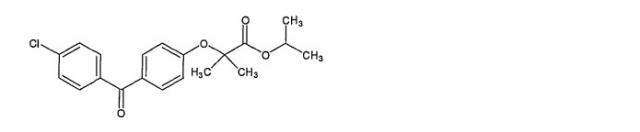
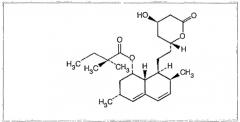
Химическое название фенофибрата: 1-метилэтиловый сложный эфир 2-[4-(4-хлорбензоил)]-2-метилпропаноевой кислоты, который описывается следующей структурной формулой:
Фенофибрат представляет собой белое твердое вещество, нерастворимое в воде. Точка плавления составляет 79-82°С.
Результаты клинических исследований показали, что повышенные уровни общего холестерина, холестерина типа липопротеина низкой плотности (ЛПНП-Х) и аполипопротеина В (apo B) ассоциируются с развитием атеросклероза у человека. Сниженные уровни холестерина типа липопротеина высокой плотности (ЛПВП-Х) и комплекса, осуществляющего его транспортировку, аполипопротеина А (apo AI и apo AII), ассоциированы с развитием атеросклероза.
Фенофибрат также эффективен при лечении диабета типа II.
Фенофибриновая кислота, то есть активный метаболит фенофибрата, приводит к снижению у пациентов в ходе лечения общего уровня холестерина, ЛПНП-холестерина, аполипопротеина В, уровня суммарных триглицеридов и липопротеина, обогащенного триглицеридами. Кроме того, лечение с использованием фенофибрата приводит к повышению уровня ЛПВП-холестерина и apo AI и apo AII. Фенофибрат действует как мощный регулятор липидного метаболизма, обеспечивающий уникальные клинически выраженные преимущества относительно существующих в настоящее время продуктов из семейства лекарственных веществ на основе фибрата. Фенофибрат приводит к существенному снижению уровня триглицеридов в плазме у пациентов с гипертриглицеридемией и плазменного уровня холестерина и ЛПНП-Х у пациентов с гиперхолестеринемией и со смешанной формой дислипидемии.
Фенофибрат также снижает уровень мочевой кислоты в сыворотке у пациентов с гиперуремией и повышение экскреции мочевой кислоты с мочой у здоровых субъектов.
Фенофибрат также показан в качестве дополнительной терапии в сочетании с диетой, рекомендуемой при лечении взрослых пациентов с гипертриглицеридемией (гиперлипидемия Фредриксона типа IV и V). Улучшение гликемического контроля у пациентов с диабетом, имеющих хиломикронемию натощак, обычно приводит к снижению уровня триглицеридов натощак и удаляет хиломикронемию, что устраняет необходимость фармакологического вмешательства.
Статины
Статины включают симвастатин, аторвастатин, ловастатин, правастатин, розувастатин, питавастатин и флувастатин и их фармацевтически приемлемые соли, такие как соли щелочного металла и щелочно-земельного металла. Статины оказывают положительный эффект при регуляции метаболизма липидов и используются при различных заболеваний, для которых важно контролировать уровень липидов в плазме. В целом, липиды хорошо всасываются (например, флувастатин и симвастатин) после перорального введения, хотя некоторые статины имеют плохую биологическую доступность (ловастатин имеет уровень биологической доступности около 30-40%, правастатин около 30%, симвастатин около 5% и розувастатин около 50%). Некоторые статины водорастворимы (например, правастатин и флувастатин), тогда как другие статины характеризуются плохой водорастворимостью (например, аторвастатин, ловастатин, питавастатин, розувастатин и симвастатин). В целом, статины чувствительны к влаге, то есть считается, что повышенную стабильность имеют композиции, не содержащие влаги или содержащие очень небольшой уровень воды, и то же самое относится к композициям, которые производятся без использования водной среды.
Концентрация статина в носителе в случае материала в форме частиц или твердой дозированной формы согласно настоящему изобретению составляет по меньшей мере 1 мас.% от общего веса фибрата, статина и носителя. Более конкретно, концентрации статина в носителе составляет по меньшей мере 1,5 мас.%, или по меньшей мере 2,5 мас.%, или по меньшей мере 5 мас.%, или по меньшей мере 7,5 мас.% или по меньшей мере 10 мас.% от общего веса фибрата, статина и носителя.
В конкретном варианте настоящее изобретение относится к материалу в форме частиц, содержащему фенофибрат и симвастатин или их фармацевтически приемлемую соль, материал в форме частиц, содержащий фенофибрат и аторвастатин или их фармацевтически приемлемую соль, материал в форме частиц, содержащий фенофибрат и ловастатин или их фармацевтически приемлемую соль, материал в форме частиц, содержащий фенофибрат и правастатин или их фармацевтически приемлемую соль, материал в форме частиц, содержащий фенофибрат и розувастатин или их фармацевтически приемлемую соль, материал в форме частиц, содержащий фенофибрат и симвастатин или их фармацевтически приемлемую соль.
Ниже приведены примеры конкретных статинов, однако изобретение не ограничивается указанными конкретными примерами.
Аторвастатин
Аторвастатин-кальций представляет собой кристаллический порошок от белого до желтовато-белого цвета, не растворимый в водных растворах с pH 4 и ниже. Аторвастатин-кальций очень слабо растворим в дистиллированной воде, фосфатном буфере с pH 7,4 и ацетонитриле, слабо растворим в этаноле и хорошо растворим в метаноле.
Таблетки Липитор (Lipitor) для перорального введения содержат 10, 20, 40 или 80 мг аторвастатина и следующие неактивные ингредиенты: карбонат кальция, USP; канделильский воск, FCC; натрий-кроскармеллозу, НФ; гидроксипропилцеллюлозу, НФ; моногидрат лактозы, НФ; стеарат магния, НФ; микрокристаллическую целлюлозу, НФ; белый краситель Opadry White YS-1-7040 (гидроксипропилметилцеллюлоза, полиэтиленгликоль, тальк, диоксид титана); полисорбат 80, НФ; эмульсию циметикона.
Аторвастатин представляет собой синтетический агент, снижающий уровень липидов. Аторвастатин представляет собой ингибитор редуктазы 3-гидрокси-3-метилглутарил-коэнзима А (HMG-CoA). Данный фермент катализирует превращение HMG-CoA в мевалонат, что представляет собой раннюю и лимитирующую скорость стадию в биосинтезе холестерина.
Аторвастатин представляет собой селективный конкурентный ингибитор HMG-CoA-редуктазы, фермент, ограничивающий скорость реакции, которая осуществляет превращение 3-гидрокси-3-метилглутарил-коэнзима А в мевалонат, предшественник стеролов, включая холестерин. Холестерин и триглицериды циркулируют в кровотоке в виде части липопротеиновых комплексов. При ультрацентрифугировании такие комплексы разделяются на ЛПВП (липопротеин высокой плотности) и ЛПСП (липопротеин средней плотности), ЛПНП (липопротеин низкой плотности) и ЛПОНП (липопротеин очень низкой плотности). Триглицериды (ТГ) и холестерин в печени включаются в состав ЛПОНП и высвобождаются в плазму для доставки в периферические ткани. ЛПНП формируется из ЛПОНП и катаболизируется преимущественно через рецепторы, имеющие высокую активность к ЛПНП. Клинические исследования и исследования патологических состояний показывают, что повышенные уровни в плазме общего холестерина (общий-Х), ЛПНП-холестерина (ЛПНП-Х) и аполипопротеина В (apo B) способствуют развитию атеросклероза у человека и являются факторами риска развития сердечно-сосудистого заболевания, тогда как повышенные уровни ЛПВП-Х ассоциированы со сниженным риском развития сердечно-сосудистого заболевания.
Аторвастатин быстро абсорбируется при пероральном введении; максимальные концентрации в плазме достигаются в течение 1-2 часов. Уровень абсорбции повышается пропорционально принятой дозе аторвастатина. Абсолютная биологическая доступность аторвастатина (исходный препарат) составляет примерно 14% и системная доступность ингибиторной активности в отношении редуктазы HMG-CoA составляет примерно 30%. Низкая системная доступность связана с пресистемным клиренсом в слизистой желудочно-кишечного тракта и/или пресистемным метаболизмом в печени. Хотя пища снижает скорость и степень абсорбции лекарственного вещества примерно на 25% и 9%, по данным определения Cmax и AUC, отмечается, что снижение ЛПНП-Х аналогично в случае приема аторвастатина с пищей и без пищи. Концентрация аторвастатина в плазме ниже (примерно на 30%, по данным определения Cmax и AUC) после вечернего приема препарата в сравнении с утренним приемом. Однако отмечается, что снижение ЛПНП-Х не зависит от времени дневного приема препарата.
Правастатин
Правастатин-натрий (PRAVACHOL®) является представителем нового класса липид-снижающих соединений, ингибиторов редуктазы HMG-CoA, которые снижают биосинтез холестерина. Данные агенты являются конкурентными ингибиторами редуктазы 3-гидрокси-3-метилглутарил-коэнзима А (HMG-CoA), фермента, катализирующего раннюю, лимитирующую скорость стадию биосинтеза холестерина, а именно: превращение HMG-CoA в мевалонат.
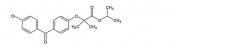
Химически правастатин-натрий представляет собой 1-нафталин-гептаноевую кислоту, 1,2,6,7,8,8а-гексагидро-(бета),(бета),6-тригидрокси-2-метил-8-(2-метил-1-оксобутокси)-мононатриевую соль, [1S-[1(альфа)((бета)S*, (бета)S*),2(альфа),6(альфа),8(бета)(R*),8а(альфа)]]-. Структурная формула показана ниже.
Правастатин-натрий представляет собой тонкоизмельченный или кристаллический порошок без запаха, белого или желтовато-белого цвета. Это относительно полярное гидрофильное соединение с коэффициентом распределения (октанол/вода) 0,59 при pH 7,0. Он растворим в метаноле и воде (>300 мг/мл), слабо растворим в изопропаноле и практически не растворим в ацетоне, ацетонитриле, хлороформе и диэтиловом эфире.
Правахол (PRAVACHOL) доступен для перорального введения в виде таблеток по 10 мг, 20 мг, 40 мг и 80 мг. Неактивные ингредиенты включают: натрий-кроскармеллозу, лактозу, оксид магния, стеарат магния, микрокристаллическую целлюлозу и повидон. Таблетка 10 мг также содержит красный железооксидный пигмент, таблетки по 20 мг и 80 мг содержат также желтый железооксидный пигмент, а таблетка 40 мг содержит зеленую пигментную смесь (Green Lake Blend) (смесь желтого пигмента D&C Yellow No. 10-Aluminum Lake и синего пигмента FD&C Blue No. 1-Aluminum Lake).
Правастатин индуцирует снижение уровня липидов двумя путями. Во-первых, вследствие обратимого ингибирования активности редуктазы HMG-CoA, он оказывает умеренное снижение внутриклеточного пула холестерина. Это приводит к повышению числа рецепторов ЛПНП на клеточных поверхностях и усиливает опосредованный рецепторами метаболизм, а также клиренс циркулирующего ЛПНП. Во-вторых, правастатин ингибирует продукцию ЛПНП за счет ингибирования синтеза ЛПОНП, предшественника ЛПНП.
Клинические и патологические исследования показали, что повышенные уровни в плазме общего холестерина (общего-Х), холестерина типа липопротеина низкой плотности (ЛПНП-Х) и аполипопротеина В (apo B - комплекс, осуществляющий транспортировку ЛПНП через мембрану) способствуют развитию атеросклероза у человека. Аналогично, сниженные уровни ЛПВП-Х и его транспортного комплекса аполипопротеина А ассоциированы с развитием атеросклероза. Эпидемиологические исследования установили, что заболеваемость и смертность от сердечно-сосудистых болезней варьирует, находясь в прямой зависимости от уровня общего-Х и ЛПНП-Х и в обратной зависимости от уровня ЛПВП-Х. Как и ЛПНП, холестерин, обогащенный липопротеинами, обогащенными триглицеридами, включая ЛПНОП, ЛПСП и другие, может также способствовать развитию атеросклероза. Повышенный уровень ТГ в плазме часто встречается в триаде вместе с низким уровнем ЛПВП-Х и малыми частицами ЛПНП, а также в сочетании с нелипидными метаболическими факторами риска ишемической болезни сердца. В качестве такового фактора, общий плазменный уровень ТГ не всегда является независимым фактором риска КБС. Кроме того, независимый эффект повышенного ЛПВП или сниженного ТГ на риск заболеваемости и смертности от ишемической болезни и сердечно-сосудистых заболеваний не определен. Как у здоровых волонтеров, так и у пациентов с гиперхолестеринемией лечение с использованием правахола (PRAVACHOL) (правастатина-натрия) снижает уровень общего-Х, ЛПНП-Х и аполипопротеина В. Правахол (PRAVACHOL) также снижает уровень ЛПОНП-Х и ТГ и приводит к повышению уровня ЛПВП-Х и аполипопротеина А. Эффект правастатина на Lp (а), фибриноген и некоторые другие независимые биохимические маркеры риска развития ишемической болезни сердца неизвестен. Хотя правастатин относительно более гидрофилен, чем другие ингибиторы редуктазы HMG-CoA, влияние относительной гидрофильности, при ее наличии, на эффективность или безопасность не установлено.
Правастатин, как и другие ингибиторы редуктазы HMG-CoA, характеризуется варьирующей биологической доступностью. Коэффициент вариации (КВ) на основании данных, полученных по вариабельности для разных пациентов, составляет от 50% до 60%, по данным AUC. Правастатин в дозе 20 мг вводят натощак взрослым. Среднее геометрическое значение Cmax и AUC составляет от 23,3 до 26,3 нг/мл и от 54,7 до 62,2 нг·час/мл, соответственно.
Розувастатин
Розувастатин является мощным ингибитором редуктазы HMG-CoA (статином). Розувастатин разрешен для лечения первичной гиперхолестеринемии, смешанной дислипидемии, гипертриглицеридемии и гомозиготной семейной гиперхолестеринемии. Он оказывает более сильное снижение уровня холестерина типа липопротеина низкой плотности (ЛПНП), чем аторвастатин, симвастатин и правастатин.
Дозу от 5 до 40 миллиграмм (мг) вводят один раз день перорально, при этом начальная доза составляет от 5 до 20 мг один раз в день. Дозы могут титроваться до 40 мг/день у тех пациентов, для которых не достигается ожидаемого снижения 20 мг/день. Лекарственное средство может вводиться вместе с пищей или без нее в любое время дня. Корректировка дозы предусматривается для пациентов с тяжелым нарушением функции почек и в случае пациентов, получающих в качестве сопутствующего лечения циклоспорин или гемфиброзил.
Пиковые уровни в плазме достигаются в период от 3 до 5 часов после введения пероральных доз и описываются линейными характеристиками в диапазоне от 5 до 80 мг; накопление в равновесном состоянии минимально. Розувастатин, по всей видимости, поступает селективно в печень, в сравнении с не печеночными тканями, что определяется его относительной гидрофильностью. Лекарственное вещество подвергается лишь минимальному метаболизму в печени, и большая часть дозы выделяется с желчью. Биологическая доступность составляет примерно 20%.
Симвастатин
Симвастатин представляет собой агент, снижающий содержание липидов, который получают путем синтеза из продукта ферментации Aspergillus terreus. После перорального приема симвастатин, который является неактивным лактоном, гидролизуется до соответствующей (бета)-гидроксикислоты. Указанный агент представляет собой ингибитор редуктазы 3-гидрокси-3-метилглутарил-коэнзима А (HMG-CoA). Данный фермент катализирует превращение HMG-CoA в мевалонат, что представляет собой раннюю, лимитирующую скорость стадию в процессе биосинтеза холестерина.
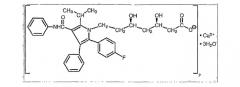
Сивмастатин представляет собой бутаноевую кислоту, 2,2-диметил-1,2,3,7,8,8а-гексагидро-3,7-диметил-8-[2-(тетрагидро-4-гидрокси-6-оксо-2Н-пиран-2-ил)-этил]-1-нафталиновый сложный эфир, [1S-[1(альфа),3(альфа),7(бета),8(бета),(2S*,4S*)-8a(бета)]]. Эмпирическая формула симвастатина: C25H38O5, а его молекулярный вес составляет 418,57. Структурная формула представлена ниже.
Симвастатин представляет собой кристаллический негигроскопичный порошок от белого до желтовато-белого цвета, который практически нерастворим в воде и свободно растворим в хлороформе, метаноле и этаноле.
Таблетки Зокор® (ZOCOR®) для перорального введения содержат 5 мг, 10 мг, 20 мг, 40 мг или 80 мг симвастатина и указанные ниже неактивные ингредиенты: целлюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, оксиды железа, лактозу, стеарат магния, крахмал, тальк, диоксид титана и другие ингредиенты. В качестве консерванта добавляют бутилированный гидроксианизол.
Повышенные плазменные уровни общего холестерина (общий-Х) ЛПНП-холестерина и аполипопротеина В (apo B) способствуют развитию атеросклероза у человека и являются факторами риска развития сердечно-сосудистого заболевания, тогда как повышенные уровни холестерина типа липопротеина высокой плотности (ЛПВП-Х) и его транспортного комплекса apo A-I, ассоциированы со сниженным риском развития сердечно-сосудистых заболеваний. Высокие плазменные уровни триглицеридов (ТГ) и холестерина, обогащенного липопротеинами, обогащенными ТГ, включающими липопротеины очень низкой плотности (ЛПОНП), липопротеины средней плотности (ЛПСП) и других, также могут способствовать развитию атеросклероза. Повышенный уровень ТГ в плазме зачастую обнаруживается в триаде вместе с низким уровнем ЛПВП-Х и малыми частицами ЛПНП в сочетании с нелипидными факторами риска ИБС. Не было показано, что общий уровень ТГ является независимым фактором риска для ИБС. Кроме того, независимый эффект повышенного уровня ЛПВП-Х или сниженного уровня ТГ на риск развития ишемической болезни или сердечно-сосудистых заболеваний и смертности не был определен. Было показано, что симвастатин снижает и нормальные и повышенные концентрации ЛПНП-Х. ЛПНП образуется из липопротеина очень низкой плотности (ЛПОНП) и катаболизируется преимущественно с вовлечением рецептора, имеющего высокое сродство к ЛПНП.
Симвастатин подвергается мощной экстракции при его пресистемном поступлении в печень, которая является первичным сайтом действия, с последующим выделением лекарственных эквивалентов с желчью. Вследствие обширной печеночной экстракции симвастатина (оцениваемой на уровне >60% у человека), доступность лекарственного вещества для общего кровотока низка.
Настоящее изобретение относится к материалу в форме частиц и к твердым дозированным формам, предназначенным для усовершенствованного режима лечения состояний, которые реагируют на терапию с использованием фибрата и статина. Кроме того, такие композиции и твердая дозированная форма могут также включать другие активные вещества или использоваться в сочетании с другими активными веществами, такими как, например, другие антилипидемические агенты, антидиабетические вещества, применяемые при диабете типа II, такие как, например, глимепирид, глибенкламид, гликлазид, репаглинид, натеглинид, метформин, пиоглитазон, розиглитазин или акарбоза. К ним относятся также сочетания с ингибиторами абсорбции холестерина, такие как эзетимиб и раскислители холестерина типа колесевелама. Указанные средства могут быть также включены в состав препарата или использоваться в сочетании с лекарственными агентами, которые могут приводить к нежелательному уровню триглицеридов и/или холестерина. Таким образом, композиция по настоящему изобретению может быть включена или использована в сочетании с лекарственными веществами типа, например, изотретионина и ингибитора протеазы ретровирусов, таких как ингибиторы протеазы ВИЧ и другие.
Материал в форме частиц по настоящему изобретению обладает подходящей текучестью, определяемой по методу, описанному в Европейской Фармакопее, в соответствии с которым проводят измерение скорости истечения композиции из воронки с соплом 10,0 мм. Для того чтобы исключить прилипание к производственному оборудованию и аппаратуре, используемой для заполнения, важно, чтобы материал в форме частиц был легко текучим. Эти характеристики также важны в тех случаях, когда желательно обрабатывать материал в форме частиц с получением в итоге других видов композиции, таких как, например, твердые дозированные формы.
Как отмечалось выше, материал в форме частиц по настоящему изобретению содержит носитель. В некоторых вариантах данный носитель является масляным и/или является маслоподобным, и/или он присутствует в относительно высоких количествах. В таких случаях может возникнуть необходимость включить в материал вещество, которое обладает адсорбирующими или абсорбирующими свойствами, так чтобы окончательный материал в форме частиц выглядел как немаслянистый порошок и при хранении из него не высвобождались никакие компоненты носителя, которые могли бы приводить к созданию маслянистой поверхности. Соответственно, материал в форме частиц может содержать один или несколько сорбирующих масло материалов, так что он при тестировании в соответствии с приведенным в настоящем описании способом:
i) имеет значение порога маслянистости 10% или более, при определении по приведенному в настоящем описании тесту оценки порогового значения,
и обладает по меньшей мере одним из следующих свойств:
ii) высвобождает по меньшей мере 30% масла, по данным тестирования в рамках описанного теста на высвобождение и
iii) в форме таблетки характеризуется временем дезинтеграции, равным максимум 1 час, при тестировании по методу Европейской Фармакопеи оценки степени дезинтеграции, так что таблетки содержат примерно 90 мас.% или более маслосорбирующего материала. В некоторых ситуациях было показано, что включение сорбционного материала в композицию является некоторым преимуществом, поскольку при этом, например, достигается высокая концентрация носителя, который обладает масляным или маслоподобным характером. В некоторых случаях, когда носитель имеет точку плавления максимум примерно 25°С, может быть особенно удобно включать сорбционный материал. Соответствующие примеры материалов, подходящих для использования в качестве носителя, а также сорбционных материалов приведены ниже в описании.
В другом варианте настоящее изобретение относится к материалу в форме частиц, включающему один или несколько фибратов и гидрофобный, или гидрофильный, или смешивающийся с водой носитель, в котором концентрация носителя составляет по меньшей мере примерн