Применение хиральных арилкетонов в лечении нейтрофил-зависимых воспалительных заболеваний
Иллюстрации
Показать всеИзобретение относится к применению соединений формулы (I) для изготовления лекарственного препарата, ингибирующего хемотаксис PMN человека, стимулированный ИЛ-8. Соединения могут найти применение в качестве лекарственных средств для лечения заболеваний, связанных с хемотаксисом PMN, вызванным ИЛ-8, таких как псориаз, ревматоидный артрит, язвенный колит и для лечения повреждений, вызванных ишемией и реперфузией. В формуле (I)
Ar представляет собой фенил, необязательно замещенный от одного до трех заместителей, которые могут быть одинаковыми или отличаться друг от друга, выбранными из: галогена, С1-С4-алкила, С1-С4-алкокси, гидрокси, С1-С4-ацилокси, фенокси, циано, нитро, амино, С1-С4-ациламино, галоген-С1-С3-алкила, галоген-С1-С3-алкокси, бензоила; или Ar представляет собой 4-тиеноилфенил, 4-(1-оксо-2-изоиндолинил)фенил, 3-хлор-4-(2,5-дигидро-1Н-пиррол-1-ил)фенил, 6-метокси-β-нафтил, 1-гидроксифенил-1-метил; или Ar представляет собой группу формулы III, где А представляет собой бензил, фенокси, бензоил, бензоилоксим, 1-гидроксифенил-1-метил; В представляет собой гидрокси, С1-С4-ацилокси или группу формулы -O-C(=S)-N(CH3)2, или -S-С(=O)-N(СН3)2; Ra и Rb независимо выбраны из группы, включающей водород, линейный или разветвленный C1-С6-алкил, фенил, α- или β-нафтил, 2,3,4-пиридил, С1-С4-алкилфенил, С1-С4-алкил(α- или β-нафтил), С1-С4-алкил(2,3,4-пиридил), циано (-CN), карбоксамид, карбоксил или карбоксиэфиры формулы CO2R", в которой R" представляет собой остаток линейного или разветвленного алифатического C1-С6-спирта, фосфонат PO(OR")2, где R" имеет вышеуказанные значения, или группу формулы X-(CH2)n-Z, где Х представляет собой СО, SO или SO2 группу; Z представляет собой водород, трет-бутил, изопропил, CO2R", CN, фенил, α- или β-нафтил, 2,3,4-пиридил, С3-С6-циклоалкил, NH-BOC, NH2; n равно нулю или целому числу от 1 до 3; или Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклический остаток 2,2-дизамещенный 4,6-диоксо-1,3-диоксанил формулы II, где R' представляет собой метил или этил, или две группы R' образуют циклогексановое или циклопентановое кольцо. 4 н. и 3 з.п. ф-лы.
Реферат
Настоящее изобретение относится к хиральным арилкетонам, способу их получения и фармацевтическим препаратам, содержащим их, которые могут использоваться для профилактики и лечения повреждения тканей в результате усиленного рекрутмента полиморфно-ядерных нейтрофилов в очагах воспаления.
Другие классы соединений, такие как амиды R-2-арилпропионовых кислот и N-ацилсульфонамиды, которые могут использоваться для профилактики и лечения повреждения тканей в результате усиленного рекрутмента полиморфно-ядерных нейтрофилов в очагах воспаления, описаны в WO 01/58852 и WO 00/24710 соответственно.
Как правило, соединения по изобретению хорошо известны и описаны в Справочнике Бельштейна по органической химии.
Подробное описание изобретения
Более конкретно, настоящее изобретение относится к хиральным арилкетонам общей формулы I
в которой Ar представляет собой арил; Ra и Rb независимо выбраны из группы, включающей водород, линейный или разветвленный С1-С6-алкил, фенил, α- или β-нафтил, 2,3,4-пиридил, С1-С4-алкилфенил, С1-С4-алкил-(α- или β-нафтил), С1-С4-алкил(2,3,4-пиридил), циано (-CN), карбоксамид, карбоксил или карбоксиэфиры формулы CO2R", где R" представляет собой остаток линейного или разветвленного алифатического С1-С6-спирта, фосфонат PO(OR")2, где R" такой, как определено выше, группу формулы ди-Х-(СН2)n-Z, где Х представляет собой СО, SO или SO2 группу; Z представляет собой водород, трет-бутил, изопропил, CO2R", CN, фенил, α- или β-нафтил, 2,3,4-пиридил, С3-С6-циклоалкил, NH-BOC, NH2; n равно нулю или целому числу от 1 до 3; или Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклический остаток 2,2-дизамещенный 4,6-диоксо-1,3-диоксанил формулы II
,
в которой R' представляет собой метил или этил, или две группы R' образуют циклогексановое или циклопентановое кольцо.
Под арильной группой подразумевают предпочтительно фенил, необязательно замещенный одним или тремя заместителями, которые могут быть одинаковыми или отличаться друг от друга, такими как атомы галогена, С1-С4-алкил, С1-С4-алкокси, гидрокси, С1-С4-ацилокси, фенокси, циано, нитро, амино, С1-С4-ациламино, галоген-С1-С3-алкил, галоген-С1-С3-алкокси, бензоил или арильная группа известных противовоспалительных 2-арилпропионовых кислот, таких как ибупрофен, кетопрофен, напроксен, сурпрофен, карпрофен, пирпрофен и фенопрофен.
Предпочтительными заместителями 2-арилпропионовой кислоты являются 4-изобутилфенил, 3-бензоилфенил, 5-бензоил-2-ацетоксифенил, 3-феноксифенил, 5-бензоил-2-тиофенил, 4-тиеноилфенил, 1-оксо-2-изоиндолинилфенил, 3-хлор-4-(2,5-дигидро-1Н-пиррол-1-ил)фенил, 6-метокси-β-нафтил, 1-гидроксифенил-1-метил или остаток формулы III
,
где А представляет собой бензил, фенокси, бензоил, бензоилоксим, 1-гидроксифенил-1-метил, В представляет собой гидрокси, С1-С4-ацилокси или группу формулы -О-С(=S)-N(СН3)2; -S-С(=О)-N(СН3)2.
R предпочтительно представляет группу известной противовоспалительной 2-арилпропионовой кислоты, как определено выше; более предпочтительно R представляет: 4-(2-метилпропил)фенил, 3-феноксифенил, 3-бензоилфенил, 2-[4-(1-оксо-2-изоиндолинил)фенил], 5-бензоилтиен-2-ил, 4-тиеноилфенил.
Предпочтительным линейным или разветвленным С1-С6-алкилом и заместителем алифатического С1-С6-спирта является метил или этил; С1-С4-алкил предпочтительно представляет изобутил; С1-С4-ацилоксигруппой является предпочтительно ацетоксигруппа.
Особенно предпочтительными соединениями формулы I по изобретению являются соединения, в которых пространственная конфигурация атома углерода, к которому присоединен заместитель R, соответствует конфигурации (R).
Нижеследующие соединения:
(R,S)(±)-2-бутанон, 3-[4-(2-метилпропил)фенил] (CAS № 64758-90-3);
(R,S)(±)-2-бутанон, 3-(3-феноксифенил) (CAS № 108671-27-8);
(R,S)(±)-2-бутанон, 3-(3-бензоилфенил) (CAS № 79868-87-4);
этил-(R,S)(±)-4-(3-бензоилфенил)-3-оксопентаноат (CAS № 145927-45-3);
(R,S)(±)-1,3-диоксан-4,6-дион, 5-[2-(3-бензоилфенил-1-оксопропил)]-2,2-диметил (CAS № 154023-15-1);
известны как рацемические промежуточные соединения для получения 2-арилпропионовых кислот [JP 03024023 (02.01.1991); JP 52108949 (09.12.1991); JP 52083426 (07.01.1977); JP 56097249 (08.05.1981); Tetr. Lett., 27, 4175, 1986] и тиазолов [ER 511021 (28.10.1992); JP 0528902 (11.02.1993)].
Соединения формулы (I) получают взаимодействием активированной 2-арилпропионовой кислоты формулы (IV)
,
где Ar имеет значения вышеуказанного арила, и Y представляет собой группу, активирующую карбонил, предпочтительно галоген, такую как хлор, 1-имидазолил, пивалоил, С1-С3-алкоксикарбонил, сукцинилокси, бензтриазол-1-илокси,
с карбанионом формулы (V)
,
где:
если R'a представляет собой группу комплекса между карбоксилом и этоксидом магния, то R'b представляет собой CO2R", CONH2, CN, PO(OR")2 или -X-(CH2)n-Z', где Х такой, как определено выше; Rc представляет собой Н или -(CH2)n-Z', где Z' представляет собой Н, трет-бутил, изопропил, CO2R", CN, фенил, α- или β-нафтил, 2,3,4-пиридил, С3-С6-циклоалкил, NH-BOC;
если R'a представляет собой водород и Rc представляет собой водород или радикал -(CH2)n-Z', определенный выше, то R'b представляет собой фосфонат PO(OR")2, CO2R", или R'a и R'b с атомом углерода, к которому они присоединены, образуют карбанион на атоме углерода С5 радикала 2,4-диоксо-1,3-диоксанила формулы Va
,
где R' такой, как указано выше, с выходом соединения формулы (Ia)
,
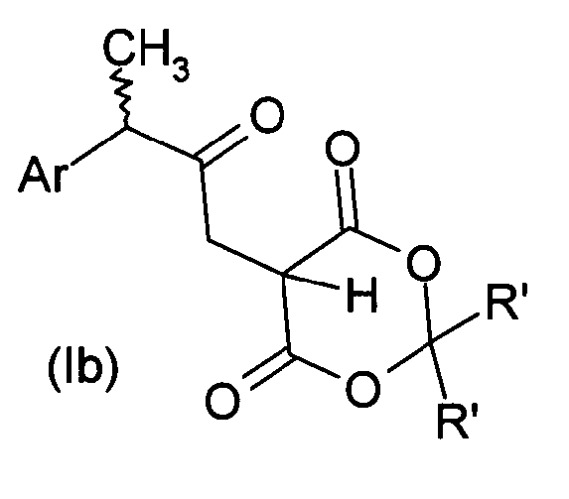
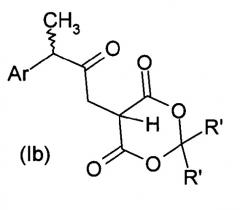
где R'a, R'b и Rc имеют значения, указанные выше, при условии, что Rc представляет собой водород, если R'a и R'b с атомом углерода, к которому они присоединены, образуют 4,6-диоксо-1,3-диоксанил формулы (II), также известный как аддукт Мелдрума формулы Ib
,
где Ar и R' имеют значения, описанные выше. Если желательно, аддукты Мелдрума превращают кипячением в линейном или разветвленном С1-С6-спирте в соответствующий β-кетоэфир формулы Ic
β-Кетоэфир формулы Ia и Ic может необязательно быть деалкоксидекарбоксилирован в соответствующий арилкетон формулы I простым нагреванием в апротонном растворителе (предпочтительно диметилсульфоксиде) в присутствии небольших количеств воды и, необязательно, небольших количеств электролитов, таких как NaCl, NaCN, LiCl, LiI (в соответствии с J.P.Krapcho, Synthesis, 805 и 893, 1982 и приведенными здесь ссылками). Подобным образом, используя хорошо известные способы, соединение формулы Ia может быть преобразовано в еще одно соединение формулы I удалением любой защитной группы, которые могут присутствовать, или омылением карбоксильных групп, или преобразованием нитрилов в карбоксамиды.
Соединения формулы IV получают обычным способом, сохраняя их энантиомерную чистоту, исходя из индивидуальных энантиомеров 2-арилпропионовых кислот формулы IVa
,
которые являются хорошо известными соединениями и могут быть получены из индивидуальных рацематов, используя известные методы оптического разделения.
Получение карбанионов формулы V заключается в процессе С-ацилирования по существу в нейтральных условиях, подробно описанном в литературе (смотри, например, D.W. Brooks et al., Angew. Chem. Int. Ed. Engl., 18, 72, 1979), а также моноэфиров малоновых кислот и монозамещенных малоновых кислот, также сульфинилуксусных кислот, сульфонилуксусных кислот и фосфоноуксусных кислот. Все эти кислоты хорошо известны в литературе или могут быть получены, используя известные способы, такие как моноомыление диэфиров малоновых кислот и их монозамещенных аналогов или омыление фосфоноуксусных кислот и 2-замещенных аналогов; сульфинилуксусные кислоты и сульфонилуксусные кислоты могут быть получены окислением простых эфиров тиогликолевой кислоты. Альтернативно, можно использовать еноляты лития формулы V, полученные реакцией литийалкилов с известными алкиловыми эфирами алкилфосфонатов (смотри, например, N. Mongelli et al., Synthesis, 310, 1988) или с эфирами уксусной кислоты (по D.H. Harris et al., Tetrah. Lett., 28, 2837, 1987).
Для получения енолятов формулы Va и, в основном, для реакции ацилирования циклических алкилиденовых эфиров малоновой кислоты (также известных как кислоты Мелдрума) активированными карбоксильными соединениями формулы IV применяют метод, описанный Y. Oikawa et al., J. Org. Chem., 43, 2087 (1978), R.P. Houghton and D.J. Lapham, Synthesis, 451 (1982) и C.C. Chan and X. Hung, 452 (1982).
Примеры получения диалкоксифосфоноуксусных кислот и их эфиров приведены в US 4151172 (24 апреля 1979) или описаны R.A. Malevannaya et al., Zh. Obshch. Khim., 41, 1426 (1971).
Конкретными примерами соединений по изобретению являются:
метил-(R)(-)-4-[(4'-изобутил)фенил]-3-оксопентаноат;
метил-(S)(+)-4-[(4'-изобутил)фенил]-3-оксопентаноат;
(R,S)-4-[(4'-изобутил)фенил]-3-оксопентановая кислота;
метил-(R)(-)-4-[(3'-бензоил)фенил]-3-оксопентаноат;
(R)(-)-3-[(4'-изобутил)фенил]бутан-2-он;
(S)(+)-3-[(4'-изобутил)фенил]бутан-2-он;
(R)(-)-3-[(3'-бензоил)фенил]бутан-2-он;
(R)(-)-диметил-3-(4'-изобутилфенил)-2-оксобутан-1-фосфонат;
(S)(±)-диметил-3-(3'-феноксифенил)-2-оксобутил-1-фосфонат;
(R)(-)-2-(4-изобутилфенил)пентан-3-он;
(S)(+)-этил-4-[(3'-бензоил)фенил]-3-оксопентаноат;
(S)(+)-3-[(3'-бензоил)фенил]бутан-2-он;
(R)(-)-2-(4-изобутилфенил)-4-фенилбутан-3-он;
(R)(-)-2-(4-изобутилфенил)-5-фенилпентан-3-он;
(R)(-)-2-(4'-изобутилфенил)-5-(пирид-3-ил)пентан-3-он;
(R)(-)-метил-4-[(4'-бензоилокси)фенил]-3-оксопентаноат;
(R)(-)-метил-4-[(4'-изопропилсульфонилокси)фенил]-3-оксопентаноат;
(R)(-)-метил-4-{[(4'-(2"-этил)фенилсульфониламино]-фенил}-3-оксопентаноат;
(R,S)-5-(4'-изобутилфенил)гексан-2,4-дион;
(R,S)-1-фенил-5-(4'-изобутилфенил)-2,4-гександион;
(R,S)-1-(пирид-2-ил)-4-(4'-изобутилфенил)-1,3-пентандион;
(R)(-)-2-(4-изобутилфенил)-7-трет-бутоксикарбониламиногептан-3-он;
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, метилсульфоксид;
(R,S)-2-(3'-бензоилфенил)-3-оксобутил, метилсульфоксид;
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, метилсульфон;
(R,S)-2-(3'-бензоилфенил)-3-оксобутил, метилсульфон;
(R,S)-2-(3'-феноксифенил)-3-оксобутил, метилсульфон;
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, фенилсульфон;
(R)(-)-4-(4'-пиридил)-2-[(4"-изобутил)фенил]бутан-3-он;
(R)-2-[4-(1-оксо-2-изоиндолинил)фенил]-3-оксовалерамид;
(R)-2-[4-(1-оксо-2-изоиндолинил)фенил]-3-оксовалеронитрил;
(R)(+)-5-[2-(4-изобутилфенил)пропион-1-ил]-2,2-диметил-1,3-диоксан-4,6-дион;
(R)(-)-5-[2-(3'-бензоилфенил)пропион-1-ил]-2,2-диметил-1,3-диоксан-4,6-дион.
Соединения формулы 1 являются сильными ингибиторами хемотаксиса нейтрофилов, индуцированного ИЛ-8 и ингибируют увеличение выработки TNF-α, стимулированного липополисахаридами и пероксидом водорода. Повышенная выработка пероксида водорода является печально известным следствием нейтрофильной активации, являющейся результатом хемотактического стимулирования.
Примерами β-кетоэфиров формулы I являются метил-(R)(-)-4-[(4'-изобутил)фенил]-3-оксопентаноат и метил-(R)(-)-4-[(3'-бензоил)фенил]-3-оксопентаноат, которые при концентрации 10-8 М ингибируют хемотаксис нейтрофилов человека более чем на 50% по сравнению с контрольными величинами.
Типичным примером 2-арилалкан-3-она является (R)(-)-3-[(4'-изобутил)фенил]бутан-2-он, ИК50 которого была рассчитана в том же тесте ингибирования in vitro и равна 5·10-10 М. Для оценки соединений по изобретению были использованы полиморфно-ядерные клетки крови, полученные из гепаринизованной крови здоровых взрослых добровольцев посредством осаждения на декстран. Моноядерные клетки удаляли с помощью Ficoll/Hypaque, а эритроциты удаляли обработкой гипотоническими растворами. Жизнеспособность клеток полиморфно-ядерных нейтрофилов (PMN) рассчитывали методом окрашивания Turk и трипановым синим после окрашивания Diff Quinck, а процентное содержание РМ-клеток оценивали центрифугированием (подробное описание эксперимента см. в W.J. Ming et al., J. Immunol., 138, 1469, 1987). В каждом эксперименте in vitro PMN инкубировали с соединениями по изобретению в течение 10 минут, манипулируя при температуре 37°С.
В экспериментах по хемотаксису и по измерению уровня ионов Са2+ в цитозоле в качестве стимулятора использовали человеческий рекомбинантный ИЛ-8 (Pepro Tech.); лиофилизированный белок растворяли в HBSS (сбалансированном соляном растворе Хенка) при концентрации 100 нг/мл и использовали после разбавления в HBSS до концентрации 10 нг/мл в экспериментах по хемотаксису, а в экспериментах для оценки модификаций [Са2+] после разбавления до 25-50 нг/мл.
При анализе хемотаксиса (согласно W. Falket et al.,J. Immunol. Methods, 33, 239, 1980) использовали поливинилпирролидоновые (PVP) фильтры, пористость которых составляла 5 мкм и микрокамеру из органического стекла, пригодную для проведения 48 репликаций. Микрокамера состоит из блока из органического стекла, содержащего 48 лунок, каждая емкостью 25 мкл, и снабженного крышкой, которая, в свою очередь, содержит 48 отверстий, устроенных таким образом, что будучи установленной на место и привинченной к нижней части, образует верхние отсеки микрокамеры, емкостью 50 мкл каждый.
Исследуемые соединения добавляют в одной одинаковой концентрации в лунки верхнего уровня, содержащие суспензию PMN, и в лунки нижнего уровня, которые содержат носитель, к которому добавляли или нет ИЛ-8 (или другой стимулятор).
Для определения изменений [Са2+] в цитозоле была выбрана экспериментальная модель, описанная C. Bizzarri et al., Blood, 86, 2388, 1995), c использованием предметных стекол, содержащих прилипшие PMN, которые подпитали 1 мкМ Fura-2AM для того, чтобы выявить изменения [Са2+] в реальном времени. В свою очередь, цитоцентрифугаты PMN повторно суспендировали в среде RPMI 1640 с 5% FCS (фетальной телячьей сыворотки) с концентрацией 3×106/мл и затем высевали на круглые стеклянные предметные стекла диаметром 25 мм, которые помещали в инкубатор на 30 минут при 37°С. После трех последовательных промывок сбалансированным солевым раствором (BSS) для удаления неприлипших клеток дальнейшее инкубирование выполняли на прилипших клетках в течение максимум 4 часов перед подпиткой Fura-2AM.
Соединения по изобретению предотвращают рост внутриклеточной концентрации Са2+, индуцированный ИЛ-8.
Соединения по изобретению характеризуются своей способностью ингибировать in vitro хемотаксис лейкоцитов PMN человека, стимулированный интерлейкином 8 (ИЛ-8), также известным как нейтрофил-активирующий белок моноцитов (NAP/ИЛ-8 или проще ИЛ-8). Такое ингибирование зависит от дозы с величиной ИК50 (доза, ингибирующая 50% эффекта) в интервале 10-7-10-9 М; ингибирующий эффект является селективным и специфическим в отношении хемотаксиса, стимулированного ИЛ-8. Для ингибирования хемотаксиса, стимулированного in vitro другими хемотактическими факторами (С5а, формилпептиды бактериальной или синтетической природы, такие как f-LMP), необходимы концентрации, которые выше на один или два порядка. Кроме того, специфичность соединений по изобретению демонстрируется по их способности ингибировать повышение внутриклеточной концентрации [Са2+] в PMN человека, повышение, которое связано с самоактивацией PMN человека посредством ИЛ-8 (J.H. Liu et al., J. Infect. Dis., 166, 1089, 1992).
Независимо от абсолютной конфигурации соединения по изобретению не оказывают значительного влияния на циклооксигеназу и на выработку простагландинов (ПГ).
Действительно, в мышиных макрофагах, стимулируемых липополисахаридами (ЛПС)(1 мкг/мл), соединения по изобретению (в интервале концентраций 10-5-10-7 М) ингибируют выработку PGE2, которая, хотя зачастую на пределе статистической значимости, никогда не бывает больше 10-15% основной величины.
В отличие от определенных 2-арилпроионовых кислот незначительное ингибирование синтеза PGE2 имеет преимущество, которое заключается в отсутствии стимула, вероятно, увеличивающего синтез TNF-α макрофагами мыши (после стимуляции LPS). Считается, что усиление синтеза TNF-α совпадает, в свою очередь, с усилением активации хемотаксиса нейтрофилов и синтеза ИЛ-8. С другой стороны, эти эффекты отсутствия усиления синтеза TNF-α проявляются также в отношении синтеза TNF-α, стимулированного пероксидом водорода.
Известно, что интерлейкин 8 (ИЛ-8) и зависимые цитокины являются наиболее важными модуляторами инфильтрации нейтрофилов при заболеваниях, таких как псориаз (B.J. Nickoloff et al., Am. J. Pathol., 138, 129, 1991), ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1991), язвенный колит (Y.R. Mahkla et al., Clin. Sci., 82, 273, 1992), острый респираторный дистресс-синдром (ARDS), идиопатический фиброз (P.C. Carre et al., J. Clin. Invest., 88, 1802, 1991 and E.J. Miller et al., Am. Rev. Respir. Dis.), гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994) и буллезная пузырчатка. Соединения по изобретению, с которыми разработана рецептура для фармацевтических композиций для удобного приема, получаемых обычными способами и в смеси с обычными наполнителями, могут использоваться для лечения указанных заболеваний.
Соединения по изобретению также можно применять для профилактики и лечения повреждений, вызванных ишемией и реперфузией, в частности, в связи с трансплантацией органов.
Препараты по изобретению могут быть введены внутримышечной инъекцией, внутривенным путем в виде болюсов, в препаратах для дерматологического применения (кремы, лосьоны, спреи и мази), а также пероральным путем в форме капсул, таблеток, сиропа, композиций с контролируемым высвобождением и так далее.
Средняя дневная доза будет зависеть от разных факторов, таких как степень тяжести болезни и состояние больного (возраст, пол и вес). Доза может широко варьироваться от одного мг или нескольких мг до 1500 мг соединений в день, необязательно разделенных на несколько приемов. Так как токсичность соединений по изобретению низка, также могут вводиться более высокие дозы, а также проводиться более длительное лечение. Нижеприведенные примеры приведены для иллюстрирования изобретения. Примеры не должны рассматриваться как ограничивающие область изобретения.
Пример 1
(R)(-)-3-[(4'-изобутил)фенил]-бутан-2-он
(R)(-)-Ибупрофен (2 г, 9,69 ммоль) растворяют в тионил хлориде (4 мл) и полученный раствор кипятят с обратным холодильником в течение 4 часов.
После охлаждения до комнатной температуры растворитель упаривают при пониженном давлении, а избыток тионил хлорида удаляют, дважды растворяя остаток в диоксане и упаривая растворитель в высоком вакууме. Полученный желтый маслянистый остаток (2,34 г, 9,34 ммоль) растворяют в сухом дихлорметане (3 мл) и медленно добавляют по каплям в инертной атмосфере к раствору 2,2-диметил-1,3-диоксан-4,6-диона (кислоты Мелдрума)(1,35 г, 9,34 ммоль) и пиридина (1,83 мл, 22,9 ммоль) в сухом дихлорметане (7,5 мл), предварительно охлажденном до 0-5°С на бане со льдом и водой. После завершения добавления продукт оставляют на один час при этой температуре и еще на один час при комнатной температуре. Смесь, разбавленную дихлорметаном, распределяют между 2н. HCl и дробленым льдом, интенсивно перемешивая в течение 30 мин. После разделения фаз органическую фазу промывают 2н. HCl (2×10 мл) и насыщенным раствором NaCl и сушат над Na2SO4. После упаривания растворителей при пониженном давлении получают 2,69 г (R)(+)-5-[2-(4-изобутилфенил)пропион-1-ил]-2,2-диметил-1,3-диоксан-4,6-диона в виде масла ([α]D=+61,7°; с=1%, CH2Cl2), который без дополнительной очистки растворяют в диоксане (10 мл). Добавляют ледяную уксусную кислоту (0,84 мл) и воду (0,13 мл) и образующийся раствор кипятят с обратным холодильником в течение 3 часов. После охлаждения и упаривания растворителей остаток очищают флэш-хроматографией (элюент: н-гексан/этиловый эфир 9:1) и получают (R)(-)-3-[(4'-изобутил)фенил]бутан-2-он в виде бледно-желтого масла (0,97 г, 4,75 ммоль).
[α]D=-216,1°; (с=1%, CH3СН2ОН); 1Н ЯМР (CDCl3): δ 6,95 (с, 4Н), 3,61 (кв, 1Н, J=8 Гц), 2,3 (д, 3Н, J=7 Гц), 1,93 (с, 3Н), 1,75 (м, 1Н), 1,26 (д, 2Н, J=8 Гц), 0,85 (д, 6Н, J=7 Гц).
Пример 2
(S)(+)-3-[(4'-изобутил)фенил]бутан-2-он
(R)(-)-3-[(3'-бензоил)фенил]бутан-2-он
По методике Примера 1 из 0,3 г (1,33 ммоль) (S)(+)-ибупрофена получают (S)(+)-3-[(4'-изобутил)фенил]бутан-2-он (0,13 г, 0,63 ммоль) в виде бледно-желтого масла; [α]D=+210,5°; (с=1%, CH3СН2ОН); 1Н ЯМР (CDCl3): δ 7,10 (с, 4Н), 3,75 (кв, 1Н, J=8 Гц), 2,45 (д, 3Н, J=7 Гц), 2,05 (с, 3Н), 1,85 (м, 1Н), 1,32 (д, 2Н, J=8 Гц), 0,92 (д, 6Н, J=7 Гц). Также из 0,74 г (2,9 ммоль) (R)(-)-кетопрофена получают (R)(-)-3-[(3'-бензоил)фенил]бутан-2-он (0,46 г, 1,79 ммоль) в виде бледно-желтого масла; [α]D=-103°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,85 (м, 2Н), 7,75 (м, 2Н), 7,60 (м, 1Н), 7,55-7,40 (м, 4Н), 3,85 (кв, 1Н, J=8 Гц), 2,1 (с, 3Н), 1,45 (д, 3Н, J=8 Гц).
Пример 3
Метил-(R)(-)-4-[(4'-изобутил)фенил]-3-оксопентаноат
4-[(4'-изобутил)фенил]-3-оксопентановая кислота
(R)(-)-Ибупрофен (1,2 г, 5,8 ммоль) растворяют в диоксане (5 мл), добавляют тионил хлорид (2,36 мл) и полученный раствор кипятят с обратным холодильником 3 часа. После охлаждения до комнатной температуры растворитель упаривают при пониженном давлении, а избыток тионил хлорида удаляют, дважды растворяя остаток в диоксане и упаривая растворитель в высоком вакууме. Полученный желтый маслянистый остаток (1,3 г, 5,79 ммоль) растворяют в сухом дихлорметане (2 мл) и медленно добавляют по каплям в инертной атмосфере к раствору 2,2-диметил-1,3-диоксан-4,6-диона (кислоты Мелдрума)(0,83 г, 5,79 ммоль) и пиридина (1,12 мл, 14 ммоль) в сухом дихлорметане (5 мл), предварительно охлажденном до +5°С на бане со льдом и водой. После завершения добавления смесь оставляют на один час при этой температуре и еще на один час при комнатной температуре. Смесь, разбавленную дихлорметаном, распределяют между 2н. HCl и дробленым льдом при сильном перемешивании в течение 30 мин. После разделения фаз органическую фазу промывают 2н. HCl (2×10 мл) и насыщенным раствором NaCl и сушат над Na2SO4. После упаривания растворителя при пониженном давлении остаток (R)(+)-5-[2-(4-изобутилфенил)пропион-1-ил]-2,2-диметил-1,3-диоксан-4,6-диона ([α]D=+62°; с=1,1%, CH2Cl2), без дополнительной очистки растворяют в метаноле (14 мл) и раствор кипятят с обратным холодильником в течение 3 часов. После охлаждения и упаривания растворителя остаток очищают флэш-хроматографией (элюент: н-гексан/этиловый эфир 8:2) и получают чистый метиловый эфир (R)(-)-4-[(4'-изобутил)фенил]-3-оксопентановой кислоты в виде бесцветного масла (0,6 г, 2,28 ммоль). [α]D=-192,5°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,1 (с, 4Н), 3,88 (кв, 1Н, J=8 Гц), 3,67 (с, 3Н), 3,47-3,28 (кв, 2Н, J=8 Гц), 2,45 (д, 2Н, J=8 Гц), 1,85 (м, 1Н), 1,40 (д, 3Н, J=8 Гц), 0,95 (д, 6Н, J=7 Гц).
К раствору полученного эфира (0,15 г, 0,57 ммоль) в метаноле (2 мл) добавляют 1н. раствор NaOH (1 мл)и смесь перемешивают при комнатной температуре в течение ночи. Затем растворители упаривают при пониженном давлении, а остаток растворяют в воде (3 мл) и к раствору добавляют 2н. HCl по каплям до рН=1, затем смесь экстрагируют этиловым эфиром (3×10 мл), органическую фазу промывают насыщенным раствором NaCl (10 мл), сушат над Na2SO4 и упаривание при пониженном давлении дает 0,12 г (0,48 ммоль) чистой (+)4-[(4'-изобутил)фенил]-3-оксопентановой кислоты в виде бесцветного масла. 1Н ЯМР (CDCl3): δ 7,1 (м, 4Н), 3,88 (кв, 1Н, J=8 Гц), 3,45 (м, 2Н), 2,48 (д, 2Н, J=8 Гц), 1,90 (м, 1Н), 1,45 (д, 3Н, J=8 Гц), 0,90 (д, 6Н, J=7 Гц).
Пример 4
Метил-(R)(-)-4-[(3'-бензоил)фенил]-3-оксопентаноат
Заменив R-ибупрофен на (R)(-)-кетопрофен (0,74 г, 2,9 ммоль) в способе по Примеру 3 получают 0,81 г (R) (-)-5-[2-(3'-бензоилфенил)пропион-1-ил]-2,2-диметил-1,3-диоксан-4,6-диона ([α]D=-39,5°; с=1%, CH2Cl2), который кипячением в метаноле дает после очистки флэш-хроматографией (элюент: н-гексан/этилацетат 8:2) 0,49 г (1,56 ммоль) чистого метил-(R)(-)-4-[(3'-бензоил)фенил]-3-оксопентаноата в виде бесцветного масла, [α]D=-135°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,85-7,40 (м, 9Н), 4,0 (кв, 1Н, J=8 Гц), 3,70 (с, 3Н), 3,50-3,30 (кв, 2Н, J=8 Гц), 1,45 (д, 3Н, J=8 Гц).
Пример 5
(S)(+)-Этил-4-[(3'-бензоил)фенил]-3-оксопентаноат
(S)(+)-3-[(3'-бензоил)фенил]-бутан-2-он
При комнатной температуре в атмосфере инертного газа и при перемешивании добавляют моноэтиловый эфир малоновой кислоты (1,3 г) в ТГФ (3 мл) к суспензии этилата магния (0,57 г) в ТГФ (6 мл). После полного растворения реагентов к смеси, содержащей комплекс магний-этилмалонат, быстро прикапывают раствор (S)(+)-2-(3-бензоилфенил)пропионилимидазолида (0,83 г) в 10 мл безводного ТГФ, полученный in situ добавлением 0,43 г 1,1'-карбонилдиимидазола к раствору (S)(+)-2-(3-бензоилфенил)пропионовой кислоты (0,66 г) в ТГФ. Смесь перемешивают 4 часа, подкисляют 50% водной АсОН (1,2 мл) и концентрируют в вакууме до малого объема и разбавляют водой. После повторных экстракций этилацетатом органические фазы объединяют, промывают насыщенным раствором NaCl, сушат над Na2SO4 и упаривают до сухого состояния и получают после очистки на силикагеле 0,82 г этил-(S)(+)-4-[(3'-бензоил)фенил]-3-оксопентаноата; [α]D=+129°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,82-7,45 (м, 9Н), 4,1 (кв, 1Н, J=8 Гц), 3,75 (с, 3Н), 3,50-3,25 (кв, 2Н, J=8 Гц), 1,48 (д, 3Н, J=8 Гц).
По той же описанной методике и исходя из соответствующих арилпропионовых кислот синтезированы следующие 3-оксоэфиры:
(R)(-)-метил-4-[(4'-бензоилокси)фенил]-3-оксопентаноат;
1Н ЯМР (CDCl3): δ 8,02 (м, 2Н), 7,51 (м, 1Н), 7,35 (м, 2Н), 7,27 (с, 1Н), 7,22 (м, 2Н), 3,85 (м, 2Н), 3,74 (с, 3Н), 3,42-3,37 (кв, 2Н, J=8 Гц), 2,78 (кв, 2Н, J=8 Гц), 1,25 (т, 3Н, J=8 Гц).
(R)(-)-метил-4-[(4'-изопропилсульфонилокси)фенил]-3-оксопентаноат
[α]D=-184,2°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,32 (д, 2Н, J=7 Гц), 7,21 (д, 2Н, J=7 Гц), 4,1 (кв, 1Н, J=8 Гц), 3,81 (м, 1Н), 3,70 (с, 3Н), 3,50-3,30 (кв, 2Н, J=8 Гц), 1,75 (д, 6Н, J=7 Гц), 1,45 (д, 3Н, J=8 Гц).
(R)(-)-метил-4-{[(4'-(2"-этил)фенилсульфониламино]фенил}-3-оксопентаноат; [α]D=-81,3°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,32 (д, 2Н, J=7 Гц), 7,20 (м, 6Н), 6,84 (шир.с, 1Н, SO2NH), 4,05 (кв, 1Н, J=8 Гц), 3,72 (с, 3Н), 3,55-3,35 (кв, 2Н, J=8 Гц), 2,75 (кв, 2Н, J=8 Гц), 1,45 (д, 3Н, J=8 Гц), 1,22 (т, 3Н, J=8 Гц). К раствору 0,4 г соединения в 1,5 мл диметилсульфоксида добавляют 2 капли насыщенного водного раствора NaCl, затем нагревают в течение 4 часов при перемешивании на бане при 140-145°С; затем охлаждают и разбавляют водой, смесь повторно экстрагируют этилацетатом. Из объединенных органических фаз после обычной обработки получают маслянистый остаток, который после очистки флэш-хроматографией дает 0,24 г S-(+)-3-[(3'-бензол)фенил]бутан-2-он в виде желтого масла; [α]D=+1-1°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,83 (м, 2Н), 7,77 (м, 2Н), 7,65 (м, 1Н), 7,50-7,45 (м, 4Н), 3,85 (кв, 1Н, J=8 Гц), 2,3 (с, 3Н), 1,40 (д, 3Н, J=8 Гц).
Пример 6
(R)(-)-диметил-3-(4-изобутилфенил)-2-оксобутан-1-фосфонат
К раствору (R)(-)-ибупрофена (3,45 г) в этиловом эфире, охлажденному до 5°С, добавляют по каплям 0,6 М раствор диазометана в этиловом эфире до постоянного желтого цвета. Растворитель удаляют в вакууме, остаточное масло очищают флэш-хроматографией и получают 3,3 г метил-(R)(-)-2-(4'-изобутилфенил)пропионата.
Альтернативно, карбонилдиимидазол (2,6 г) добавляют при перемешивании к раствору (R)(-)-ибупрофена (3,45 г) в ТГФ (10 мл). Смесь перемешивают 1 час, растворитель упаривают в вакууме и остаточное масло очищают флэш-хроматографией и получают 4,05 г (R)(-)-2-(4'-изобутилфенил)пропионилимидазолида.
В атмосфере инертного газа раствор бутиллития (1,56 М, 13,3 мл, 0,027 моль) в гексане добавляют по каплям к раствору диметилметилфосфоната (3,69 г, 0,03 моль) в безводном ТГФ (10 мл), охлажденном до -70°С. Смесь перемешивают 15 минут перед прибавлением по каплям раствора в безводном ТГФ (10 мл) метилового эфира или имидазолида, полученных, как описано выше.
После завершения прибавления реакционную смесь выдерживают при перемешивании 1 час при -70°С и затем 1 час при комнатной температуре. Затем смесь охлаждают до -10°С и добавляют по каплям ледяную уксусную кислоту (1,8 мл). Растворитель удаляют под вакуумом, остаток разбавляют водой и смесь неоднократно экстрагируют дихлорметаном (4×50 мл). Органические экстракты сушат над сульфатом натрия; после упаривания растворителя остаток очищают на силикагеле, элюируют этилацетатом и получают 3,02 г (R)(-)-диметил-3-(4-изобутилфенил)-2-оксобутан-1-фосфоната в виде бесцветного масла; [α]D=-171°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,03 (с, 4Н), 4,1-3,9 (дд, 2Н, J1=15 Гц, J2=8 Гц), 3,8 (с, 3Н), 3,70 (м, 1Н), 3,65 (с, 3Н), 2,55 (д, 2Н, J=8 Гц), 1,75 (м, 1Н), 1,50 (д, 3Н, J=8 Гц), 0,85 (д, 6Н, J=7 Гц).
Пример 7
(R)(-)-2-(4-изобутилфенил)-7-трет-бутоксикарбониламиногептан-3-он
Раствор этил-5-трет-бутоксикарбониламино-2-этоксикарбонилпентаноата (WO 94/10127) (1,59 г) в метаноле (3 мл) добавляют к 0,63 н. раствору (8 мл) LiOH·H2O в смеси вода/метанол (1:1) и смесь перемешивают 12 часов при комнатной температуре. Смесь разбавляют насыщенным раствором мононатрийфосфата (10 мл) и избыток метанола удаляют под вакуумом. Смесь экстрагируют этилацетатом (2×10 мл), из органических экстрактов, объединенных и высушенных над сульфатом натрия, после упаривания растворителя получают 1,4 г (4,8 ммоль) 5-трет-бутоксикарбониламино-2-этоксикарбонилпентановой кислоты.
К раствору кислоты (2,4 ммоль) в безводном ТГФ (8 мл) добавляют коммерчески доступный этоксид магния 0,27 г (2,4 ммоль) и суспензию перемешивают при комнатной температуре до полного растворения реагентов с образованием комплекса магния.
Затем добавляют раствор (R)(-)-2-(4'-изобутилфенил)пропионилимидазолида (0,3 г) и смесь перемешивают при комнатной температуре 4 часа. Смесь подкисляют добавлением нескольких мл 50% водной АсОН и растворитель упаривают под вакуумом. Остаток распределяют между водой и этилацетатом и после обычной обработки получают неочищенный продукт, (R,S)-2-[R-2-(4-изобутил)пропионил-5-трет-бутоксикарбониламинопентаноат (0,42 г), который очищают флэш-хроматографией.
Раствор β-кетоэфира (0,15 г) в ДМСО/NaCl/H2O затем деалкоксидекарбоксилируют нагреванием при 135-145°С и получают 0,08 г (R)(-)-2-(4-изобутилфенил)-7-трет-бутоксикарбониламиногептан-3-она; [α]D=-25°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,25 (c, 4Н), 6,35 (шир.с, 1Н, CONH), 3,70 (кв, 1Н, J=8 Гц), 3,40 (м, 2Н), 2,45 (д, 2Н, J=7 Гц), 2,31 (м, 2Н), 1,85 (м, 1Н), 1,75-1,62 (м, 4Н), 1,60 (д, 3Н, J=7 Гц), 1,45 (с, 9Н), 0,94 (д, 6Н, J=7 Гц).
Пример 8
По методике Примера 7, но используя в качестве исходного материала моноэфир замещенной малоновой кислоты, выбранный из группы:
метил-2-карбоксипропионат;
метил-2-карбокси-2-фенилацетат;
метил-2-карбокси-3-фенилпропионат;
метил-2-карбокси-3-(пирид-3-ил)пропионат;
метил-2-карбокси-3-циклопентилпропионат;
получены следующие β-кетоэфиры:
метил-(R',S')-2-[R-2-(4-изобутилфенил)пропионил]пропионат;
метил-(R',S')-2-[R-2-(4-изобутилфенил)пропионил]-2-фенилацетат;
метил-(R',S')-2-[R-2-(4-изобутилфенил)пропионил]-3-фенилпропионат;
метил-(R',S')-2-[R-2-(4-изобутилфенил)пропионил]-3-(пирид-3-ил)пропионат;
метил-(R',S')-2-[R-2-(4-изобутилфенил)пропионил]-3-циклопентилпропионат;
чтобы получить после декарбоксилирования в ДМСО/NaCl соответствующие кетоны:
(R)(-)-2-(4-изобутилфенил)пентан-3-он; [α]D=-36°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,20 (д, 2Н, J=7 Гц), 7,10 (д, 2Н, J=7 Гц), 3,70 (кв, 1Н, J=8 Гц), 2,47 (д, 2Н, J=7 Гц), 2,40 (кв, 2Н, J=7 Гц), 1,82 (м, 1Н), 1,55 (д, 3Н, J=7 Гц), 0,98 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
(R)(-)-2-(4-изобутилфенил)-4-фенилбутан-3-он; [α]D=-48,5°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,35-7,18 (м, 5Н), 7,15 (д, 2Н, J=7 Гц), 7,05 (д, 2Н, J=7 Гц), 3,72 (кв, 1Н, J=8 Гц), 3,65 (с, 2Н), 2,42 (д, 2Н, J=7 Гц), 1,80 (м, 1Н), 1,60 (д, 3Н, J=7 Гц), 0,93 (д, 6Н, J=7 Гц).
(R)(-)-2-(4-изобутилфенил)-5-фенилпентан-3-он; [α]D=-40°; (с=1,5%, CH3ОН); 1Н ЯМР (CDCl3): δ 7,37-7,20 (м, 5Н), 7,10 (д, 2Н, J=7 Гц), 7,00 (д, 2Н, J=7 Гц), 3,70 (кв, 1Н, J=8 Гц), 2,88 (м, 2Н), 2,75 (м, 2Н), 2,45 (д, 2Н, J=7 Гц), 1,82 (м, 1Н), 1,63 (д, 3Н, J=7 Гц), 0,95 (д, 6Н, J=7 Гц).
(R)(-)-2-(4-изобутилфенил)-5-(пирид-3-ил)пентан-3-он; [α]D=-89°; (с=1%, CH3ОН); 1Н ЯМР (CDCl3): δ 8,62 (м, 2Н), 7,80 (м, 1Н), 7,35 (м, 1Н), 7,15 (д, 2Н, J=7 Гц), 7,08 (д, 2Н, J=7 Гц), 5,35 (т, 2Н, J=8 Гц), 5,05 (т, 2Н, J=8 Гц), 3,72 (кв, 1Н, J=8 Гц), 2,42 (д, 2Н, J=7 Гц), 1,80 (м, 1Н), 1,63 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
Пример 9
(R,S)-1-фенил-4-(4'-изобутилфенил)-1,3-пентадион
Суспензию этилата магния (0,55 г) в растворе бензоилуксусной кислоты (1,61 г) перемешивают при комнатной температуре в атмосфере инертного газа до полного растворения реагентов. Затем добавляют раствор (R,S)-2-(4'-изобутилфенил)пропионилимидазолида (0,6 г) и смесь перемешивают при комнатной температуре в течение ночи. Смесь приводят к нейтральности добавлением нескольких капель 50% водной АсОН и затем упаривают под вакуумом до сухого состояния. Остаток распределяют между водой и этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и упаривают до сухого состояния. Остаток очищают флэш-хроматографией и получают 0,78 г (R,S)-1-фенил-4-(4'-изобутилфенил)-1,3-пентадиона.
1Н ЯМР (CDCl3): δ 7,90 (м, 2Н), 7,65 (м, 1Н), 7,52 (м, 2Н), 7,20 (д, 2Н, J=7 Гц), 7,12 (д, 2Н, J=7 Гц), 3,77 (с, 2Н), 3,68 (кв, 1Н, J=8 Гц), 2,41 (д, 2Н, J=7 Гц), 1,82 (м, 1Н), 1,60 (д, 3Н, J=7 Гц), 0,95 (д, 6Н, J=7 Гц).
Пример 10
По методике Примера 9, но используя β-кетокислоту, выбранную из группы: ацетилуксусная кислота, 4-фенил-3-оксомасляная кислота или никотиноилуксусная кислота, вместо бензоилуксусной кислоты получают: (R,S)-5-(4'-изобутилфенил)гексан-2,4-дион;
1Н ЯМР (CDCl3): δ 7,20 (д, 2Н, J=7 Гц), 7,12 (д, 2Н, J=7 Гц), 3,75 (с, 2Н), 3,65 (кв, 1Н, J=8 Гц), 2,40 (д, 2Н, J=7 Гц), 2,10 (с, 3Н), 1,82 (м, 1Н), 1,62 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
(R,S)-1-фенил-5-(4-изобутилфенил)-2,4-гександион;
1Н ЯМР (CDCl3): δ 7,35-7,20 (м, 5Н), 7,15 (д, 2Н, J=7 Гц), 7,05 (д, 2Н, J=7 Гц), 3,75 (с, 2Н), 3,68 (кв, 1Н, J=8 Гц), 3,63 (с, 2Н), 2,41 (д, 2Н, J=7 Гц), 1,80 (м, 1Н), 1,64 (д, 3Н, J=7 Гц), 0,95 (д, 6Н, J=7 Гц).
(R,S)-1-(пирид-2-ил)-4-(4'-изобутилфенил)-1,3-пентандион;
1Н ЯМР (CDCl3): δ 8,60 (м, 2Н), 7,81 (м, 1Н), 7,37 (м, 1Н), 7,18 (д, 2Н, J=7 Гц), 7,10 (д, 2Н, J=7 Гц), 3,70 (кв, 1Н, J=8 Гц), 3,65 (с, 2Н), 2,40 (д, 2Н, J=7 Гц), 1,81 (м, 1Н), 1,65 (д, 3Н, J=7 Гц), 0,95 (д, 6Н, J=7 Гц).
Пример 11
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, метилсульфоксид
Раствор гидрида натрия (21 ммоль) в сухом диметилсульфоксиде (5 мл) нагревают при 60°С в атмосфере инертного газа 1 час. Прикапывают раствор метил-2-(4'-изобутилфенил)пропионата (2,2 г, 10 ммоль) в сухом диметилсульфоксиде и перемешивают 2 часа при 60°С. Смесь охлаждают при комнатной температуре, приводят к нейтральности добавлением АсОН (0,25 мл) и разбавляют диэтиловым эфиром. Добавляют 1н. HCl до рН 2, добавляют СН2Cl2 и воду. Две фазы перемешивают и разделяют; объединенные органические фазы сушат над сульфатом натрия и упаривают до сухого состояния. Остаток очищают флэш-хроматографией и получают 0,35 г (R,S)-2-(4'-изобутилфенил)-3-оксобутил, метилсульфоксида; 1Н ЯМР (CDCl3): δ 7,14 (с, 4Н), 3,84 (м, 1Н), 2,65+2,54 (с, 3Н), 2,47 (д, 2Н, J=7 Гц), 1,87 (м, 1Н), 1,43 (д, 3Н, J=7 Гц), 0,92 (д, 6Н, J=7 Гц).
По методике, описанной выше, и используя соответствующий метиловый эфир кетопрофена, получено следующее соединение:
(R,S)-2-(3'-бензоилфенил)-3-оксобутил, метилсульфоксид.
1Н ЯМР (CDCl3): δ 7,85-7,60 (м, 4Н), 7,52-7,40 (м, 5Н), 3,80 (м, 2Н), 3,55 (м, 1Н), 2,62+2,55 (с, 3Н), 2,47 (д, 2Н, J=7 Гц), 1,85 (м, 1Н), 1,40 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
По методике, описанной выше, и используя метиловый эфир соответствующих арилпропионовых кислот и метилсульфон (или фенилсульфон) вместо метилсульфоксида, получены следующие соединения:
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, метилсульфон
1Н ЯМР (CDCl3): δ 7,18 (c, 4Н), 4,18 (м, 2Н), 3,90 (м, 1Н), 3,10 (с, 3Н), 2,40 (д, 2Н, J=7 Гц), 1,80 (м, 1Н), 1,52 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
(R,S)-2-(3'-бензоилфенил)-3-оксобутил, метилсульфон
1Н ЯМР (CDCl3): δ 7,85-7,60 (м, 4Н), 7,52-7,40 (м, 5Н), 4,20 (м, 3Н), 3,95 (м, 1Н), 3,18 (с, 3Н), 1,55 (д, 3Н, J=7 Гц).
(R,S)-2-(3'-феноксифенил)-3-оксобутил, метилсульфон
1Н ЯМР (CDCl3): δ 7,25-7,38 (м, 2Н), 7,15-7,05 (м, 2Н), 7,02 (м, 2Н), 6,70-6,60 (м, 2Н), 6,55 (с, 1Н), 4,21 (м, 3Н), 4,15 (м, 1Н), 3,20 (с, 3Н), 1,58 (д, 3Н, J=7 Гц).
(R,S)-2-(4'-изобутилфенил)-3-оксобутил, фенилсульфон
1Н ЯМР (CDCl3): δ 8,05 (м, 2Н), 7,75 (м, 1Н), 7,60 (м, 2Н), 7,15 (с, 4Н), 4,15 (м, 2Н), 3,95 (м, 1Н), 2,40 (д, 2Н, J=7 Гц), 1,80 (м, 1Н), 1,52 (д, 3Н, J=7 Гц), 0,94 (д, 6Н, J=7 Гц).
Пример 12
(R)(-)-4-(4'-пиридил)-2-[(4"-изобутил)фенил]бутан-3-он
Диизопропиламин (0,17 мл, 1,21 ммоль) и гидрид натрия (60% в минеральном масле, 0,106 мг, 2,66 ммоль) растворяют в сухом ТГФ (20 мл) в атмосфере азота; порциями добавляют 4-пиридилуксусную кислоту (0,166 г, 1,21 ммоль) и смесь кипятят с обратным холодильником 15 минут. После охлаждения до 0-4°С на бане с водой и льдом добавляют бутиллитий (1,6 М в гексанах, 0,75 мл, 1,21 ммоль) и через 30 минут добавляют по каплям раствор (R)(-)-2-(4'-изобутилфенил)пропионилхлорида (0,27 г, 1,21 ммоль) в сухом ТГФ (10 мл). В конце добавления баню убирают и раствор оставляют перемешиваться при комнатной температуре в течение ночи. Растворитель упар