Тетрагидрохинолиновые производные
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к тетрагидрохинолиновым производным общей формулы (I), где Y-X обозначает С(O)-O, C(O)-NH, S(O)2-NH, NHC(O)-NH, NHC(S)-NH, OC(O)-NH; R6 обозначает Н, (1-6С)алкил, 1- или 2-адамантил(1-4С)алкил, (3-9С)гетероарил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил, алкилтио(1-4С)алкил, фенил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, R8, R9аминокарбонил(1-4C) алкил, R8, R8,R9-амино (1-4С)алкил, R8-оксикарбонил(l-4C)алкил, R8-окси(l-4C)алкил, R8-карбонил(1-4С)алкил или фенил, необязательно замещенный гидрокси, амино, галогеном, нитро, трифторметилом, (3-9С)гетероарилом, (1-4С)алкилкарбониламино, (1-4С)алкилкарбонилокси, (3-9С)гетероарилкарбонилокси, (3-9С)гетероарилсульфонилокси, (2-6С)гетероциклоалкилкарбамоилом или дифениламино. Кроме того, настоящее изобретение также относится к фармацевтической композиции, обладающей модулирующей активностью в отношении рецептора ФСГ, включающей указанные производные. 2 з. и 15 з.п. ф-лы.
Реферат
Настоящее изобретение относится к соединению, обладающему ФСГ-модулирующей активностью, в частности тетрагидрохинолиновому производному, к фармацевтической композиции, содержащей его, а также к применению указанного соединения в терапии.
Гонадотропины выполняют важную роль в многочисленных функциях организма, включая метаболизм, терморегуляцию и репродуктивный процесс. Гонадотропины действуют на специфические типы половых клеток, инициируя дифференциацию клеток яичника и яичек и стероидогенез. Гипофизарный гонадотропин ФСГ (фолликулостимулирующий гормон) играет, например, важную роль в стимуляции развития и созревания фолликул, в ходе которой ЛГ (лютеинизирующий гормон) индуцирует овуляцию (Sharp, R.M. Clin Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35:301-342, 1979). В настоящее время ФСГ используется клинически в сочетании с ЛГ для стимуляции яичника, например для гиперстимуляции яичника с целью оплодотворения in vitro (IVF) и индукции овуляции у женщин с ановулярным бесплодием (Insler, V., Int. J. Fertility 33:85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5:3-13, 1988), а также в случае мужского гипогонадизма и мужского бесплодия.
Гонадотропин ФСГ высвобождается из передней доли гипофиза под воздействием гонадотропин-рилизинг гормона и эстрогенов, а также из плаценты во время беременности. У женщин ФСГ действует на яичники, ускоряя развитие фолликул, и представляет собой основной гормон, регулирующий секрецию эстрогенов. У мужчин ФСГ отвечает за целостность семенных канальцев и действует на клетки Сертоли, поддерживая гаметогенез. Очищенный ФСГ используют клинически для лечения бесплодия у женщин и некоторых типов недостаточности сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтического применения, могут быть выделены из мочи человека и в этом случае характеризуются низкой чистотой (Morse et al., Amer. J. Reproduct. Immunol. and Microbiology 17:143, 1988). Альтернативно, они могут быть получены в виде рекомбинантных гонадотропинов. Рекомбинантный человеческий ФСГ доступен коммерчески и используется в искусственной репродукции (Olijve et al., Mol. Hum. Reprod. 2:371, 1996; Devroey et al., Lancet 339:1170, 1992).
Действие ФСГ гормона опосредовано специфическим рецептором плазматической мембраны, которая является представителем большого семейства рецепторов, связанных с G-белком. Указанные рецепторы состоят из одного полипептида, включающего семь трансмембранных доменов, и способны взаимодействовать с G-белком, что приводит к активации аденилатциклазы.
ФСГ рецептор представляет собой высокоспецифичную мишень в процессе роста фолликул яичника и экспрессируется исключительно в яичнике. Блокирование указанного рецептора или ингибирование сигнального пути, который в норме индуцируется после активации ФСГ-опосредованного рецептора, будет нарушать развитие фолликулы и, таким образом, овуляцию и способность к оплодотворению. В этой связи низкомолекулярные антагонисты ФСГ могут использоваться в качестве основы для создания контрацептивных средств. Такие антагонисты ФСГ могут привести к снижению развития фолликулы (к отсутствию овуляции) со все еще достаточной продукцией эстрогена, что позволит избежать неблагоприятного воздействия, например, на костную массу.
Настоящее изобретение описывает получение низкомолекулярных аналогов гормона, которые оказывают селективное модулирующее воздействие на ФСГ рецептор. Соединения согласно настоящему изобретению могут использоваться как (частичные) агонисты или (частичные) антагонисты ФСГ рецептора.
Таким образом, авторами было обнаружено, что приведенный ниже класс тетрагидрохинолиновых соединений формулы I или их фармацевтически приемлемых солей обладает ФСГ-модулирующей активностью:
где R1 обозначает формил, (1-6С)алкилкарбонил или (1-6С)алкилсульфонил;
R2 и R3 обозначают H или (1-4С)алкил;
R4 обозначает фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей гидрокси, амино, галоген, нитро, трифторметил, циано, (1-4С)алкил, (2-4С)алкенил, (2-4С)алкинил, (1-4С)алкокси, (1-4С)(ди)алкиламино. Предпочтительным для замещения является пара-положение.
R5 обозначает (1-4С)алкил;
Y-X обозначает C(O)-O, S(O)2-O, NHC(O)-O, NHC(S)-O, OC(O)-O, связь-О, C(O)-NH, S(O)2-NH, NHC(O)-NH, NHC(S)-NH, OC(O)-NH, связь-HN, NH-C(O), O-C(O), NH-S(O)2 или O-S(O)2 или X-Y обозначает связь;
R6 обозначает H, трифторметил, (1-6С)алкил, 1- или 2-адамантил(1-4С)алкил, (2-6С)алкенил, (2-6С)алкинил, (6-10С)арил, (3-9С)гетероарил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил, (1-4С)алкилтио(1-4С)алкил, (6-10С)арил(1-4С)алкил, (3-9С)гетероарил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, R8,R9-аминокарбонил(1-4С)алкил, R8,R9-амино(1-4С)алкил, R8-оксикарбонил(1-4С)алкил, R8-окси(1-4С)алкил, R8-карбонил(1-4С)алкил.
Если R6 обозначает H, то следует отметить, что X-Y не может представлять собой связь.
Если R6 обозначает фенил, указанный фенил, вдобавок к заместителям для (6-10С)арильных групп, указанным в определении, может быть необязательно замещен (6-10С)арилом, (6-10С)арилокси, (6-10С)арил(1-4С)алкокси, (3-9С)гетероарилом, (3-9С)гетероарилокси, (3-9С)гетероарил(1-4С)алкокси, (1-4С)алкилкарбониламино, (1-4С)алкилкарбонилокси, (3-6С)циклоалкилкарбонилокси, (1-4С)алкоксикарбонил(1-4С)алкилкарбонилокси, (1-4С)алкокси(1-4С)алкилкарбонилокси, (6-10С)арилкарбонилокси, (3-9С)гетероарилкарбонилокси, (1-4С)алкилсульфонилокси, (6-10С)арилсульфонилокси, (3-9С)гетероарилсульфонилокси, (1-4С)(ди)алкилкарбамоилом, (6-10С)(ди)арилкарбамоилом, (2-6С)гетероциклоалкилкарбамоилом, (6-10С)(ди)ариламино, (3-6С)циклоалкилом, (3-6С)циклоалкил(1-4С)алкилом, (2-6С)гетероциклоалкилом, (2-6С)гетероциклоалкил(1-4С)алкилом.
R7 обозначает H, (1-4С)алкил, (1-4С)алкокси, галоген, трифторметил, циано, нитро, гидроксил;
R8 и/или R9 обозначает H, (1-4С)алкил, (2-4С)алкенил, (2-4С)алкинил, (6-10С)арил, (3-9С)гетероарил, (6-10С)арил(1-4С)алкил, (3-9С)гетероарил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, (1-4С)(ди)алкиламино(1-4С)алкил, (1-4С)алкокси(1-4С)алкил, (1-4С)алкилтио(1-4С)алкил, (1-4С)алкилкарбониламино(1-4С)алкил, (1-4С)алкоксикарбонил(1-4С)алкил, (1-4С)алкоксикарбониламино(1-4С)алкил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил или R8 иR9 могут соединяться в (2-6С)гетероциклоалкильное кольцо.
Соединения согласно настоящему изобретению модулируют функции ФСГ рецептора и могут использоваться для тех же клинических целей, что и нативный ФСГ, если они ведут себя как агонисты, с тем преимуществом, что они обладают измененными свойствами стабильности и могут вводиться разными способами. Если они блокируют ФСГ рецептор, то могут использоваться, например, в качестве контрацептивного средства.
Таким образом, модуляторы ФСГ рецептора согласно настоящему изобретению могут использоваться для лечения бесплодия, для контрацепции, для лечения гормонзависимых заболеваний, таких как рак молочной железы, рак предстательной железы и эндометриоз. Предпочтительно соединения согласно настоящему изобретению используются для инактивации ФСГ рецептора.
Термин "(1-4С)алкил" в контексте настоящего описания обозначает разветвленную или неразветвленную алкильную группу, содержащую 1-4 атома углерода, например метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
Термин "(1-6С)алкил" в контексте настоящего описания обозначает разветвленную или неразветвленную алкильную группу, содержащую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил и гексил. Предпочтительны (1-5С)алкильные группы и наиболее предпочтителен (1-4С)алкил.
Термин "1-или 2-адамантил(1-4С)алкил" обозначает адамантильную группу, присоединенную к положению 1 или 2 алкильной группы, содержащей 1-4 атома углерода, и имеет то же значение, что и указанные выше.
Термин "(2-4С)алкенил" обозначает разветвленную или неразветвленную алкенильную группу, содержащую 2-4 атома углерода, такую как этенил и 2-бутенил.
Термин "(2-6С)алкенил" обозначает разветвленную или неразветвленную алкенильную группу, содержащую 2-6 атомов углерода, такую как этенил, 2-бутенил и н-пентенил.
Термин "(2-4С)алкинил" обозначает разветвленную или неразветвленную алкинильную группу, содержащую 2-4 атома углерода, такую как этинил и пропинил.
Термин "(2-6С)алкинил" обозначает разветвленную или неразветвленную алкинильную группу, содержащую 2-6 атомов углерода, такую как этинил, пропинил и н-пентинил.
Термин "(3-6С)циклоалкил" обозначает циклоалкильную группу, содержащую 3-6 атомов углерода, которая может представлять собой циклопропил, циклобутил, циклопентил и циклогексил.
Термин "(2-6С)гетероциклоалкил" обозначает гетероциклоалкильную группу, содержащую 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и включающую по меньшей мере один гетероатом, выбранный из N, O и/или S, который может быть присоединен через гетероатом, если это доступно, или атом углерода. Предпочтительные гетероатомы включают N или О. Наиболее предпочтительными являются пиперидин, морфолин и пирролидин.
Термин "(1-4С)алкокси" обозначает алкоксигруппу, содержащую 1-4 атома углерода, алкильный фрагмент, которой имеет указанное выше значение. Предпочтительны (1-2С)алкоксигруппы.
Термин "(6-10С)арил" обозначает ароматическую углеводородную группу, содержащую 6-10 атомов углерода, такую как фенил, нафтил, тетрагидронафтил или инденил, которая может быть необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, (1-4С)алкила, (2-4С)алкенила, (2-4С)алкинила, (1-4С)алкокси, (1-4С)(ди)алкиламино, в которых алкильный фрагмент имеет указанное выше значение. Предпочтительной ароматической углеводородной группой является фенил.
Термин "(3-9С)гетероарил" обозначает замещенную или незамещенную ароматическую группу, содержащую 3-9 атомов углерода, включающую по меньшей мере один гетероатом, выбранный из N, O и/или S, такую как имидазолил, тиадиазолил, пиридил, (бенз)тиенил, (бензо)фурил, хинолил, тетрагидрохинолил, хиноксалил или индолил. Заместители на гетероарильной группе могут быть выбраны из заместителей, перечисленных для арильной группы. Гетероарильная группа может быть присоединена через атом углерода или гетероатом, если он доступен. Предпочтительные гетероарильные группы представляют собой тиенил, фурил и пиридил.
Термин "(6-10С)арилокси" обозначает определенную выше арильную группу, содержащую 6-10 атомов углерода, присоединенную к атому кислорода. (3-9С)гетероарилоксигруппы являются аналогами (6-10С)арилоксигрупп, которые включают по меньшей мере один гетероатом, выбранный из N, O или S.
Термин "(1-4С)алкоксикарбонил(1-4С)алкил" обозначает алкоксикарбонилалкильную группу, в которой алкоксигруппа включает 1-4 атома углерода и имеет указанное выше значение, а алкильная группа содержит 1-4 атома углерода и также имеет указанное выше значение.
Термин "(1-4С)алкокси(1-4С)алкил" обозначает алкоксиалкильную группу, в которой алкоксигруппа включает 1-4 атома углерода и имеет указанное выше значение, а алкильная группа содержит 1-4 атома углерода и также имеет указанное выше значение.
Термин "(3-6С)циклоалкил(1-4С)алкил" обозначает циклоалкильную группу, содержащую 3-6 атомов углерода, присоединенную к алкильной группе, включающей 1-4 атома углерода, в которой циклоалкильная группа представляет собой определенную выше (3-6С)циклоалкильную группу, а алкильная группа представляет собой определенную выше (1-4С)алкильную группу.
Термин "(2-6С)гетероциклоалкил(1-4С)алкил" обозначает гетероциклоалкильную группу, содержащую 2-6 атомов углерода, присоединенную к алкильной группе, включающей 1-4 атома углерода, в которой гетероциклоалкильная группа представляет собой определенную выше (2-6С)гетероциклоалкильную группу, а алкильная группа представляет собой определенную выше (1-4С)алкильную группу.
Термин "(1-4С)(ди)алкиламино" обозначает (ди)алкиламиногруппу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)(ди)ариламино" обозначает (ди)ариламиногруппу, арильные группы которой содержат 6-10 атомов углерода и имеют указанное выше значение.
Термин "(1-4С)(ди)алкиламино(1-4С)алкил" обозначает (ди)алкиламиноалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(1-4С)алкилтио(1-4С)алкил" обозначает алкилтиоалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "аминокарбонил(1-4С)алкил" в определении R8,R9-аминокарбонил(1-4С)алкила обозначает аминокарбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение. Аминокарбонилметильная группа является предпочтительной аминокарбонилалкильной группой.
Термин "амино(1-4С)алкил" в определении R8,R9-амино(1-4С)алкила обозначает аминоалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "оксикарбонил(1-4С)алкил" в определении R8-оксикарбонил(1-4С)алкила обозначает оксикарбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение. Оксикарбонилметильная группа является предпочтительной оксикарбонилалкильной группой.
Термин "окси(1-4С)алкил" в определении R8-окси(1-4С)алкила обозначает оксиалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "карбонил(1-4С)алкил" в определении R8-карбонил(1-4С)алкила обозначает карбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)арил(1-4С)алкил" обозначает арилалкильную группу, содержащую 7-14 атомов углерода, в которой алкильная группа представляет собой (1-4С)алкильную группу, а арильная группа представляет собой определенный выше (6-10С)арил. Фенил(1-4С)алкильные группы, такие как бензил, являются предпочтительными арилалкильными группами. (3-9С)гетероарил(1-4С)алкильные группы являются аналогами (6-10С)арил(1-4С)алкильных групп, включающими по меньшей мере один гетероатом, выбранный из N, O и/или S, в которых гетероарильная группа может быть присоединена через атом углерода или через гетероатом, если доступно.
Термин "соединенные в (2-6С)гетероциклоалкильное кольцо" в определении NR8R9, где R8 и R9 вместе с атомом азота, к которому они присоединяются с образованием кольца, обозначает кольцо, содержащее атом азота и максимум 2-6 атомов углерода, причем указанное кольцо может содержать один или более дополнительных гетероатомов, выбранных из N, O и/или S. Примеры таких колец включают азетидин, пирролидин, пиперидин, пиперазин и (тио)морфолин.
Термин "галоген" обозначает фтор, хлор, бром или иод.
Термин "(1-6С)алкилкарбонил" обозначает алкилкарбонильную группу, алкильные группы которой содержат 1-6 атомов углерода и имеют указанное выше значение. Предпочтительны (1-4С)алкилкарбонильные группы.
Термин "(1-4С)алкилкарбониламино(1-4С)алкил" обозначает алкилкарбониламиноалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)арил(1-4С)алкокси" обозначает арильную группу, содержащую 6-10 атомов углерода, определенную выше, которая присоединена к (1-4С)алкоксигруппе, определенной ранее. (3-9С)гетероарил(1-4С)алкоксигруппы являются аналогами (6-10С)арил(1-4С)алкоксигрупп и включают по меньшей мере один гетероатом, выбранный из N, O или S, в которых гетероарильная группа может быть присоединена через атом углерода или через гетероатом, если доступно.
Термин "(1-4С)алкилкарбонилокси" обозначает алкилкарбонилоксигруппу, алкильная группа которой содержит 1-4 атома углерода. Термин (3-6С)циклоалкилкарбонилокси обозначает циклоалкилкарбонилоксигруппу, в которой циклоалкильная группа содержит 3-6 атомов углерода, а циклоалкильная группа имеет указанное выше значение.
Термин "(1-4С)алкоксикарбонил(1-4С)алкилкарбонилокси" обозначает (1-4С)алкоксикарбонильную группу, присоединенную к алкилкарбонилоксигруппе, в которой алкильный фрагмент содержит 1-4 атома углерода, а алкоксигруппа имеет указанное выше значение.
Термин "(1-4С)алкокси(1-4С)алкилкарбонилокси" обозначает алкоксигруппу, содержащую 1-4 атома углерода, присоединенную к алкилкарбонилоксигруппе, содержащей 1-4 атома углерода, в которой алкокси и алкильная группы имеют указанные выше значения.
Термин "(1-4С)алкилкарбониламино" обозначает алкилкарбониламиногруппу, алкильная группа которой содержит 1-4 атома углерода.
Термин "(1-4С)алкоксикарбониламино(1-4С)алкил" обозначает алкоксикарбонильную группу, содержащую 1-4 атома углерода, с указанным выше значением, присоединенную к аминоалкильной группе, в которой алкильная группа содержит 1-4 атома углерода и значение которой указано выше.
Термин "(6-10С)арилкарбонилокси" обозначает арилкарбонилоксигруппу, в которой арильная группа содержит 6-10 атомов углерода. Предпочтительной арилкарбонилоксигруппой является фенилкарбонилоксигруппа. (3-9С)гетероарилкарбонилоксигруппы являются аналогами (6-10С)арилкарбонилоксигрупп, которые включают по меньшей мере один гетероатом, выбранный из N, O или S, и могут присоединяться через атом углерода или гетероатом, если доступно.
Термин "(1-4С)алкилсульфонил" обозначает алкилсульфонильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение.
Термин "(1-6С)алкилсульфонил" обозначает алкилсульфонильную группу, алкильная группа которой содержит 1-6 атомов углерода и имеет указанное выше значение. (1-3С)алкилсульфонильные группы являются предпочтительными.
Термин "(1-4С)алкилсульфонилокси" обозначает алкилсульфонилоксгруппу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение. (1-3С)алкилсульфонилоксигруппы являются предпочтительными.
Термин "(6-10С)арилсульфонилокси" обозначает арилсульфонилоксигруппу, арильная группа которой содержит 6-10 атомов углерода и имеет указанное выше значение. Фенилсульфонилоксигруппа является предпочтительной. (3-9С)гетероарилсульфонилоксигруппы являются аналогами (6-10С)арилсульфонилоксигрупп и включают по меньшей мере один гетероатом, выбранный из N, O или S, которые могут присоединяться через атом углерода или через гетероатом, если доступно.
Термин "(1-4С)(ди)алкилкарбамоил" обозначает (ди)алкилкарбамоильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение.
Термин "(6-10С)(ди)арилкарбамоил" обозначает (ди)арилкарбамоильную группу, арильные фрагменты которой содержат 6-10 атомов углерода и имеют указанные выше значения.
Термин "(2-6С)гетероциклоалкилкарбамоил" обозначает гетероциклоалкилкарбамоильную группу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода и имеет указанное выше значение.
Предпочтительными соединениями согласно настоящему изобретению являются соединения формулы I, в которой Y-X обозначает C(O)-NH, OC(O)-NH или C(O)-O. Более предпочтительными являются соединения, в которых Y-X обозначает C(O)-NH.
Предпочтительными соединениями являются также соединения, в которых R1 обозначает (1-4C)алкилкарбонил, предпочтительно ацетил, и/или R2 и/или R3 и R5 обозначают независимо (1-4С)алкил, более предпочтительно метил.
R6 предпочтительно обозначает объемную группу. Предпочтительными соединениями являются такие соединения, в которых R6 обозначает (6-10С)арил, (3-9С)гетероарил, (6-10С)арил(1-4С)алкил или (3-9С)гетероарил(1-4С)алкил. Наиболее предпочтительными являются соединения, в которых R6 обозначает (6-10С)арил, еще более предпочтительным является фенил. Предпочтительные R7 группы обозначают Н, (1-4С)алкил или (1-4С)алкокси. Наиболее предпочтительными являются Н или (1-4С)алкил и еще более предпочтительным является Н или метил. Наиболее предпочтительными являются соединения, в которых R7 обозначает Н.
В наиболее предпочтительных соединениях согласно настоящему изобретению R1 обозначает (1-4С)алкилкарбонил, R2, R3, R5 обозначают независимо (1-4С)алкил, R4 обозначает фенил и Y-X обозначает C(O)-NH и R7 обозначает Н. Еще более предпочтительными являются соединения, в которых R1 обозначает ацетил, R2, R3, R5 обозначают независимо метил, R4 обозначает фенил и Y-X обозначает C(O)-NH и R7 обозначает Н.
В указанных выше предпочтительных соединениях замещения возможны в соответствии с указаниями, данными в определениях групп. Фенил в R6 может быть, кроме того, замещен как указано в определении R6.
Из настоящего изобретения исключаются следующие соединения: 1-ацетил-6-бензоиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6,8-пентаметилхинолин, 1-ацетил-6-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-(4-хлорфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин и 1-ацетил-4-(4-бромфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин.
Исключенные соединения раскрыты в Ref. Zh., Khim. Abstr. No. 1Zh311, 1972; Khim. Geterosikl. Soedin. 7:795, 1971; Ambinter Screening Collection, order nrs 28020-A0839/0039328 (CAS 310456-97-4) and -A0705/0032919 (CAS 327981-38-4); ChemDiv. Inc. order nr 8005-9747 (CAS360760-14-1); ChemStar Product list, order nr CHS0065413 (CAS 299418-67-0); Asinex Compound Collection, order nr BAS0068990 (CAS 299970-20-0).
Приемлемые способы получения соединений согласно настоящему изобретению приведены ниже.
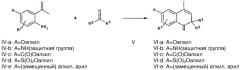
| II-a: A=Оалкил | III-a: A=Oалкил |
| II-b: A=NH(защитная группа) | III-b: A=NH(защитная группа) |
| II-c: A=C(O)Oалкил | III-c: A=C(O)Oалкил |
| II-d: A=S(O)2Oалкил | III-d: A=S(O)2Oалкил |
| II-e: A=(замещенный) алкил, арил | II-e: А=(замещенный) алкил, арил |
Соединения согласно настоящему изобретению, в которых R2 и R3 обозначают метил, могут быть получены из (защищенных) анилинов общей формулы II-a-e, в которой R7 имеет указанное выше значение, с помощью известной реакции Скраупа, которая дает 1,2-дигидро-2,2,4-триметилхинолиновые производные формулы III-a-e.
Аналогичные реакции циклизации Скраупа описаны в литературе: A. Knoevenagel, Chem. Ber. 54:1726, 1921: R.L. Atkins and D.E. Bliss, J. Org. Chem. 43:1975, 1978; J.V. Johnson, B.S. Rauckman, D.P. Baccanari and B. Roth, J. Med. Chem. 32:1942, 1989: W.C. Lin, S.-T. Huang and S.-T. Lin, J. Chin. Chem. Soc. 43:497, 1996: J.P. Edwards, S.J. West, K.B. Marschke, D.E. Mais, M.M. Gottardis and T.K. Jones, J. Med. Chem. 41:303, 1998.
Обычно указанную выше реакцию проводят при повышенной температуре в ацетоне, мезитилоксиде или этилацетоацетате в присутствии иода или протонной кислоты, такой как хлористоводородная кислота, п-толуолсульфоновая кислота или водный раствор хлористого иода. Альтернативно, 1,2-дигидро-2,2,4-триметилхинолины формулы III-a-e могут быть получены посредством реакции соответствующего анилина формулы II-a-e с ацетоном в присутствии MgSO4, 4-трет-бутилкатехола и иода (L.G. Hamann, R.I. Higuchi, L. Zhi, J.P. Edwards and X.-N. Wang, J. Med. Chem. 41:623, 1998). Исходный материал может быть получен либо непосредственно из коммерческих источников, либо посредством замещения ароматического кольца известными приемами, как, например, описано в литературе (H. Cerfontain, Y. Zou and B.H. Bakker, Recl. Trav. Chim. Pays-Bas, 113:403, 1994; A. Coppock, J. Org. Chem. 22:325, 1957; M. Schlosser, J.H. Choi and Takagishi, Tetrahedron, 46:5633, 1990).
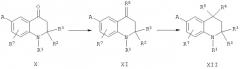
Альтернативно, соединения общей формулы VI-a-e, в которой R2 и R3 обозначают (2-4C)алкил и R7 определен выше, могут быть синтезированы путем циклизации анилина формулы IV-a-e с соответствующим кетоном формулы V.
Указанную выше реакцию проводят обычно в инертном растворителе, таком как толуол, при повышенной температуре с использованием протонной кислоты или кислоты Льюиса, такой как, но не ограничиваясь, п-толуолсульфоновая кислота или трифторид бора, для ускорения циклизации (H. Walter, H. Sauter and T. Winkler, Helv. Chim. Acta, 75:1274, 1992; H. Walter, Helv. Chim. Acta, 77:608, 1994; H. Walter and J. Schneider, Heterocycles, 41:1251, 1995; J.P. Edwards, J.D. Ringgenberg and T.K. Jones, Tetrahedron Lett. 39:5139, 1998).
Требуемые для построения молекулы блоки формулы IV-a-e могут быть получены по реакции Виттига кетонов формулы VII-a-e. Введение заместителей А в ароматическое кольцо может быть осуществлено с использованием известных реакций замещения ароматического кольца либо на стадии анилина, либо на стадии 1,2-дигидро-2,2,4-триметилхинолина, как указывалось выше для соединений формулы II.
Кроме того, соединения общей формулы VI-a-e, в которой R2 = R3 = Н, могут быть получены из анилинов общей формулы II-a-e посредством реакции с 1-метилстиролом и формальдегидом в ацетонитриле при температуре окружающей среды или при повышенной температуре. Аналогичные реакции циклизации описаны в литературе: J.M. Mellor and G.D. Merriman, Tetrahedron, 51:6115, 1995.
Последующее 1-N-ацилирование или 1-N-сульфонилирование соединений формулы VI, в которой R2, R3 R7 и А определены выше, может быть проведено в стандартных условиях, известных специалистам в данной области. В типичном эксперименте соединения формулы VI подвергают взаимодействию в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или пиридин, с ацилгалогенидом или ангидридом кислоты или сульфонилхлоридом в присутствии основания, такого как, но не ограничиваясь, N,N-диизопропилэтиламин, триэтиламин, пиперидин или гидрид натрия, с получением N-ацилированнного или N-сульфонилированного 1,2-дигидро-4-метилхинолинового производного формул VIII-a и VIII-b, соответственно.
Аналогичные реакции N-ацилирования дигидрохинолинового скелета описаны в литературе: Zh. V. Shmyreva, Kh. S. Shikhaliev and E.B. Shpanig, Izv. Vyssh. Uchebn. Zaved. Khim. Tekhnol. 31:45, 1988; Zh. V. Shmyreva, Kh. S. Shikhaliev, L.P. Zalukaev, Y.A. Ivanov, Y.S. Ryabokobylko and I.E. Pokrovskaya, Zh. Obshch. Khim. 59:1391, 1989.
1-N-формилирование может быть легко проведено посредством реакции дигидрохинолина формулы VI с муравьиной кислотой в присутствии трифторуксусной кислоты при повышенной температуре (см., например, P. Bouyssou, C. Le Goff and J. Chenault, J. Heterocycl. Chem. 29:895, 1992) или с этиловым эфиром муравьиной кислоты в присутствии ацетата натрия, как описано в литературе (например, N. Atanes, S. Perez, E. Guitan, L. Castedo and J.M. Saa, Tetrahedron, 50:11257, 1994).
Введение требуемой фенильной группы в положении 4 дигидрохинолинового скелета может быть осуществлено посредством реакции алкилирования Фриделя-Крафтса (замещенных) производных бензола соединениями общей формулы VIII, в которой R1, R2, R3, R7 и А определены ранее.
Последнюю реакцию обычно проводят при повышенной температуре либо в чистом (замещенном) бензоле, либо в соответствующем инертном растворителе, таком как гептан или гексан, с использованием в качестве реагента (замещенного) бензола, катализируемую кислотой Льюиса (например, AlCl3, AlBr3, FeCl3 или SnCl4). Алкилирование по реакции Фриделя-Крафтса с использованием 1,2-дигидро-2,2,4-триметилхинолина описано в литературе (B.A. Lugovik, L.G. Yudin and A.N. Kost, Dokl. Akad. Nauk. SSSR, 170:340, 1966; B.A. Lugovik, L.G. Yudin, S.M. Vinogradova and A.N. Kost, Khim. Geterosikl. Soedin. 7:795, 1971).
Соединения согласно настоящему изобретению, описываемые формулой XII, в которых R5 Me и R1, R2, R3, R4, R7 и А определены ранее, могут быть синтезированы из тетрагидрохинолиновых кетонов формулы X. Так, реакция Виттига кетонов формулы X с соответствующим реагентом Виттига дает ненасыщенное производное формулы XI, которое, в свою очередь, является исходным материалом для алкилирования по реакции Фриделя-Крафтса (замещенного) бензола в указанном выше способе получения соединений общей формулы IX.
Указанная выше реакция Виттига известна специалистам в данной области.
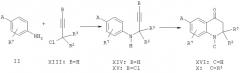
Требуемый кетон формулы X может быть получен посредством реакции анилина формулы II с 3-хлор-3-метил-1-бутином (XIII) в смеси диэтиловый эфир/вода в присутствии порошка меди и триэтиламина с получением алкина формулы XIV. Водородгалогеновый обмен может осуществляться путем депротонирования соединения формулы XIV в инертном растворителе, таком как тетрагидрофуран, с использованием н-бутиллития при температуре ниже -50°С при добавлении п-толуолсульфонилхлорида с получением хлорида общей формулы XV. И, наконец, катализируемая кислотой циклизация (например, серной кислотой) может быть осуществлена при повышенной температуре в растворителе, таком как полиэтиленгликоль, с получением соединений формулы XVI, которые могут быть ацилированы или сульфонилированы, как было описано выше для производных общей формулы VI.
Указанная выше последовательность реакций описана в литературе (P. Barmettler and H.-J. Hansen, Helv. Chim. Acta, 73:1515, 1990 (и содержащиеся в работе ссылки)).
Функционализация положения 6 в тетрагидрохинолинах общей формулы XII может быть осуществлена по известным процедурам снятия защиты-сопряжения:
Соединения согласно настоящему изобретению, в которых Х = О и Y = C(O), S(O)2, NHC(O), NHC(S), OC(O) или связь и которые описываются формулой I-a, могут быть получены из тетрагидрохинолина, содержащего 6-метокси, формулы XII-a. Реакция деметилирования известна специалистам в данной области.
В типичном эксперименте деметилирование осуществляют посредством реакции соединения формулы XII-а с BBr3 в инертном растворителе, таком как, но не ограничиваясь, дихлорметан или тетрагидрофуран, при низкой температуре с получением соединений со снятой защитой общей формулы XVII. Альтернативно, деметилирование может быть достигнуто при проведении реакции соединений формулы XII-a с комплексом BF3 .Me2S при температуре окружающей среды в инертном растворителе, как указывалось для деметилирования с использованием BBr3.
Способы последующей функционализации свободных OH групп в производных формулы XVII также известны специалистам в данной области и могут быть легко осуществлены с использованием реактивов формулы XVIII-a-g.
В случае галогенсодержащих реактивов формулы XVIII указанную выше реакцию проводят обычно при комнатной температуре в подходящем растворителе, например, в апротонном растворителе, таком как N,N-диметилформамид, дихлорметан или тетрагидрофуран, в присутствии основания, такого как, не ограничиваясь приведенными ниже, N,N-диизопропилэтиламин или гидрид натрия. Для ускорения последней реакции могут быть введены добавки, такие как N,N-диметиламинопиридин или иодид тетрабутиламмония. Кроме того, использование изоцианатов или изотиоцианатов формулы XVIII-d и XVIII-e в инертном растворителе при температуре окружающей среды или при повышенной температуре приводит к получению соединений формулы I-а, в которой Y = NHC(O) или NHC(S) соответственно.
Соединения, в которых Y = C(O), могут быть также получены альтернативным способом с использованием карбоновых кислот общей формулы XVIII-b и с помощью связующего реагента, такого как тетрафторборат О-(бензотриазол)-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или гексафторфосфат бромтрипирролидинофосфония (PyBrOP) и третичное основание, например, N,N-диизопропилэтиламин, в растворителе, таком как N,N-диметилформамид или дихлорметан, при температуре окружающей среды или при повышенной температуре.
Соединения, описываемые формулой I-b-c, в которой W = R8,R9N или R8O, соответственно, могут быть синтезированы посредством взаимодействия соединений общей формулы XVII с хлорангидридом формулы XIX в стандартных условиях.
Альтернативно, соединения формулы I-b-c могут быть получены из производных формулы XVII и хлорангидрида формулы XIX, в которых W = OEt, с омылением щелочью (например, NaOH) и последующей конденсацией свободной карбоновой кислоты либо с аминами общей формулы R8,R9NH, либо со спиртами общей формулы R8OH в присутствии связующего реагента, такого как указанные ранее TBTU, HATU или PyBrOP, и третичного основания, такого как N,N-диизопропилэтиламин.
Соединения формулы I-d-e, в которых V = R8,R9N или R8O, соответственно, могут быть получены путем нуклеофильного замещения галогена, такого как Br, присутствующего в соединениях формулы XXI, аминами общей формулы R8,R9NH или спиртами общей формулы R8OH. В свою очередь, требуемый тетрагидрохинолин формулы XXI может быть синтезирован из соединения формулы XVII и бромацилхлорида общей формулы XX с использованием известных процедур синтеза.
Соединения, описываемые формулой I-f-g, в которых U=(замещенное) гетероароматическое соединение или (замещенный) фенил соответственно могут быть получены посредством реакции сопряжения Сузуки (замещенных) иодбензоильных производных формулы XXII бороновыми кислотами общей формулы XXIII-a-b.
Обычно проводят реакцию иодида формулы XXII с бороновой кислотой формулы XXIII-a-b в смеси растворителей, такой как смесь диметоксиэтан/этанол, с использованием фторида цезия и палладиевого катализатора, такого как палладийтетракистрифенилфосфин или трис(дибензилиденацетон)дипалладий при повышенной температуре в атмосфере азота. Добавление трифенилфосфина может ускорять реакцию и улучшать ее выход. Указанная выше реакция достаточно широко описана в литературе (см., например A. Suzuki, Acc. Chem. Res. 15:178, 1982; N. Miyaura, T. Ishiyama, H. Sasaki, M. Ishikawa, M. Satoh and A. Suzuki, J. Am. Chem. Soc. 111:314, 1989).
Аналогично, соединения, описываемые формулой I-h, в которой X = NH и Y определен выше, могут быть синтезированы с использование способов, описанных выше для соединений общей формулы I-a-g, в которой X = O.
Соединения описываемой формулы I-i-j, в которой X = C(O) или S(O)2 и Y = NH или О соответственно, могут быть получены посредством реакции соответствующих ацил- или сульфонилхлоридов формулы XXV с аминами общей формулы R6NH2 или со спиртами общей формулы R6OH с использованием способа, описанного выше для получения соединений формулы I-a.
Требуемые ацил- или сульфонилхлориды формулы XXV могут быть получены из соответствующих соединений формулы XXIV при обработке, например, POCl3, PCl5, оксалилхлоридом, фосгеном или SOCl2, в растворителях, таких как толуол, ацетонитрил или N,N-диметилформамид, процедуры которой описаны в литературе. (См., например, M. Bonnat, M. Bradley and J.D. Kilburn, Tetrahedron Lett. 37:5409, 1996; J.G. Montana, G.M. Buckley, N. Cooper, H.J. Dyke and L. Gowers, Bioorg. Med. Chem. Lett, 8:2635, 1998; J. Hayler, P.D. Kane, D. LeGrand, F. Lugrin, K. Menear, R. Price, M. Allen, X. Cockcroft, J. Ambler, K. Butler and K. Durren, Bioorg. Med. Chem. Lett. 10:1567, 2000).
Альтернативно, соединения формулы XXIV, в которой X = C(O), могут использоваться непосредственно в качестве исходных материалов для получения производных формулы I-I-j с использованием связующих реагентов, как указано выше.
В случае соединений, описываемых формулой I-k-p, в которой X=C(O) или S(O)2 и Y=NH или О и n=1-4, могут использоваться известные процедуры синтеза.
Таким образом, получение тетрагидрохинолинов формулы I-k-l может быть осуществлено при конденсировании амина или спирта, описываемых формулой XXVI (Y = NH или O соответственно) с хлоридами общей формулы XXV в стандартных условиях. В аналогичном случае для получения соединений формулы I-m-n могут использоваться амины или спирты формулы XXVII. И, наконец, использование указанных ранее бороновых кислот формулы XXIII ведет к получению соединений формулы I-o-p посредством указанной выше реакции сопряжения Сузуки.
Соединения согласно настоящему изобретению, в которых X-Y обозначает связь и которые описываются формулой I-q, могут быть приобретены непосредственно из коммерческих источников или из легко получаемых анилинов формулы XXVIII с помощью последовательности реакций Скраупа, ацилирования и алкилирования Фриделя-Крафтса.
В аналогичном случае соединения, описываемые формулой I-r, в которой X-Y обозначает связь и U=(замещенное) гетероароматическое соединение или (замещенный) фенил, могут быт