Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные композиции
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Вакцинная композиция содержит гликозид сапонина, стерин и антиген, где указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл. Указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав. Вакцина содержит гликозид сапонина и стерин при количественном весовом соотношении сапонина к стерину от 1:100 до 5:1. Указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью. Вакцина дополнительно содержит иммунологически эффективное количество антигена. Указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав. Адъювантная композиция «масло в воде» содержит Quil А и холестерин при количественном весовом отношении сапонина к стерину от 1:100 до 5:1 в приемлемом в ветеринарии носителе. Указанные Quil А и холестерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью, где масло представлет собой неметаболизируемое масло. Причем указанные спиралевидные мицеллы микрофлюидизированы с приемлемым в ветеринарии носителе с образованием субмикронной эмульсии «масло в воде». Способ получения вакцины включает: a) получение композиции антигена в буфере; b) добавление сапонина к композиции со стадии а) и c) добавление стерина в спирте к композиции со стадии b). Это изобретение относится к субмикронным эмульсиям типа "масло в воде", приемлемым в качестве адъюванта вакцины для повышения иммуногенности антигенов. Также настоящее изобретение относится к композициям вакцин, содержащим антиген, комбинированный непосредственно в составе такой эмульсии или отдельно. Также настоящее изобретение относится к способам получения эмульсий и вакцин. 4 н. и 8 з.п. ф-лы, 17 табл., 12 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение относится, в основном, к области вакцин и, в частности, к препаратам адъювантов для повышения иммунного ответа у животных в ветеринарии. В частности, это изобретение относится к использованию субмикронных эмульсий типа "масло в воде" в качестве вакцинного адъюванта для увеличения иммуногенности антигенов. Настоящее изобретение относится к препаратам субмикронной эмульсии типа "масло в воде", вакцинным композициям, содержащим включенный в состав таких эмульсий антиген, а также к способам получения эмульсий и вакцин. Также настоящее изобретение относится к композициям, содержащим комплексы, образованные пригодными для использования в вакцинах гликозидом сапонина и стерином.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Бактериальные, вирусные, паразитарные и микоплазменные инфекции часто встречаются у животных, таких как крупный рогатый скот, свиньи и животные-компаньоны. Заболевания, вызванные этими инфекционными агентами, часто не поддаются противомикробной фармацевтической терапии, что не оставляет эффективных способов лечения. Таким образом, подходы вакцинологии все более широко используются для контроля инфекционного заболевания у животных в ветеринарии. Для использования в вакцине можно сделать пригодным цельный инфекционный патоген после химической инактивации или соответствующей генетической манипуляции. Альтернативно, для использования в вакцинном препарате можно экспрессировать белковую субчастицу патогена в рекомбинантной экспрессирующей системе и очистить.
К адъюванту обычно относится любое вещество, усиливающее гуморальный и/или клеточный иммунный ответ на антиген. Традиционные вакцины состоят из неочищенного препарата убитых патогенных микроорганизмов, и примеси, ассоциированные с культурами патогенных микроорганизмов, могут действовать в качестве адъюванта для повышения иммунного ответа. Однако когда гомогенные препараты патогенных микроорганизмов или очищенных белковых субчастиц используют в качестве антигенов для вакцинации, иммунитет, вызванный такими антигенами, является недостаточным, и поэтому добавление определенных экзогенных веществ в качестве адъюванта становится необходимым. Кроме того, производство синтетических вакцин и вакцин из субчастиц является дорогостоящим. Следовательно, с помощью адъювантов для стимуляции иммунного ответа могут требоваться меньшие дозы антигена, таким образом снижается стоимость производства вакцин.
Известно, что к усилению иммунного ответа приводит ряд различных способов действия адъювантов. Большое количество адъювантов модифицируют систему цитокинов, ассоциированных с иммунным ответом. Такие иммуномодулирующие адъюванты могут оказывать свое действие, даже если они находятся не совместно с антигенами. Как правило, иммуномодулирующие адъюванты вызывают общую позитивную регуляцию определенных цитокинов и сопутствующую негативную регуляцию других, приводя к клеточному Th1 и/или гуморальному Th2 ответу.
Некоторые адъюванты обладают способностью поддерживать конформационную целостность антигена, так что антигены могут эффективно презентироваться соответствующим иммунным эффекторным клеткам. В результате поддержания конформации антигена составом адъюванта вакцина может обладать увеличенным сроком хранения, как это показано для иммуностимулирующих комплексов (ISCOM). Ozel M., et. al.; Quarternary Structure of the Immunestimmulating Complex (Iscom), J. of Ultrastruc. and Molec. Struc. Res. 102, 240-248 (1989).
Некоторые адъюванты обладают способностью задерживать антиген в виде депо в области инъекции. В результате этого депо-эффекта антиген не выводится быстро посредством печеночного клиренса. Соли алюминия и эмульсии типа "вода в масле" действуют посредством этого депо-эффекта более кратковременно. Например, можно получить долговременные депо, используя полный адъювант Фрейнда (FCA), который представляет собой эмульсию типа "вода в масле". Как правило, FCA сохраняется в области инъекции до тех пор, пока биологическая деградация не обеспечит удаление антигена антиген-представляющими клетками.
На основании физической природы адъюванты можно разделить на две очень широкие группы, а именно дисперсные адъюванты и недисперсные адъюванты. Дисперсные адъюванты существуют в виде микрочастиц. Иммуноген способен либо встраиваться внутрь, либо ассоциировать с микрочастицами. Соли алюминия, эмульсии типа "вода в масле", эмульсии типа "масло в воде", иммуностимулирующие комплексы, липосомы, нано- и микрочастицы являются примерами дисперсных адъювантов. Недисперсные адъюванты, как правило, представляют собой иммуномодуляторы, и их, как правило, используют в сочетании с дисперсными адъювантами. Мурамилдипептид (обладающий адъювантной активностью компонент пептидогликана, экстрагированный из микобактерий), неионные блок-сополимеры, сапонины (комплексная смесь тритерпеноидов, экстрагированная из коры дерева Quillaja saponaria), липид А (дисахарид глюкозамина с двумя фосфатными группами и пятью или шестью цепями жирных кислот, как правило, длиной от C12 до C16), цитокины, углеводные полимеры, производные полисахаридов и бактериальные токсины, такие как холерный токсин и лабильный токсин (LT) E. coli, являются примерами недисперсных адъювантов.
Некоторые из общеизвестных адъювантов представляют собой сочетание недисперсных иммуномодуляторов и дисперсных веществ, которые могут придавать депо-эффект составу адъюванта. Например, FCA сочетает в себе иммуномодулирующие свойства компонентов Mycobacterium tuberculosis, а также кратковременный депо-эффект масляных эмульсий.
Масляные эмульсии в течение длительного времени использовали в качестве вакцинного адъюванта. Le Moignic и Pinoy в 1916 году обнаружили, что суспензия убитых Salmonella typhimurium в минеральном масле усиливает иммунный ответ. Затем в 1925 году Ramon описал масло на основе крахмала в качестве одного из веществ, усиливающих антитоксический ответ на дифтерийный анатоксин. Однако масляные эмульсии не были распространены до 1937 года, когда появился состав адъюванта Фрейнда, известный в настоящее время как полный адъювант Фрейнда (FCA). FCA представляет собой эмульсию типа "вода в масле", состоящую из минерального (парафинового) масла, смешанного с убитыми микобактериями и Arlacel A. Arlacel A представляет собой, главным образом, моноолеат маннида и используется в качестве эмульгирующего вещества. Несмотря на то, что FCA является превосходным в отношении стимуляции образования антител, он вызывает сильную боль, образование абсцесса, лихорадку и гранулематозное воспаление. Чтобы избежать этих нежелательных побочных реакций, был разработан неполный адъювант Фрейнда (IFA). IFA сходен с FCA по составу, за исключением отсутствия микобактериальных компонентов. IFA действует посредством депонирования состава в области инъекции и медленного высвобождения антигена со стимуляцией антител-продуцирующих клеток.
Другой подход для улучшения FCA основан на том, что замена минерального масла биологически совместимым маслом может способствовать устранению реакций, ассоциированных с FCA в области инъекции. Также считалось, что эмульсия должна быть эмульсией типа "масло в воде", а не "вода в масле", так как последняя создает долговременное депо в области инъекции. Hilleman et al. описали адъювант на основе масла "адъювант 65", состоящий на 86% из арахисового масла, на 10% из Arlacel A в качестве эмульгатора и на 4% из моностеарата алюминия в качестве стабилизатора. Hilleman, 1966, Prog. Med. Virol. 8: 131-182; Hilleman and Beale, 1983, in New Approaches to Vaccine Development (Eds. Bell, R. and Torrigiani, G.), Schwabe, Basel. Адъювант 65 был безопасным и эффективным для человека, но проявлял меньшие адъювантные свойства, чем IFA. Тем не менее, использование адъюванта 65 было прекращено вследствие реактогенности у человека определенного количества вакцин и снижения адъювантных свойств, если вместо Arlacel A использовали очищенный или синтетический эмульгатор. В патентах США 5718904 и 5690942 показано, что в целях улучшения профиля безопасности минеральное масло в эмульсии типа "масло в воде" можно заменять метаболизирующимся маслом.
Кроме адъювантных свойств и безопасности, также существенное коммерческое значение имеют физические свойства эмульсии. Физические свойства эмульсии зависят от стабильности эмульсии. Расслоение, образование осадка и коалесценция являются показателями нестабильности эмульсии. Расслоение происходит, если масляная и водная фазы эмульсии имеют различный удельный вес. Расслоение также происходит, если первоначальный размер капель эмульсии большой и эмульсионные капли не осуществляют какого-либо броуновского движения. Если размер капель большой, то существует тенденция к межфазному распределению и капли сливаются в крупные частицы. Стабильность эмульсии определяется рядом факторов, таких как тип и количество используемых эмульгаторов, величина размера капель в эмульсии и различие по плотности между масляной и водной фазами.
Эмульгаторы обеспечивают стабилизацию дисперсных капель посредством снижения межфазной свободной энергии и создания физических или электростатических барьеров для коалесценции капель. В качестве эмульгаторов можно использовать как неионные, так и ионные детергенты. Неионные эмульгаторы упорядочиваются на границе раздела и создают относительно крупные структуры, которые приводят к пространственному разделению дисперсных капель. Анионные или катионные эмульгаторы приводят к образованию электрического двойного слоя притягивающимися противоионами; силы отталкивания в двойном слое приводят к отталкиванию капель при их сближении.
Кроме использования эмульгаторов, стабильности эмульсии также можно добиться уменьшением размера капель эмульсии механическими способами. Как правило, для получения эмульсий используют пропеллерные мешалки, турбинные роторы, коллоидные мельницы, гомогенизаторы и ультразвуковые устройства. Микрофлюидизация представляет собой еще один способ повышения гомогенности размера капель в эмульсии. Микрофлюидизацией можно получить превосходную физически стабильную эмульсию с постоянным размером капель субмикронного порядка. Кроме повышения стабильности эмульсии, процесс микрофлюидизации позволяет осуществлять терминальную фильтрацию, что является предпочтительным способом обеспечения стерильности конечного продукта. Кроме того, субмикронные масляные частицы могут проникать из области инъекции в лимфатические сосуды, а затем в лимфатические узлы дренажной системы, кровь и селезенку. Это снижает вероятность образования в области инъекции масляного депо, которое может привести к местному воспалению и значительной реакции в области инъекции.
Микрофлюидизаторы в настоящее время являются коммерчески доступными. Образование эмульсии происходит в микрофлюидизаторе при взаимодействии в камере для взаимодействия двух флюидизированных потоков при высоких скоростях. Микрофлюидизатор является пневматическим или азотным и может работать при внутреннем давлении, превышающем 20000 фунт/кв. дюйм. В патенте США 4908154 описано применение микрофлюидизатора для получения эмульсий, по существу свободных от любых эмульгирующих веществ.
В литературе описан ряд составов субмикронных адъювантов типа "масло в воде". В патенте США 5376369 описан состав адъюванта на основе субмикронной эмульсии типа "масло в воде", известный как Syntax Adjuvant Formulation (SAF). SAF содержит сквален или сквалан в качестве масляного компонента, образующее эмульсию количество Pluronic L121 (блок-сополимер полиоксипропилена и полиоксиэтилена) и иммуностимулирующее количество мурамилдипептида. Сквален представляет собой линейный углеводородный предшественник холестерина, обнаруживаемый во многих тканях, особенно в печени акул и других рыб. Сквалан получают гидрогенизацией сквалена, и он является полностью насыщенным. Сквален и сквалан могут метаболизироваться и обладают хорошими данными токсикологических исследований. Эмульсии на основе сквалена или сквалана использовали у человека в вакцинах против злокачественной опухоли с умеренными побочными эффектами и желательной эффективностью. См., например, Anthony C. Allison, 1999, Squalene and Squalane emulsions as adjuvants, Methods 19: 87-93.
В патенте США 6299884 и международной публикации WO 90/14837 описано, что блок-сополимеры полиоксипропилена и полиоксиэтилена не являются необходимыми для состава субмикронной эмульсии типа "масло в воде". Кроме того, в этих документах описано использование нетоксичного метаболизирующегося масла и намеренное исключение использования в составах эмульсий минерального масла и токсичных петролейных дистиллятных масел.
В патенте США 5961970 описана еще одна субмикронная эмульсия типа "масло в воде" для использования в качестве вакцинного адъюванта. В эмульсии, описанной в этом патенте, гидрофобный компонент выбран из группы, состоящей из масла на основе триглицерида средней цепи, растительного масла и их смеси. Поверхностно-активное вещество, включенное в состав этой эмульсии, может представлять собой природное биологически совместимое поверхностно-активное вещество, такое как фосфолипид (например, лецитин), или фармацевтически приемлемое неприродное поверхностно-активное вещество, такое как TWEEN-80. В этом патенте также описано включение антигена в состав эмульсии во время образования эмульсии, в отличие от смешивания антигена с эмульсией после того, как эмульсия самостоятельно и отдельно сформирована.
В патенте США 5084269 описано, что состав адъюванта, содержащий лецитин в сочетании с минеральным маслом, приводит к снижению раздражения у животного-хозяина и одновременно вызывает повышение системного иммунитета. Состав адъюванта, полученный в соответствии с патентом США 5084269, коммерчески используется в ветеринарных вакцинах под товарным наименованием AMPHIGEN®. Состав AMPHIGEN® состоит из мицелл - масляных капель, окруженных лецитином. Эти мицеллы позволяют добиться связывания большего количества цельных клеточных антигенов, чем традиционные адъюванты на основе масла. Кроме того, вакцинные препараты на основе AMPHIGEN® содержат пониженное содержание масла, составляющее от 2,5 до 5% минерального масла, по сравнению с другими вакцинными препаратами, содержащими масляные адъюванты, которые, как правило, содержат от 10% до 20% масла. Такое низкое содержание масла приводит к тому, что этот вакцинный препарат на основе адъюванта в меньшей степени раздражает ткани в области инъекции, что приводит к уменьшению участка повреждения и к уменьшению сроков до забоя. Кроме того, лецитиновая оболочка, окружающая капли, дополнительно снижает реакции в области инъекции, что приводит к вакцине, которая безопасна и эффективна.
Состав AMPHIGEN® используют в качестве адъюванта в ряде ветеринарных вакцин, и существует необходимость сохранять физические свойства вакцинного продукта в течение коротких или длительных периодов хранения, а также во время разбавления. Кроме того, лиофилизированный антиген смешивают с предварительно изготовленным составом адъюванта непосредственно перед инъекцией. Этот способ не всегда гарантирует, что распределение антигена в эмульсии типа "масло в воде" является равномерным и свойства эмульсии могут быть непригодными. Кроме того, после стояния в гомогенизированной эмульсии можно увидеть разделение фаз. Таким образом, существует необходимость в стабильном составе адъюванта, для которого не показано разделение фаз в течение длительного срока хранения. Один способ для предотвращения разделения фаз представляет собой уменьшение размера капель и повышение гомогенности частиц эмульсии. В то время как процессы микрофлюидизации метаболизирующихся составов эмульсий на основе масла были документированы, микрофлюидизация эмульсий типа "масло в воде", таких как состав AMPHIGEN®, еще не была осуществлена.
В настоящем изобретении микрофлюидизацию использовали для доведения размеров окруженных лецитином капель минерального масла до субмикронного размера. Неожиданно авторами настоящего изобретения было обнаружено, что микрофлюидизация вакцинных препаратов с адъювантами на основе эмульсии типа "масло в воде", содержащими смесь лецитина и масла, не только улучшает физические свойства препаратов, но также усиливает иммунизирующие эффекты препаратов. Также микрофлюидизированные препараты характеризуются улучшенным профилем безопасности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Неожиданно авторами настоящего изобретения было обнаружено, что адъювантную активность и профиль безопасности эмульсий типа "масло в воде" на основе неметаболизирующегося масла можно улучшить посредством микрофлюидизации. Антигены, включенные в состав микрофлюидизированных эмульсий, являются стабильными, даже если антигены включают непосредственно в состав эмульсий перед микрофлюидизацией.
Таким образом, в одном варианте осуществления настоящее изобретение относится к составу субмикронной эмульсии типа "масло в воде", пригодному в качестве адъюванта вакцины. Субмикронные эмульсии типа "масло в воде" по настоящему изобретению состоят из неметаболизирующегося масла, по меньшей мере одного поверхностно-активного вещества и водного компонента, где масло диспергировано в водном компоненте со средним размером масляных капель субмикронного порядка. Предпочтительным неметаболизирующимся маслом является легкое минеральное масло. Предпочтительные поверхностно-активные вещества включают в себя лецитин, TWEEN®-80 и SPAN®-80.
Предпочтительная эмульсия типа "масло в воде", предоставленная в настоящем изобретении, состоит из состава AMPHIGEN®.
Эмульсии типа "масло в воде" по настоящему изобретению могут включать в себя пригодные и желательные дополнительные компоненты, включая консерванты, осмотические средства, биоадгезивные молекулы и иммуностимулирующие молекулы. Предпочтительные иммуностимулирующие молекулы включают в себя, например, Quil A, холестерин, GPI-0100, бромид диметилдиоктадециламмония (DDA).
В другом варианте осуществления настоящее изобретение относится к способам получения субмикронной эмульсии типа "масло в воде". В соответствии с настоящим изобретением различные компоненты эмульсии, включая масло, одно или несколько поверхностно-активных веществ, водный компонент и любой другой компонент, пригодный для использования в эмульсии, смешивают. Смесь подвергают предварительному процессу эмульгирования с получением эмульсии типа "масло в воде", которую затем пропускают через микрофлюидизатор с получением эмульсии типа "масло в воде" с диаметром капель менее 1 микрона, предпочтительно со средним размером капель менее 0,5 микрон.
В еще одном варианте осуществления настоящее изобретение относится к вакцинным композициям, которые содержат антиген и субмикронную эмульсию типа "масло в воде", описанную выше. Антиген включают как непосредственно в состав эмульсии, так и отдельно, предпочтительно непосредственно в состав эмульсии. Антиген, который может быть включен в состав вакцинных композиций по настоящему изобретению, может представлять собой бактериальный, грибковый или вирусный антиген или их комбинацию. Антиген может находиться в форме инактивированного цельного или частичного клеточного или вирусного препарата или в форме антигенных молекул, полученных обычными способами очистки белка, способами генетической инженерии или химическим синтезом.
В следующем варианте осуществления настоящее изобретение относится к способам получения вакцинных композиций, содержащих антиген или антигены, комбинированные с субмикронной эмульсией типа "масло в воде".
Для получения вакцинных композиций по настоящему изобретению антиген(ы) можно комбинировать с компонентами эмульсии типа "масло в воде" либо непосредственно (например перед микрофлюидизацией), либо отдельно (например после микрофлюидизации). Предпочтительно антиген комбинируют непосредственно с компонентами эмульсии типа "масло в воде".
В еще одном варианте осуществления настоящее изобретение относится к вакцинным композициям, которые содержат микроинкапсулированный антиген и субмикронную эмульсию типа "масло в воде", описанную выше, где микроинкапсулированный антиген комбинируют с эмульсией отдельно.
Также было неожиданно обнаружено, что при комбинировании в растворе сапонин и стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл. В соответствии с настоящим изобретением эти спиралевидные комплексы мицелл обладают иммуностимулирующей активностью и являются особенно пригодными в качестве адъювантов в вакцинных композициях.
Таким образом, настоящее изобретение относится к вакцинным композициям, содержащим сапонин и стерин, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл. Настоящее изобретение также относится к композициям, содержащим сапонин, стерин и антиген, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл и где антиген смешан со спиралевидными мицеллами, но не включен в состав спиралевидных мицелл.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
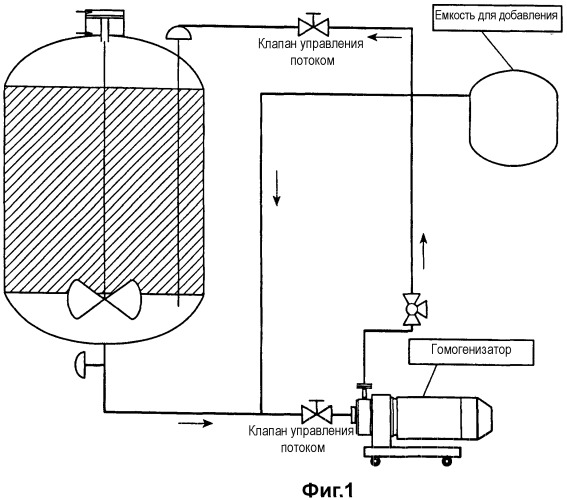
Фигура 1 иллюстрирует процесс серийного получения немикрофлюидизированных вакцинных композиций. В этом процессе различные компоненты вакцины добавляют в емкость для добавления слева, а затем перекачивают в емкость для смешивания, где компоненты смешиваются друг с другом простыми механическими способами.
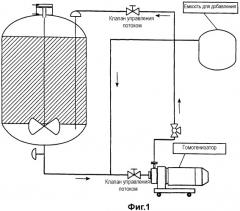
Фигура 2 иллюстрирует процесс получения микрофлюидизированных вакцинных композиций, содержащих антиген, непосредственно включенный в состав вакцины. Различные компоненты вакцин добавляют в емкость для добавления и переносят в отделение для смешивания пре-эмульсии для смешивания простыми механическими способами. Затем эмульсию пропускают через микрофлюидизатор и собирают в постмикрофлюидизационной камере.
Фигура 3 иллюстрирует распределение размеров капель немикрофлюидизированной вакцины на основе состава AMPHIGEN®, микрофлюидизированной вакцины на основе состава AMPHIGEN® и вакцинного препарата, смешанного с помощью настольного смесителя.
Фигура 4 иллюстрирует отсутствие разделения фаз в микрофлюидизированном вакцинном препарате.
Фигура 5 иллюстрирует сравнение стабильности антигенов, включенных непосредственно в состав микрофлюидизированного вакцинного препарата на основе состава AMPHIGEN® (A907505), и трех контрольных немикрофлюидизированных вакцинных препаратов на основе состава AMPHIGEN® (A904369, A904370, и A904371). Все четыре вакцинных препарата хранили при 4°C в течение двух лет. На различных этапах хранения (0, 6, 12 или 24 месяцев) все четыре препарата использовали для вакцинации коров в возрасте трех месяцев. Вакцинацию на 0 и 21 сутки проводили вакциной в дозе 2 мл и через две недели после второй вакцинации осуществляли забор сыворотки. Титр нейтрализующих антител против вируса BVD II типа определяли в каждом образце сыворотки. Данные представлены в виде среднего геометрического значения для 5 животных.
Фигура 6 иллюстрирует среднеквадратичную ректальную температуру у коров до и после введения микрофлюидизированных и немикрофлюидизированных вакцин. T01: группа плацебо - единичная доза; T02: группа плацебо - двойная доза; T03: немикрофлюидизированный состав - единичная доза; T04: немикрофлюидизированный состав - двойная доза; T05: микрофлюидизированный состав - единичная доза; T06: микрофлюидизированный состав - двойная доза.
Фигура 7 иллюстрирует среднеквадратичный размер реакции в области инъекции, наблюдаемой у коров после введения немикрофлюидизированных и микрофлюидизированных вакцинных составов. T03: немикрофлюидизированный состав - единичная доза; T04: немикрофлюидизированный состав - двойная доза; T05: микрофлюидизированный состав - единичная доза; T06: микрофлюидизированный состав - двойная доза.
Фигура 8 иллюстрирует среднее геометрическое значение титров IgG против рекомбинантного антигена PauA из Streptococcus uberis после вакцинации различными вакцинными составами, содержащими как рекомбинантный антиген PauA, так и цельный клеточный антиген E. coli.
Фигура 9 иллюстрирует среднее геометрическое значение титров IgG против цельного клеточного антигена E. coli из Streptococcus uberis после вакцинации различными вакцинными составами, содержащими как рекомбинантный антиген PauA, так и цельный клеточный антиген E. coli.
Фигуры 10A и 10B иллюстрируют распределение размеров частиц микрофлюидизированного состава Amphigen первоначально после изготовления (фигура 10A) и через 22 месяца после изготовления (фигура 10B).
Фигура 11 представляет собой электронно-микроскопическую фотографию, иллюстрирующую формирование спиралевидных мицелл с мицеллами Quil A и кристаллами холестерина.
Фигура 12 представляет собой электронно-микроскопическую фотографию, иллюстрирующую спиралевидные иммуногенные комплексы, образованные Quil A и холестерином на поверхности антигена BVD I типа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения неожиданно было обнаружено, что микрофлюидизация вакцинных препаратов с адъювантом в виде эмульсии типа "масло в воде", содержащей смесь лецитина и минерального масла, не только улучшает физические свойства вакцинного препарата, но также усиливает иммунизирующие эффекты вакцинного препарата. Также микрофлюидизированные вакцинные препараты характеризуются улучшенным профилем безопасности.
На основании этих открытий настоящее изобретение относится к субмикронным эмульсиям типа "масло в воде", пригодным в качестве адъюванта в вакцинных композициях. Также предлагаются способы получения таких субмикронных эмульсий типа "масло в воде" с применением микрофлюидизатора. Кроме того, настоящее изобретение относится к субмикронным вакцинным композициям, в которых антиген комбинирован с субмикронной эмульсией типа "масло в воде". Также предлагаются способы получения таких вакцинных композиций. Кроме того, настоящее изобретение относится к вакцинным композициям, содержащим микроинкапсулированные антигены, комбинированные с субмикронной эмульсией типа "масло в воде" и способам получения таких вакцин.
Для ясности описания, но не для ограничения, подробное описание настоящего изобретения разделено на следующие подразделы, в которых описаны или проиллюстрированы определенные характеристики, варианты осуществления или применения настоящего изобретения.
Субмикронные эмульсии типа "масло в воде"
В одном варианте осуществления настоящее изобретение относится к составам субмикронной эмульсии типа "масло в воде", пригодным в качестве адъюванта вакцины. Субмикронные эмульсии типа "масло в воде" по настоящему изобретению повышают иммуногенность антигенов в вакцинных композициях, являются безопасными для введения животным и стабильными при хранении.
Субмикронные эмульсии типа "масло в воде" по настоящему изобретению содержат неметаболизирующееся масло, по меньшей мере одно поверхностно-активное вещество и водный компонент, где масло диспергировано в водном компоненте со средним размером масляных капель субмикронного порядка.
Под термином "субмикронный" подразумевают, что размер капель составляет менее 1 мкм (микрона) и средняя величина или среднее значение размера масляных капель составляет менее 1 мкм. Предпочтительно средний размер капель эмульсии составляет менее 0,8 мкм; более предпочтительно менее 0,5 мкм и еще более предпочтительно менее 0,4 мкм или приблизительно 0,1-0,3 мкм.
Термин "средний размер капель" определяется как размер частиц среднего диаметра по объему (VMD) в пределах объемного распределения размеров частиц. VMD вычисляют умножением диаметра каждой частицы на объем всех частиц этого объема выборки и суммированием. Затем это значение делят на общий объем всех частиц.
В рамках изобретения термин "неметаболизирующееся масло" относится к маслам, которые не могут метаболизироваться в организме животного субъекта, которому вводят эмульсию.
В рамках изобретения термины "животное" и "животный субъект" относятся ко всем не относящимся к человеку животным, включая, например, крупный рогатый скот, овец и свиней.
Неметаболизирующиеся масла, приемлемые для использования в эмульсиях по настоящему изобретению, включают в себя алканы, алкены, алкины и соответствующие им кислоты и спирты, их простые и сложные эфиры и их смеси. Предпочтительно отдельные структуры масел представляют собой легкие углеводородные соединения, т.е. такие компоненты имеют от 6 до 30 атомов углерода. Масло можно получить синтетически или очисткой нефтяных продуктов. Предпочтительные для использования в эмульсиях по настоящему изобретению неметаболизирующиеся масла включают в себя, например, минеральное масло, парафиновое масло, циклопарафины.
Термин "минеральное масло" относится к смеси жидких углеводородов, полученных из вазелина способами дистилляции. Термин является синонимом терминам "жидкий парафин", "жидкий вазелин" и "белое минеральное масло". Термин также подразумевает включение термина "легкое минеральное масло", т.е. масло, которое аналогично получено дистилляцией вазелинового масла, но которое обладает более низким удельным весом, чем белое минеральное масло. См., например, Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pa.: Mack Publishing Company, 1990, стр. 788 и 1323). Минеральное масло можно получать из различных коммерческих источников, например, J.T. Baker (Phillipsburg, PA), USB Corporation (Cleveland, OH). Предпочтительное минеральное масло представляет собой легкое минеральное масло, коммерчески доступное под названием DRAKEOL®.
Как правило, масляный компонент субмикронных эмульсий по настоящему изобретению представлен в количестве от 1% до 50% по объему; предпочтительно в количестве от 10% до 45%; более предпочтительно в количестве от 20% до 40%.
Эмульсии типа "масло в воде" по настоящему изобретению, как правило, включают в себя по меньшей мере одно (т.е. одно или несколько) поверхностно-активное вещество. Поверхностно-активные вещества и эмульгаторы - термины, которые используются здесь взаимозаменяемо, - представляют собой вещества, которые стабилизируют поверхность масляных капель и поддерживают масляные капли в пределах желательных размеров.
Поверхностно-активные вещества, пригодные для использования в настоящих эмульсиях, включают в себя природные биологически совместимые поверхностно-активные вещества и неприродные синтетические поверхностно-активные вещества. Биологически совместимые поверхностно-активные вещества включают в себя фосфолипидные соединения или смесь фосфолипидов. Предпочтительными фосфолипидами являются фосфатидилхолины (лецитин), такие как соевый или яичный лецитин. Лецитин можно получать в виде смеси фосфатидов и триглицеридов промыванием водой неочищенных растительных масел и разделением и высушиванием полученных гидратированных камедей. Очищенный продукт можно получать фракционированием смеси путем промывания ацетоном для получения нерастворимых в ацетоне фосфолипидов и гликолипидов, оставшихся после удаления триглицеридов и растительного масла при промывании ацетоном. Альтернативно, лецитин можно получать из различных коммерческих источников. Другие приемлемые фосфолипиды включают в себя фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидную кислоту, кардиолипин и фосфатидилэтаноламин. Фосфолипиды можно выделять из природных источников или синтезировать обычными способами.
Неприродные синтетические поверхностно-активные вещества, пригодные для применения в субмикронных эмульсиях по настоящему изобретению, включают в себя неионные поверхностно-активные вещества на основе сорбитана, например замещенные жирными кислотами сорбитановые поверхностно-активные вещества (коммерчески доступные под названием SPAN® или ARLACEL®), сложные эфиры жирной кислоты и полиэтоксилированного сорбита (TWEEN®), сложные эфиры полиэтиленгликоля и жирных кислот из источников, таких как касторовое масло (EMULFOR); полиэтоксилированные жирные кислоты (например, стеариновая кислота, доступная под названием SIMULSOL M-53), сополимер полиэтоксилированного изооктилфенола и формальдегида (TYLOXAPOL), полиоксиэтиленовый эфир жирного спирта (BRIJ®); нонилфениловые эфиры полиоксиэтилена (TRITON® N), изооктилфениловые эфиры полиоксиэтилена (TRITON® X). Предпочтительные синтетические поверхностно-активные вещества представляют собой поверхностно-активные вещества, доступные под названием SPAN® и TWEEN®.
Предпочтительные поверхностно-активные вещества для использования в эмульсии типа "масло в воде" по настоящему изобретению включают в себя лецитин, TWEEN-80 и SPAN-80.
В общем, поверхностно-активное вещество или комбинация поверхностно-активных веществ, если используется два или более поверхностно-активных вещества, представлены в эмульсии в количестве от 0,01% до 10% по объему, предпочтительно от 0,1% до 6,0%, более предпочтительно от 0,2% до 5,0%.
Водный компонент содержит дисперсионную фазу эмульсии и может представлять собой воду, забуференный физиологический раствор или любой другой приемлемый водный раствор.
Эмульсии типа "масло в воде" по настоящему изобретению могут включать в себя пригодные и желательные дополнительные компоненты, включая консерванты, осмотические средства, биоадгезивные молекулы и стимулирующие иммунную систему молекулы.
Считается, что биоадгезивные молекулы могут увеличивать доставку и связывание антигенов на намеченные для воздействия поверхности слизистых оболочек или через намеченные для воздействия поверхности слизистых оболочек, обеспечивая слизистым оболочкам иммунитет. Примеры приемлемых биоадгезивных молекул включают в себя кислотные неприродные полимеры, такие как полиакриловая кислота и полиметакриловая кислота (например, CARBOPOL®, CARBOMER); кислотные синтетически модифицированные природные полимеры, такие как карбоксиметилцеллюлоза; нейтральные синтетически модифицированные полимеры, такие как гидроксипропилметилцеллюлоза; основные содержащие аминогруппу полимеры, такие как хитозан; кислотные полимеры, получаемые из природных источников, такие как альгиновая кислота, гиалуроновая кислота, пектин, трагакантовая камедь и камедь карайи; и нейтральные неприродные полимеры, такие как поливиниловый спирт; или их комбинации.
В рамках изобретения термин "стимулирующие иммунную систему молекулы" относится к таким молекулам, которые усиливают защитный иммунный ответ, индуцируемый антигенным компонентом в вакцинных композициях. Приемлемые вещества, стимулирующие иммунную систему, включают в себя компоненты бактериальной клеточной стенки, например производные N-ацетилмурамил-L-аланил-D-изоглутамина, такие как мурабутид, треонил-MDP и мурамилтрипептид; гликозиды сапонина и их производные, например, Quil A, QS 21 и GPI-0100; холестерин и четвертичные аммониевые соединения, например, бромид диметилдиоктадециламмония (DDA) и N,N-диоктадецил-N,N-bis-2-гидроксиэтилпропандиамин ("avridine").
Сапонины представляют собой гликозидные соединения, которые продуцируются в качестве вторичных метаболитов у большого количества видов растений. Химическая структура сапонинов обеспечивает большое разнообразие фармакологических и биологических видов активности, включая какую-либо сильную и эффективную иммунологическую активность.
Структурно сапонины состоят из любого агликона, соединенного с одной или несколькими цепями сахаров. Сапонины можно классифицировать в соответствии с их агликоновым составом: тритерпеновые гликозиды, стероидные гликозиды и стероидные алкалоидные гликозиды.
Сапонин можно выделять из коры Quillaja saponaria. Сапонин давно известен в качестве иммуностимулятора. Dalsgaard, K., "Evaluation of its adjuvant activity with a special reference to the application in the vaccination of cattle against foot-and-mouth disease", Acta. Vet. Scand. 69: 1-40 1978. Неочищенные экстракты растений, содержащие сапонин, увеличивают эффективность вакцин против ящура. Однако при использовании в вакцинах неочищенные экстракты ассоциированы с неблагоприятными побочными эффектами. Впоследствии Dalsgaard частично очистил обладающий адъювантной активностью компонент из сапонина диализом, ионообменной хроматографией и гель-фильтрацией. Dalsgaard, K. et al., "Saponin adjuvants III. Isolation of a substance from Quillaja saponaria Morina with adjuvant activity in foot-and-mouth disease vaccines", Arch. Gesamte. Virusforsch. 44: 243-254, 1974. Обладающий адъювантной активностью компонент, очищенный таким обра