Способы и композиции с использованием иммуномодулирующих соединений для лечения и поддержания состояния при раке и других заболеваниях
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для лечения различных онкологических заболеваний. Предложены фармацевтические композиции в твердой форме, включающие иммуномодулирующее соединение, а именно 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион. Композиции характеризуются многообразными модификациями кристаллической решетки данного иммуномодулирующего соединения. Изобретение позволяет обеспечить стабильность кристаллического состояния содержащегося в фармацевтических композициях иммуномодулятора в процессе изготовления и хранения лекарственных форм наряду с хорошей растворимостью в водной среде. 8 н. и 26 з.п. ф-лы, 2 табл., 1 ил.
Реферат
urn:schemas:contacts1. Область техники, к которой относится изобретение
Данное изобретение относится к способам лечения, профилактики и/или поддержания состояния при специфических видах рака и других заболеваниях, включая, но не ограничиваясь указанным, заболевания, связанные или отличающиеся нежелательным ангиогенезом, включающим введение одного или нескольких иммуномодулирующих соединений по отдельности или в сочетании с другими лекарственными средствами. В частности, изобретение охватывает применение специфических комбинаций или «коктейлей» лекарственных средств и других видов терапии, например, облучения, для лечения таких специфических видов рака, включая те, которые не поддаются лечению с помощью общепринятой терапии. Изобретение также относится к фармацевтическим композициям и режимам дозировки.
2. Уровень техники.
2.1.Патобиология рака и других заболеваний
Рак характеризуется в первую очередь увеличением числа аномальных клеток, образующихся из данной обычной ткани, проникновением данных аномальных клеток в смежные ткани или распространением за счет лимфатического или кровяного перенесения злокачественных клеток в периферические лимфатические узлы и отдаленные места (метастазы). Клинические данные и молекулярные биологические исследования указывают, что рак представляет собой многостадийный процесс, который начинается с минимальных преднеопластических изменений, которые могут при определенных условиях прогрессировать в новообразования. Неопластическое повреждение может клонировано эволюционировать и развивать повышенную способность для проникновения, роста, метастазов и неоднородности, особенно в условиях, в которых неопластические клетки избегают иммунного надзора хозяина. Roitt I., Brosroff J. and Kale D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное множество видов рака, которые подробно описаны в медицинской литературе. Примеры включают рак легкого, толстой кишки, прямой кишки, предстательной железы, молочной железы, мозга и кишечника. Заболеваемость раком продолжает расти с общим возрастом населения, появлением новых видов рака и ростом восприимчивого населения (например, люди, зараженные СПИДом или избыточно подвергавшиеся действию солнечного света). Поэтому существует острая необходимость в новых способах и композициях, которые можно использовать для лечения пациентов, болеющих раком.
Многие типы рака связаны с образованием новых кровеносных сосудов, процессом, известным как ангиогенез. Было выявлено несколько механизмов, вовлеченных в индуцированный опухолью ангиогенез. Наиболее прямой из данных механизмов представляет собой секрецию опухолевыми клетками цитокинов с ангиогенными свойствами. Примеры данных цитокинов включают кислотные и основные факторы роста фибробластов (a,b-FGF), ангиогенин, сосудистый эндотелиальный фактор роста (VEGF) и TNF-α. Альтернативно, опухолевые клетки могут высвобождать ангиогенные пептиды посредством продуцирования протеаз и последующего распада межклеточного матрикса, где хранятся некоторые цитокины (например, b-FGF). Ангиогенез также может быть индуцирован косвенно через увеличение численности воспалительных клеток (особенно макрофагов) и последующее высвобождение ими ангиогенных цитокинов (например, TNF-α, bFGF).
Множество других заболеваний и нарушений также связано или характеризуется нежелательным ангиогенезом. Например, повышенный или нерегулируемый ангиогенез влечет за собой ряд заболеваний и медицинских состояний, включая, но не ограничиваясь указанными, глазные неоваскулярные (связанные с образованием новых сосудов) заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, покраснение радужки (неоваскуляризация угла передней камеры глазного яблока), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, но не ограничиваются указанным: диабетическую ретинопатию; ретинопатию недоношенных; отторжение трансплантата роговицы; неоваскулярную глаукому; ретролентальную фиброплазию; и пролиферативную ретинопатию стекловидного тела.
Соответственно, соединения, которые могут контролировать ангиогенез или ингибировать продуцирование определенных цитокинов, включая TNF-α, могут быть полезными для лечения или профилактики различных заболеваний и состояний.
2.2. Способы лечения рака
В настоящее время лечение рака может включать хирургическое вмешательство, химиотерапию, гормональную терапию и/или лучевую терапию для уничтожения неопластических клеток у пациента (смотри, например, Stockdale, 1998, Medicine, vol.3, Rubenstein and Federman, eds., Chapter 12, Section IV). Недавно терапия рака также смогла включать биологическую терапию или иммунотерапию. Все данные подходы обладают значительными недостатками для пациента. Хирургия, например, может быть противопоказана вследствие состояния здоровья пациента или может быть не приемлема для пациента. Кроме того, при хирургическом вмешательстве неопластическая ткань может быть удалена не полностью. Лучевая терапия эффективна только в том случае, когда непластическая ткань проявляет более высокую чувствительность к облучению по сравнению с обычной тканью. Лучевая терапия также может вызывать серьезные побочные действия. Гормональная терапия редко назначается в качестве единственного агента. Хотя гормональная терапия может быть эффективной, ее часто используют для предотвращения и замедления рецидива рака после того, как большинство раковых клеток было удалено с помощью других методов лечения. Биологическая терапия и иммунотерапия ограничены в своем числе и могут вызывать побочные действия, такие как сыпь или отеки, напоминающие симптомы гриппа, включая лихорадку, озноб и утомление, проблемы желудочного тракта или аллергические реакции.
Что касается химиотерапии, существует множество химиотерапевтических агентов, доступных для лечения рака. Большинство химиотерапевтических противораковых лекарственных средств действует путем ингибирования синтеза ДНК, непосредственно или косвенно, путем ингибирования биосинтеза дезоксирибонуклеотидных трифосфатных предшественников, для предотвращения репликации ДНК и сопутствующего деления клеток. Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed., (McGraw Hill, New York).
Несмотря на доступность множества химиотерапевтических агентов, химиотерапия имеет множество недостатков. Почти все химиотерапевтические агенты являются токсичными, и химиотерапия вызывает заметные и часто опасные побочные действия, включая сильную тошноту, депрессию костного мозга и иммуносупрессию. Кроме того, даже при введении комбинации химиотерапевтических агентов многие опухолевые клетки являются устойчивыми или развивают устойчивость к химиотерапевтическим агентам. Действительно, те клетки, которые устойчивы к определенным химиотерапевтическим агентам, используемым в протоколе лечения, часто оказываются устойчивыми к действию других лекарственных средств, даже если те действуют по механизму, отличающемуся от механизма лекарств, используемых в конкретном лечении. Данное явление упоминается как плейотропное лекарственное средство или мультилекарственная резистентность. Вследствие устойчивости к лекарственным средствам, многие виды рака оказываются не восприимчивыми к стандартным химиотерапевтическим лечебным протоколам.
Другие заболевания или состояния, связанные или отличающиеся нежелательным ангиогенезом также трудно поддаются лечению. Однако некоторые соединения, такие как протамин, гепаин и стероиды, были предложены как полезные при лечении некоторых конкретных заболеваний. Taylor et al., Nature, 297:307 (1982); Folkman et al., Science 221:719 (1983); и патенты США №№ 5001116 и 4994443. Талидомид и некоторые его производные также были предложены для лечения таких заболеваний и состояний. См. патенты США №№ 5593990, 5629327, 5712291, 6071948 и 6114355, выданные D'Amato.
Все еще существует значительная необходимость в безопасных и эффективных способах лечения, профилактики и оказания помощи больному при раке и других заболеваниях и состояниях, особенно при заболеваниях, которые не поддаются лечению стандартными способами, такими как хирургия, лучевая терапия, химиотерапия и гормональная терапия, при снижении или исключении токсичности и/или побочных действий, связанных с обычным лечением.
2.3.IMIDS
Был проведен ряд исследований с целью обнаружения соединений, которые могут безопасно и эффективно использоваться для лечения заболеваний, связанных с аномальным продуцированием TNF-α. См., например, Marriott J.B., et al., Expert Opin.Biol.Ther. 1(4): 1-8 (2001); G.W. Muller et al., Journal of Medicinal Chemistry 39(17): 3238-3240 (1996); и G.W. Muller et al., Bioorganic & Medicinal Chemistry Letters 8: 2669-2674 (1998). Некоторые исследования были сфокусированы на группе соединений, выбранных благодаря их способности эффективно ингибировать продуцирование TNF-α посредством LPS, стимулированных РВМС. L.G.Corral et al., Ann.Rheum. Dis. 58: (Suppl.I) 1107-1113 (1999). Данные соединения, которые упоминаются как ImiDsTM (Celgene Corporation) или иммуномодулирующие лекарственные средства, демонстрируют не только эффективное ингибирование TNF-α, но и заметное ингибирование индуцированного LPS продуцирования моноцитов IL1β и IL12. IL6, индуцированный LPS, также ингибируется иммуномодулирующими соединениями, хотя и частично. Данные соединения являются мощными стимуляторами IL10, индуцированного LPS. Конкретные примеры ImiDsTM включают, но не ограничиваются указанным, замещенные 2-(2,6-диоксопиперидин-3-ил)фталимиды и замещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолы, описанные в патентах США №№ 6281230 и 6316471, оба из которых выданы G.W. Muller et al.
3. Краткое изложение сущности изобретения
Данное изобретение охватывает способы лечения и профилактики некоторых типов рака, включая первичный и метастатический рак, а также виды рака, которые являются трудноизлечимыми или устойчивыми к общепринятому химиотерапевтическому лечению. Способы включают введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства. Изобретение также охватывает способы поддержания состояния пациента при некоторых видах рака (например, предотвращение или продление периода до рецидива, или продление времени ремиссии), которые включают введение пациенту, нуждающемуся в таком поддержании состояния, профилактически эффективного количества иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В определенных способах по изобретению иммуномодулирующее соединение вводят в сочетании с терапией, общепринято используемой для лечения, профилактики или поддержания состояния больного раком. Примеры такой терапии включают, но не ограничиваются указанным, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию.
Данное изобретение охватывает способы лечения, поддержания состояния больного или профилактики заболеваний или нарушений, отличающихся от рака, которые связаны или характеризуются нежелательным ангиогенезом, включающие введение пациенту, нуждающемуся в таком лечении, поддержании состояния или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В других способах лечения иммуномодулирующее соединение вводят в сочетании с терапией, обычно используемой для лечения, профилактики или поддержания состояния больного при заболеваниях или нарушениях, связанных или характеризуемых нежелательным ангиогенезом. Примеры такой терапии включают, но не ограничиваются указанным, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию.
Данное изобретение охватывает фармацевтические композиции, единичные препаративные лекарственные формы, режимы дозировки и наборы, которые включают иммуномодулирующее соединение или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство, и второй дополнительный активный агент. Второй активный агент включает специфические комбинации или «коктейли» лекарственных средств.
Краткое описание чертежа
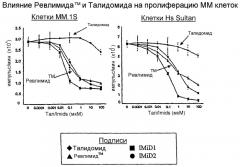
На чертеже показано сравнение влияния 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона (REVLIMIDTM) и талидомида при ингибировании пролиферации клеточной линии множественной миеломы (ММ) при исследовании in vitro. В качестве индикатора пролиферации клеток измеряли поглощение [3H]тимидина клетками различных клеточных линий ММ (MM.1S, Hs Sultan, U266 и RPMI-8226).
Подробное описание изобретения
Первый вариант осуществления изобретения относится к способам лечения, поддержания состояния больного или профилактики рака, включающим введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В конкретных способах лечения, охватываемых данным вариантом осуществления, иммуномодулирующее соединение вводят в сочетании с другим лекарственным средством («второй активный агент») или в сочетании с другим способом лечения, поддержания состояния больного или профилактики рака. Второй активный агент включает небольшие молекулы и большие молекулы (например, белки и антитела), примеры которых приведены в данном описании, а также стволовые клетки. Способы или терапия, которые можно использовать в сочетании с введением иммуномодулирующего соединения, включают, но не ограничиваются указанным, хирургию, переливание крови, иммунотерапию, биологическую терапию, лучевую терапию и другие виды терапии не на основе лекарственных средств, которые используются в настоящее время для лечения, профилактики или поддержания состояния при раке.
Другой вариант осуществления изобретения относится к способам лечения, поддержания состояния больного или профилактики заболеваний или нарушений, отличающихся от рака, которые характеризуются нежелательным ангиогенезом. Данные способы включают введение терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
Примеры заболеваний и нарушений, связанных или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются указанным, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и покраснение радужки (неоваскуляризация угла передней камеры глазного яблока). Конкретные примеры заболеваний и нарушений, связанных или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются указанным, эндометриоз, болезнь Крона, сердечную недостаточность, прогрессирующую сердечную недостаточность, почечную недостаточность, эндотоксемию (наличие в крови эндотоксинов), синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарное нарушение, связанную со злокачественным новообразованием гиперкальцимию, шок, циркуляторный шок, периодонтит, гингивит, рефрактерную анемию и 5q-синдром.
В конкретных способах, охватываемых данным вариантом осуществления, иммуномодулирующее соединение вводят в сочетании со вторым активным агентом или в сочетании со способом лечения, поддержания состояния или профилактики заболевания или состояния. Второй активный агент включает небольшие молекулы и большие молекулы (например, белки и антитела), примеры которых приведены в данном описании, а также стволовые клетки. Способы или терапия, которые можно использовать в сочетании с введением иммуномодулирующего соединения включают, но не ограничиваются указанным, хирургию, переливание крови, иммунотерапию, биологическую терапию, лучевую терапию и другие виды терапии не на основе лекарственных средств, которые используются в настоящее время для лечения, поддержания состояния или профилактики поддержания состояния при заболеваниях или состояниях, связанных или отличающихся нежелательным ангиогенезом.
Данное изобретение также охватывает фармацевтические композиции (например, единичные препаративные лекарственные формы), которые можно использовать в раскрываемых в данном описании способах. Конкретные фармацевтические композиции включают иммуномодулирующее соединение или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство, и второй активный агент.
5.1. Иммуномодулирующие соединения
Соединения по изобретению могут быть либо приобретены коммерчески, либо получены в соответствии со способами, описанными в патентах или патентных публикациях, раскрываемых в данном изобретении. Кроме того, оптически чистые композиции могут быть асимметрически синтезированы или разделены с использованием известных разделяющих реагентов или хиральных колонок, а также с помощью других стандартных методов синтетической органической химии. Соединения, используемые по изобретению, могут включать иммуномодулирующие соединения, которые являются рацемическими, стереомерно обогащенными или стереомерно чистыми, а также их фармацевтически приемлемые соли, сольваты, стереоизомеры, клатраты и пролекарства.
Как использовано в данном описании, если не указано другого, термин «сольваты» включает гидраты соединений по изобретению.
Предпочтительные соединения, используемые в данном изобретении, представляют собой небольшие органические молекулы, имеющие молекулярную массу менее чем примерно 1000 г/моль, и не являются белками, пептидами, олигонуклеотидами, олигосахаридами или другими макромолекулами.
Как использовано в данном описании, и если не указано другого, термины «иммуномодулирующие соединения» и «ImiDsTM» (Celgrene Corporation) относятся к небольшим молекулам, которые в значительной степени ингибируют TNF-α, индуцированные LPS моноциты IL1β и IL12, и частично ингибируют продуцирование IL6. Конкретные иммуномодулирующие соединения обсуждаются ниже.
TNF-α представляет собой воспалительный цитокин, продуцируемый макрофагами и моноцитами во время острого воспаления. TNF-α является ответственным за диапазон разнообразных сигналов внутри клеток. TNF-α может играть патологическую роль при раке. Не ограничиваясь теорией, одно из биологических действий, вызываемых иммуномодулирующими соединениями по изобретению, может заключаться в снижении синтеза TNF-α. Иммуномодулирующие соединения по изобретению усиливают распад мРНК TNF-α.
Кроме того, не ограничиваясь теорией, иммуномодулирующие соединения, используемые в данном изобретении, также могут представлять собой эффективные со-стимуляторы Т-клеток и резко увеличивать пролиферацию клеток доза-зависимым образом. Иммуномодулирующие соединения по изобретению также могут оказывать большее со-стимулирующее действие на CD8+ подтип Т-клеток, чем на CD4+ подтип Т-клеток. Кроме того, соединения предпочтительно обладают противовоспалительными свойствами и рационально со-стимулируют Т клетки.
Конкретные примеры иммуномодулирующих соединений включают, но не ограничиваются указанными, циано- и карбоксильные производные замещенных стиролов, такие как описанные в патенте США 5929117; 1-оксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины и 1,3-диоксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины, такие как описанные в патентах США №№ 5874448 и 5955476; тетразамещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолины, описанные в патенте США 5798368; 1-оксо- и 1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)изоиндолины (например, 4-метильные производные талидомида), включая, но не ограничиваясь указанным, описанные в патентах США №№ 5635517, 6476052, 6555554 и 6403613; 1-оксо- и 1,3-диоксоизоиндолины, замещенные в 4- или 5-положении индолинового кольца (например, 4-(4-амино-1,3-диоксоизоиндолин-2-ил)-4-карбамоилбутановая кислота), описанные в патенте США 6380239; изоиндолин-1-он и изоиндолин-1,3-дион, замещенные во 2-положении 2,6-диоксо-3-гидроксипиперидин-5-илом (например, 2-(2,6-диоксо-3-гидрокси-5-фторпиперидин-5-ил)-4-аминоизоиндолин-1-он), описанные в патенте США № 6458810; класс неполипептидных циклических амидов, описанный в патентах США №№ 5698579 и 5877200; аминоталидомид, а также аналоги, продукты гидролиза, метаболиты, производные и предшественники аминоталидомида и замещенные 2-(2,6-диоксопиперидин-3-ил)фталимиды и замещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолы, такие как описанные в патентах США №№ 6281230 и 6316417; и изоиндол-имидные соединения, такие как описанные в заявке на патент США № 09/972487, поданной 5 октября 2001 г., заявке на патент США № 10/032286, поданной 21 декабря 2001 г., и Международной заявке № РСТ/US01/50401 (Международная публикация № WO 02/059106). Все указанные в данном описании патенты и патентные заявки включены в данное описание во всей полноте путем ссылки. Иммуномодулирующие соединения не включают талидомид.
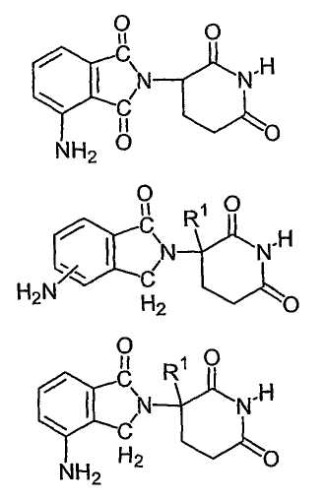
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанным, 1-оксо- и 1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)изоиндолины, замещенные аминогруппой в бензольном кольце, как описано в патенте США 5635517, который включен в данное описание путем ссылки. Данные соединения имеют структуру I:
в которой один из Х и Y представляет собой С=О, другой из Х и Y представляет собой С=О или СН2, и R2 представляет собой водород или низший алкил, в частности метил. Конкретные иммуномодулирующие соединения включают, но не ограничиваются указанным:
1-оксо-2-(2,6-диоксопиперидин-3-ил)-4-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-5-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-6-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-7-аминоизоиндолин;
1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)-4-аминоизоиндолин и
1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)-5-аминоизоиндолин.
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу замещенных 2-(2,6-диоксопиперидин-3-ил)фталимидов и замещенных 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолов, таких как описанные в патентах США №№ 6281230; 6316471; 6335349 и 6476052, и международной патентной заявке № РСТ/US97/13375 (Международная публикация No. WO98/03502), все из которых включены в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
в которой
один из Х и Y представляет собой С=О, другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные из R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензил или галоген;
при условии, что R6 отличается от водорода, если Х и Y представляют собой С=О и (i) каждый из R1, R2, R3 и R4 представляет собой фтор, или (ii) один из R1, R2, R3 и R4 представляет собой амино.
Соединения, являющиеся представителями данного класса, имеют формулы:
где R1 представляет собой водород или метил. В отдельном варианте осуществления изобретение охватывает применение энантиомерно чистых форм (например, оптически чистые (R) или (S) энантиомеры) данных соединений.
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу изоиндол-имидов, описанному в публикациях патентных заявок США №№ US 2003/0096841 и US 2003/0045552 и международной патентной заявке № РСТ/US01/50401 (Международная публикация No. WO 02/059106), каждая из которых включена в данное описание путем ссылки. Иллюстративные соединения имеют формулу II:
и их фармацевтически приемлемые соли, гидраты, сольваты, клатраты, энантиомеры, диастереомеры, рацематы и смеси стереоизомеры, где:
один из Х и Y представляет собой С=О, и другой представляет собой СН2 или С=О;
R1 представляет собой Н, (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, C(O)R3, C(S)R3, C(O)OR4, (C1-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, C(O)NHR3, C(S)NHR3, C(O)NR3R3', C(S)NR3R3' или (C1-C8)алкил-O(CO)R5;
R2 представляет собой Н, F, бензил, (С1-С8)алкил, (С2-С8)алкенил или (С2-С8)алкинил;
R3 и R3' независимо представляют собой (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C0-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5;
R4 представляет собой (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, (C1-C4)алкил-OR5, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил или (С0-С4)алкил-(С2-С5)гетероарил;
R5 представляет собой (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил или (С2-С5)гетероарил;
при каждом появлении R6 независимо представляет собой Н, (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С2-С5)гетероарил или (C0-C8)алкил-С(O)О-R5, или группы R6 могут быть объединены с образованием гетероциклоалкильной группы;
n равно 0 или 1; и
* представляет собой хиральный углеродный центр.
В конкретных соединениях формулы II, если n равно 0, то R1 представляет собой (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, C(O)R3, C(O)OR4, (C1-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, C(S)NHR3 или (C1-C8)алкил-O(CO)R5;
R2 представляет собой Н или (С1-С8)алкил; и
R3 представляет собой (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C5-C8)алкил-N(R6)2, (С0-С8)алкил-NH-C(O)O-R5; (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5; и другие переменные имеют те же самые определения.
В других конкретных соединениях формулы II, R2 представляет собой Н или (С1-С4)алкил.
В других конкретных соединениях формулы II, R1 представляет собой (С1-С8)алкил или бензил.
В других конкретных соединениях формулы II, R1 представляет собой Н, (С1-С8)алкил, бензил, СН2ОСН3, СН2СН2ОСН3 или
В другом варианте осуществления соединений формулы II, R1 представляет собой
где Q представляет собой О или S, и при каждом появлении R7 независимо представляет собой Н, (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, галоген, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C0-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5; или при расположении в смежных положениях R7 могут, вместе взятые, образовывать бициклическое алкильное или арильное кольцо.
В других конкретных соединениях формулы II, R1 представляет собой C(O)R3.
В других конкретных соединениях формулы II, R3 представляет собой (С0-С4)алкил-(С1-С6)гетероарил, (С1-С8)алкил, арил или (C0-C4)алкил-OR5.
В других конкретных соединениях формулы II, гетероарил представляет собой пиридил, фурил или тиенил.
В других конкретных соединениях формулы II, R1 представляет собой C(O)OR4.
В других конкретных соединениях формулы II, Н в C(O)NHC(O) может быть заменен на (С1-С4)алкил, арил или бензил.
Следующие примеры соединений данного класса включают, но не ограничиваются указанным: [2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]амид; трет-бутиловый эфир (2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]карбаминовой кислоты; 4-(аминометил)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-дион; N-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил)ацетамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}циклопропилкарбоксамид; 2-хлор-N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}ацетамид; N-(2-(2,6-диоксо-(3-пиперидил)-1,3-диоксоизоиндолин-4-ил)-3-пиридилкарбоксамид; 3-{1-оксо-4-(бензиламино)изоиндолин-2-ил}пиперидин-2,6-дион; 2-(2,6-диоксо-(3-пиперидил))-4-(бензиламино)изоиндолин-1,3-дион; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}пропанамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}-3-пиридилкарбоксамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}гептанамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}-2-фурилкарбоксамид; {N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)карбамоил}метилацетат; N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)пентанамид; N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)-2-тиенилкарбоксамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}(бутиламино)карбоксамид; N-{[2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил]метил}(октиламино)карбоксамид; и N-{[2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил]метил}(бензиламино)карбоксамид.
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу изоиндол-имидов, описанному в публикации патентной заяки США № 2002/0045643, Международной публикации № WO 98/54170 и патенте США № 6395754, все из которых включены в данное описание путем ссылки. Иллюстративные соединения имеют формулу III:
и их фармацевтически приемлемые соли, гидраты, сольваты, клатраты, энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
один из Х и Y представляет собой С=О, и другой представляет собой СН2 или С=О;
R представляет собой Н или CH2OCOR';
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой нитрогруппу или -NHR5, а остальные из R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
R' представляет собой R7CHR10-N(R8R9);
R7 представляет собой м-фенилен или п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметилен, пентаметилен, гексаметилен или -CH2CH2X1CH2CH2-, где Х1 представляет собой -О-, -S- или -NH-;
R10 представляет собой водород, алкил, содержащий до 8 атомов углерода, или фенил; и
* представляет собой хиральный углеродный центр.
Другие иллюстративные соединения имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
R7 представляет собой м-фенилен или п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметилен, пентаметилен, гексаметилен или -CH2CH2X1CH2CH2-, где Х1 представляет собой -О-, -S- или -NH-;
R10 представляет собой водород, алкил, содержащий до 8 атомов углерода, или фенил.
Другие иллюстративные соединения имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой нитрогруппу или защищенную аминогруппу, а остальные R1, R2, R3 и R4 представляют собой водород;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
Другие иллюстративные соединения имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород, алкил, содержащий 1-8 атомов углерода, или CO-R7-CH(R10)NR8R9, в которой каждый из R7, R8, R9 и R10 является таким, как определено в данном описании; и
R6 представляет собой алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор.
Конкретные примеры соединений имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензил, хлор или фтор;
R7 представляет собой м-фенилен, п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметил