Производные бензотиазола и их применение при лечении заболеваний, связанных с аденозиновыми а2а-рецепторами
Иллюстрации
Показать всеИзобретение относится к производным бензотиазола общей формулы (I) и их фармацевтически приемлемым кислотно-аддитивным солям в качестве лигандов рецептора аденозина с высоким сродством к рецептору аденозина A2A и к лекарственному средству на их основе. Соединения могут найти применение для лечения и профилактики заболеваний, опосредованных рецепторами аденозина А2A, например болезни Альцгеймера, некоторых депрессивных состояний, токсикомании, болезни Паркинсона. В общей формуле (I)
R представляет собой С5-С6-циклоалкил, незамещенный или замещенный группой гидрокси, или представляет собой этил или изобутил, или представляет собой тетрагидропиран-4-ил или -(СН2)n-тетрагидрофуран-2 или 3-ил или представляет собой 5-гидроксибицикло[2,2,1]гепт-2-ил; Х представляет собой СН или N; n означает 0 или 1. 2 н. и 10 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям общей формулы
где R представляет собой C5-С6-циклоалкил, незамещенный или замещенный группой гидрокси, или
представляет собой этил, изобутил, или
представляет собой тетрагидропиран-4-ил, или
представляет собой -(СН2)n-тетрагидрофуран-2 или 3-ил, или
представляет собой 5-гидроксибицикло[2,2,1]гепт-2-ил;
Х представляет собой СН или N;
n означает 0 или 1;
и к их фармацевтически приемлемым кислотно-аддитивным солям (солям - продуктам присоединения кислоты).
Неожиданно было обнаружено, что соединения общей формулы I представляют собой лиганды аденозинового рецептора. А именно, соединения согласно настоящему изобретению обладают значительным сродством к А2A-рецептору и высокой селективностью по отношению к A1- и А3-рецепторам. Аденозин является модулятором большого числа физиологических функций, что осуществляется посредством взаимодействия со специфическими рецепторами поверхности клетки. Обзор, посвященный возможному использованию аденозиновых рецепторов в качестве мишеней для лекарственных средств, был впервые выполнен в 1982 году. Аденозин связан как структурно, так и метаболически с биологически активными нуклеотидами аденозинтрифосфатом (АТФ), аденозиндифосфатом (АДФ), аденозинмонофосфатом (АМФ) и циклическим аденозинмонофосфатом (цАМФ); с биохимическим метилирующим агентом S-аденозил-L-метионом (SAM) и структурно - с коферментами NAD, FAD и коферментом А; и с РНК. Аденозин и родственные ему соединения играют важную роль в регулировании многих аспектов клеточного метаболизма и в модулировании различных видов активности центральной нервной системы.
Аденозиновые рецепторы классифицируют как A1, A2A, А2B и А3 рецепторы, принадлежащие к семейству рецепторов, сопряженных с G-белками. Активация аденозиновых рецепторов аденозином инициирует систему передачи сигнала. Эти механизмы опосредованы G-белком, ассоциированным с рецептором. Каждый подтип аденозинового рецептора обычно характеризуется аденилатциклазной эффекторной системой, в которой в качестве вторичного мессенджера используется цАМФ. A1 и А3 рецепторы, связанные с Gi белками, ингибируют аденилатциклазу, что приводит к снижению содержания цАМФ в клетках, в то время как A2А и А2B рецепторы сопряжены с Gs белками и активируют аденилатциклазу, что приводит к повышению содержания цАМФ в клетках. Известно, что система A1 рецептора включает активацию фосфолипазы С и модулирование как калиевых, так и кальциевых ионных каналов. Подтип А3, в дополнение к ассоциации с аденилатциклазой, также стимулирует фосфолипазы С и таким образом активирует кальциевые ионные каналы.
Клонирован А1 рецептор (326-328 аминокислот) различных видов (семейства псовых, человека, крысы, собаки, цыпленка, крупного рогатого скота, морской свинки), при этом у млекопитающих наблюдается 90-95%-ная идентичность последовательности. Клонирован A2A рецептор (409-412 аминокислот) семейства псовых, крысы, человека, морских свинок и мышей. Клонирован А2B рецептор (332 аминокислоты) человека и мыши, при этом наблюдается 45%-ная гомологичность последовательности рецептора А2B человека по отношению к A1 и A2A рецепторам человека. Клонирован А3 рецептор (317-320 аминокислот) человека, крысы, собаки, кролика и овцы.
Предполагается, что подтипы рецептора A1 и A2A дополняют друг друга при регуляции аденозином процесса обеспечения энергией. Аденозин, который является продуктом метаболической трансформации АТФ, диффундирует из клетки и локально воздействует на активацию аденозиновых рецепторов, снижая потребность в кислороде (A1) или увеличивая снабжение кислородом (А2A) и таким образом поддерживая равновесие между обеспечением энергией и ее потреблением в тканях. Действие обоих подтипов заключается в увеличении количества доступного для тканей кислорода и в защите клеток от повреждения, вызванного кратковременным дисбалансом в поступлении кислорода. Одной из важных функций эндогенного аденозина является предупреждение повреждения при травмах, таких как гипоксия, ишемия, гипотензия и эпилептические припадки.
Кроме того, известно, что связывание агониста аденозинового рецептора с тучными клетками, экспрессирующими рецептор А3 крысы, приводит к увеличению уровня инозиттрифосфата и концентрации кальция внутри клетки, что усиливает антиген-индуцируемую секрецию медиаторов воспалительной реакции. Следовательно, рецептор А3 играет важную роль в качестве медиатора в случае приступов астмы и других аллергических реакций.
Аденозин является также нейромодулятором, способным модулировать различные аспекты физиологической деятельности мозга. Эндогенный аденозин, центральное связующее звено между энергетическим обменом и нейрональной активностью, изменяется в соответствии с поведенческим состоянием и (пато)физиологическими состояниями. В условиях повышения потребности и снижения доступности энергии (таких как гипоксия, гипогликемия и/или чрезмерная активность нейронов), аденозин обеспечивает эффективный защитный механизм обратной связи. Взаимодействие с аденозиновыми рецепторами является многообещающим направлением терапевтического воздействия в случае разнообразных неврологических и психиатрических заболеваний, таких как эпилепсия, расстройства и нарушения сна и двигательной активности (болезнь Паркинсона или болезнь Хантингтона (Huntington), болезнь Альцгеймера, депрессия, шизофрения или привыкание.
Увеличение скорости высвобождения нейромедиатора происходит при травме, такой как гипоксия, ишемия и эпилептические припадки. Эти нейромедиаторы в конечном счете отвечают за дегенерацию и гибель нейронов, что влечет за собой повреждение мозга или смерть организма. Таким образом, агонисты аденозинового рецептора А1, имитирующие ингибиторные процессы в центральной нервной системе (ЦНС), вызываемые аденозином, могут найти применение в качестве нейропротекторных агентов. Аденозин предполагается использовать в качестве эндогенного противосудорожного агента, ингибирующего высвобождение глутамата из возбужденных нейронов и ингибирующего возбуждение нейронов. Таким образом, агонисты аденозина могут быть использованы в качестве противоэпилептических агентов.
Антагонисты аденозина стимулируют активность ЦНС и, как установлено, являются эффективными усиливающими агентами в отношении познавательных (когнитивных) способностей. Селективные А2а антагонисты обладают терапевтическим потенциалом в отношении лечения различных форм деменции, например, в случае болезни Альцгеймера, и при нейродегенеративных заболеваниях, например, при нарушении мозгового кровообращения. Антагонисты аденозинового А2а рецептора модулируют активность стриатальных GABA-эргических нейронов и регулируют плавные движения и координацию, таким образом, предоставляют возможность для лечения симптомов, наблюдающихся при паркинсонизме.
Аденозин также принимает участие в ряде физиологических процессов, лежащих в основе седативного эффекта, гипноза, шизофрении, беспокойства и тревоги, боли, дефицит дыхания, депрессии, наркомании и лекарственного привыкания (амфетамин, кокаин, опиоиды, этанол, никотин, каннабиноиды). Следовательно, лекарственные средства, воздействующие на аденозиновые рецепторы, обладают терапевтическим потенциалом в качестве седативных агентов, мышечных релаксантов, антипсихотических средств, транквилизаторов, анальгетиков, стимуляторов дыхания и антидепрессантов и при лечении наркомании и лекарственного привыкания. Они также могут быть использованы для лечения нарушений и расстройств, связанных с дефицитом внимания и гиперактивностью (ADHD).
В сердечно-сосудистой системе аденозин выполняет важную функцию в качестве кардиопротектора (кардиозащитного средства). Уровень эндогенного аденозина повышается как реакция на ишемию и гипоксию, что защищает ткани сердца при травме и после травмы (стабилизация). Посредством воздействия на A1 рецептор агонисты аденозинового A1 могут осуществлять защиту от повреждений, вызываемых ишемией миокарда и реперфузией. Модулирование воздействия A2a рецепторов на адренергическую функцию может иметь большое значение в случае различных заболеваний, например, таких как заболевания коронарной артерии и сердечная недостаточность. А2а антагонисты могут представлять интерес для терапии при таких ситуациях, когда необходима повышенная адренергическая реакция, например при остром инфаркте миокарда. Селективные антагонисты по отношению к A2a рецепторам также могут повышать эффективность аденозина при непериодической наджелудочковой (суправентрикулярной) аритмии.
Аденозин является модулятором множества аспектов функционирования почек, включая высвобождение ренина, скорость гломерулярной (клубочковой) фильтрации и почечный кровоток. Соединения, которые противодействуют воздействию аденозина на почки, являются защитными агентами для почек. Кроме того, антагонисты аденозиновых рецепторов А3 и/или A2B могут быть полезны при лечении астмы и других аллергических реакций или при лечении сахарного диабета и ожирения.
Современное состояние исследований в области аденозиновых рецепторов отражает множество опубликованных документов, например следующие публикации:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J. Med. Chem. (1998), 41, 2835-2845,
J. Med. Chem. (1998), 41, 3186-3201,
J. Med. Chem. (1998), 41, 2126-2133,
J. Med. Chem. (1999), 42, 706-721,
J. Med. Chem. (1996), 39, 1164-1171,
Arch. Pharm. Med. Chem., 332, 39-41 (1999),
Am. J. Physiol., 276, H1113-1116 (1999) или
Naunyn Schmied, Arch. Pharmacol. 362, 375-381, (2000).
Целью настоящего изобретения является получение соединений формулы I самих по себе, применение соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств, предназначенных для лечения заболеваний, связанных с аденозиновым А2 рецептором, их получение, лекарственные средства на основе соединения согласно настоящему изобретению и их получение, а также применение соединений формулы I для контроля или профилактики заболеваний, связанных с работой аденозиновой системы, например, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротективное действие, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, привыкание к наркотическим и лекарственным средствам, таким как амфетамин, кокаин, опиоиды, этанол, никотин, каннабиноиды, или применение при астме, аллергических реакциях, гипоксии, ишемии, припадках и злоупотреблении алкоголем или наркотиками.
Кроме того, соединения согласно настоящему изобретению могут быть полезны в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, противосудорожных средств и кардиопротекторных средств при таких заболеваниях, как, например, заболевания коронарной артерии и сердечная недостаточность. Наиболее предпочтительными показаниями в соответствии с настоящим изобретением являются такие, которые основаны на антагонистической активности в отношении A2A рецептора и которые включают расстройства центральной нервной системы, например, лечение или профилактику болезни Альцгеймера, некоторые депрессивные нарушения или расстройства, наркоманию, лекарственное привыкание, нейропротективное действие и болезнь Паркинсона, а также нарушения и расстройства, связанные с дефицитом внимания и гиперактивностью (ADHD).
Термин "фармацевтически приемлемые аддитивные соли с кислотами" (соли - продукты присоединения кислоты) включает соли с неорганическими и органическими кислотами, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота, и подобными им кислотами.
Предпочтительными соединениями согласно настоящему изобретению являются такие соединения формулы I, где R представляет собой С5-С6-циклоалкил, необязательно замещенный группой гидрокси, например следующие соединения:
4-гидрокси-циклогексиловый эфир (транс)-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты,
циклогексиловый эфир (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты,
4-гидроксициклогексиловый эфир (транс)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты,
4-гидроксициклогексиловый эфир (цис)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты или
3-гидроксициклопентиловый эфир (цис/транс)-(4-метокси-7-морфолин-4-ил-бензотиазол-2-ил)карбаминовой кислоты.
Дополнительно предпочтительными являются такие соединения формулы I, в которой R представляет собой этил, изобутил или метоксиэтил, например следующие соединения:
этиловый эфир [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты,
изобутиловый эфир (4-метокси-7-морфолин-4-ил-бензотиазол-2-ил)карбаминовой кислоты.
Предпочтительными соединениями согласно настоящему изобретению являются такие соединения формулы I, в которой R представляет собой тетрагидропиран-4-ил или -(СН2)n-тетрагидрофуран-2 или 3-ил, например следующие соединения:
тетрагидропиран-4-иловый эфир (4-метокси-7-морфолин-4-ил-бензотиазол- 2-ил)карбаминовой кислоты,
тетрагидрофуран-3 -иловый эфир (R)-(4-метокси-7-морфолин-4-ил-бензотиазол-2-ил)карбаминовой кислоты,
тетрагидрофуран-2-ил-метиловый эфир [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты или
(S)-(тетрагидрофуран-3-ил)овый сложный эфир [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты.
Кроме того, предпочтительными являются такие соединения формулы I, в которой R представляет собой 5-гидроксибицикло[2,2,1]гепт-2-ил, например следующее соединение:
5-гидроксибицикло[2,2,1]гепт-2-иловый эфир (рац)-(экзо,экзо)-(4-метокси-7-морфолин-4-ил-бензотиазол-2-ил)карбаминовой кислоты.
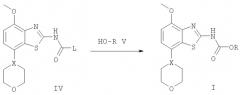
Соединения формулы I согласно настоящему изобретению и их фармацевтически приемлемые соли могут быть получены с использованием методов, известных из предшествующего уровня техники, например, способом, который описан ниже. Указанный способ включает:
а) взаимодействие соединения формулы
с соединением формулы
с получением соединения формулы
в которой R и Х имеют значения, приведенные выше, или
б) взаимодействие соединения формулы
с соединением формулы
с получением соединения формулы
в которой R и Х являются такими, как определено выше, L означает отщепляемую группу, такую как галоген, -O-фенил или O-низший алкил, и, если необходимо, превращение полученного соединения в фармацевтически приемлемые кислотно-аддитивные соли.
В примерах 1-13 и на приведенных ниже схемах 1 и 2 получение соединений формулы I описано более подробно.
Исходные вещества представляют собой известные соединения или могут быть получены согласно методикам, известным из предшествующего уровня техники.
Получение соединений формулы I
Промежуточные соединения 7-(морфолин-4-ил)-4-метоксибензотиазол-2-иламин и 7-(тетрагидропиран-4-ил)-4-метоксибензотиазол-2-иламин могут быть получены в соответствии с методами, раскрытыми в опубликованной международной заявке WO 01/97786. Получение соединений формулы (I) с использованием промежуточного соединения формулы (II) также описано в опубликованной международной заявке WO 01/97786.
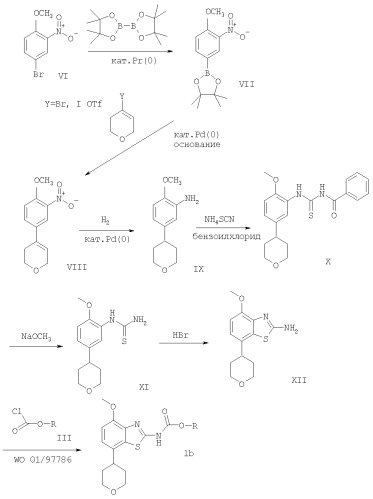
Схема 1
Получение соединений формулы (VII)
Производные арилбромида формулы (VI) подвергают взаимодействию с небольшим избытком бис(пинаколято)диборона в органическом растворителе, предпочтительно в диметилсульфоксиде, содержащем палладиевый катализатор, предпочтительно такой, как аддукт дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладий(II) - дихлорметан, и избыток ацетата калия. Взаимодействие проводят при повышенной температуре, предпочтительно при приблизительно 80°С, в течение приблизительно 2-24 часов, предпочтительно приблизительно 2 часов. Полученный продукт формулы (VII) выделяют по общепринятым методикам и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединений формулы (VIII)
Один из способов получения соединений формулы (VIII) заключается в обработке соединения формулы (VII) производным винилбромида, винилиодида или винилтрифлата в присутствии палладиевого катализатора, предпочтительно в присутствии аддукта дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладий(II) - дихлорметан, и неорганического основания, предпочтительно такого, как карбонат натрия. Взаимодействие проводят в смеси растворителей, предпочтительно в смеси этанола, толуола и воды. Взаимодействие проводят при повышенной температуре, предпочтительно приблизительно 80°С, в течение приблизительно 0,1-2 часов, предпочтительно приблизительно 20 минут. Полученный продукт формулы (VIII) выделяют по общепринятым методикам и предпочтительно очищают посредством хроматографии или перекристаллизации. Исходные производные винилбромида, винилиодида или винилтрифлата могут быть коммерчески доступными, например получены от фирмы "Fluka", или могут быть получены в соответствии с методиками, известными из предшествующего уровня техники.
Получение соединений формулы (IX)
Соединения формулы (IX) могут быть получены посредством гидрирования соединений формулы (VIII) в присутствии катализатора гидрирования, предпочтительно 10%-ного палладия на углероде. Эти взаимодействия возможно проводить в различных органических растворителях, например, таких как метанол, этанол или тетрагидрофуран, предпочтительно в метаноле, при комнатной температуре и при давлении, равном атмосферному или выше атмосферного, предпочтительно при давлении, равном одной атмосфере, в течение 16-72 часов, предпочтительно приблизительно в течение 72 часов. Полученный продукт формулы (IX) выделяют по общепринятым методикам и предпочтительно очищают посредством хроматографии или перекристаллизации.
Получение соединения формулы (X)
К раствору роданида аммония в ацетоне добавляют бензоилхлорид и раствор 2-метокси-5-(тетрагидропиран-4-ил)фениламина (IX). Взаимодействие проводят при кипячении с обратным холодильником в течение приблизительно 20 минут. Полученный продукт- 1-бензоил-3-[2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевину (X) выделяют по общепринятым методикам.
Получение соединения формулы (XI)
К раствору 1-бензоил-3-[2-метокси-5-(тетрагидропиран 4-ил)фенил]тиомочевины (X) в метаноле добавляют раствор метилата натрия и продолжают перемешивание в течение приблизительно 1 ч при комнатной температуре. Полученный продукт (XI) [2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевину выделяют по общепринятым методикам.
Получение соединения формулы (XII)
К раствору 1-[2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевина (XI) в уксусной кислоте добавляют бромоводородную кислоту и затем продолжают перемешивание в течение приблизительно 30 минут при 80°С. Затем добавляют по каплям ДМСО и реакционную смесь перемешивают дополнительно в течение 30 минут при 80°С. Полученный продукт (XII) - 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламин - выделяют по общепринятым методикам.
Получение соединения формулы (Iб)
4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламин (XII) сначала подвергают взаимодействию с фенилхлороформиатом таким образом, как описано в отношении бензилового эфира (4-метокси-7-фенилбензотиазол-2-ил)карбаминовой кислоты в опубликованной международной заявке WO 01/97786 и затем с N-этилдиизопропиламином и соответствующим спиртом формулы HO-R в диметилсульфоксиде при приблизительно 50°С в течение 2 ч, как показано также на схеме 2.
Схема 2
R и X являются такими, как описано выше, L означает отщепляемую группу, такую как галоген, -O-фенил или O-низший алкил.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, описанных в тексте настоящей заявки, могут быть выполнены, если необходимо, с использованием любой подходящей методики разделения или очистки, например, такой как фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная хроматография низкого или высокого разрешения или жидкостная хроматография при высоком давлении, или с использованием комбинации этих методик.
Конкретные иллюстрации использования подходящих методик разделения и выделения можно найти в разделе, посвященном синтезу и примерам конкретного выполнения ниже в тексте настоящей заявки. Однако, безусловно, могут быть использованы и другие эквивалентные методики разделения и выделения.
Соли соединений формулы I
Соединения формулы I могут быть основного характера, например, в тех случаях, когда остаток R содержит группу основного характера, например, такую как фрагмент алифатического или ароматического амина. В таких случаях соединения формулы I могут быть превращены в соответствующую аддитивную соль с кислотой (продукт присоединения кислоты).
Превращение осуществляют посредством обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, например, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные кислоты, и такой как органическая кислота, например уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная (β-фенилакриловая) кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, n-толуолсульфоновая кислота, салициловая кислота и подобные кислоты. Обычно свободное основание растворяют в инертном органическом растворителе, например, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и подобном им, и добавляют кислоту в подобном растворителе. Температуру поддерживают в интервале от 0 до 50°С. Полученная соль выпадает в осадок спонтанно или может быть выделена из раствора с использованием менее полярного растворителя.
Аддитивные соли с кислотами соединений основного характера формулы I могут быть превращены в соответствующие свободные основания посредством обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, например, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобного основания.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли с кислотами обладают ценными фармакологическими свойствами. А именно, было показано, что соединения согласно настоящему изобретению являются лигандами аденозинового рецептора и обладают высоким сродством по отношению к аденозиновому A2A рецептору.
Соединения были исследованы в соответствии с приведенными ниже методиками тестирования.
Аденозиновый А2A рецептор человека
Аденозиновый А2A рецептор человека рекомбинантно экспрессируют в клетках яичника китайского хомячка (СНО) с использованием системы экспрессии вируса semliki forest. Клетки собирают, дважды промывают посредством центрифугирования, гомогенизируют и снова промывают посредством центрифугирования. Промытый осадок мембранной фракции суспендируют в Трис-буферном растворе (50 мМ), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). Исследование связывания [3H]-SCH-58261 (Dionisotti et al., 1997, Br J Pharmacol, 121, 353; 1 нМ) проводят в 96-луночных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг Ysi-поли-1-лизин-SPA гранул и 0,1 Ед. аденозиндеаминазы в конечном объеме буфера А, составляющем 200 мкл. Неспецифическое связывание определяют с использованием соединения того же класса - ксантинамина (ХАС; 2 мкМ). Соединения анализируют при 10 концентрациях от 10 мкМ до 0,3 нМ. Все исследования проводят в двух параллельных сериях и анализ повторяют по меньшей мере два раза. Планшеты, в которых проводят исследование, инкубируют в течение 1 часа при комнатной температуре перед центрифугированием и затем связанный лиганд определяют с использованием сцинтилляционного счетчика "Packard Topcount". Значения IC50 рассчитывают с использованием программы нелинейной аппроксимации, а значения Ki рассчитывают по уравнению Ченга-Прусоффа.
Значения pKi для соединений согласно настоящему изобретению находятся в интервале от 7,6 до 8,7. Для наиболее предпочтительных соединений значения pKi>8,0.
| Пример № | hA2 (pKi) | Пример № | hA2 (pKi) |
| 1 | 8,7 | 8 | 8,1 |
| 2 | 8,3 | 9 | 8,4 |
| 3 | 7,9 | 10 | 7,6 |
| 4 | 7,6 | 11 | 7,8 |
| 5 | 8,1 | 12 | 7,9 |
| 6 | 8,2 | 13 | 8,4 |
| 7 | 8,0 |
Соединения формулы I и фармацевтические соли соединений формулы I могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Кроме того, введение эффективно может быть осуществлено ректально, например, в виде суппозиториев, парентерально, например, в виде растворов для инъекций.
Соединения формулы I могут быть использованы вместе с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических композиций. В качестве носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и тому подобные соединения. Подходящие носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобные соединения. Однако в зависимости от природы активного соединения в случае мягких желатиновых капсул носитель может и не использоваться. Подходящие носители для получения растворов и сиропов представляют собой, например, воду, полиолы, глицерин, растительное масло и тому подобные соединения. Подходящие носители для получения растворов и сиропов представляют собой, например, воду, полиолы, глицерин, растительное масло и тому подобные вещества. Подходящие носители для суппозиториев представляют собой, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобные соединения. Однако в зависимости от природы активного соединения в случае мягких желатиновых капсул носитель может и не использоваться.
Фармацевтические композиции, кроме того, могут содержать консерванты, солюбилизаторы, стабилизаторы, агенты, улучшающие смачиваемость, эмульгаторы, подсластители, подкрашивающие вещества, агенты, улучшающие вкус и запах, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Также они могут содержать и другие терапевтически значимые соединения.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения, также как и способ их получения, который включает введение одного или более соединения формулы I и/или фармацевтически приемлемой аддитивной соли с кислотой и, если необходимо, одного или более терапевтически значимого вещества в состав лекарственного препарата, вместе с одним или более терапевтически инертным носителем.
В соответствии с настоящим изобретением соединения формулы I, а также их фармацевтически приемлемые соли можно использовать для контроля или профилактики заболеваний, связанных с агонистической активностью в отношении аденозинового рецептора, например, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейропротективное действие, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, припадки и злоупотребление алкоголем или наркотиками. Кроме того, соединения согласно настоящему изобретению могут быть полезны в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, противосудорожных средств и кардиопротекторных средств и для получения соответствующих лекарственных средств.
Наиболее подходящие показания согласно настоящему изобретению - это показания, которые включают нарушения или расстройства центральной нервной системы, например такие показания, как лечение или профилактика некоторых депрессивных расстройств, нейропротекция и болезнь Паркинсона.
Дозировка может варьироваться в широких пределах и будет, безусловно, регулироваться в зависимости от индивидуальных требований в каждом конкретном случае. В случае перорального введения дозировка для взрослых может варьироваться от приблизительно 0,01 мг до приблизительно 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Дневная дозировка может быть введена в виде одной дозы или разделенной на несколько доз и, в дополнение к этому, может быть превышен верхний предел, если обнаружится, что это необходимо по показаниям.
| Изготовление таблеток (влажное гранулирование) | |||||
| Позиция | Ингредиенты | мг/таблетка | |||
| 5 мг | 25 мг | 100 мг | 500 мг | ||
| 1 | Соединение формулы I | 5 | 25 | 100 | 500 |
| 2 | Безводная лактоза DTG | 125 | 105 | 30 | 150 |
| 3 | Sta-Rx 1500 | 6 | 6 | 6 | 30 |
| 4 | Микрокристаллическая целлюлоза | 30 | 30 | 30 | 150 |
| 5 | Стеарат магния | 1 | 1 | 1 | 1 |
| Суммарное количество | 167 | 167 | 167 | 831 |
Методика получения
1. Смешивают соединения по позициям 1, 2, 3 и 4 и проводят гранулирование, используя очищенную воду.
2. Высушивают гранулы при 50°С.
3. Пропускают гранулы через подходящее устройство для размола.
4. Добавляют вещество согласно позиции 5 и перемешивают в течение трех минут, затем прессуют, используя подходящий пресс.
| Получение капсул | |||||
| Позиция | Ингредиенты | мг/капсула | |||
| 5 мг | 25 мг | 100 мг | 500 мг | ||
| 1 | Соединение формулы I | 5 | 25 | 100 | 500 |
| 2 | Водная лактоза | 159 | 123 | 148 | --- |
| 3 | Кукурузный крахмал | 25 | 35 | 40 | 70 |
| 4 | Тальк | 10 | 15 | 10 | 25 |
| 5 | Стеарат магния | 1 | 2 | 2 | 5 |
| Суммарное количество | 200 | 200 | 300 | 600 |
Методика приготовления
1. Смешивают соединения по позициям 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют соединения согласно позициям 4 и 5 и смешивают в течение 3 минут.
3. Помещают в подходящие капсулы.
Приведенные ниже методики и примеры иллюстрируют изобретение, но их не следует рассматривать как ограничение объема настоящего изобретения.
Пример 1
4-Гидроксициклогексиловый эфир (транс)-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты
4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламин (69 мг, 0,26 ммоль) сначала подвергают взаимодействию с фенилхлороформиатом таким образом, как описано в отношении бензилового эфира (4-метокси-7-фенилбензотиазол-2-ил)карбаминовой кислоты в опубликованной международной заявке WO 01/97786, и затем с N-этилдиизопропиламином (0,090 мл, 0,5 ммоль) и (транс)-циклогексан-1,4-диолом (60 мг, 0,5 ммоль) в диметилсульфоксиде (10 мл) при 50°С в течение 2 ч. Затем добавляют 100 мл дихлорметана, полученную смесь экстрагируют насыщенным водным раствором карбоната натрия и полученную органический фазу высушивают и упаривают. После очистки экспресс-хроматографией (силикагель, элюирование смесью дихлорметан/метанол) получают указанное в заголовке соединение в виде белого твердого вещества (выход 7%). Масс-спектр: m/е=407(М+Н+), т.пл. 282-284°С.
В соответствии с общей методикой, приведенной в примере 1, получают соединения согласно примерам 211.
Пример 2
Этиловый эфир [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и этанол, указанное в заголовке соединение получают в виде белого твердого вещества (выход 35%). Масс-спектр: m/е= 337(М+Н+), т.пл. 170-174°С.
Пример 3 (не входит в объем настоящего изобретения)
2-Метоксиэтиловый эфир (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и 2-метоксиэтанол, указанное в заголовке соединение получают в виде не совсем белого твердого вещества (выход 52%). Масс-спектр: m/е= 368(М+Н+), т.пл. 149-152°С.
Пример 4
Изобутиловый эфир (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и изобутанол, указанное в заголовке соединение получают в виде желтых кристаллов (выход 12%). Масс-спектр: m/е=366(М+Н+), т. пл. 164-168°С.
Пример 5
Циклогексиловый эфир (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и циклогексанол, указанное в заголовке соединение получают в виде белого твердого вещества (выход 60%). Масс-спектр: m/е= 392(М+Н+), т.пл. 177-179°С.
Пример 6
4-Гидроксициклогексиловый эфир (транс)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-ил-бензотиазол-2-иламин и (транс)-циклогексан-1,4-диол, указанное в заголовке соединение получают в виде белого вспененного вещества (выход 14%). Масс-спектр: m/е=408(M+H+), т.пл. 176-179°С. Масс-спектр: m/е=407,49(M+H+).
Пример 7
4-Гидроксициклогексиловый эфир (цис)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и (цис)-циклогексан-1,4-диол, указанное в заголовке соединение получают в виде бесцветных кристаллов (выход 40%). Масс-спектр: m/е=408(М+Н+), т.пл. 204-206°С.
Пример 8
Тетрагидропиран-4-иловый эфир (4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и тетрагидропиран-4-ол, указанное в заголовке соединение получают в виде белого твердого вещества (выход 7%). Масс-спектр: m/е=394(М+Н+), т.пл. 187-188°С.
Пример 9
(рац)-(экзо,экзо)-(4-Метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты 5-гидроксибицикло[2,2,1]гепт-2-иловый эфир
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и (рац)-(экзо, экзо)-бицикло[2,2,1]гептан-2,5-диол, указанное в заголовке соединение получают в виде белого твердого вещества (выход 10%). Масс-спектр: m/е=420(M+H+), т.пл. 193-194°С.
Пример 10
Тетрагидрофуран-3-иловый эфир (R)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и (R)-тетрагидрофуран-3-ол, указанное в заголовке соединение получают в виде белых кристаллов (выход 33%). Масс-спектр: m/е=380(М+Н+), т.пл. 198-200°С.
Пример 11
3-Гидроксициклопентиловый эфир (цис/транс)-(4-метокси-7-морфолин-4-илбензотиазол-2-ил)карбаминовой кислоты
Используя 4-метокси-7-морфолин-4-илбензотиазол-2-иламин и (цис/транс)-циклопентан-1,3-диол, указанное в заголовке соединение получают в виде белого твердого вещества (выход 42%). Масс-спектр: m/е=394(М+Н+), т.пл. 188-189°С.
Пример 12
Тетрагидрофуран-2-илметиловый эфир [4-метокси-7-(тетрагидропиран-4-ил)б